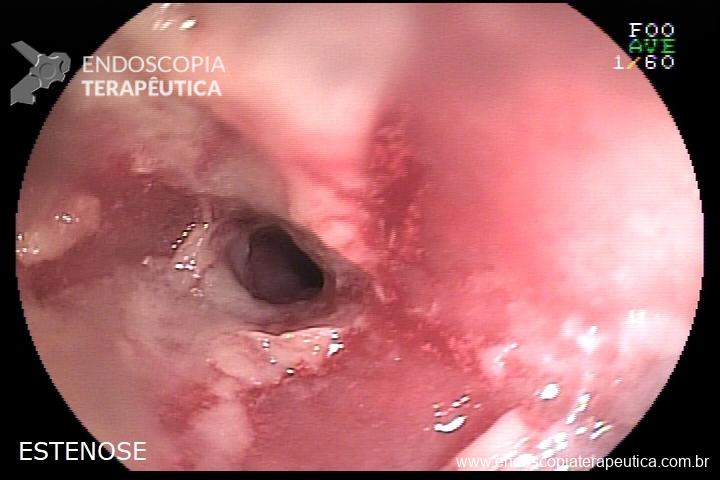
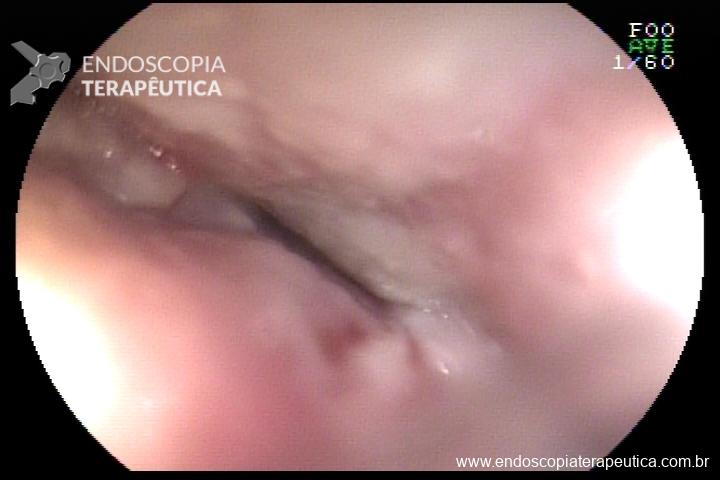
Tratamento endoscópico de estenose de anastomose pós-correção de atresia de esôfago
Caso clínico
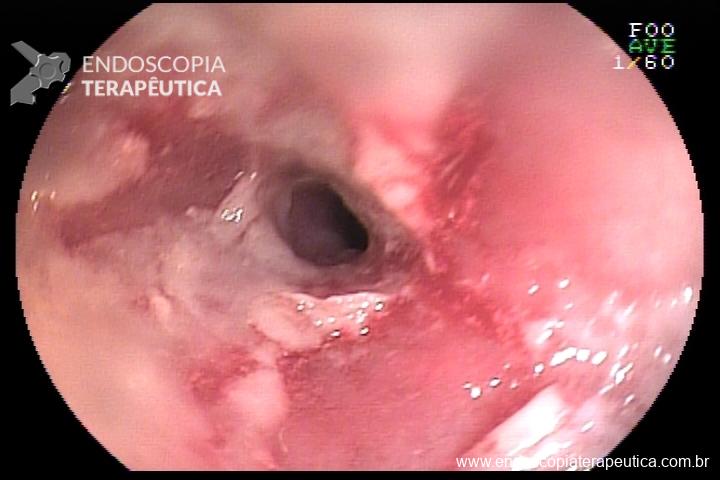
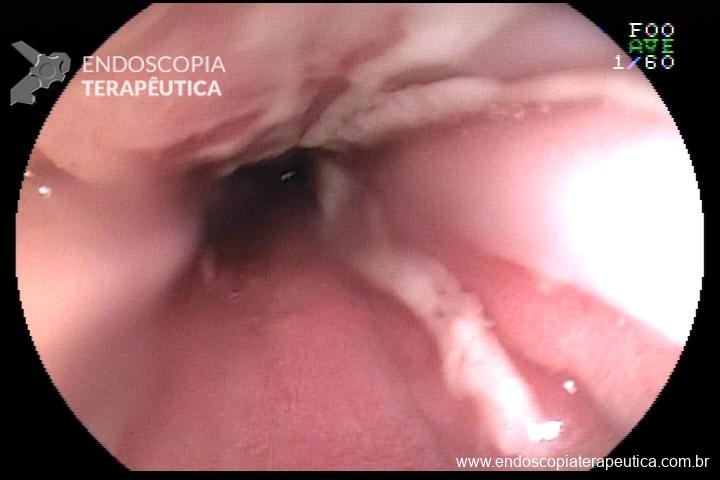
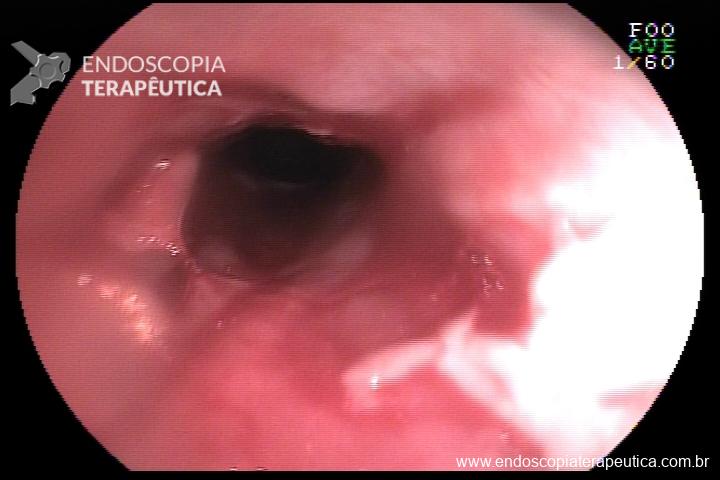
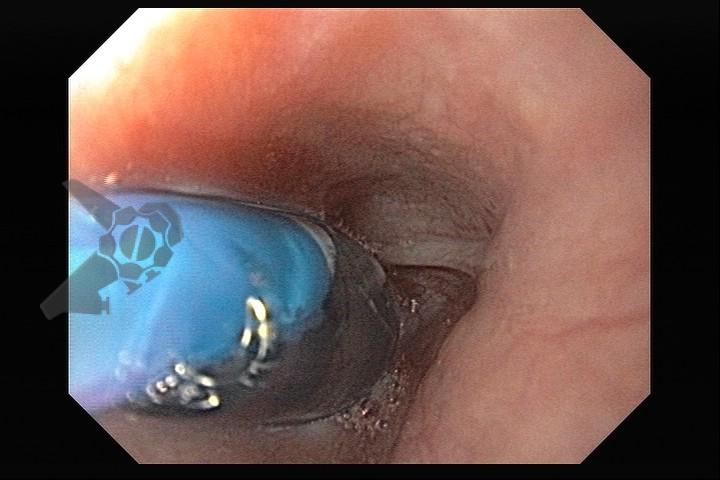
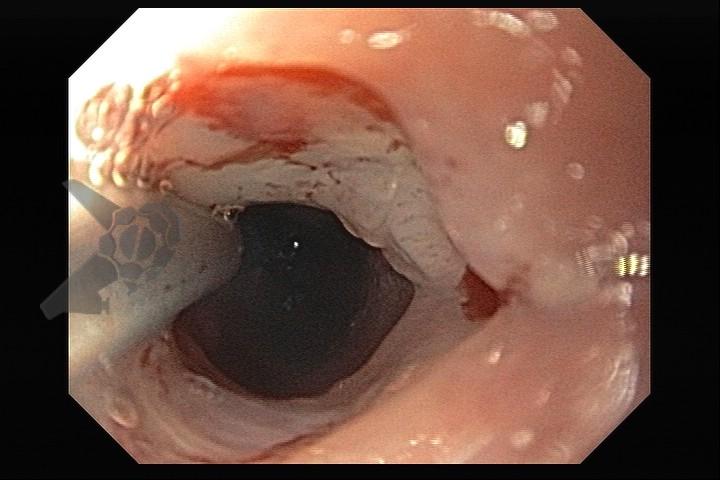
L.R.S., masculino, 8 meses, nascido a termo, com diagnóstico pré-natal de atresia de esôfago com fístula traqueoesofágica distal (Vogt IIIb/Gross C), submetido à correção cirúrgica no 3º dia de vida. Aos 3 meses, passou a apresentar episódios recorrentes de tosse durante a alimentação, engasgos, regurgitação e perda de peso progressiva. A mãe relatou dificuldade em introduzir alimentos sólidos e episódios recorrentes de infecção respiratória nos últimos dois meses. Solicitada endoscopia digestiva alta, que evidenciou estenose puntiforme da anastomose esofágica. Iniciada terapia endoscópica com dilatação esofágica utilizando vela de Savary-Gilliard. Foram realizadas 4 sessões com intervalo de 2 semanas, com melhora progressiva da aceitação alimentar e ganho ponderal adequado. Após a 4ª dilatação, o paciente encontra-se em boa evolução clínica, com alimentação por via oral plena, sem episódios de engasgos ou perda ponderal.
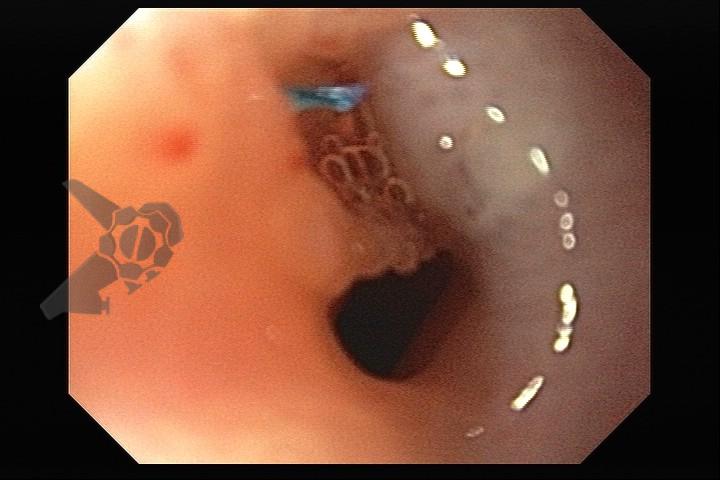
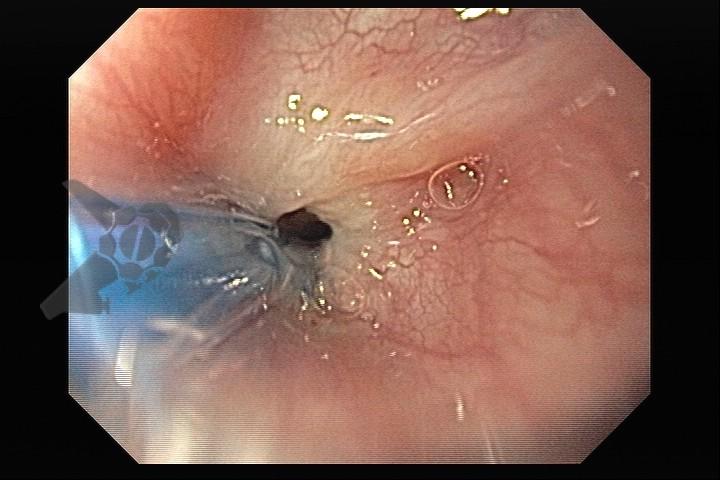
Atresia de esôfago
A atresia de esôfago (AE) é uma das anomalias congênitas mais comuns na infância e ocorre em incidência de um para cada 2.500 a 4.500 nascidos vivos e, em até 50 % dos casos, outras anomalias estão presentes [1,2]. A malformação associada mais comum ocorre no sistema cardiovascular (23%), seguida por malformações musculoesqueléticas (18%), anorretais e intestinais (16%), geniturinárias (15%), de cabeça e pescoço (10%), mediastinais (8%) e cromossômicas (5,5%) [1,2].
A atresia esofágica se apresenta sob cinco formas anatômicas distintas, classificadas pela localização da atresia e pela presença ou não de fístula para a traqueia. A primeira classificação foi publicada por Vogt em 1929 e modificada por Gross em 1953, sendo as duas classificações usadas atualmente [1,3]. Os principais tipos de atresia de esôfago congênita são AE com fístula traqueoesofágica (FTE) distal (85-86%, Vogt III b, Gross C), AE isolada sem FTE (7-8%, Vogt II, Gross A), FTE sem atresia ou FTE tipo H (4%, Gross E), AE com FTE proximal (3%, Vogt III, Gross B) e AE com FTE proximal e distal. [1,3].
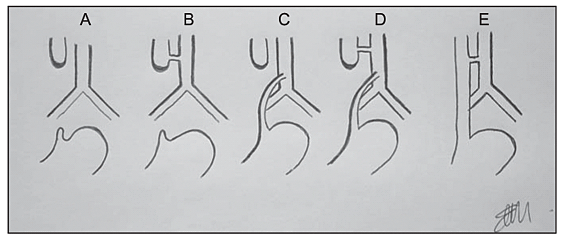
O prognóstico da atresia de esôfago varia significativamente de acordo com o tipo anatômico e a localização da fístula traqueoesofágica. A forma mais comum, a atresia com fístula distal (Tipo C), tende a ter melhor desfecho visto que, geralmente, há menor distância entre os cotos esofágicos, o que permite uma anastomose primária com menor tensão, reduzindo o risco de deiscência e de estenose [5]. Em contrapartida, tipos menos frequentes, como a atresia sem fístula (Tipo A), com fístula proximal (Tipo B) ou com fístula dupla (Tipo D), estão associados a maior distância entre os cotos ou localização menos acessível da fístula, o que dificulta o reparo cirúrgico e aumenta o risco de complicações como estenose anastomótica, refluxo gastroesofágico grave e fístula recorrente [6,7]. Além disso, a presença de malformações associadas, especialmente cardiovasculares, contribui para pior desfecho ao aumentar a complexidade cirúrgica e o risco anestésico [1,8]. Esses fatores anatômicos e clínicos combinados explicam a maior morbidade e mortalidade observadas nos tipos menos comuns da doença [8].
No entanto diante dos avanços dos cuidados intensivos, mesmo nos casos mais graves, houve uma redução na mortalidade neonatal das crianças que nascem com atresia de esôfago, com maior número de recém nascidos submetidos à correção cirúrgica [1]. Todavia a morbidade pós operatória ainda é significativa, devido a ocorrência de complicações, sendo a estenose de anastomose a mais frequente (60%) [10].
A estenose da anastomose ocorre, na maioria dos casos, no primeiro ano de idade, sendo a maioria diagnosticada nos primeiros 6 meses, com pico de incidência entre o 1º e o 3º mês pós-operatório [10,11]. Vários fatores são descritos atualmente na contribuição do seu aparecimento, como o fio de sutura utilizado na cirurgia, o grau de tensão na anastomose, a presença de fístula pós operatória e o refluxo gastroesofágico [10,11].
O diagnóstico deve ser suspeitado diante de sinais e sintomas como perda ponderal, disfagia, engasgos e infecções respiratórias recorrentes, vindo a ser confirmado através da endoscopia digestiva alta [11].
O tratamento inicial a ser considerado é a dilatação endoscópica, seja com o balão hidrostático ou com a vela de Savary – Gilliard, não havendo diferença nos desfechos, de acordo com a literatura atual, entre as duas técnicas [12]. Entretanto, alguns trabalhos sugerem que a dilatação com balão pode apresentar menor risco de complicações[12,13,14]. Estudos mostram uma média de três sessões de dilatação para a resolução do quadro, sendo estas intervaladas em um período de duas a quatro semanas, a depender da sintomatologia e evolução clínica do paciente, sendo o ganho ponderal um dos fatores clínicos mais importantes a serem considerados [8,13].
Conclusão
A atresia de esôfago representa uma das principais anomalias congênitas do trato gastrointestinal. Apesar dos avanços no manejo perioperatório e na correção cirúrgica, a estenose de anastomose permanece como a complicação pós-operatória mais prevalente, com repercussões significativas no desenvolvimento do paciente. O tratamento padrão envolve dilatações endoscópicas seriadas, embora não exista um consenso sobre o intervalo ideal entre as sessões e qual a melhor técnica de dilatação. A abordagem deve ser individualizada de acordo com a experiência do endoscopista, das características da estenose, da disponibilidade dos acessórios, dos sintomas do paciente e da resposta à dilatação.
Referências:
- Pinheiro PFM, Silva ACS, Pereira RMA. Current knowledge on esophageal atresia. World J Gastroenterol. 2012 Jul 28;18(28):3662-72.
- Al‑Salem AH, Tayeb M, Khogair S, Roy A, Al‑Jishi N, Alsenan K, et al. Esophageal atresia with or without tracheoesophageal fistula: success and failure in 94 cases. Ann Saudi Med. 2006;26(2):116-9.
- Figueiredo SS, Ribeiro LHV, Nóbrega BB, Costa MAB, Oliveira GL, Esteves E, et al. Atresia do trato gastrintestinal: avaliação por métodos de imagem. Radiol Bras. 2005 Mar-Apr;38(2):111-8.
- Sistonen SJ, Pakarinen MP, Rintala RJ. Long-term results of esophageal atresia: Helsinki experience and review of literature. Pediatr Surg Int. 2011 Nov;27(11):1141-9.
- Kate CA, Tambucci R, Vlot J, Spaander MCW, Gottrand F, Wijnen RMH, Oglio LD. An international survey on anastomotic stricture management after esophageal atresia repair: considerations and advisory statements. Surg Endosc. 2021;35:3653–3661.
- Gao XJ, Huang JX, Chen Q, Hong SM, Hong JJ, Ye H. The timing of esophageal dilatations in anastomotic stenosis after one-stage anastomosis for congenital esophageal atresia. J Cardiothorac Surg. 2021;16:284.
- Ijsselstijn H, van Beelen NW, Wijnen RMH. Long‑term morbidity in adolescents and young adults with surgically treated esophageal atresia. Dis Esophagus. 2013 May–Jun;26(4):417–21.
- Serhal L, Mougeot M, Dubois J, et al. Anastomotic stricture after surgical repair of esophageal atresia: frequency, risk factors, and efficacy of esophageal bougie dilatations. J Pediatr Surg. 2010 Jul;45(7):1459-62.
- Antoniou D, Tsilivigos C, Raptis D, et al. Anastomotic strictures following esophageal atresia repair: a 20‑year experience with endoscopic balloon dilatation. J Pediatr Gastroenterol Nutr. 2010 Oct;51(4):464-7.
- Wolfe E, Zidane M, Hancock BJ, Lum Mim SA, Zaritzky M, Keijzer R. Magnamosis for esophageal atresia is associated with anastomotic strictures requiring an increased number of dilatations. J Pediatr Surg. 2020 Feb;55(2):256-260.
- Kay M, Warkentin A, et al. Endoscopic management of esophageal strictures in children: a 10-year single center experience. World J Gastrointest Endosc. 2018 Mar 16;10(5):52-59.
- Soh P, Wong T, Lee B, et al. Endoscopic dilation with bougies versus balloon dilation in esophageal benign strictures: systematic review and meta-analysis. J Gastroenterol Hepatol. 2018;33(1):62-70. doi:10.1111/jgh.13822.
- Ambroise L, et al. Dilations of anastomotic strictures over time after repair of esophageal atresia. Pediatr Surg Int. 2016;32:777–781.
- Zhou Q, Tang S, Sun J, Zhou X, Xu Y. Comparison of balloon dilation and Savary-Gilliard dilation for benign esophageal strictures: a systematic review and meta-analysis. Gastrointest Endosc. 2016 Oct;84(4):625-632
Como citar este artigo
Retes FA, Amorim JS. Tratamento endoscópico de estenose de anastomose pós-correção de atresia de esôfago. Endoscopia Terapeutica, 2025 Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/tratamento-endoscopico-de-estenose-de-anastomose-pos-correcao-de-atresia-de-esofago/