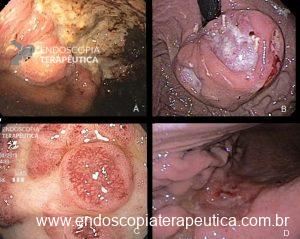
Biópsia Assistida por Incisão da Mucosa: Quando e Como Fazer?
A biópsia assistida por incisão de mucosa (mucosal incision-assisted biopsy, MIAB), denominada também biópsia por incisão única com Kneedle-Knife (incision needle‐knife biopsy, SINK biopsy) ou destelhamento, consiste em uma técnica endoscópica emergente e alternativa, descrita por Yokohata et al em 20075, utilizada para aquisição tecidual de lesões subepiteliais do trato gastrointestinal, que permite o diagnóstico histopatológico e imuno-histoquímico dessas condições.
O MIAB vem emergindo como método de abordagem de lesões subepiteliais, pois é de baixo custo-econômico e menor curva de aprendizado, mas com tempo de procedimento maior, sendo assim uma alternativa às punções ecoendoscópicas em centros de menor complexidade e com menos recursos.
Quando indicar?
O estabelecimento diagnóstico histopatológico e imuno-histoquímico das lesões subepiteliais possui importância fundamental na definição precisa de prognóstico, potencial de degeneração maligna e definição de conduta entre expectante, vigilância endoscópica e ressecções endoscópica ou cirúrgica.
Entretanto, como abordado no artigo de lesões subepiteliais, não são todas as lesões que devem ter diagnóstico anatomopatológico para definição de conduta e seguimento do caso, havendo indicações precisas para se realizar biópsias dessas lesões.
Em caso de necessidade de aquisição tecidual das lesões subepiteliais, deverá se optar por um dos três principais métodos diagnósticos: MIAB, punções ecoendoscópicas com agulha FNA (fine needle aspiration, EUS-FNA) ou com agulha FNB (fine needle biopsy, EUS-FNB).
As indicações do MIAB estão bem determinadas nos guidelines da Sociedade Europeia de Endoscopia Gastrointestinal (ESGE) e Colégio Americano de Gastroenterologia (ACG).
A ESGE recomenda que para lesões subepiteliais maiores de 20 mm, MIAB ou EUS-FNB podem ser igualmente empregados. Entretanto, em lesões subepiteliais inferiores a 20 mm, o MIAB é a primeira escolha devido maior rendimento diagnóstico, sendo a EUS-FNB segunda escolha (tabela 1).1 Com relação a taxa de rendimento do MIAB, a mesma foi avaliada em algumas metanálises, sendo demonstrado rendimento diagnóstico de 89% (IC 95% 82,7%-93,5%) para lesões subepiteliais do trato gastrointestinal superior com diâmetro médio de 21 mm, sendo 94,8% das lesões localizadas no estômago1,29.
A ACG sugere o MIAB quando o diagnóstico definitivo é necessário e as punções ecoendoscópicas prévias (FNA ou FNB) tenham sido inconclusivas.14 A diretriz recomenda igualmente como primeira escolha EUS-FNB sem avaliação macroscópica do patologista em sala (rapid on-site evaluation, ROSE) ou EUS-FNA com ROSE. Afinal, já é bem determinado na literatura que agulhas FNA possuem limitações de aquisição tecidual e seu rendimento diagnóstico adequado depende de um citopatologista em sala para atestar a representatividade da amostra periprocedimento.
A ASGE e AGA em seus guidelines descrevem o MIAB como um método diagnóstico alternativo para as lesões subepiteliais. Entretanto, não se posicionam com relação a situações de aplicabilidade.
Além disso, na escolha do método é importante considerar não somente as recomendações dos guidelines, mas também as particularidades de cada procedimento, custos hospitalares e disponibilidade de recusos. O MIAB foi associado a um maior tempo de procedimento e a um risco de fibrose perilesional, o qual pode dificultar ou impedir futuras ressecções endoscópicas28.
| Tabela 1. Recomendações da ESGE¹ | |
| Tamanho | Método de Escolha |
| LSE > 20 mm | 1ª escolha: EUS-FNB ou MIAB |
| LSE < 20 mm | 1ª escolha: MIAB 2ª escolha: EUS-FNB |
Complicações
As taxas de complicações inerente ao MIAB são baixas. Os eventos adversos mais frequentes incluem: sangramento em cerca de 2 a 5% dos casos, os quais requisitaram transfusão sanguínea e/ou tratamento endoscópico na maioria dos trabalhos29, 30-32; fibrose perilesional pós-MIAB, impossibilitando ressecções endoscópicas futuras; e mais raramente perfuração, a qual não foi observada na maioria dos ensaios clínicos, metanálises e série de casos29, 33, 34.
Como fazer?
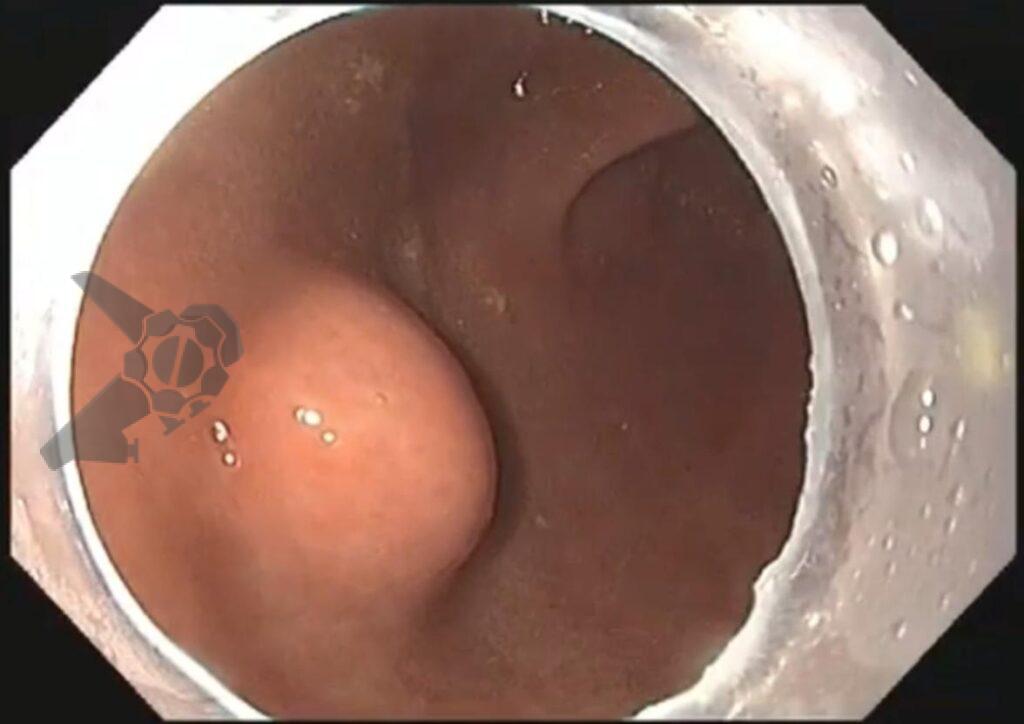
Primeiramente, é importante ressaltar os materiais necessários para o procedimento. Necessita-se de um gastroscópio convencional com cap, afinal o uso desse dispositivo permite visualização minuciosa da mucosa e do sítio manipulado por acumular menos resíduos na lente do endoscópio.
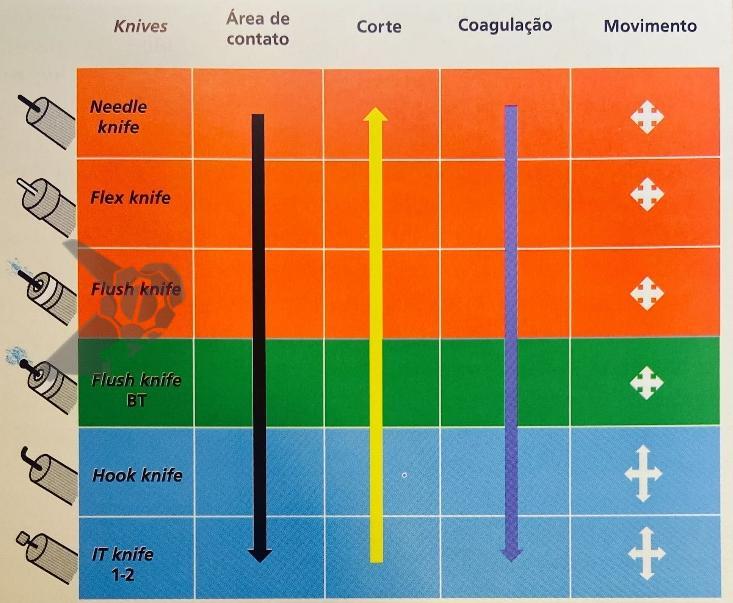
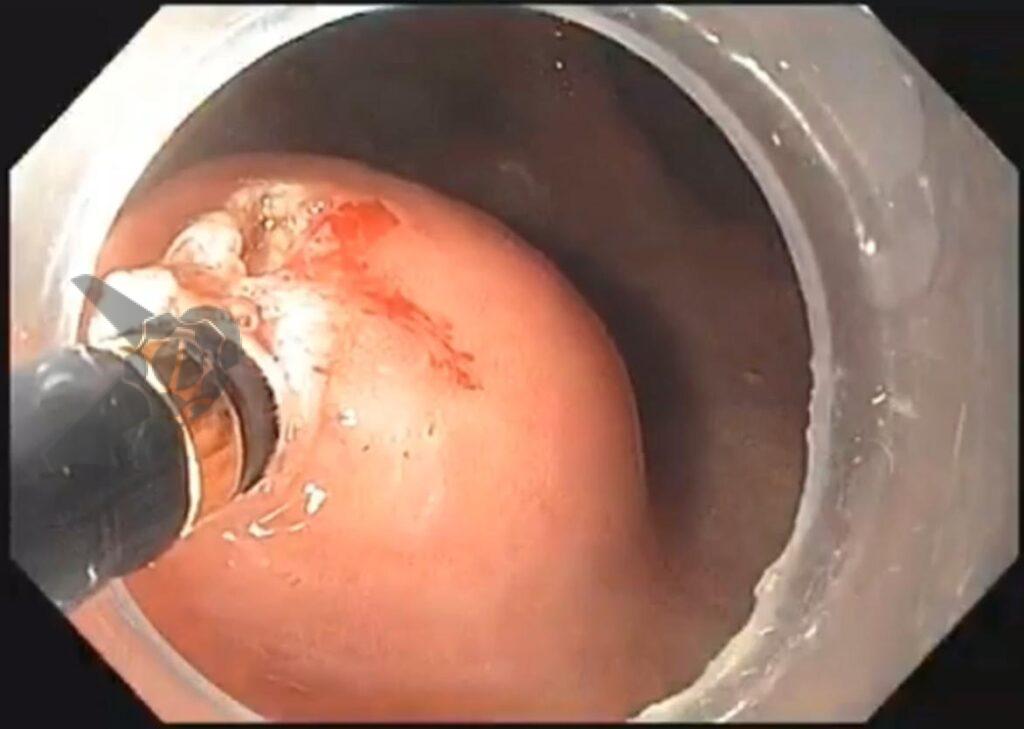
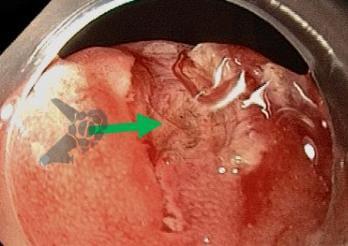
Uma faca eletrocirúrgica endoscópica é necessária, sendo sugerido o uso de Needle Knife, pois consiste no instrumento de maior poder de corte e menor poder de coagulação, uma vez que se objetiva realizar incisão precisa da mucosa seguida de divulsão dos tecidos. Um princípio básico relacionado às facas endoscópicas consiste no fato de quanto menor a área de contato do instrumento com a mucosa, maior será o poder de corte e menor será o poder de coagulação (figura 1). Sugere-se utilizar unidade eletrocirúrgica com corte em modo endocut, efeito 3 e 40 W.
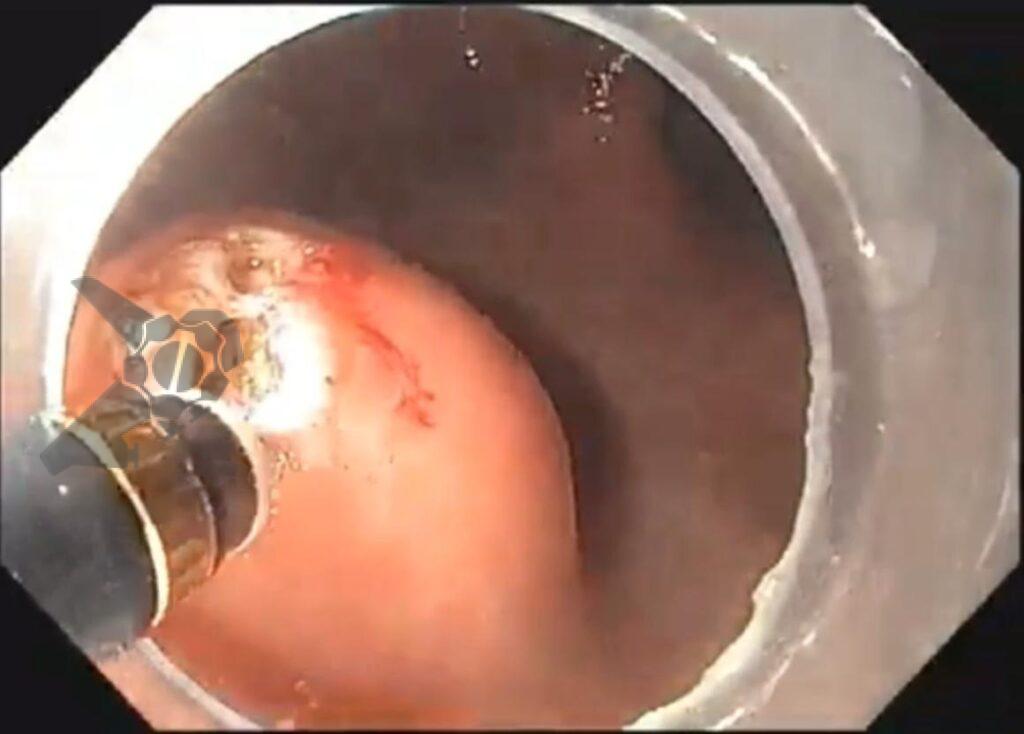
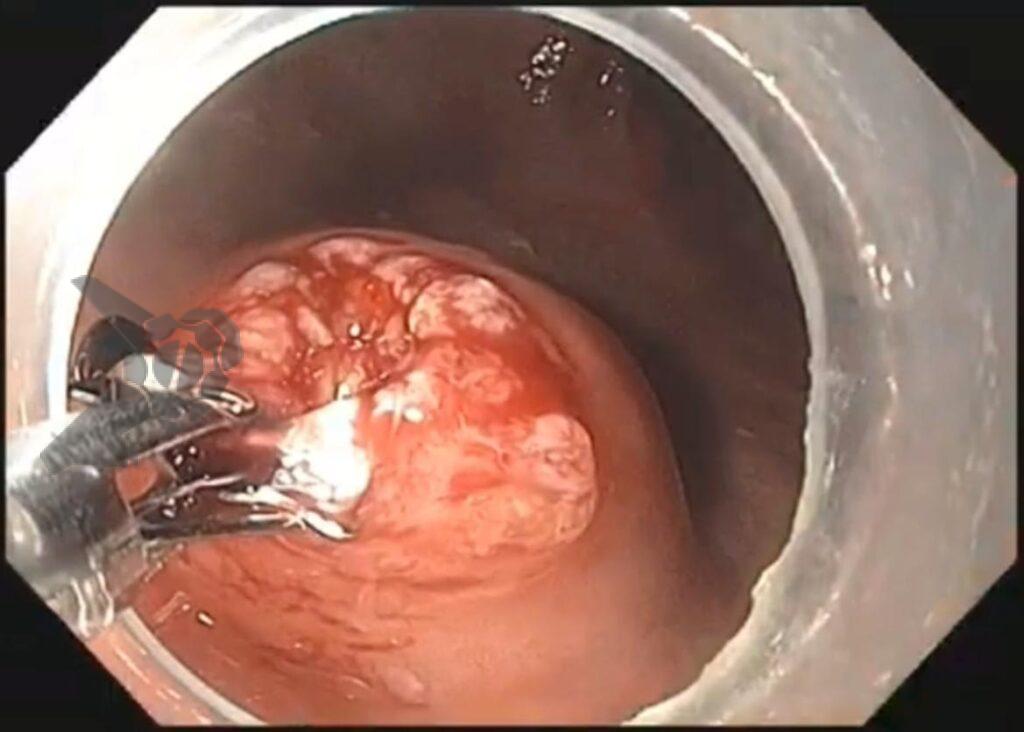
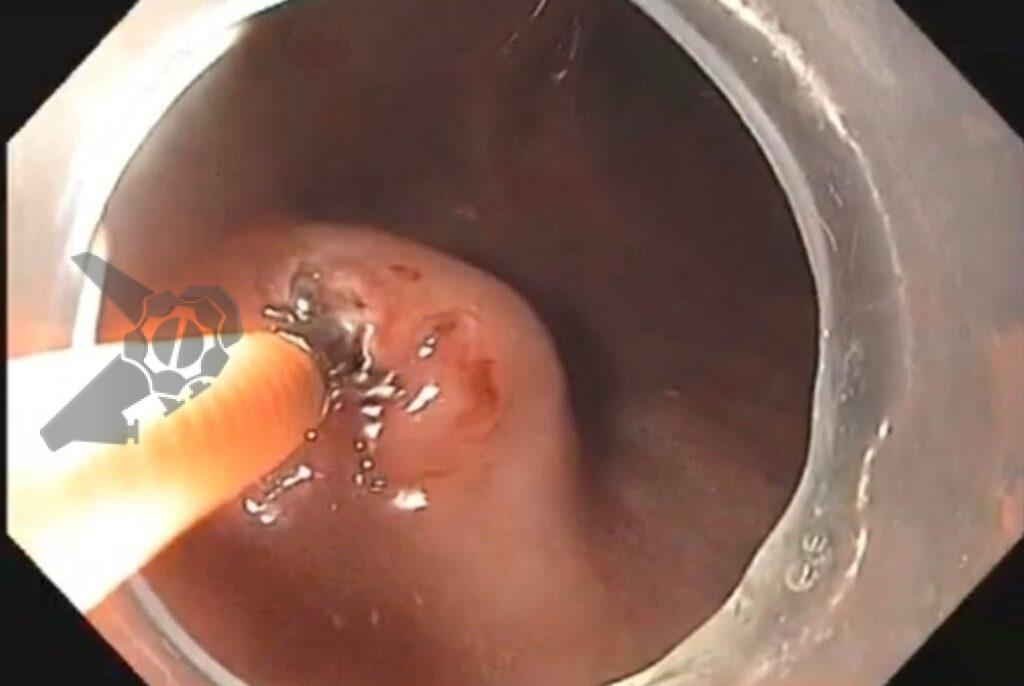
Outros materiais necessários consistem em pinça de biópsia para divulsão dos tecidos e aquisição de material, assim como clipes metálicos para fechamento do sítio manipulado pós-procedimento. Caso haja necessidade de controle hemostático peri-procedimento, sugerimos o uso de pinça hemostática coagrasper.
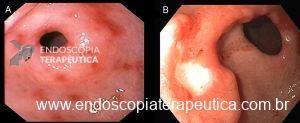
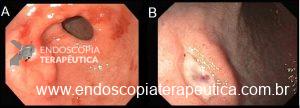
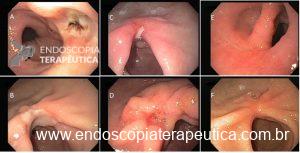
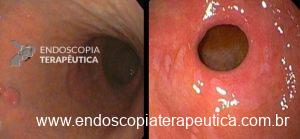
O vídeo 1 e as figuras de 2 a 7 demonstram as etapas do procedimento.
Referências
- Deprez PH, Moons LMG, OʼToole D, Gincul R, Seicean A, Pimentel-Nunes P, Fernández-Esparrach G, Polkowski M, Vieth M, Borbath I, Moreels TG, Nieveen van Dijkum E, Blay JY, van Hooft JE.
Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022 Apr;54(4):412-429. doi: 10.1055/a-1751-5742. Epub 2022 Feb 18. PMID: 35180797. - Pal S, Hodgar D. Gastrointestinal Subepithelial Lesions: A Review. J Digest Endosc 2023;14:99–105.
- Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc 2011;3(05):86–94
- Hwang JH, Saunders MD, Rulyak SJ, Shaw S, Nietsch H, Kimmey MB. A prospective study comparing endoscopy and EUS in the evaluation of GI subepithelial masses. Gastrointest Endosc 2005; 62(02):202–208
- Yokohata N, Tamegai Y, Tokuhara M, et al. 3 case of gastric SMT (submucal tumor) which was diagnoced before operation: open biopsy with ESD (endoscopic submucal dissection) for interstind SMT. Prog Dig Endosc 2007;70:82–83.
- Ji JS, Lee BI, Choi KY, et al. Diagnostic yield of tissue sampling using a bite-on-bite technique for incidental subepithelial lesions. Korean J Intern Med (Korean Assoc Intern Med) 2009;24(02): 101–105
- Buscaglia JM, Nagula S, Jayaraman V, et al.
Diagnostic yield and safety of jumbo biopsy forceps in patients with subepithelial lesions of the upper and lower GI tract. Gastrointest Endosc 2012; 75(06):1147–1152 - El Chafic AH, et al. Comparison of FNA and fine-needle biopsy for EUS-guided sampling of suspected GI stromal tumors. Gastrointest Endosc 2017;86:510–515.
- Kim GH, et al. Comparison of 22-gauge aspiration needle with 22-gauge biopsy needle in endoscopic ultrasonography-guided subepithelial tumor sampling. Scand J Gastroenterol 2014; 49:347–354.
- de Moura DTH, et al. EUS-guided fine-needle biopsy sampling versus FNA in the diagnosis of subepithelial lesions: a large multicenter study. Gastrointest Endosc 2020;92:108–119.e3.
- Sharzehi K, Sethi A, Savides T. AGA Clinical Practice Update on Management of Subepithelial Lesions Encountered During Routine Endoscopy: Expert Review. Clin Gastroenterol Hepatol. 2022 Nov;20(11):2435-2443.e4. doi: 10.1016/j.cgh.2022.05.054. Epub 2022 Jul 13. PMID: 35842117.
- Wani S, Muthusamy VR, Komanduri S. EUS-guided tissue acquisition: an evidence-based approach (with videos). Gastrointest Endosc 2014;80:939–959.e7.
- Pessoa RRP, Bestetti AM, Oliveira VL, Araujo WC, Guaraldi S, Rodrigues Silva RR, Oliveira FAA, Ribeiro MSI, Carneiro FOAA, D’Assunção MA, Medrado BFOA, Retes FA, Paulo GA, Schneider NC, Rossini LGB, Vallinoto L, Ardengh JC, Coelho Neto DE, Ide E, Silva MCB, Franco MC, Matuguma SE, Moura DTH, Arantes VN, Nahoum R, Brunaldi VO, Santos MELD, Chaves DM, Micelli-Neto O, Salomao BC, Maluf-Filho F, Luz GO. III BRAZILIAN CONSENSUS STATEMENT ON ENDOSCOPIC ULTRASOUND. Arq Gastroenterol. 2024 Oct 21;61:e24062. doi: 10.1590/S0004-2803.24612024-062. PMID: 39442127.
- Jacobson BC, Bhatt A, Greer KB, Lee LS, Park WG, Sauer BG, Shami VM. ACG Clinical Guideline: Diagnosis and Management of Gastrointestinal Subepithelial Lesions. Am J Gastroenterol. 2023 Jan 1;118(1):46-58. doi: 10.14309/ajg.0000000000002100. Epub 2022 Sep 6. PMID: 36602835.
- Landazábal B G. Lesões subepiteliais. In: Artifon ELA, Castaño R, eds. Endoscopia Digestiva Oncológica Diagnóstica-Terapêutica. 1ª ed. Rio de Janeiro: Revinter; 2015. p. 123-131.
- Kim GH. Systematic Endoscopic Approach for Diagnosing Gastric Subepithelial Tumors.
Gut Liver. 2022 Jan 15;16(1):19-27. doi: 10.5009/gnl20296. PMID: 33707348; PMCID: PMC8761929. - Miyajima NT, Toyonaga T. Dissecção Submucosa Endoscópica. In: Ferrari A, Maruta L, Averbach M, eds. Endoscopia Digestiva Terapêutica. Rio de Janeiro: Revinter; 2012. p. 115-134.
- Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005;37:635-645.
- Choe Y, Cho YK, Kim GH, et al. The prevalence, natural course, and clinical practice of upper gastrointestinal subepithelial tumors in Korea. Gastrointest Endosc 2020;91(6 Suppl):AB321.
- Hedenbro JL, Ekelund M, Wetterberg P. Endoscopic diagnosis of submucosal gastric lesions. The results after routine endoscopy. Surg Endosc 1991; 5: 20-23
- Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-645
- Rösch T, Lorenz R, Dancygier H, von Wickert A, Classen M. Endosonographic diagnosis of submucosal upper gastrointestinal tract tumors. Scand J Gastroenterol 1992; 27: 1-8
- Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc 2011;3(05):86–94
- Humphris JL, Jones DB. Subepithelial mass lesions in the upper gastrointestinal tract. J Gastroenterol Hepatol 2008;23:556-66.
- Hwang JH, Rulyak SD, Kimmey MB. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006;130:2217-28.
- Forero EA, Maluf-Filho F. Ultrasonido endoscópico en lesiones subepiteliales gastrointestinales. In: Forero EA, Maluf-Filho F. (Eds.). Tratado de ultrasonido endoscópico. São Paulo: Atheneu 2008. р. 87-110.
- Standards of Practice Committee; Faulx AL, Kothari S, Acosta RD, Agrawal D, Bruining DH, Chandrasekhara V, Eloubeidi MA, Fanelli RD, Gurudu SR, Khashab MA, Lightdale JR, Muthusamy VR, Shaukat A, Qumseya BJ, Wang A, Wani SB, Yang J, DeWitt JM. The role of endoscopy in subepithelial lesions of the GI tract.
Gastrointest Endosc. 2017 Jun;85(6):1117-1132. doi: 10.1016/j.gie.2017.02.022. Epub 2017 Apr 3. PMID: 28385194. - Minoda Y, Chinen T, Osoegawa T et al. Superiority of mucosal inci-sion-assisted biopsy over ultrasound-guided fine needle aspiration biopsy in diagnosing small gastric subepithelial lesions: a propensity score matching analysis. BMC Gastroenterol 2020; 20: 19.
- Dhaliwal A, Kolli S, Dhindsa BS, Devani K, Ramai D, Sayles H, Rangray R, Bhat I, Singh S, Adler DG. Clinical efficacy and safety of mucosal incision-assisted biopsy for the diagnosis of upper gastrointestinal subepithelial tumors: A systematic review and meta-analysis. Ann Gastroenterol. 2020 Mar-Apr;33(2):155-161. doi: 10.20524/aog.2020.0460. Epub 2020 Feb 14. PMID: 32127736; PMCID: PMC7049234.
- Koizumi E, Goto O, Nakagome S, Habu T, Ishikawa Y, Kirita K, Noda H, Higuchi K, Onda T, Akimoto T, Omori J, Akimoto N, Iwakiri K. Technical outcomes and postprocedural courses of mucosal incision-assisted biopsy for possible gastric gastrointestinal stromal tumors: A series of 48 cases (with video).
DEN Open. 2023 Jun 22;4(1):e264. doi: 10.1002/deo2.264. PMID: 37359151; PMCID: PMC10288069. - Choi CW, Kang DH, Kim HW, et al. Direct endoscopic biopsy for subepithelial tumor larger than 20mm after removal of overlying mucosa. Scand J Gastroenterol 2017;52:779-783.
- Shimamura Y, Hwang J, Cirocco M, May GR, Mosko J, Teshima CW. Efficacy of single-incision needle-knife biopsy for sampling subepithelial lesions. Endosc Int Open 2017;5:E5-E10.
- Koizumi E, Goto O, Nakagome S, Habu T, Ishikawa Y, Kirita K, Noda H, Higuchi K, Onda T, Akimoto T, Omori J, Akimoto N, Iwakiri K. Technical outcomes and postprocedural courses of mucosal incision-assisted biopsy for possible gastric gastrointestinal stromal tumors: A series of 48 cases (with video).
DEN Open. 2023 Jun 22;4(1):e264. doi: 10.1002/deo2.264. PMID: 37359151; PMCID: PMC10288069. - Giri S, Afzalpurkar S, Angadi S, Sundaram S. Mucosal incision-assisted biopsy versus endoscopic ultrasound-assisted tissue acquisition for subepithelial lesions: a systematic review and meta-analysis. Clin Endosc. 2022 Sep;55(5):615-625. doi: 10.5946/ce.2022.133. Epub 2022 Aug 4. PMID: 36205045; PMCID: PMC9539302.
Como citar este artigo
Balbinot RS, Martins B. Biópsia Assistida por Incisão da Mucosa: Quando e Como Fazer? Endoscopia Terapeutica 2025 Vol I. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/biopsia-assistida-por-incisao-da-mucosa-quando-e-como-fazer/