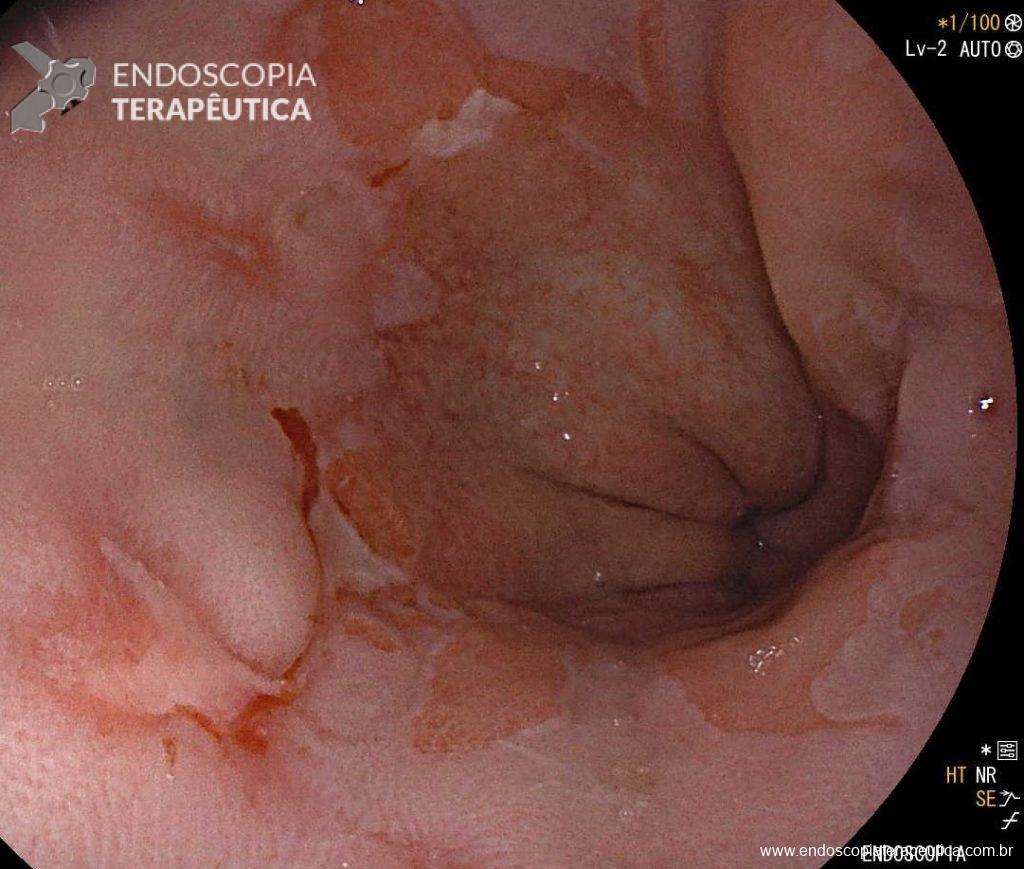
Qual melhor forma de sedar o paciente para CPRE: anestesia geral ou sedação profunda sem intubação?
Os eventos adversos mais comuns na CPRE estão relacionados a sedação. O tipo de sedação utilizado nas CPREs varia ao redor do mundo e inclui desde sedação realizada pelo próprio endoscopista à anestesia assistida pelo anestesiologista, que pode ser com ou sem intubação orotraqueal (IOT). Poucos estudos, no entanto, compararam os efeitos adversos relacionados a sedação profunda monitorizada pelo anestesista sem IOT com a anestesia geral sob IOT.
Um único estudo randomizado sobre esse tema foi realizado para pacientes de alto risco para sedação e concluiu que a anestesia geral estava associada a significativamente menos efeitos adversos e que não comprometeu o tempo da CPRE ou a taxa de sucesso quando comparada a sedação profunda.
Hoje discutiremos um artigo intitulado “Randomized trial comparing general anesthesia with anesthesiologist administered deep sedation for ERCP in average-risk patients”, onde os autores conduziram um estudo randomizado, em um hospital terciário de referência em CPRE na Arábia Saudita, com o objetivo de comparar a segurança e a eficácia da sedação profunda assistida pelo anestesiologista com a anestesia geral em pacientes de médio risco.
Métodos:
Todos os pacientes emaiores de 18 anos com ASA menor ou igual a III eram elegíveis para o estudo. Foram excluídos pacientes que precisaram de CPRE de emergência, ASA IV ou V, que tinham anatomia alterada por cirurgia prévia, gestantes, suspeita de IOT difícil pela escala de Mallampati, alérgicos a alguma das medicações anestésicas usadas no estudo para sedação ou não eram aptos a assinar o termo de consentimento.
Os pacientes foram randomizados (1:1) e anestesiologista e endoscopista foram informados no momento do procedimento a que grupo o paciente pertencia.
Para sedação profunda sem IOT foi utilizado propofol em bolus seguido de infusão contínua. Na anestesia geral foram usados cisatracurio como relaxante muscular e propofol para indução. A anestesia profunda foi mantida utilizando anestésicos inalatórios, além de fentanil e outras drogas a critério do anestesiologista.
Os procedimentos foram realizados em decúbito ventral e todos os pacientes foram encaminhados para sala de recuperação pós-anestésica e mantidos sob monitorização contínua sob supervisão do anestesiologista até estarem aptos a alta.
O desfecho primário foi a proporção de pacientes de cada grupo que desenvolveu os seguintes efeitos adversos relacionados a sedação:
- Hipotensão, quando a PAS caiu abaixo de 25% da PAS basal, com necessidade de droga vasoativa;
- Arritmia cardíaca: bradicardia < 50 bpm ou taquicardia > 120 bpm, com necessidade de tratamento;
- Hipóxia, quando a saturação caiu abaixo de 90% em qualquer período de tempo;
- Hipercapnia, quando o CO2 aumentou mais de 25% em relação a linha de base;
- Apnéia, quando a atividade respiratória cessou por 10 segundos via capnografia;
- Ou qualquer interrupção ou suspensão do procedimento devido à sedação.
Os desfechos secundários foram o tempo de indução da sedação, tempo do procedimento, tempo de recuperação, incidência de sucesso na CPRE e incidência de complicações relacionadas a CPRE (sangramento, perfuração e pancreatite).
Resultados
Duzentos e quatro pacientes foram randomizados: 107 no grupo anestesia geral e 97 no grupo sedação profunda sem IOT. Um paciente do grupo da sedação foi retirado por apresentar arritmia após a randomização e antes da administração de qualquer sedativo. Não houve diferença entre os grupos com relação aos dados demográficos, comorbidades e indicação da CPRE.
Com relação ao desfecho primário, 44 pacientes tiveram efeitos adversos relacionados a sedação, que foram significativamente maiores no grupo sedação profunda sem IOT (34/96 – 35%) que no grupo anestesia geral (10/107 – 9%), p<0,001.
Trinta e quatro pacientes do grupo sedação sem IOT tiveram 50 efeitos adversos, portanto alguns pacientes apresentaram mais que um efeito. A maioria desses efeitos resultou na interrupção temporária da CPRE (28/50 – 56%), principalmente pela necessidade de manipulação da via aérea (2 deles necessitando de IOT e conversão para anestesia geral) porém os procedimentos foram concluídos. Não houve necessidade dessa interrupção temporária no grupo da anestesia geral.
Exceto pelo tempo de indução que foi significativamente maior no grupo da anestesia geral (p<0,001), a duração da CPRE e o tempo de recuperação foi similar em ambos os grupos. Houve 02 sangramentos e 01 perfuração no grupo sedação sem IOT e não houve complicação relacionada a CPRE no grupo IOT.
Para identificar os fatores preditores dos efeitos adversos, foi feita análise univariada. Entretanto, nenhuma das variáveis incluindo gênero, idade, ASA, IMC, comorbidades, escala de Mallampati, indicação do procedimento, tempo do procedimento ou uso do fentanil foi significativamente associada a efeitos adversos.
Na regressão logística multivariada usando as variáveis mencionadas acima, o tempo do procedimento foi significativamente associado com efeitos adversos (OR 1,016; p= 0,026). Após remover as interrupções do procedimento e focar apenas nos eventos cardiorrespiratórios, o tempo do procedimento não foi mais significativo no modelo multivariado.
Discussão
Esse estudo randomizado mostrou que, para pacientes de médio risco que serão submetidos a CPRE, a anestesia geral está associada a significativamente menor risco de efeitos adversos relacionados a sedação quando comparada à sedação profunda sem IOT (9% x 35%, respectivamente; p< 0,001)
O tempo do procedimento foi um preditor independente para efeitos adversos. Porém, a associação entre duração do procedimento e efeitos adversos é complicada. A complexidade do procedimento, a dificuldade na canulação e o tipo de intervenção terapêutica prolongam a CPRE, o que potencialmente agrava os efeitos adversos. Por outro lado, os efeitos adversos e a necessidade de resolvê-los podem prolongar a duração do procedimento, o que dificulta estabelecer uma relação de causalidade com certeza.
Leia o artigo na íntegra (grátis) em: https://www.giejournal.org/article/S0016-5107(22)01739-4/fulltext