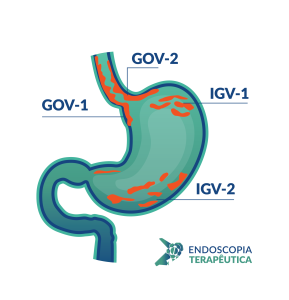
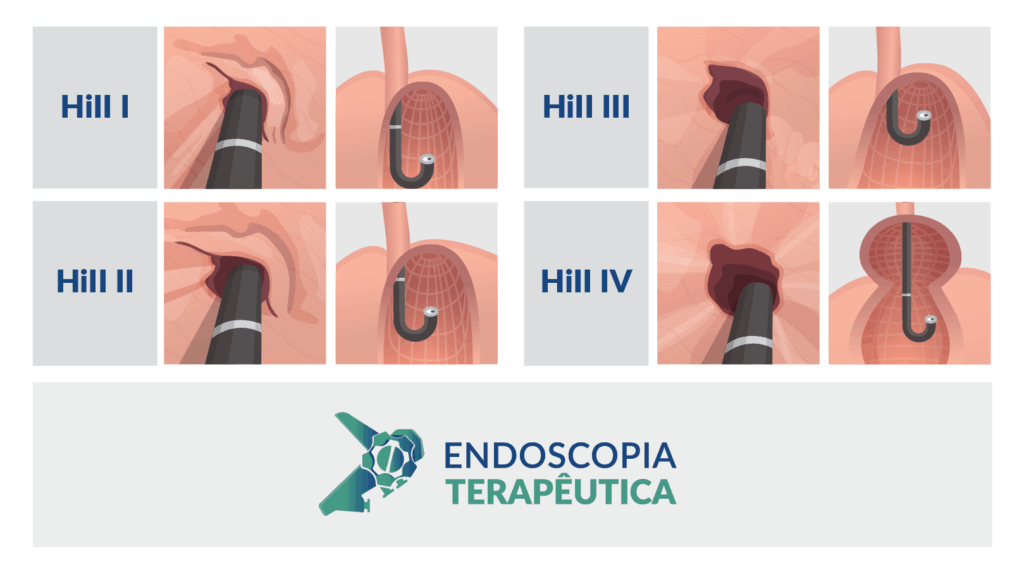
Classificação de Hill
Objetivo
Avaliar endoscopicamente a competência da junção esofagogástrica por meio da observação da prega valvar gastroesofágica, classificando-a em graus que se correlacionam com o risco de doença do refluxo gastroesofágico (DRGE).
Critérios
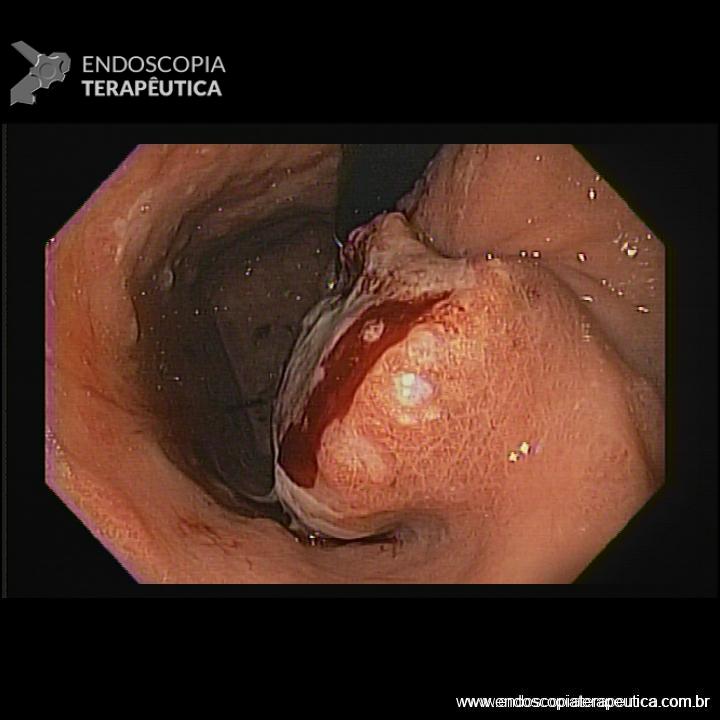
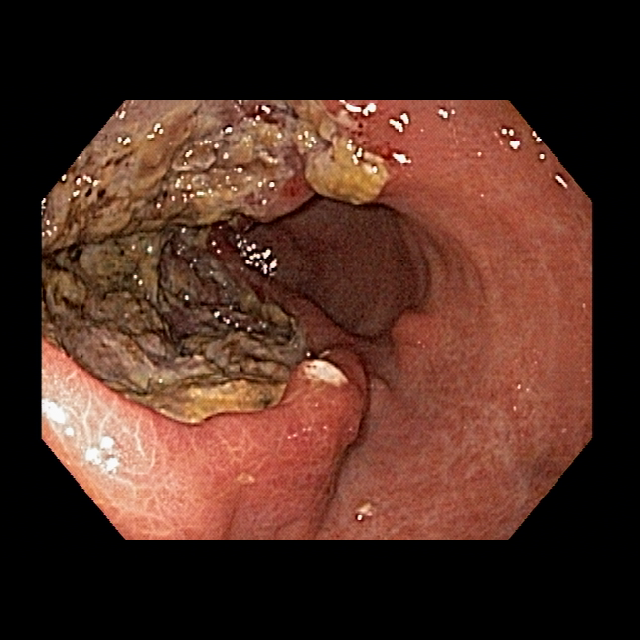
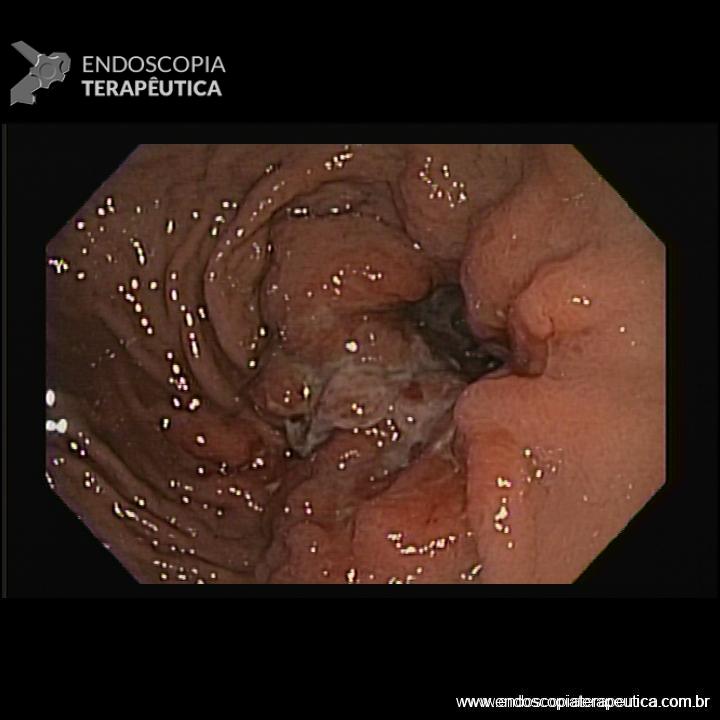
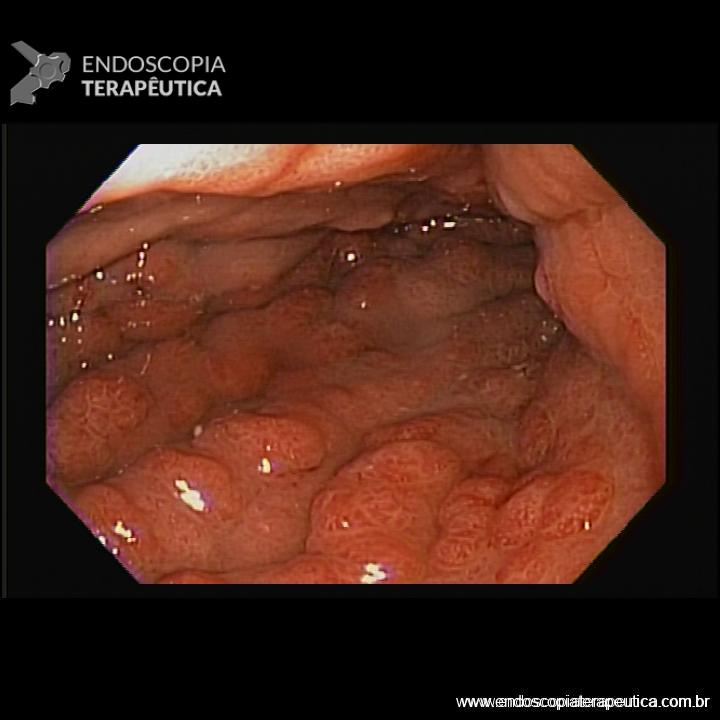
A aparência da válvula ao retroflexo do endoscópio é graduada de I a IV:
- Grau I: prega mucosa proeminente ao longo da pequena curvatura, firmemente adaptadas ao endoscópio.
- Grau II: prega presente, mas com abertura intermitente durante a respiração, fechando rapidamente.
- Grau III: prega pouco definida, fechamento incompleto ao redor do endoscópio; geralmente associada à hérnia hiatal.
- Grau IV: ausência de prega; junção permanece aberta com visualização do epitélio escamoso; hérnia hiatal quase sempre presente.
Aplicação clínica
Predição de doença e necessidade de tratamento
- Estudo de coorte (922 pacientes, 6 anos de seguimento, 2023):
- Hill III–IV → fortemente associados a esofagite e necessidade de prescrição de uso de inibidores de bomba de próton ao longo do seguimento.
- Hill IV → maior associação com esôfago de Barrett.
- Hill II–III → maior frequência de esofagite quando comparados ao Grau I.
- Observou-se que, à medida que o grau aumenta, cresce também a prevalência de sintomas de refluxo (pirose).
Implicações terapêuticas (ASGE)
- Hill I–II → podem ser submetidos a procedimentos endoscópicos de correção de refluxo.
- Hill III–IV → geralmente indicam necessidade de tratamento cirúrgico, dado o envolvimento anatômico do hiato e a insuficiência de terapias exclusivamente endoscópicas.
Importância na prática endoscópica
A classificação de Hill fornece um marcador objetivo da barreira mecânica antirrefluxo na transição esofagogástrica, é recomendada por guidelines internacionais e ,quando incorporadas à avaliação endoscópica de pacientes com suspeita de DRGE, podem auxiliar tanto o seguimento clínico quanto a estratégia terapêutica (endoscópica vs cirúrgica).
Referência
Hill LD, Kozarek RA, Kraemer SJM, Aye RW, Mercer CD, Low DE, Pope CE II. The gastroesophageal flap valve: in vitro and in vivo observations. Gastrointest Endosc. 1996;44(5):541-547. doi:10.1016/S0016-5107(96)70006-8
Cheong JH, Kim GH, Lee BE, et al. Endoscopic grading of gastroesophageal flap valve helps predict proton pump inhibitor response in patients with gastroesophageal reflux disease. Scand J Gastroenterol. 2011 Jul;46(7-8):789-96. doi: 10.3109/00365521.2011.579154. Epub 2011 May 26. PMID: 21615222.
ASGE Standards of Practice Committee; Desai M, Ruan W, Thosani NC, Amaris M, Scott JS, Saeed A, Abu Dayyeh B, Canto MI, Abidi W, Alipour O, Amateau SK, Cosgrove N, Elhanafi SE, Forbes N, Kohli DR, Kwon RS, Fujii-Lau LL, Machicado JD, Marya NB, Ngamruengphong S, Pawa S, Sheth SG, Thiruvengadam NR, Qumseya BJ; ASGE Standards of Practice Committee Chair. American Society for Gastrointestinal Endoscopy guideline on the diagnosis and management of GERD: summary and recommendations. Gastrointest Endosc. 2025 Feb;101(2):267-284. doi: 10.1016/j.gie.2024.10.008. Epub 2024 Dec 17. PMID: 39692638.
Veja mais: Você sabe avaliar o hiato diafragmático?