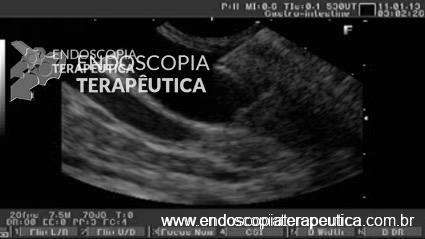
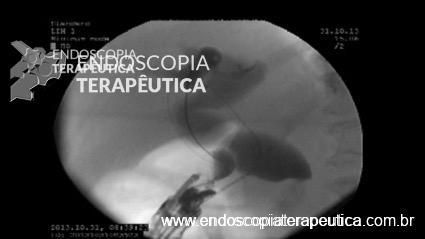
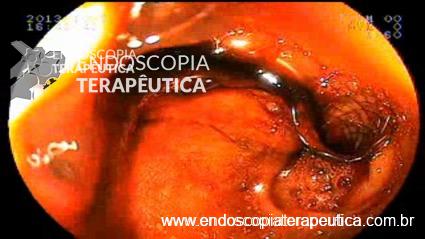
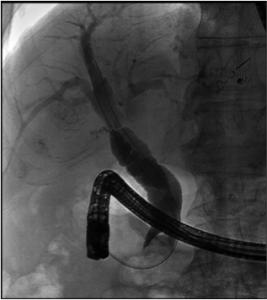
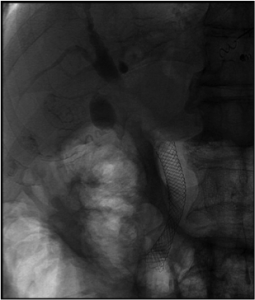
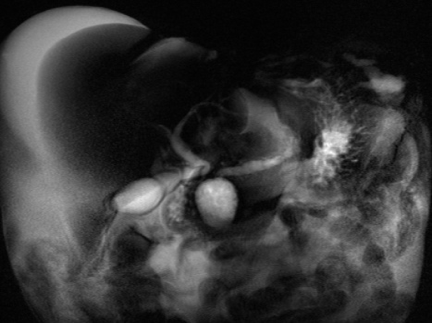
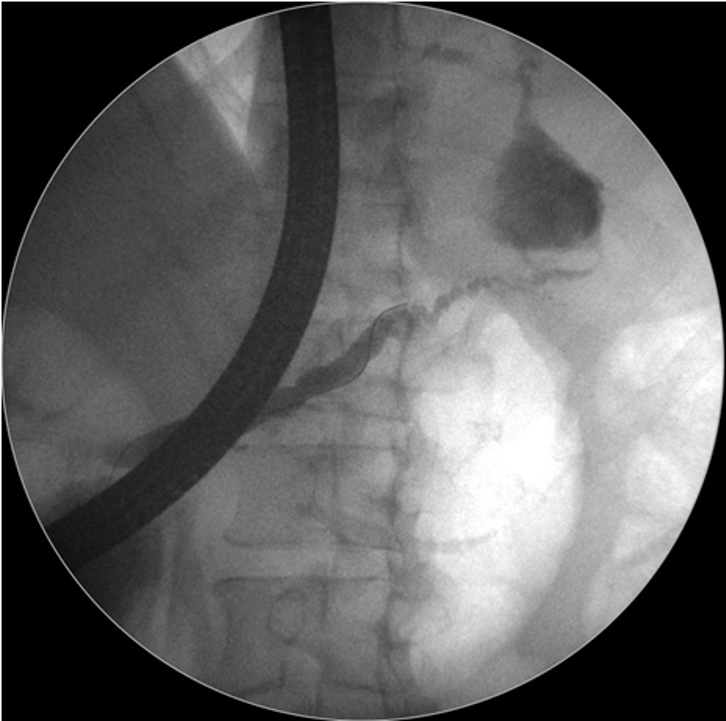
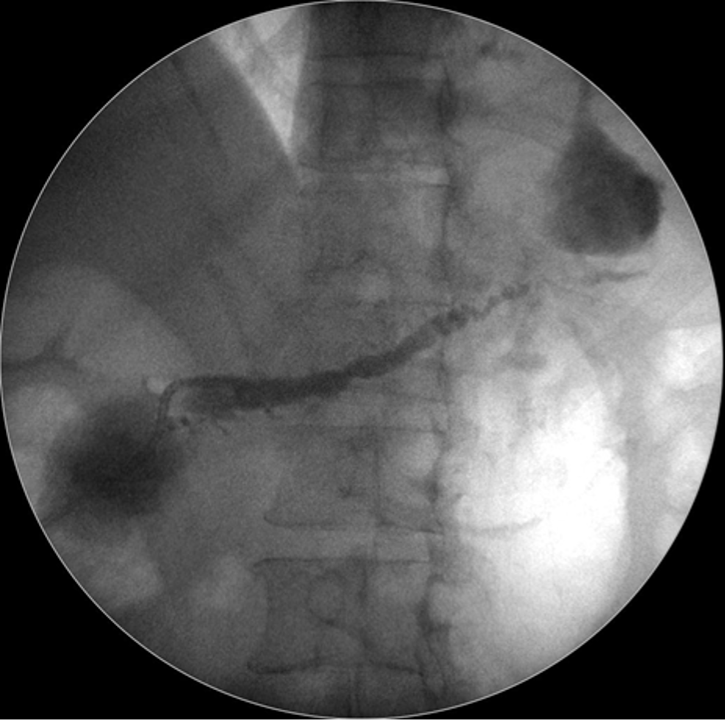
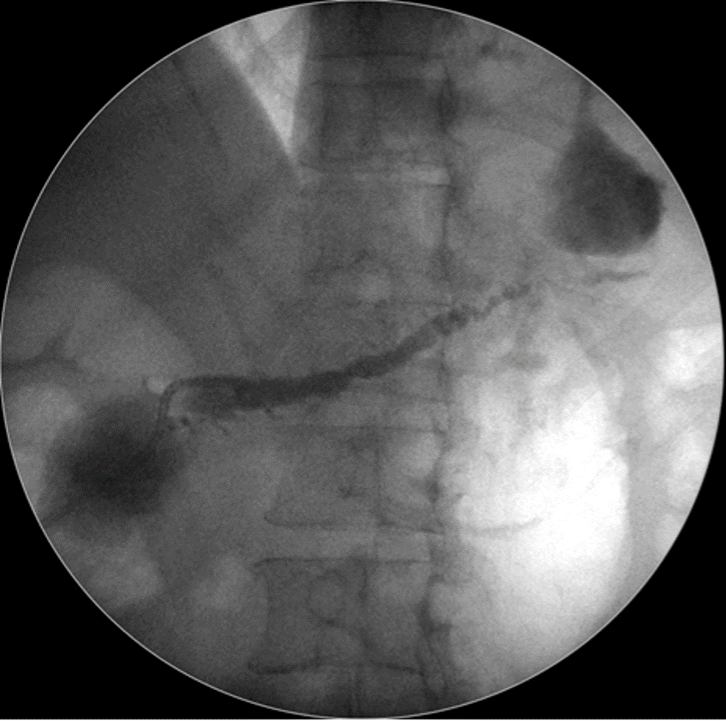
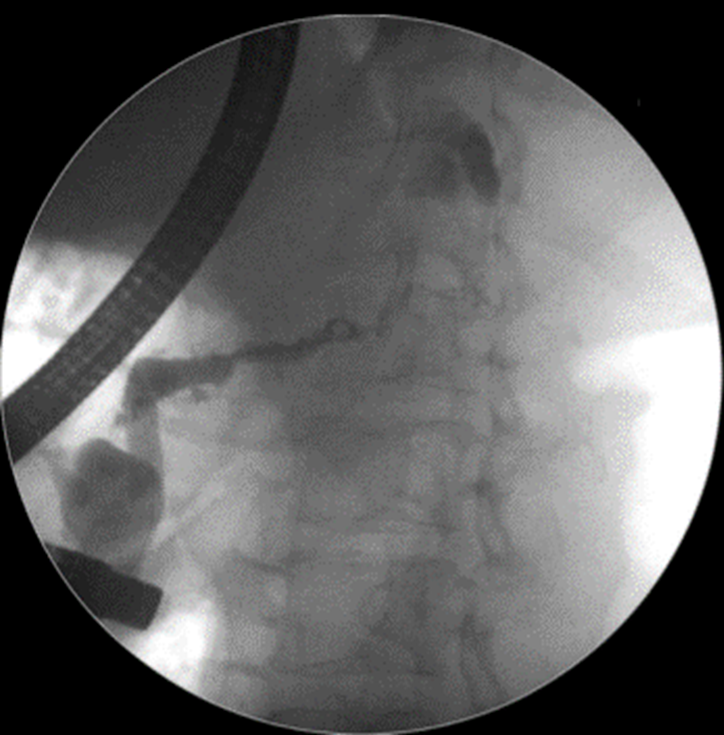
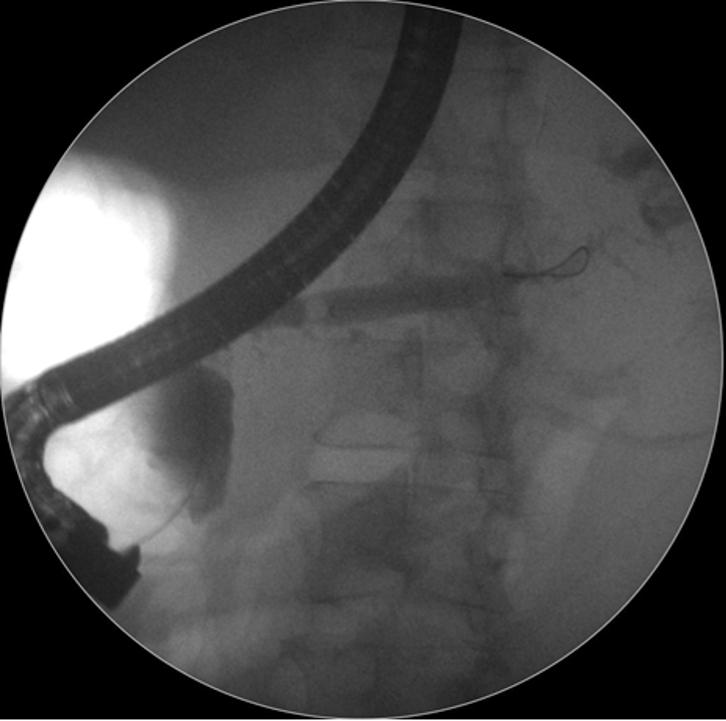
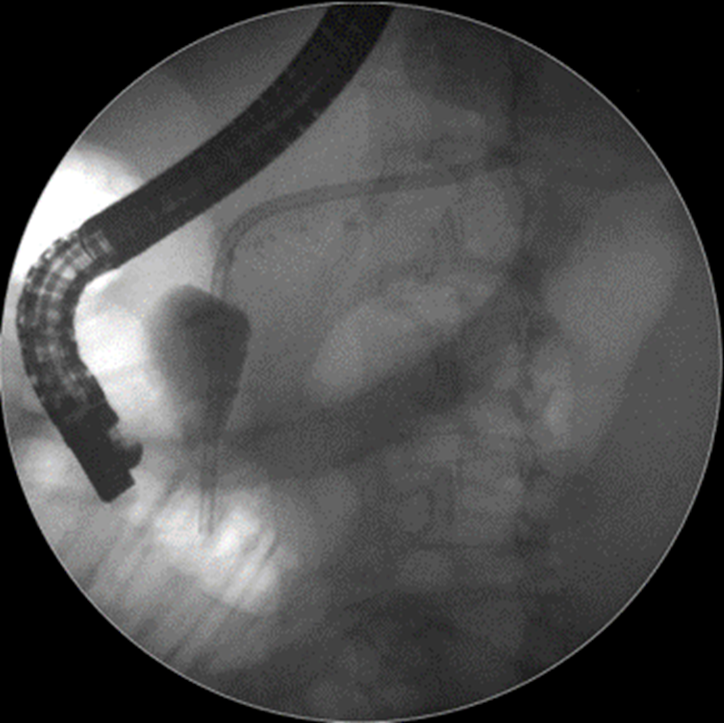
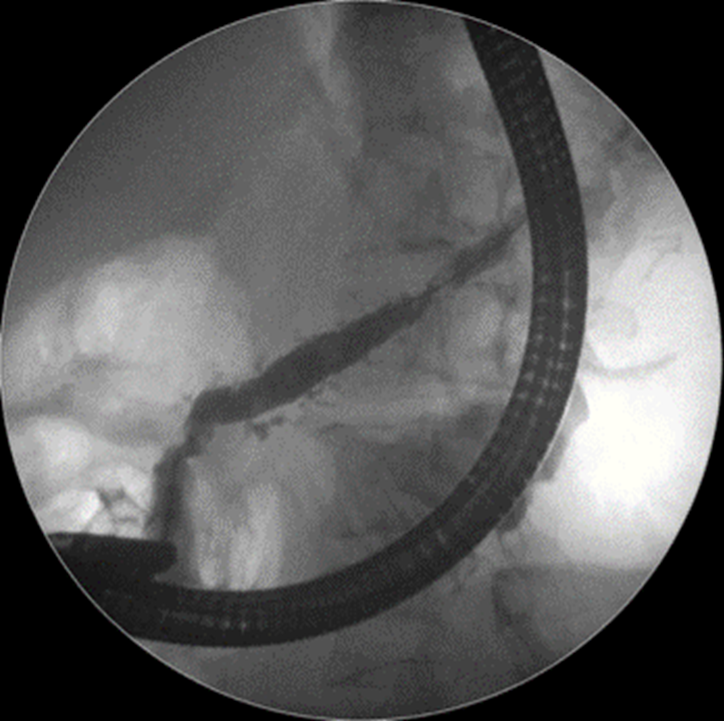
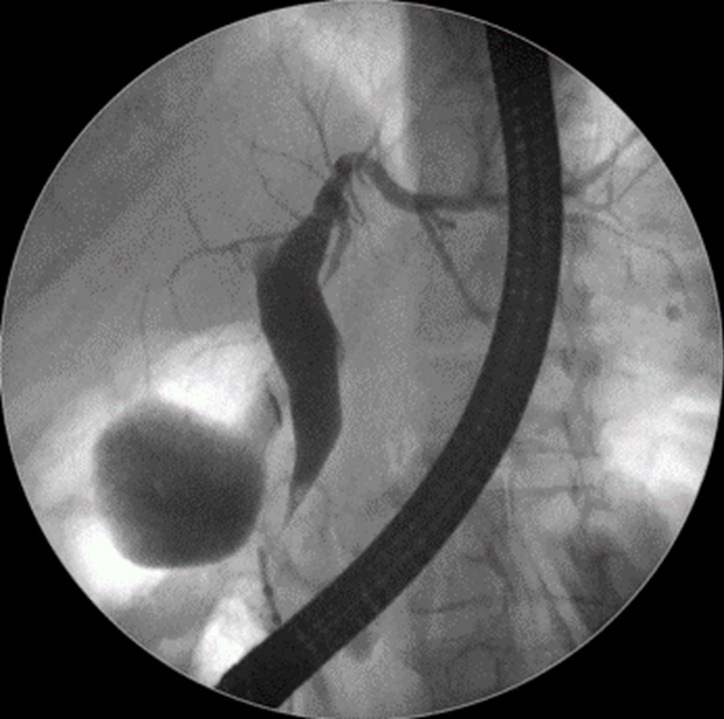
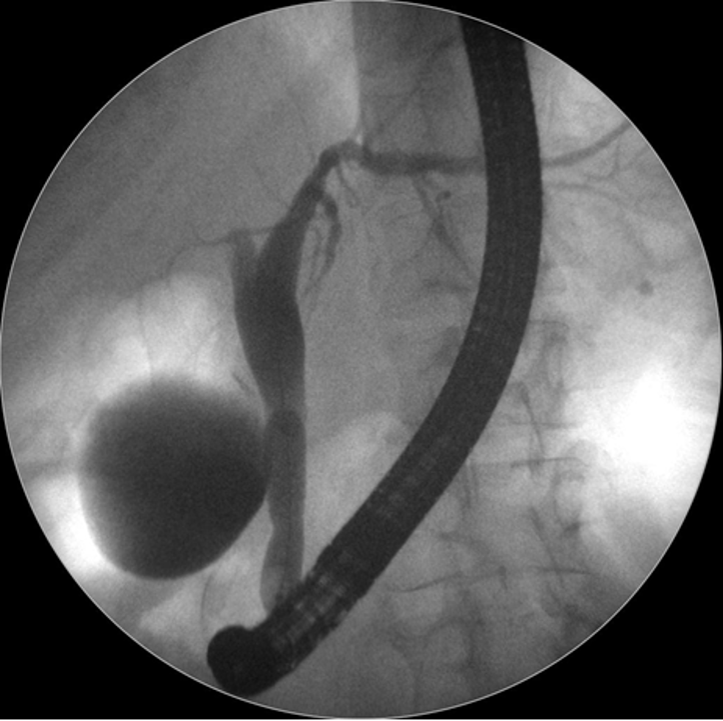
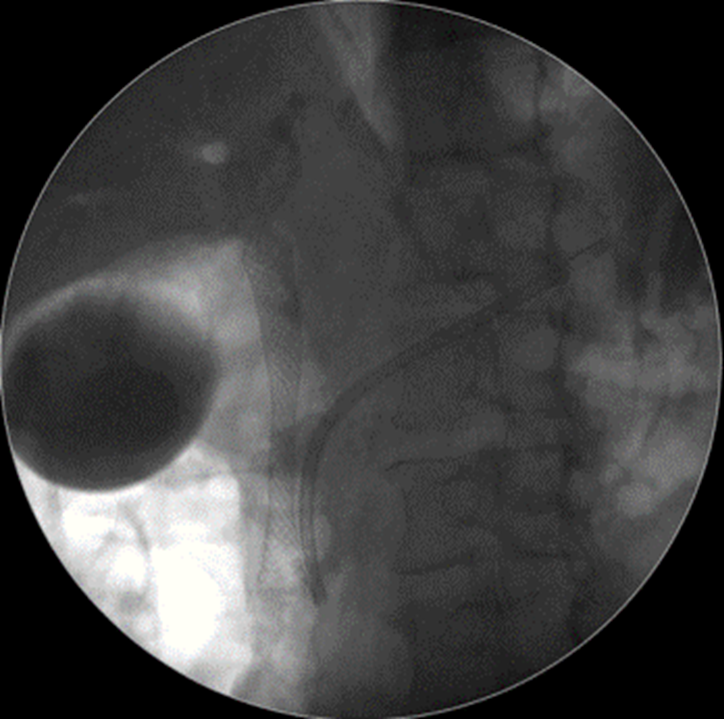
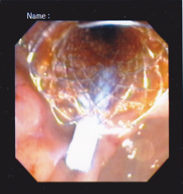
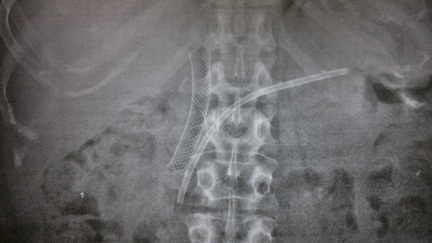
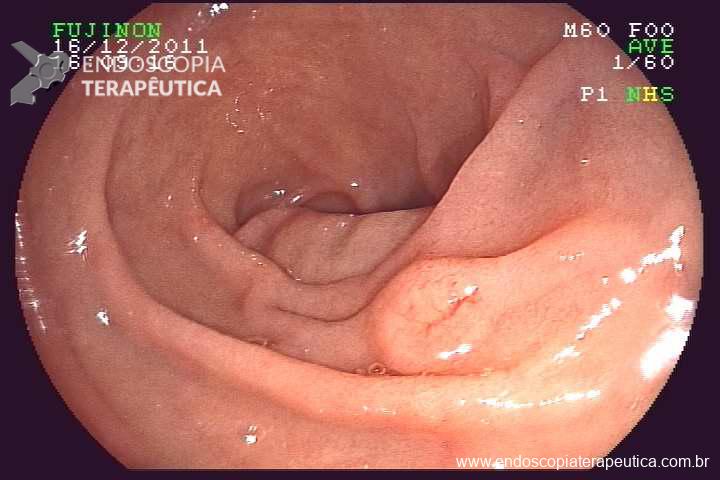
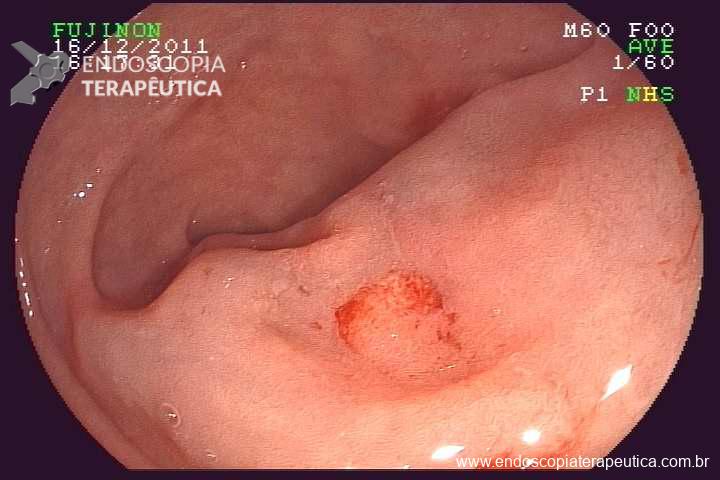
Caso Clínico – Drenagem endoscópica transmural ecoguiada de coleção peripancreática pós operatória
As coleções fluidas pós-operatórias são uma complicação bem reconhecida após ressecções pancreáticas e podem levar ao aumento da mortalidade e do tempo de internação hospitalar.
A pancreatectomia distal envolve a ressecção do parênquima pancreático à esquerda da veia porta. A morbidade pós-operatória varia de 9% a 31%, sendo as coleções fluidas peripancreáticas (PFC) uma complicação encontrada em 4% até 40% dos casos e possuindo na fístula pancreática uma das principais causas.
Embora a maioria das PFC pós pancreatectomia distal sejam manejadas conservadoramente por nutrição parenteral total, antibióticos e octreotide intravenoso, cerca de 40% dos casos necessitam de intervenções adicionais.
O caso a seguir é de uma paciente do sexo feminino com 51 anos de idade, que foi referenciada ao nosso serviço para tratamento endoscópico de uma PFC infectada (abscesso intra-abdominal) 28 dias após Pancreatectomia corpo-caudal por um IPMN de ducto principal. Na ocasião apresentava febre e dor abdominal refratárias a tentativa de tratamento clínico (antibioticoterapia).
CASO CLÍNICO
DISCUSSÃO
O tratamento das PFC secundárias a cirurgia pancreática variou ao longo do tempo de cistogastrostomia ou cistoduodenostomia cirúrgica, drenagem percutânea e, mais recentemente, drenagem endoscópica transluminal.
Existem 2 modalidades minimamente invasivas utilizadas para drenar as PFC pós operatórias:
- Percutânea: tem sido frequentemente a modalidade de escolha para a drenagem de PFC que surgem após a ressecção da cauda pancreática, embora a taxa de sucesso seja menor para PFC infectada, com uma maior taxa de fístula permanente em comparação a PFC não infectada. Cateteres percutâneos podem permanecer no local por várias semanas, prolongando a permanência no hospital para troca e manutenção dos mesmos.
- Endoscópica: é uma modalidade consagrada para o tratamento das PFC que surgem como uma complicação da pancreatite aguda ou crônica com altas taxas de sucesso, no entanto, seu uso para tratamento das PFC pós pancreatectomia é pouco relatado, apesar do potencial para drenagem efetiva e rápida recuperação.
Recentemente, a drenagem endoscópica transluminal ecoguiada tem sido utilizada com sucesso no tratamento das coleções fluidas peripancreáticas pós-operatórias. Varadarajulu e colaboradores relataram sua experiência em 2011 usando drenagem endoscópica ecoguiada no manejo de PFC após pancreatectomia distal em 20 pacientes, com uma taxa de sucesso técnico e clínico de 100% e sem complicações imediatas ou tardias. Gupta e colaboradores descreveram a drenagem endoscópica ecoguiada no pós-operatório de 43 pacientes submetidos a vários tipos de cirurgia abdominal, com taxas de sucesso técnico e clínico de 100% e 79%, respectivamente, nos pacientes de cirurgia pancreática. Além disso, em outro estudo do Memorial Sloan-Kettering Cancer Center, Kwon e colaboradores descreveram uma taxa de sucesso técnico e clínico de 100% com drenagem endoscópica ecoguiada de 9 pacientes com coleções fluidas pós-operatórias.
Um detalhe importante a considerar é que as PFC pós-operatórias, embora resultantes na maioria dos casos de fístulas do ducto pancreático, podem conter debris sólidos devido à subsequente incorporação de tecido necrótico que foi dissolvido enzimaticamente pelo suco pancreático. Assim, uma vantagem potencial para a drenagem endoscópica transluminal é a capacidade de debridamento de materiais sólidos ou de tecido necrótico por necrosectomia direta, que não podem ser realizados usando drenos percutâneos de pequeno diâmetro.
Alguns pontos permanecem controversos no manejo das PFC pós pancreatectomias:
- A drenagem transpapilar com colocação de stent de ducto pancreático para fístulas pancreáticas pós-operatórias tem mostrado algum sucesso em pacientes selecionados, no entanto seu uso rotineiro para resolução das FPC pós pancreatectomias ainda não pode ser recomendado.
- O momento ideal de realizar a drenagem endoscópica também não está estabelecido. A maioria dos estudos exclui pacientes com PFC <4 semanas por causa da presumida falta de maturação da parede. Existem dados limitados sobre a avaliação do sucesso e segurança da drenagem realizada em até 4 semanas da cirurgia. No entanto, há provavelmente uma diferença entre as PFC por complicações de pancreatite vs. ressecção pancreática em virtude das aderências que formam a partir da cirurgia, o que pode contribuir na prevenção de vazamento intraperitoneal.
Outro aspecto que merece ser ressaltado é quanto ao modelo dos stents utilizados nas drenagens. Praticamente todos os trabalhos utilizaram stents plásticos (duplo pigtail) em detrimento de stents metálicos. O manejo tradicional inclui o uso de múltiplos stents plásticos, que não foram especificamente projetados para drenagem transluminal e consequentemente requerem várias revisões por obstrução devido ao seu pequeno diâmetro. Os stents biliares metálicos auto-expansíveis (SEMS) totalmente cobertos foram empregados com a esperança que um diâmetro luminal maior facilitaria uma drenagem mais eficaz e durável. Infelizmente, os SEMS’s podem migrar ou ocasionar injúria tecidual com sangramento quando sua extremidade encosta na parede do lúmen.
Com o advento dos stents metálicos de aposição de lúmen (LAMS), as limitações técnicas descritas estão sendo superadas e provavelmente ocorrerá uma mudança de paradigma sobre o assunto, todavia o uso destes novos dispositivos ainda não está amplamente disseminado, especialmente para as PFC pós cirúrgicas, razão pela qual não foram utilizados nos trabalhos mencionados.
Em resumo, a drenagem endoscópica é pelo menos tão segura e eficaz quanto a drenagem percutânea para PFC que surgem após a pancreatectomia distal. Os menores tempo de internação hospitalar e uso de tomografias, além das demais ponderações aqui realizadas, tornam a modalidade endoscópica uma importante estratégia de tratamento dessa comum e difícil complicação, com potencial de se transformar no método de primeira linha brevemente. Uma abordagem multidisciplinar que envolva cirurgiões, endoscopistas e radiologistas intervencionistas provavelmente produzirá os melhores resultados para esses pacientes.
REFERÊNCIAS
– Azeem N, Baron TH, Topazian MD, Zhong N, Fleming CJ, Kendrick ML. Outcomes of endoscopic and percutaneous drainage of pancreatic fluid collections arising after pancreatic tail resection. J Am Coll Surg. Elsevier Inc.; 2012;215(2):177–85.
– Kwon YM, Gerdes H, Schattner M a., Brown KT, Covey AM, Getrajdman GI, et al. Management of peripancreatic fluid collections following partial pancreatectomy: A comparison of percutaneous versus EUS-guided drainage. Surg Endosc Other Interv Tech. 2013;27(7):2422–7.
– Mandai K, Uno K, Yasuda K. Endoscopic ultrasound-guided drainage of postoperative intra-abdominal abscesses. World J Gastroenterol. 2015;21(11):3402–8.
– Prasad G a., Varadarajulu S. Endoscopic Ultrasound-Guided Abscess Drainage. Gastrointest Endosc Clin N Am. Elsevier Inc; 2012;22(2):281–90.
– Tilara A, Gerdes H, Allen P, Jarnagin W, Kingham P, Fong Y, et al. Endoscopic ultrasound-guided transmural drainage of postoperative pancreatic collections. J Am Coll Surg. American College of Surgeons; 2014;218(1):33–40.
– Varadarajulu S, Wilcox CM, Christein JD. EUS-guided therapy for management of peripancreatic fluid collections after distal pancreatectomy in 20 consecutive patients. Gastrointest Endosc. Elsevier Inc.; 2011;74(2):418–23.