Manejo endoscópico no tratamento paliativo de fístula traqueoesofágica de origem tumoral
O câncer de esôfago é frequentemente diagnosticado em um estágio avançado e incurável.
Embora a paliação cirúrgica possa ser considerada em pacientes sem doença metastática e com bom risco operatório, pacientes com risco cirúrgico elevado tendem a se beneficiar mais através de tratamentos não cirúrgicos. Inclusive, com essas abordagens, não raro, apresentam melhora expressiva da disfagia.
A paliação desse sintoma pode frequentemente ser alcançada por radiação, com ou sem quimioterapia associada. No entanto, essa melhora pode ocorrer somente após várias semanas, fazendo com que por diversas vezes haja comprometimento do quadro clínico e complicações associadas (sangramentos, obstrução, fístula esofágica, aspiração, desnutrição, etc).
Pacientes sintomáticos que não são candidatos à radioquimioterapia, aqueles que apresentam disfagia recorrente mesmo após terapêutica ou naqueles que ocorre certas complicações (fístulas por exemplo), podem se beneficiar com tratamentos endoscópicos paliativos e, embora vários métodos endoscópicos tenham sido descritos, o stent esofágico (PMAE – prótese metálica auto-expansível) é provavelmente o mais usado .
Em uma diretriz de 2013, a Sociedade Americana de Endoscopia Gastrointestinal (ASGE) recomendou o implante de stent esofágico como o método preferido para paliação de disfagia em pacientes com fístulas secundárias ao câncer de esôfago .
Como regra geral, as abordagens paliativas para o câncer de esôfago inoperável devem basear-se nas características do paciente, do tumor, nos objetivos do tratamento e nas preferências do paciente e da equipe médica assistente .
Relato de caso:
Manejo endoscópio no tratamento paliativo de fístula traqueoesofágica após RT e QT.
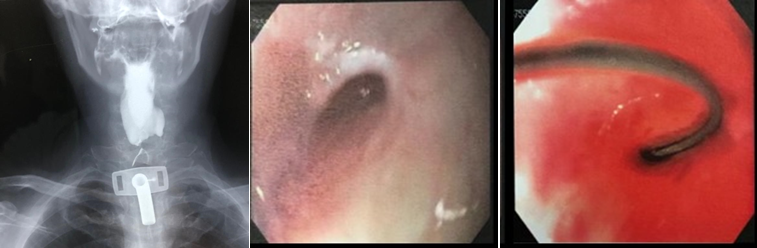
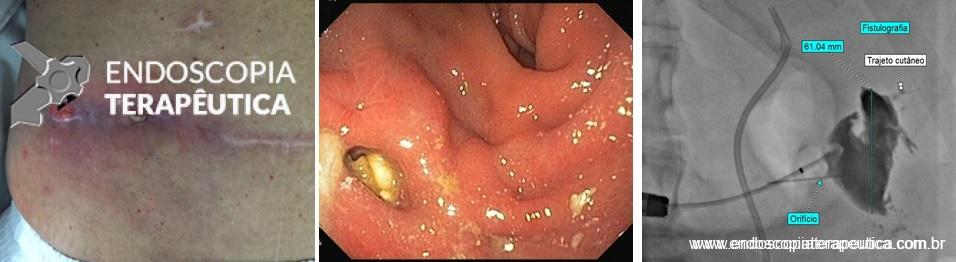
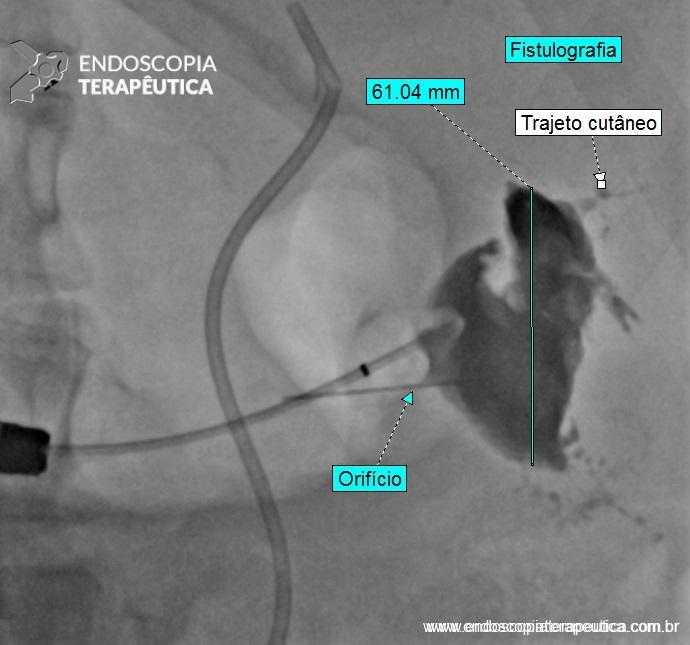
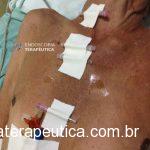
Paciente P. S. J. , masculino, 58 anos, de profissão “seresteiro”, tabagista e etilista há mais de 40 anos (SIC) , diagnosticado como portador de neoplasia esofágica avançada (tumor epidermóide) com comprometimento pulmonar e linfonodal. Foi submetido à tratamento sistêmico – QT e a RT evoluindo com fístula traqueoesofágica a qual impedia a ingestão de alimentos.
Permaneceu com SNE por 2 meses e posteriormente foi realizada uma jejunostomia para manutenção da nutrição enteral.
Após 4 meses da confecção do acesso jejunal, foi encaminhado ao serviço de endoscopia terapêutica pela equipe oncológica para avaliação de implante de PMAE.
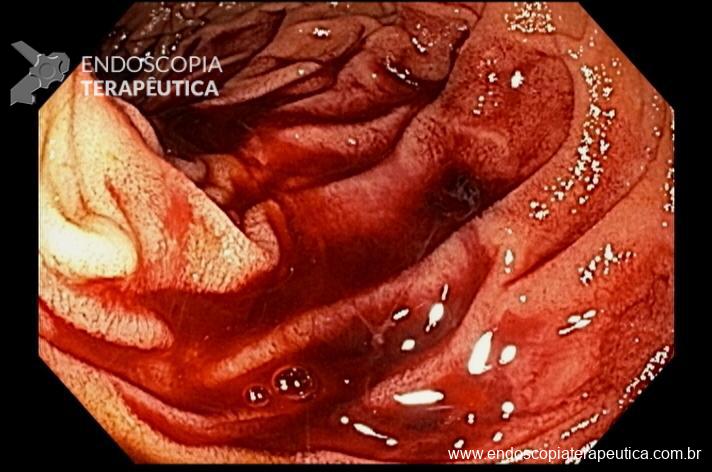
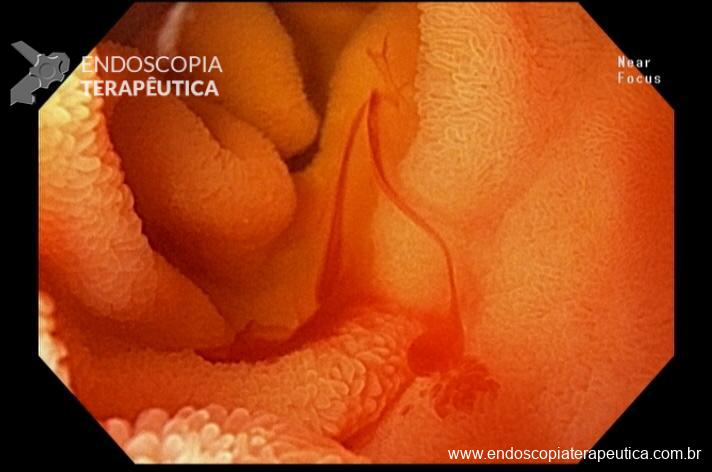
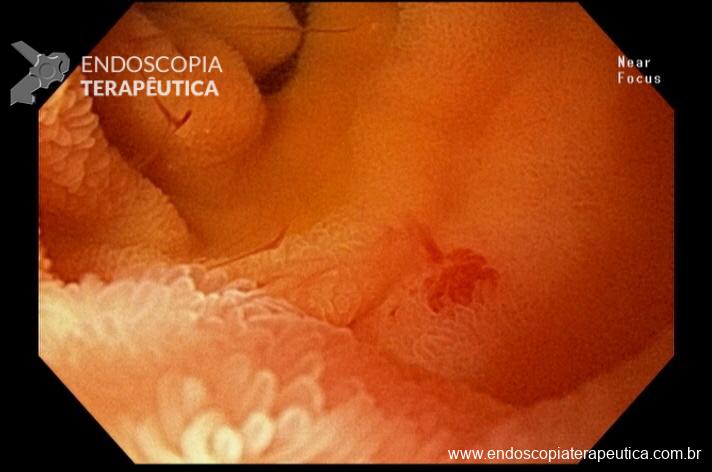
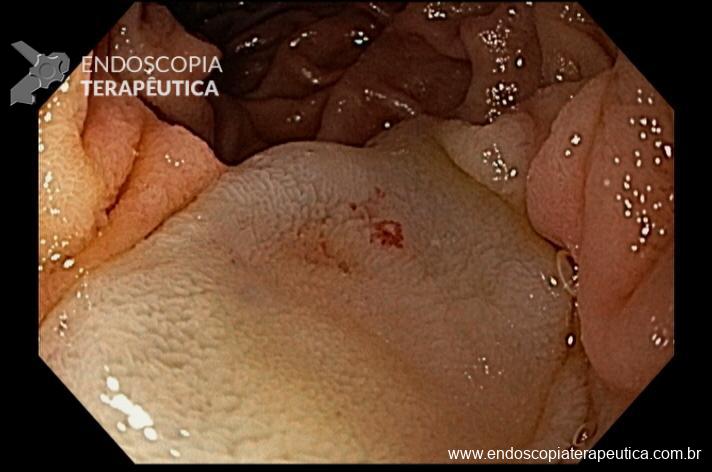
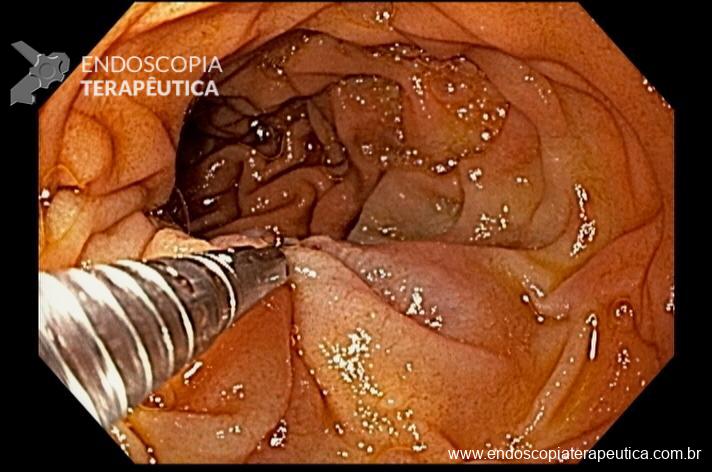
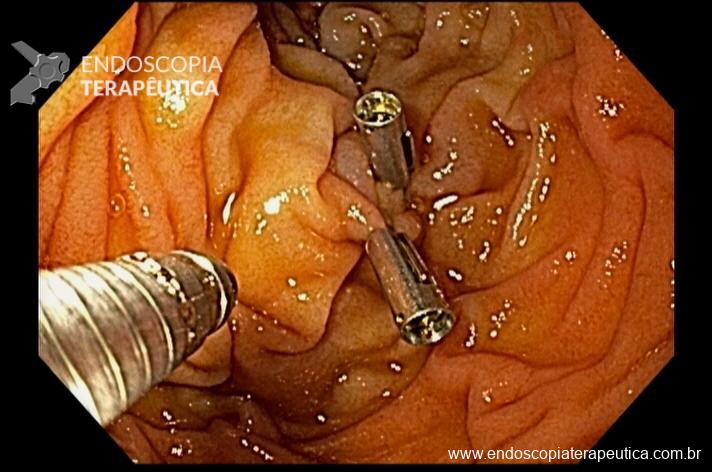
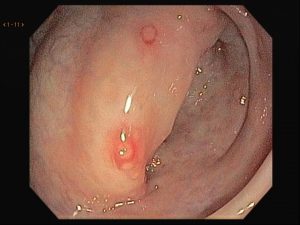
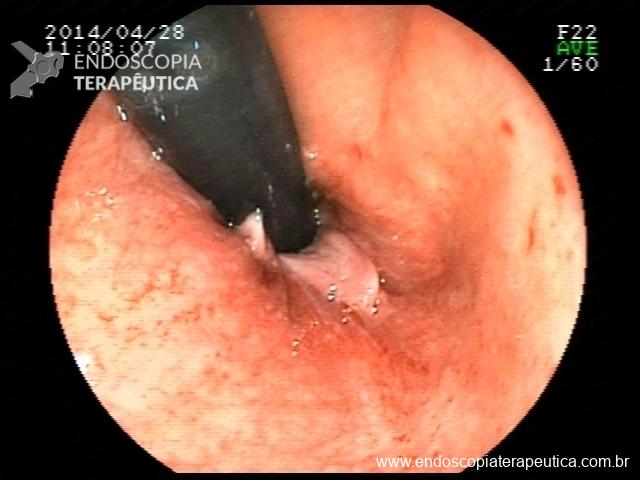
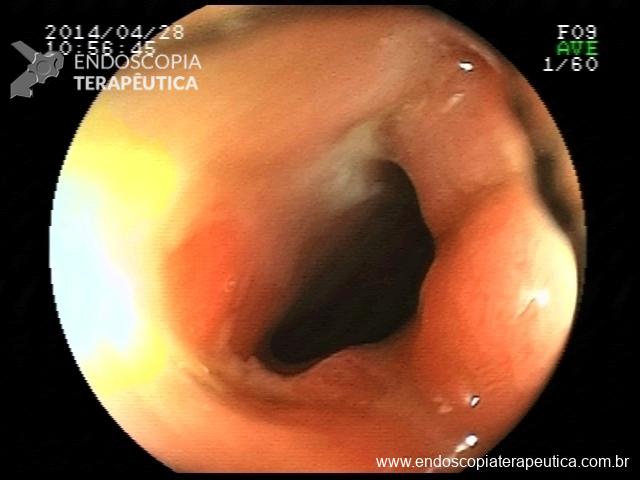
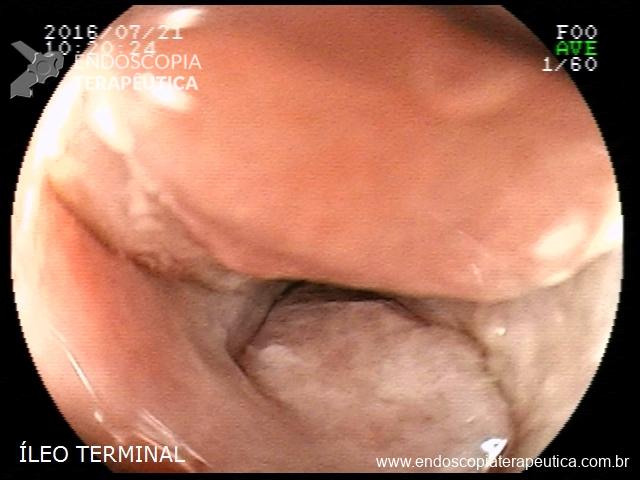
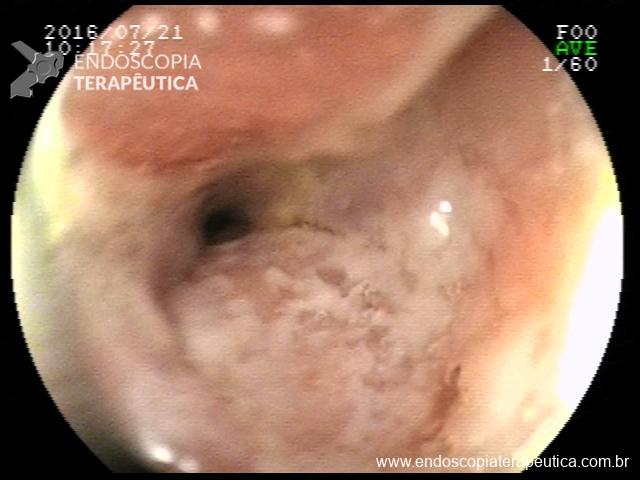
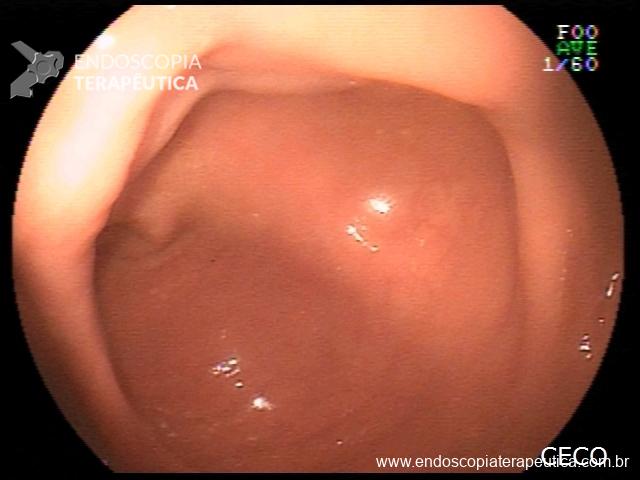
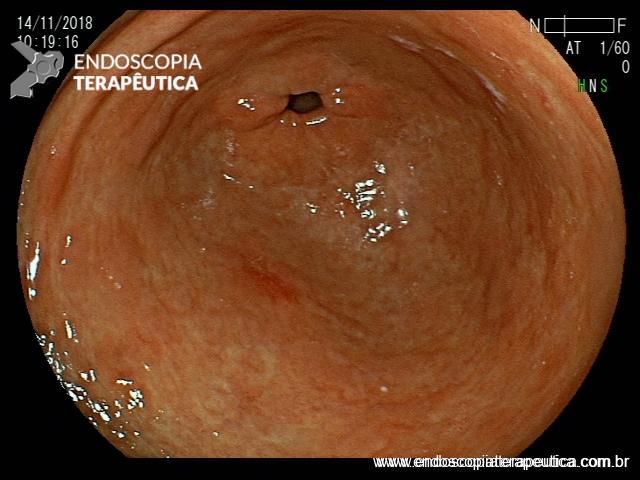
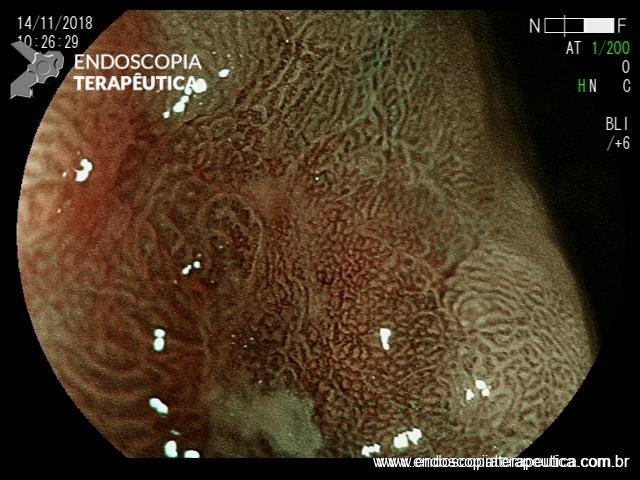
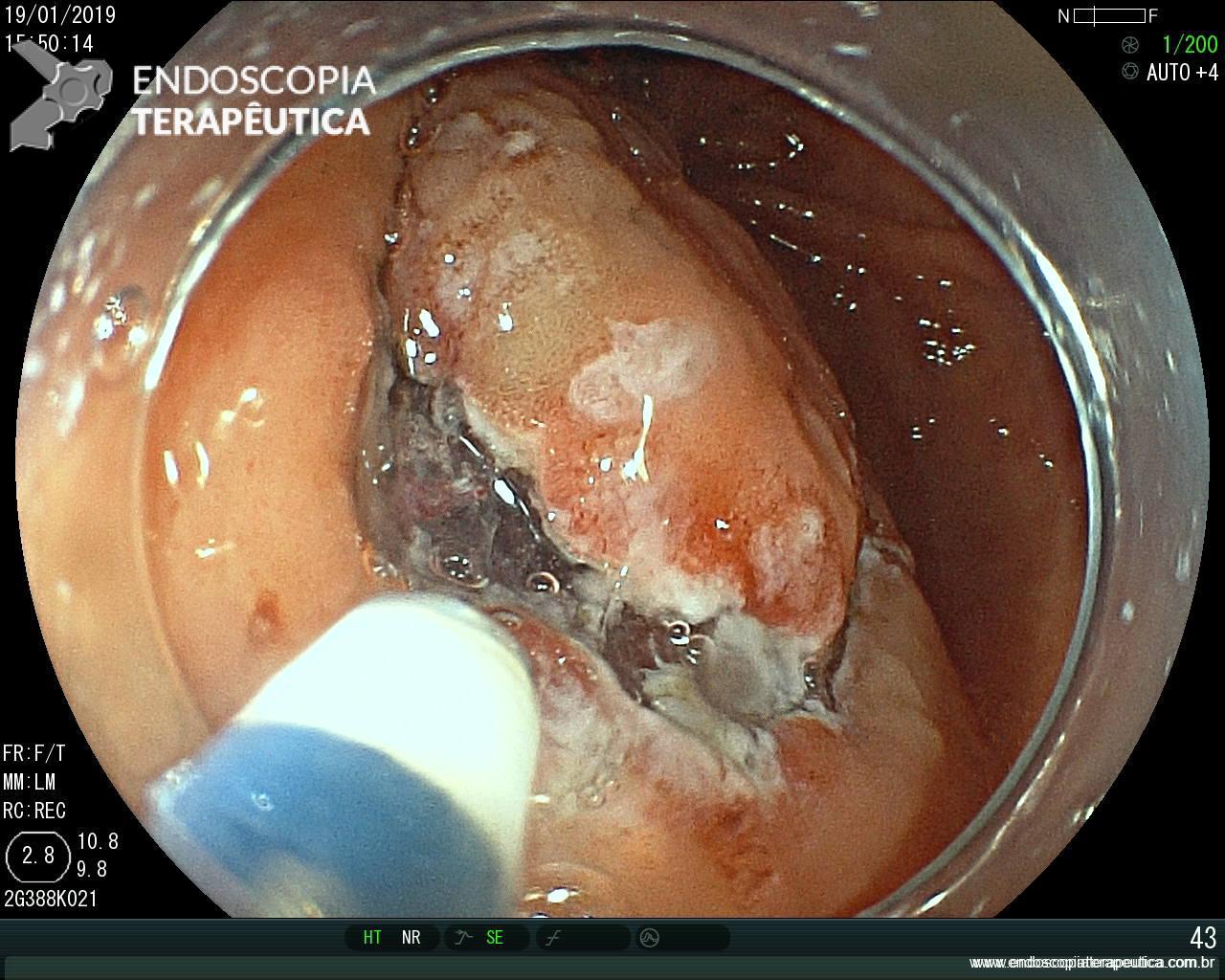
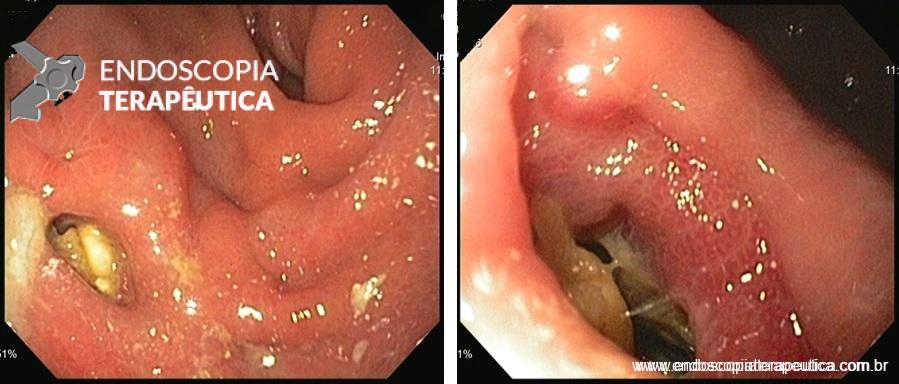
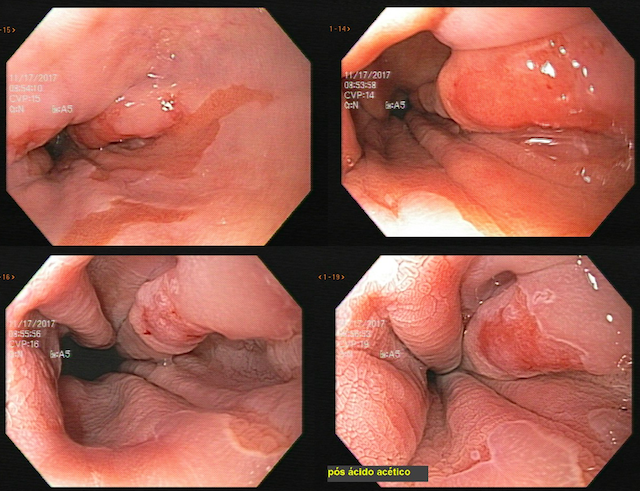
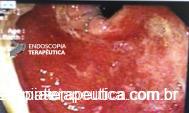
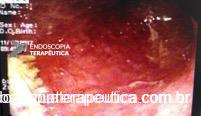
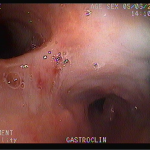
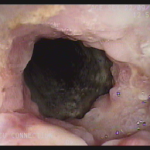
A EDA evidenciou ao nível do esôfago torácico, presença de orifício grande fistuloso que permitia a nítida visualização da árvore respiratória. Não havia estenose associada e a passagem do endoscópio para o estômago se fazia sem resistências.
Em conjunto com a equipe oncológica, optamos pelo implante de uma PMAE parcialmente recoberta.
Procedimento terapêutico:
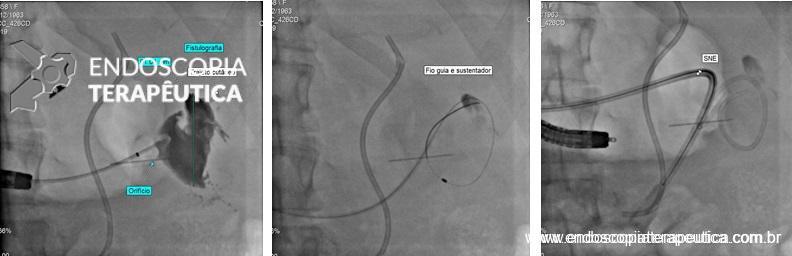
EDA – implante de PMAE
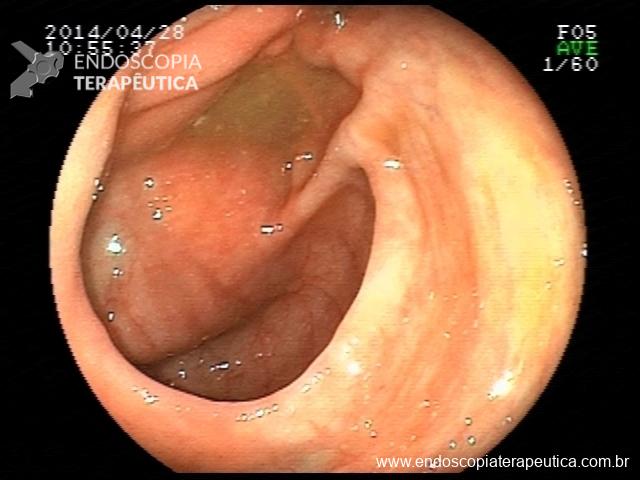
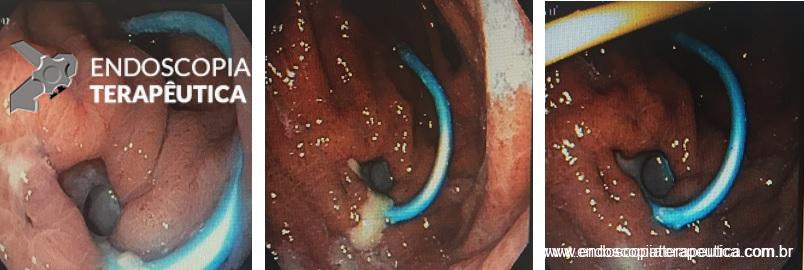
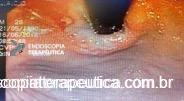
Introduzimos o fio-guia até o duodeno, retiramos o endoscópio e, sob radioscopia, liberamos PMAE parcialmente recoberta de 105 mm x 23 mm. A mesma revestiu completamente o orifício fistuloso, preservando o esôfago cervical e a região da TEG.
Obs: a ingestão de líquidos foi liberada após 24 horas do implante da PMAE e após 72 horas foi liberada a ingesta de alimentos sólidos.
Nos primeiros 5 dias queixou-se de dor torácica de leve a moderada intensidade a qual respondeu bem a analgésicos intravenosos que posteriormente (após 3 dias) foram administrados pela via oral.
Paciente recebeu alta hospitalar após 7 dias do implante (permeneceu internado para término do tratamento de pneumonia com antibioticoterapia intravenosa).
Clique sobre as imagens abaixo para ampliá-las :
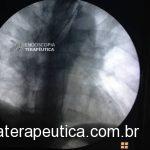
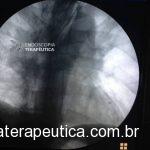
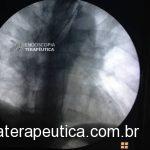
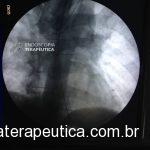
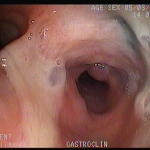
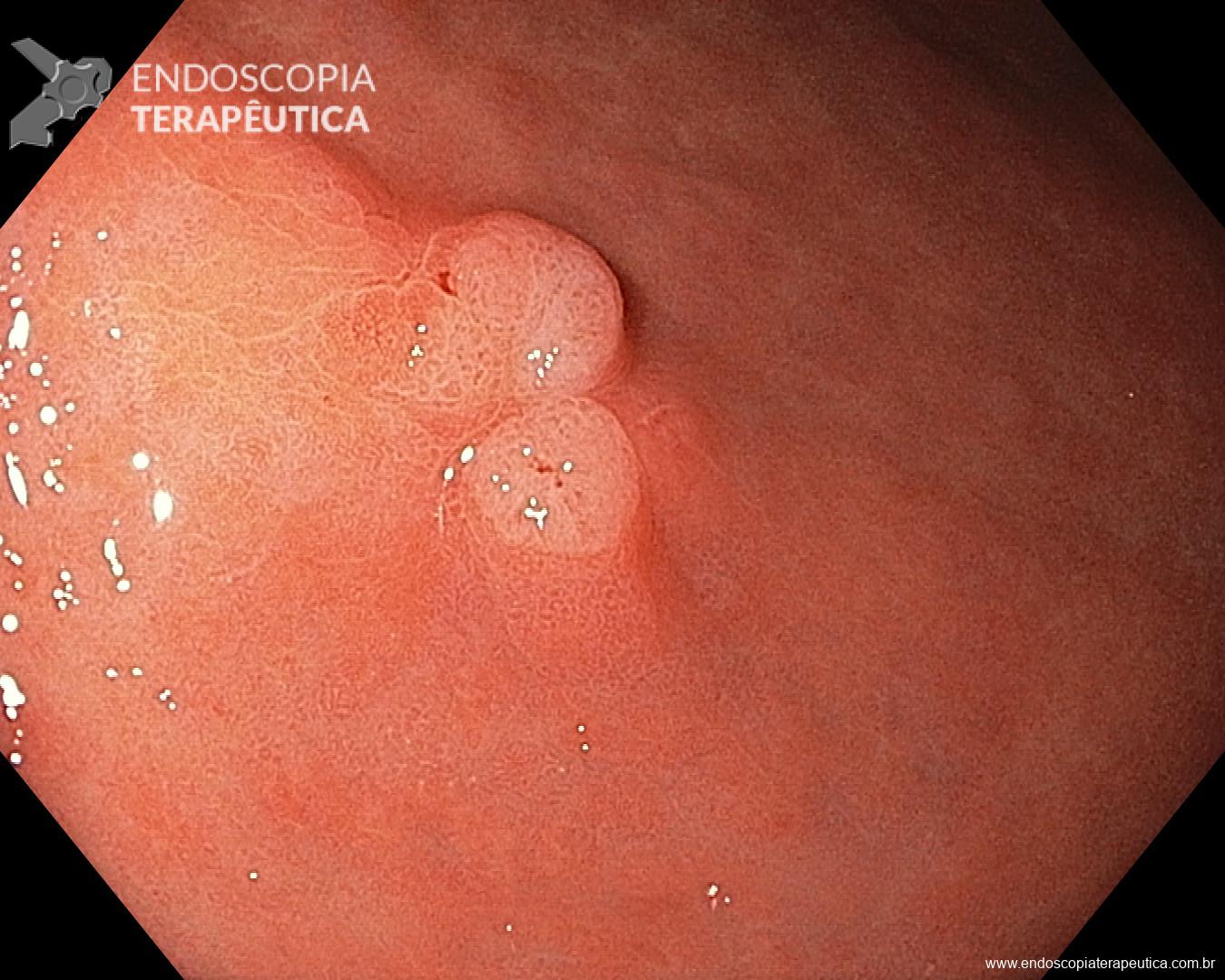
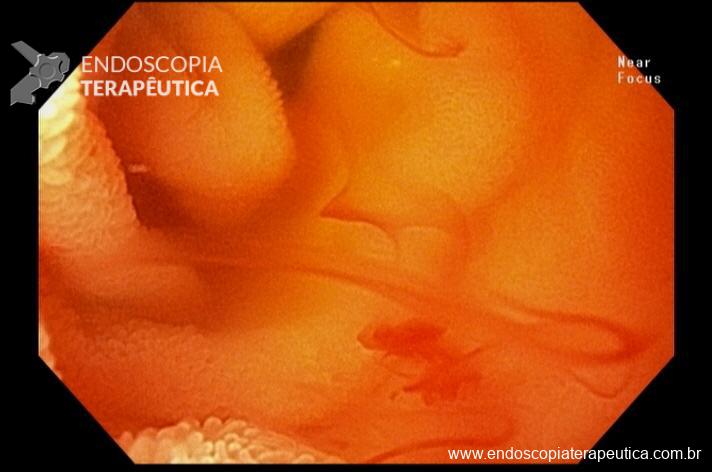
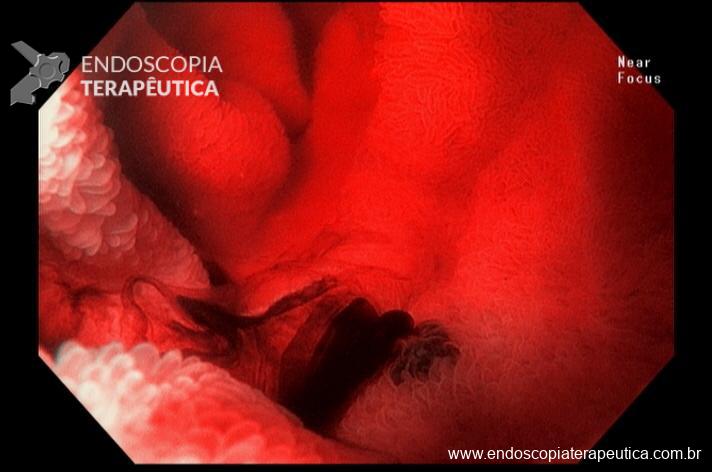
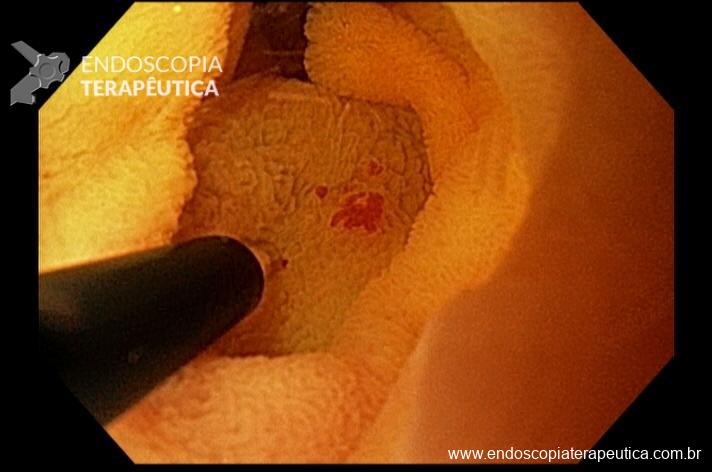
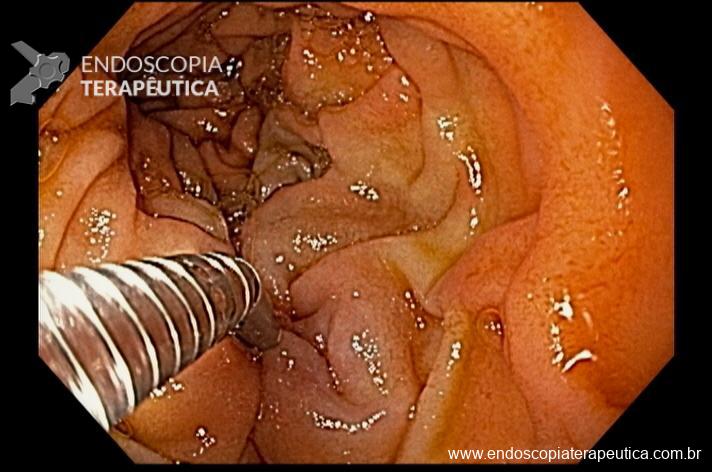
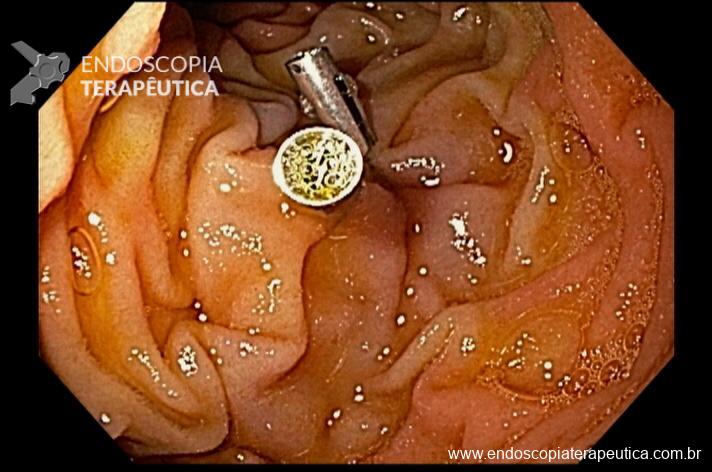
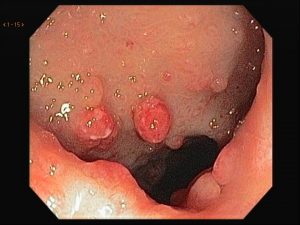
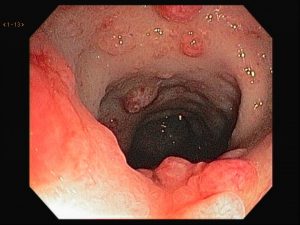
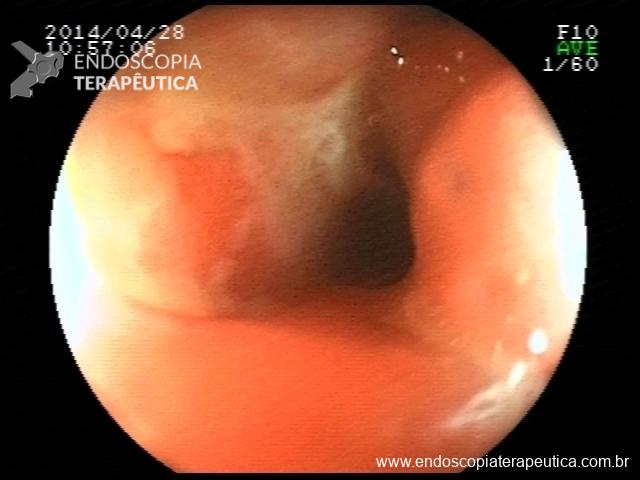
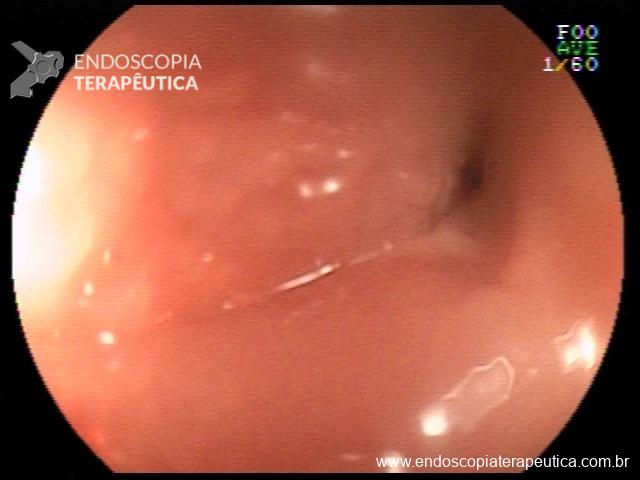
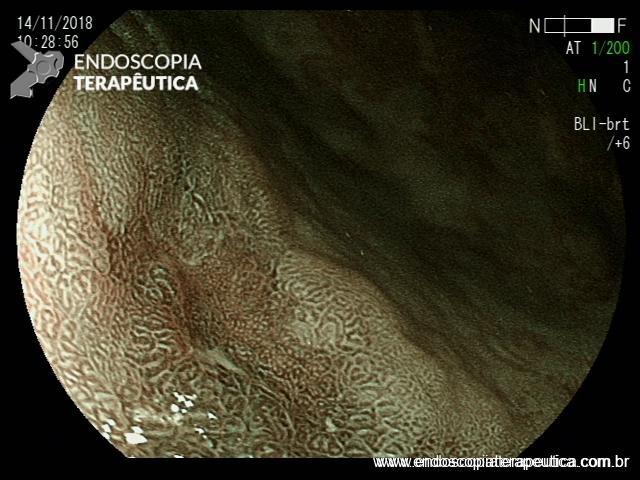
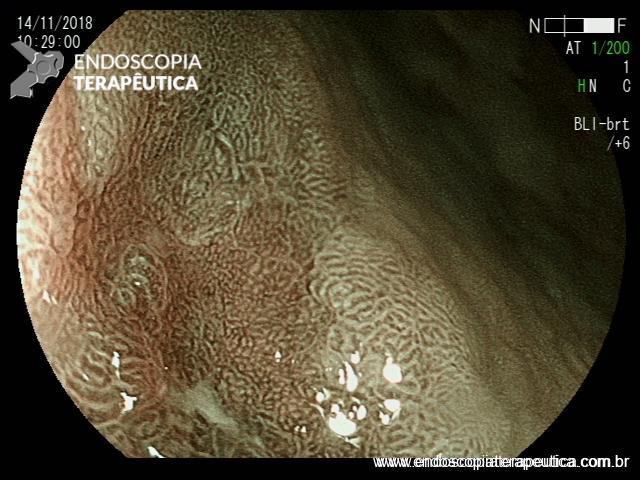
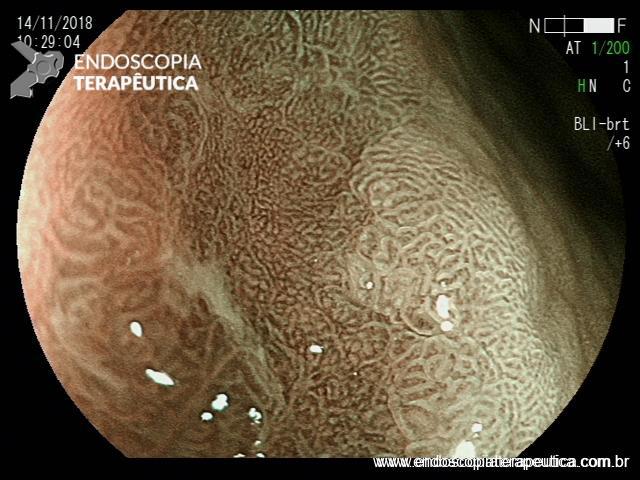
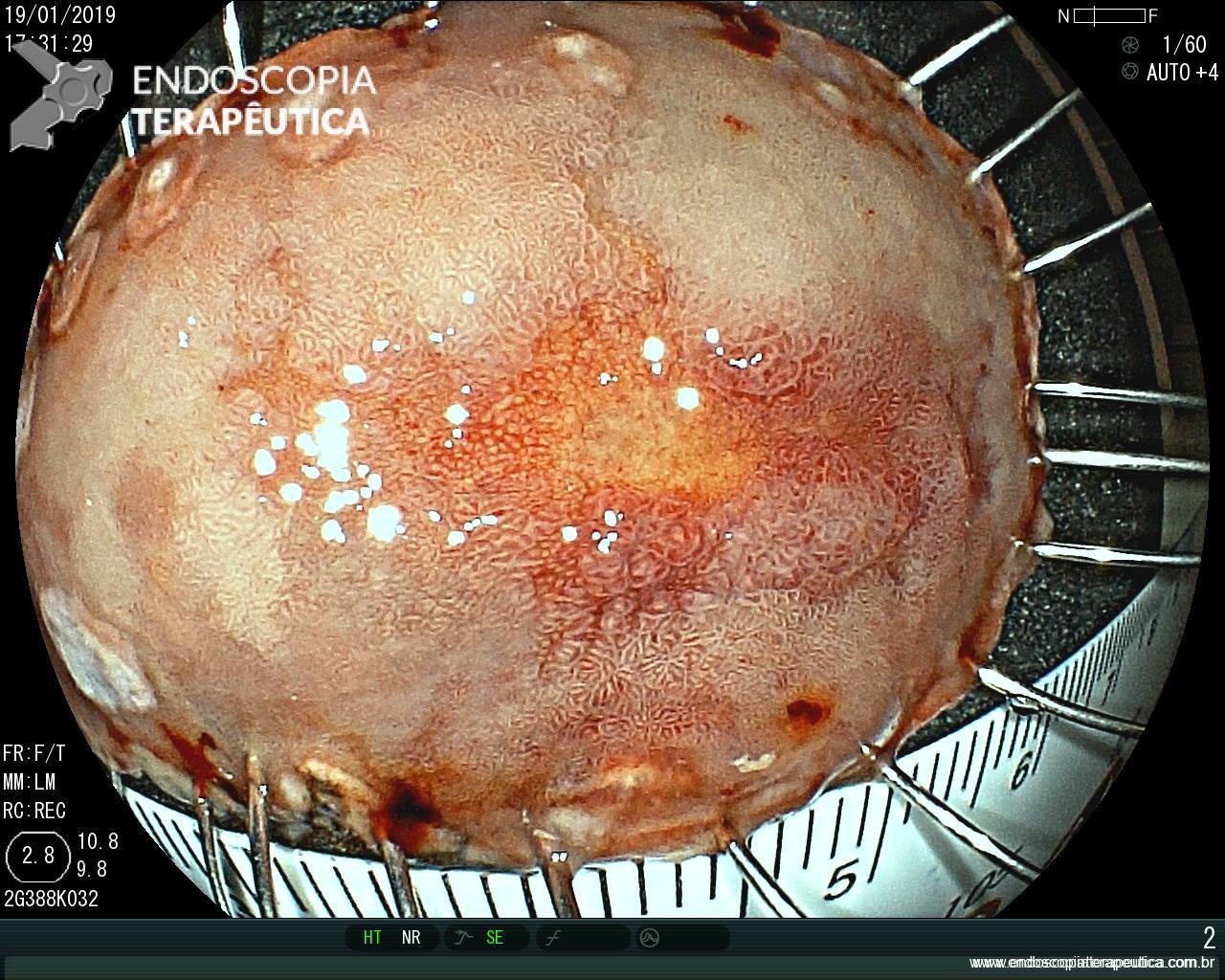
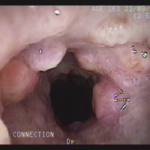
EDA controle realizada cerca de 3 meses após a passagem da prótese:
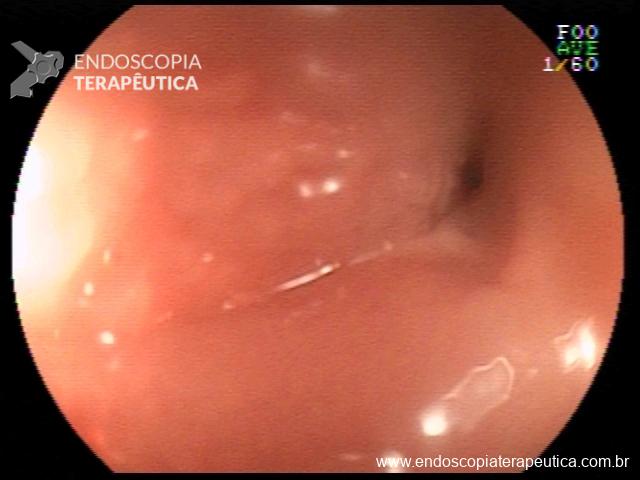
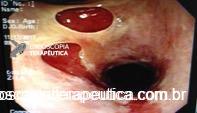
Presença de crescimento tecidual (não tumoral) ao nível da extremidade proximal (parte não recoberta) do stent o qual não impedia e não dificultava a progressão do aparelho.
Paciente negava episódios de impactação alimentar.
Clique sobre as imagens abaixo para ampliá-las :
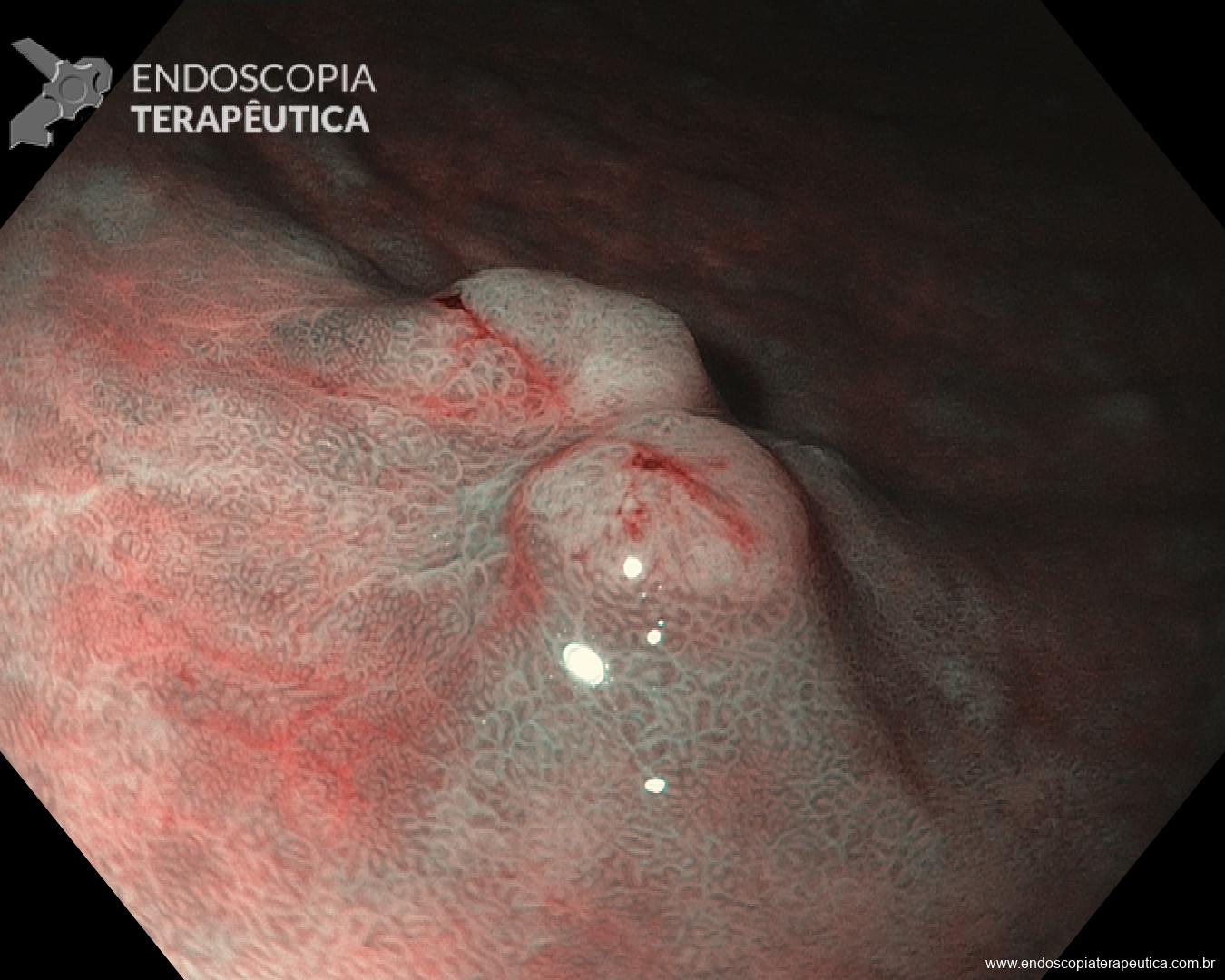
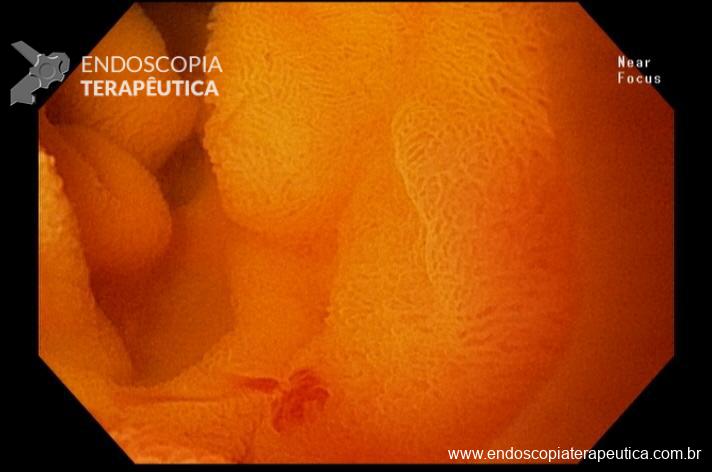
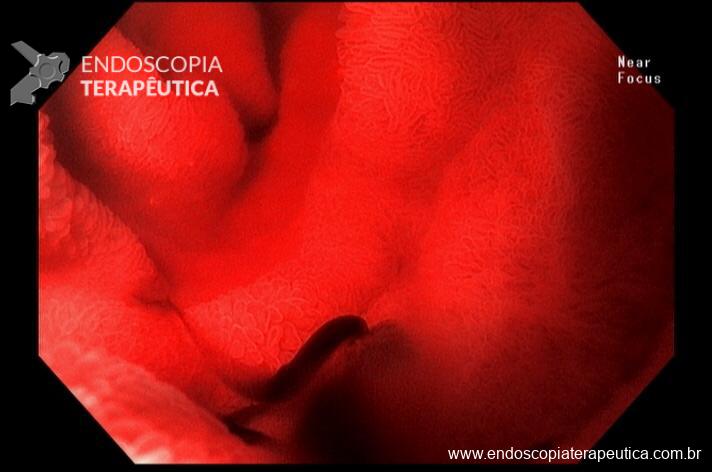
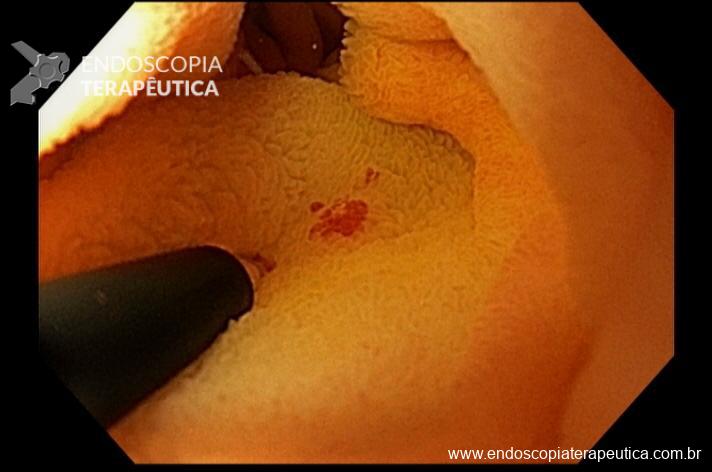
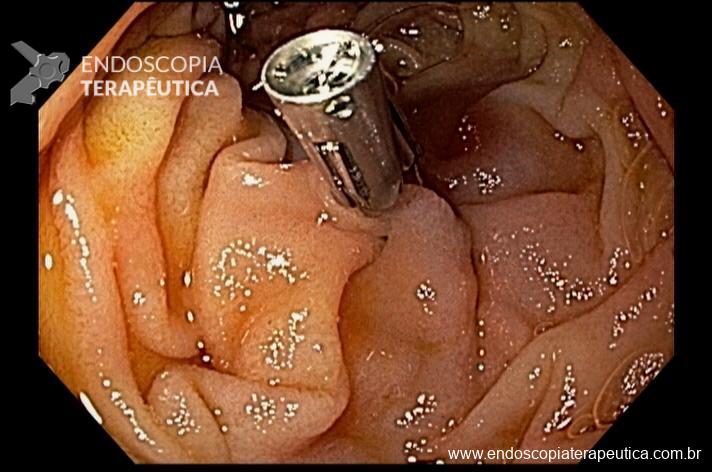
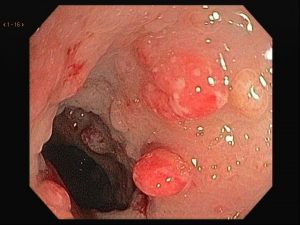
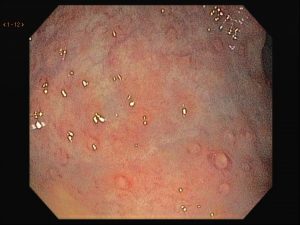
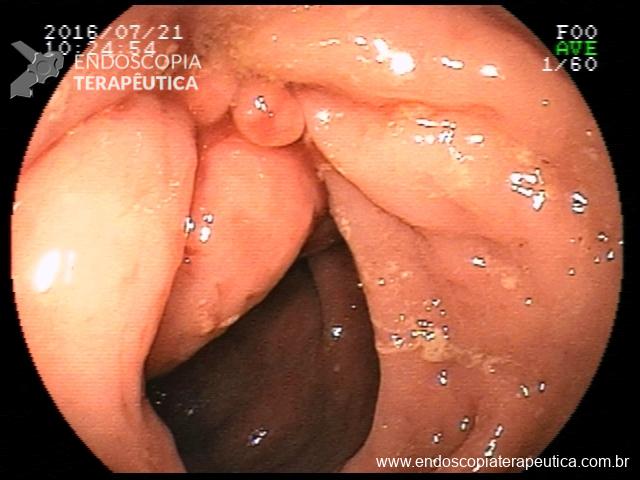
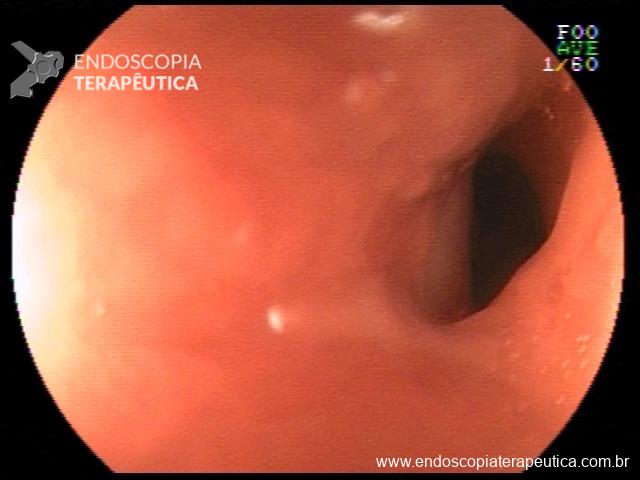
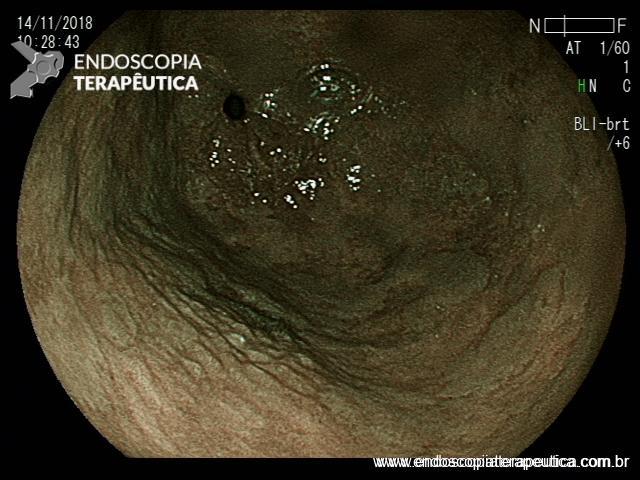
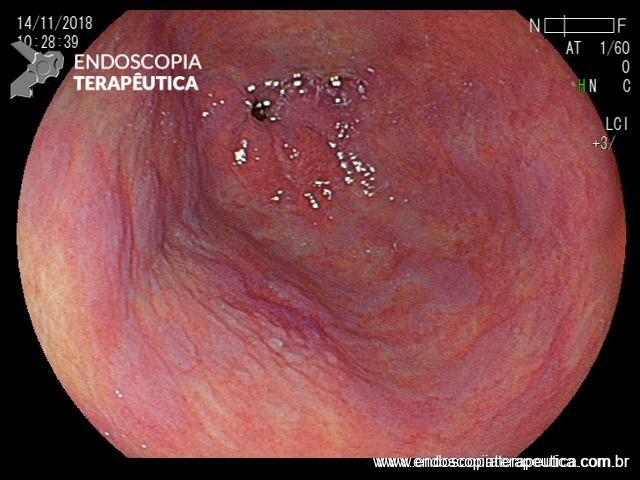
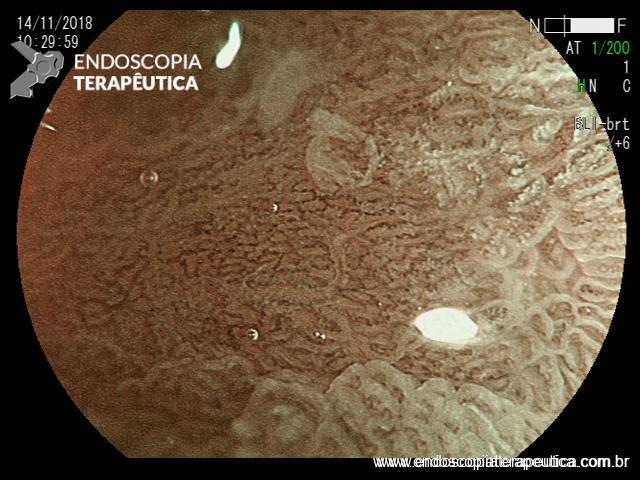
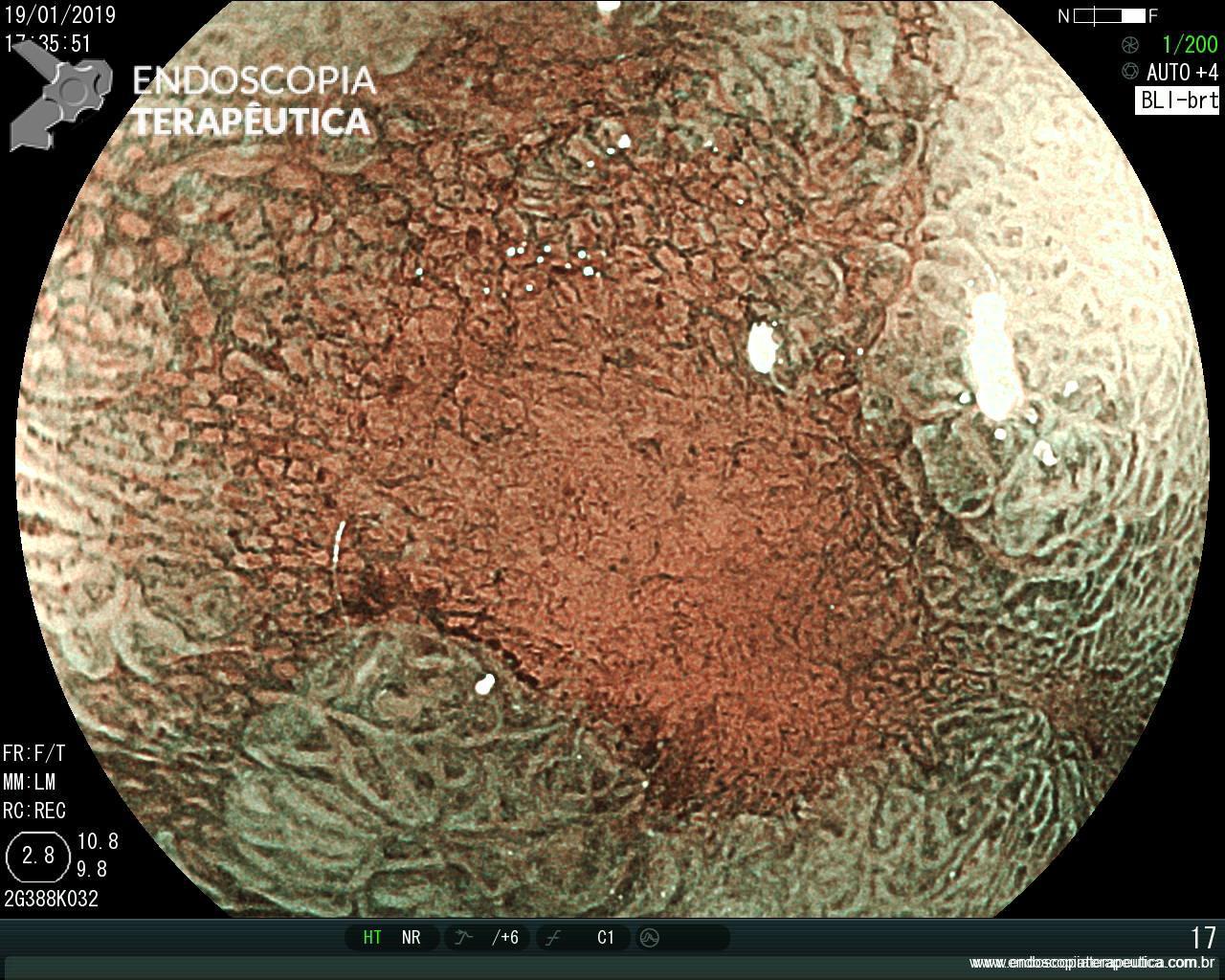
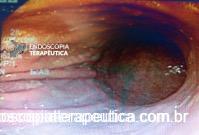
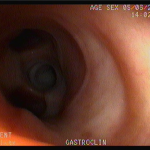
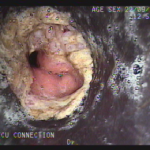
EDA controle realizada cerca de 6 meses após a passagem da prótese:
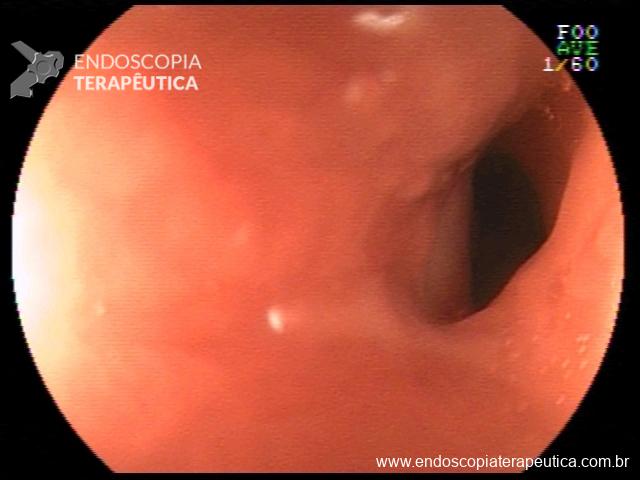
Após 6 meses do implante do stent apresentou quadro de disfagia progressiva.
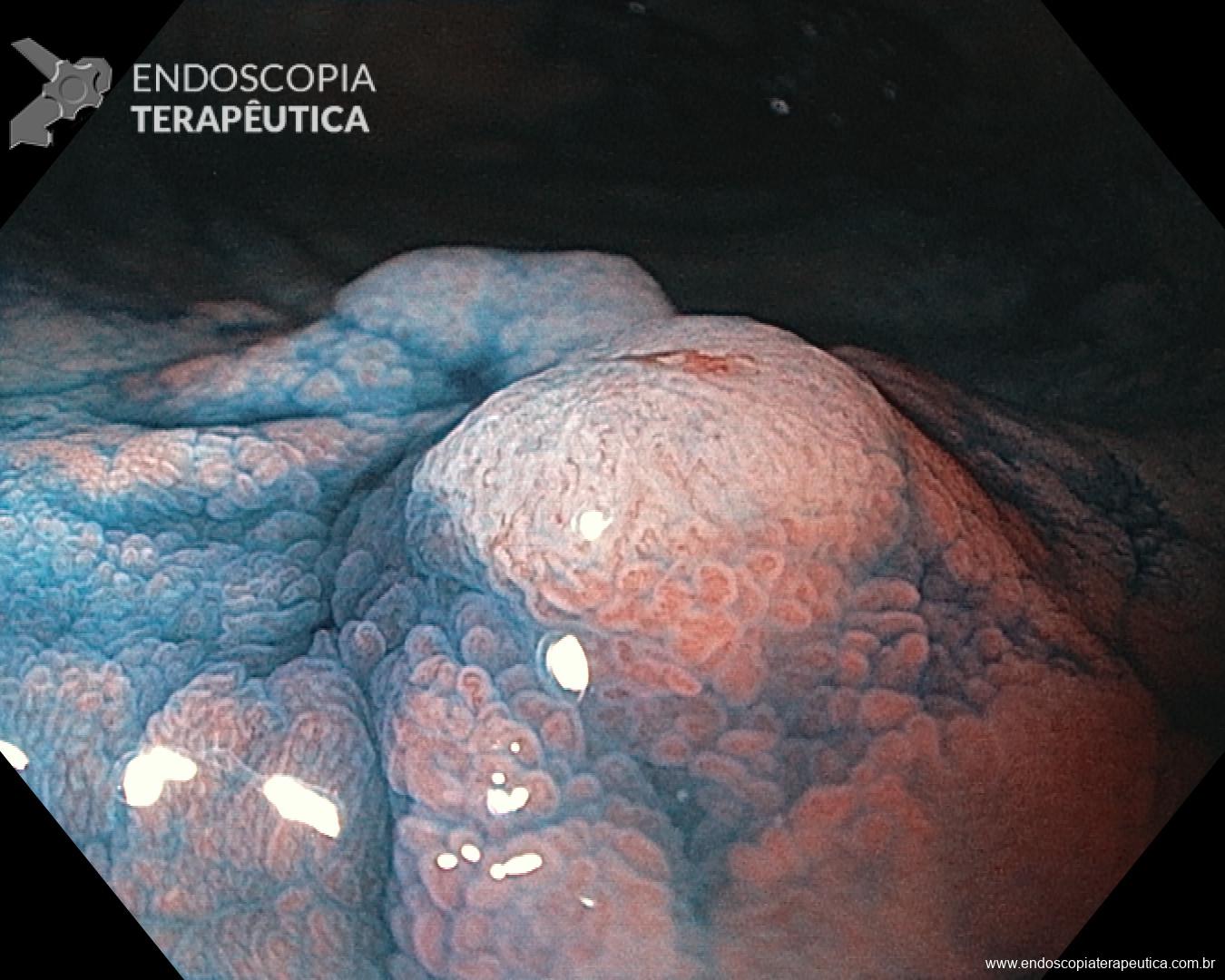
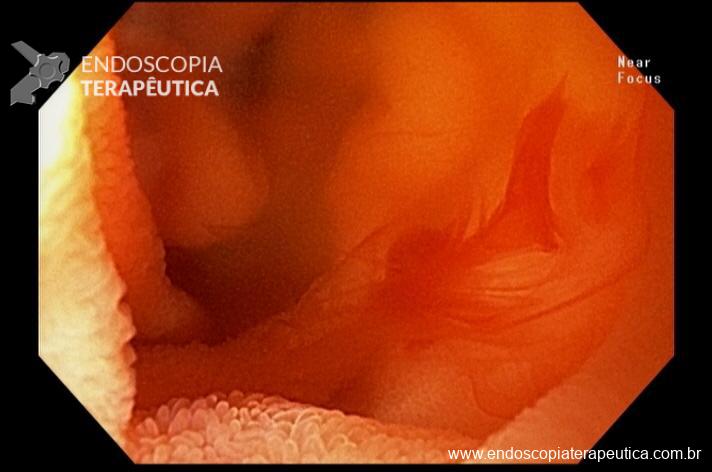
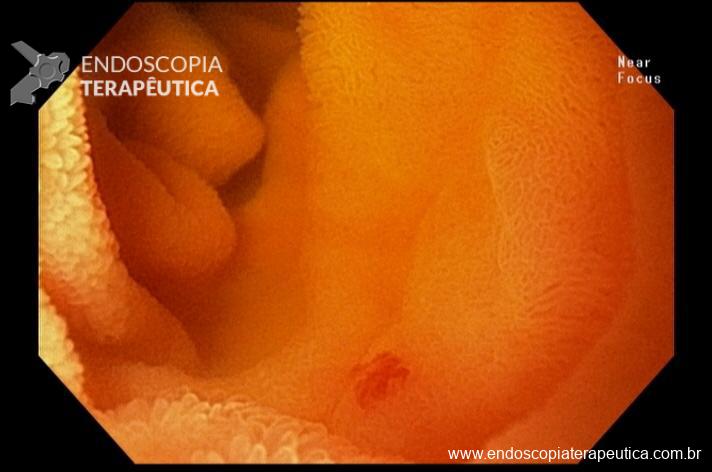
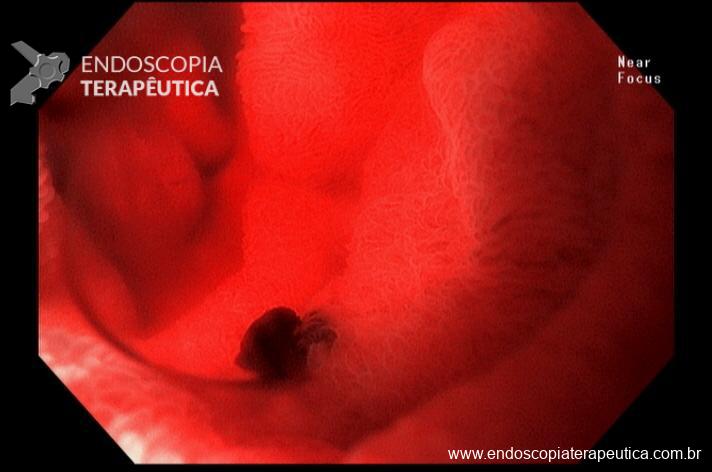
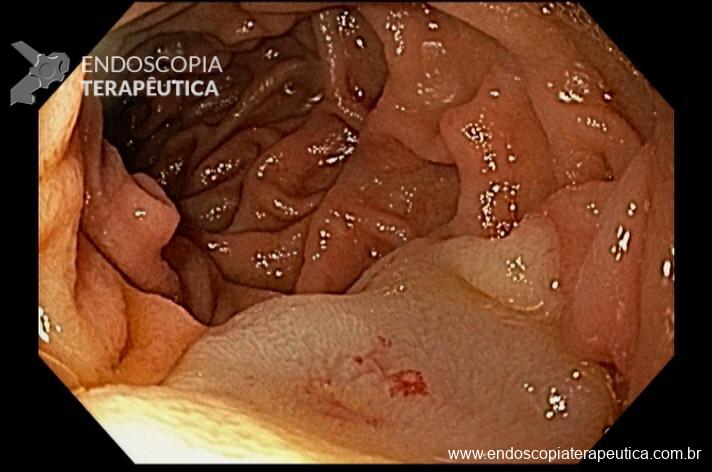
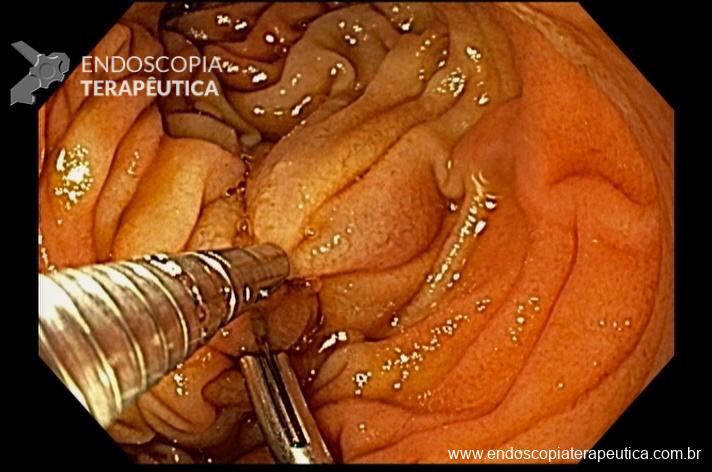
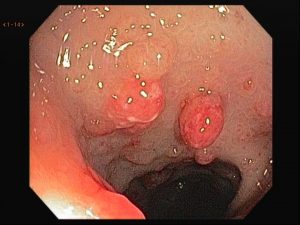
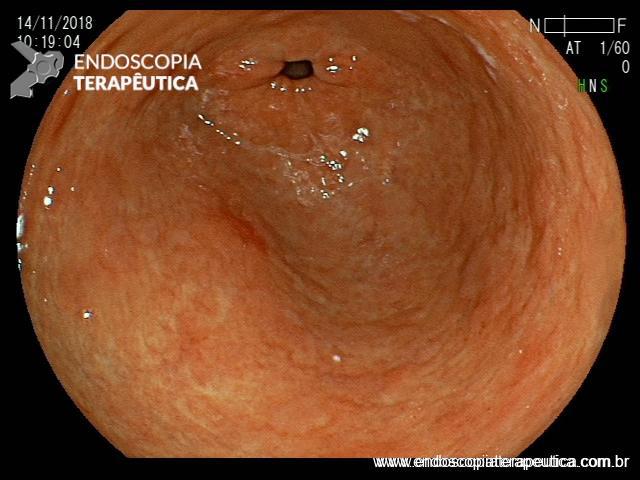
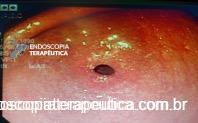
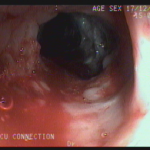
Durante a EDA evidenciamos uma estenose ao nível da extremidade proximal da PMAE (crescimento tecidual não tumoral) que não permitia a progressão do aparelho.
Realizamos dilatação com balão hidrostático sem intercorrências.
Após o procedimento paciente obteve melhora do quadro disfágico.
Clique sobre as imagens abaixo para ampliá-las :
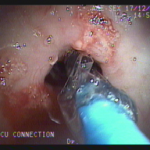
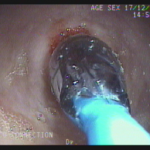
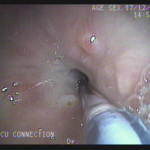
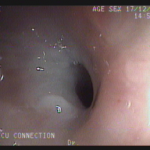
-Sobrevida de 10 meses após implante da PMAE devido à complicações causadas por metástases.