“Fechando a questão” com clipes tipo “Over the Scope”. Casos clínicos (com vídeos) e revisão da literatura.
Os clipes tipo “over the scope” têm a capacidade de apreender áreas mais amplas com maior força e atingindo camadas mais profundas da parede do trato digestório, como a camada muscular própria. Por estas características têm sido usados para fechamento de defeitos como perfurações e fístulas e também, para fechamento de leitos de ressecções. Além disso podem ser usados para fixação de stents e outros dispositivos.
Recentemente alguns autores e mesmo diretrizes de sociedades como a ESGE têm advogado seu uso para hemostasia do TGI, em casos de ressangramento e sangramento persistente. A maior parte dos estudos trata do uso dos clipes “over the scope” no manejo de úlceras pépticas. No entanto há interesse crescente em seu uso para o sangramento do TGI inferior.
Há dois tipos de clipes “over the scope” disponíveis: o OTSC® clip (Ovesco Endoscopy AG, Tübingen, Germany) e o clipe Padlock (Steris Corporation).
Nesta publicação vamos postar dois casos clínicos (com vídeos) em que os clipes foram utilizados com funções distintas: para o fechamento de uma fístula gastrocutânea persistente pós GTT e para hemostasia de cólon. À seguir há uma revisão da literatura existente.
Caso 1 – Fistula gastrocutânea persistente pós GTT
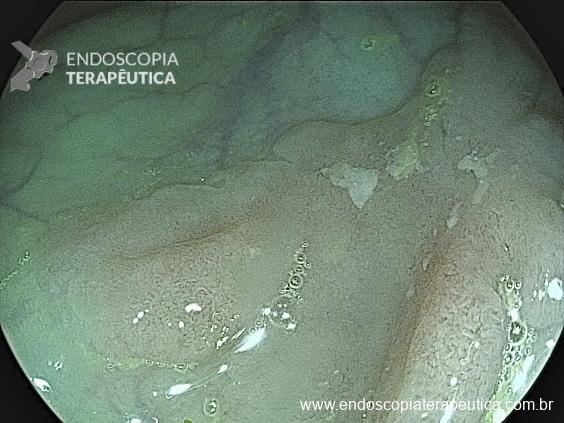
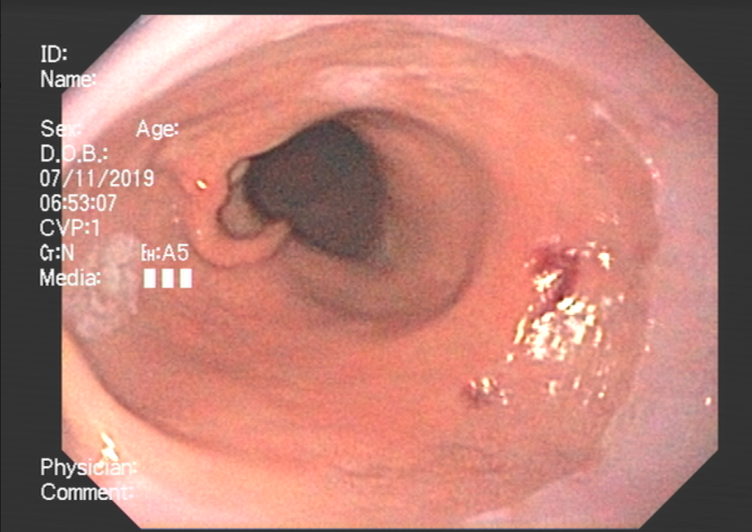
Paciente do sexo feminino, com 69 anos, portadora de neoplasia renal metastática, em vigência de tratamento quimioterápico. Paciente evoluindo com disfagia, inapetência e comprometimento importante do estado geral. Equipe de oncologia clínica indicou realização de GTT, realizada em junho de 2020. Paciente evoluiu com BBS (“Buried Bumper Syndrome”) precoce e o manejo realizado na ocasião foi o reposicionamento da sonda com sucesso (Figura 1).
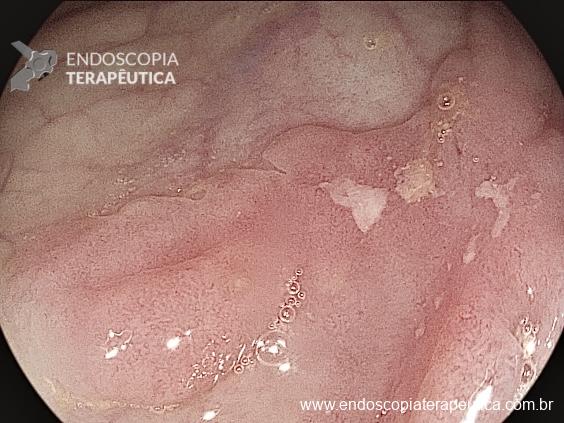
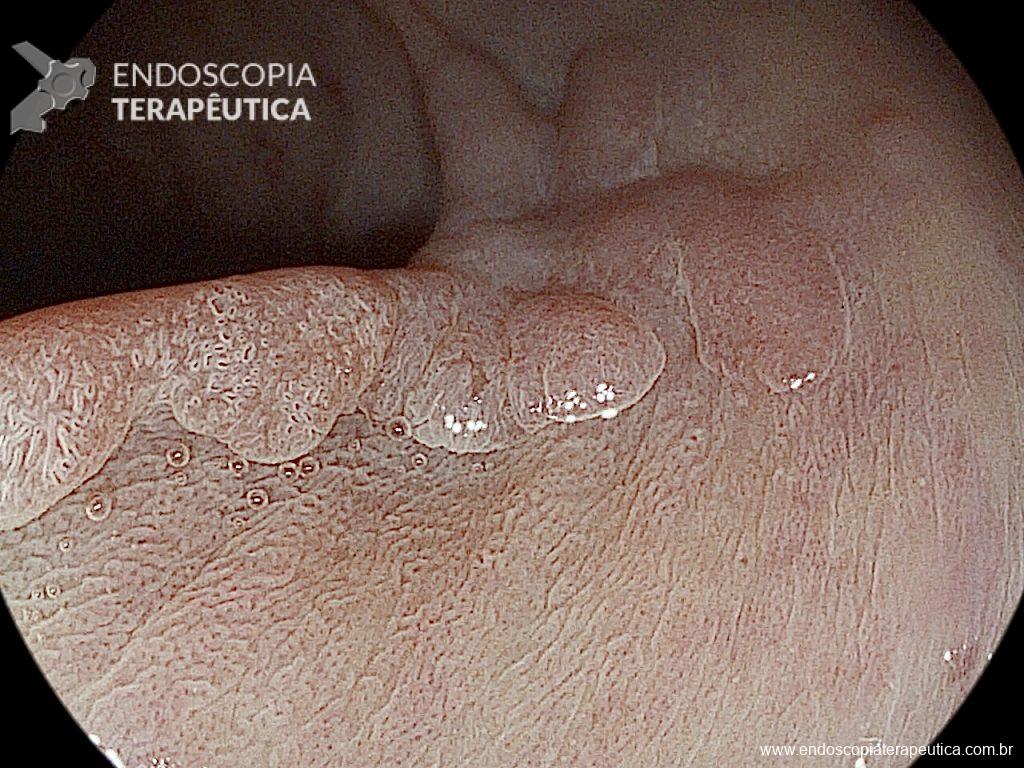
No mês de Setembro de 2020 a paciente evoluiu com perda da GTT e na ocasião foi realizada troca por sonda de baixo perfil tipo button. Em outubro de 2020 a paciente iniciou um vazamento peri GTT importante associado a dermatite e, na ocasião foi optado pela remoção da sonda de GTT (Figura 2).
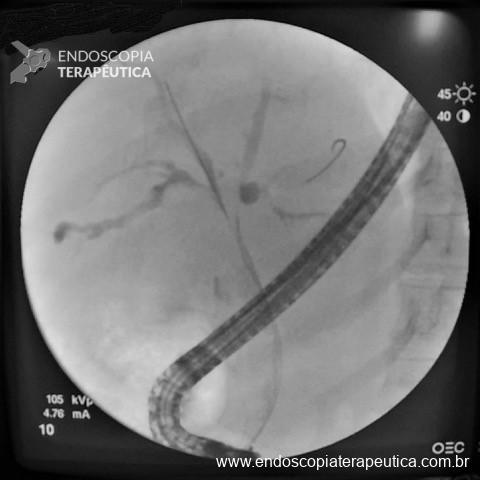
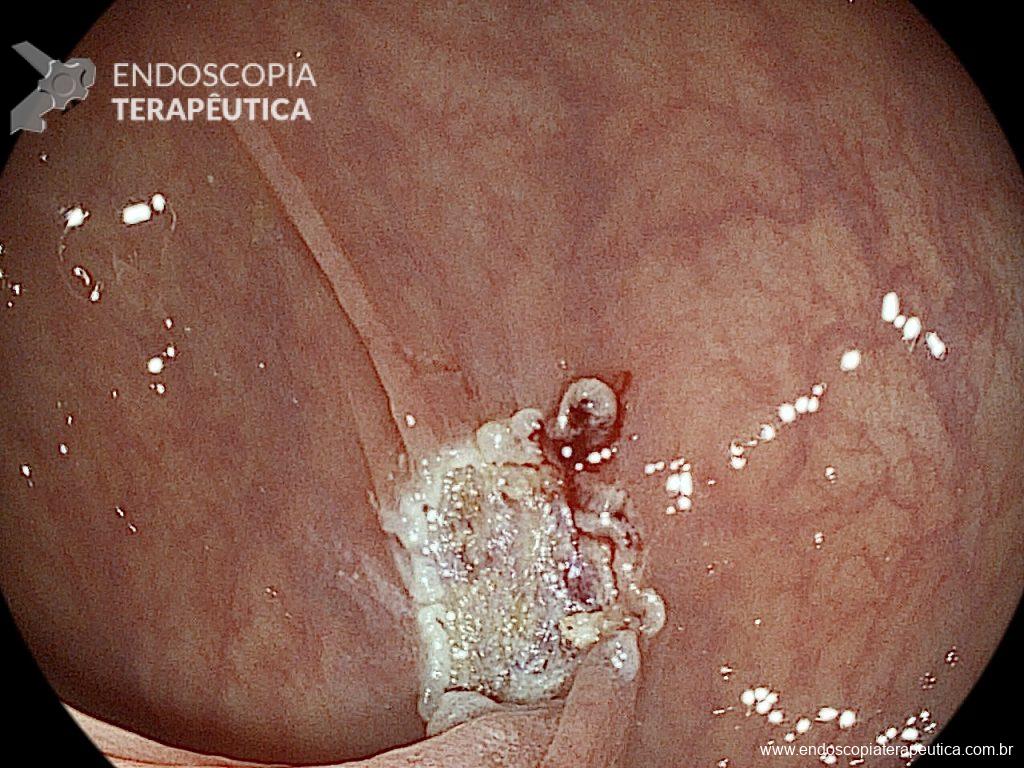
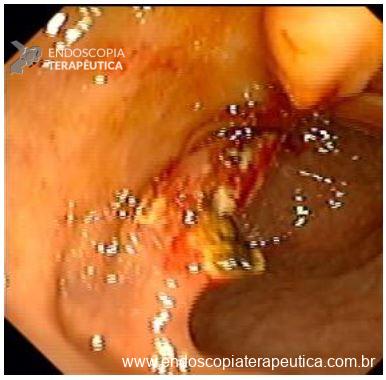
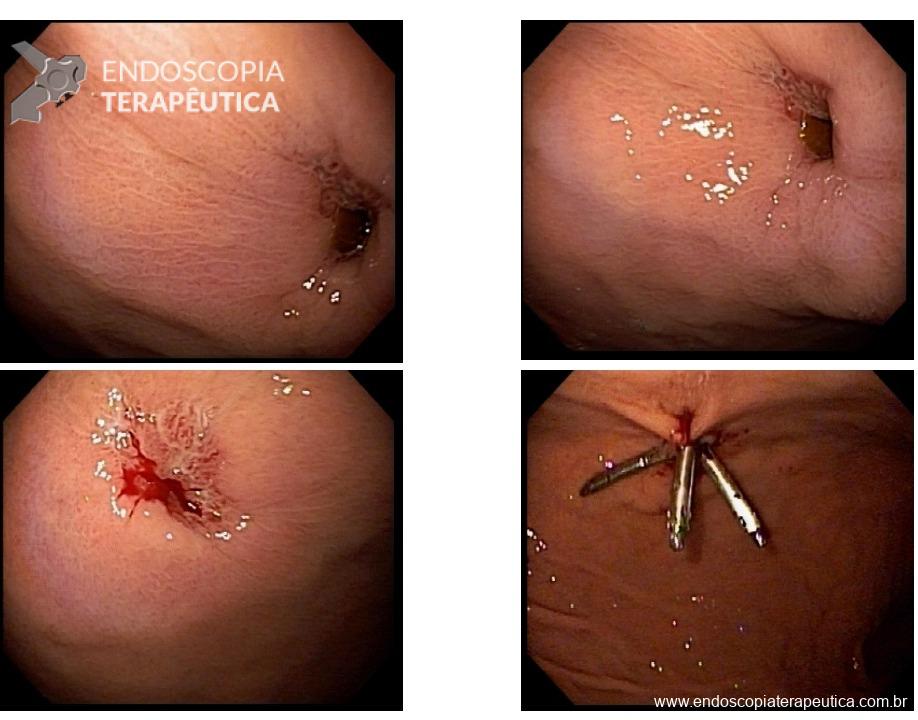
No início de Dezembro de 2020 o orifício da GTT ainda persistia aberto, e a primeira tentativa de manejo endoscópico foi realizada com escarificação do trajeto e uso de clipes convencionais, no entanto, não foi um procedimento que obteve sucesso no fechamento do orifício (Figura 3).
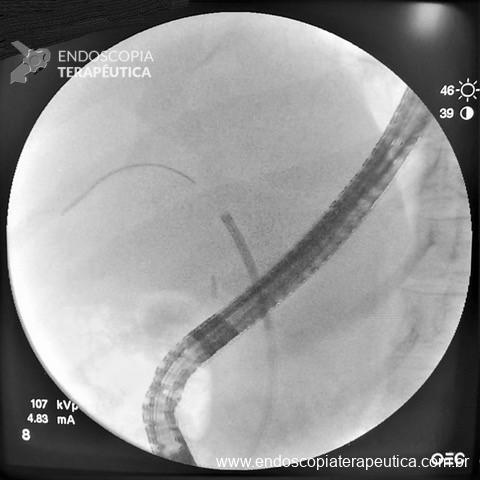
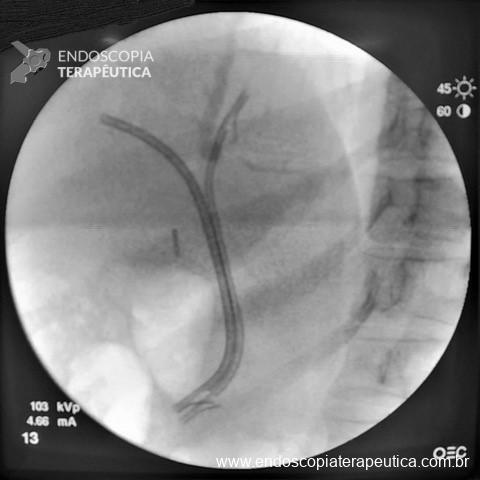
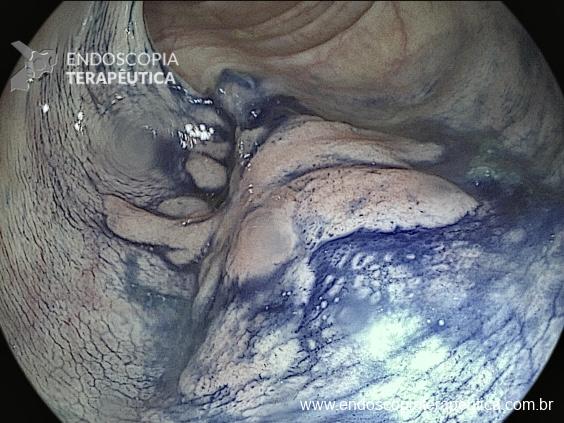
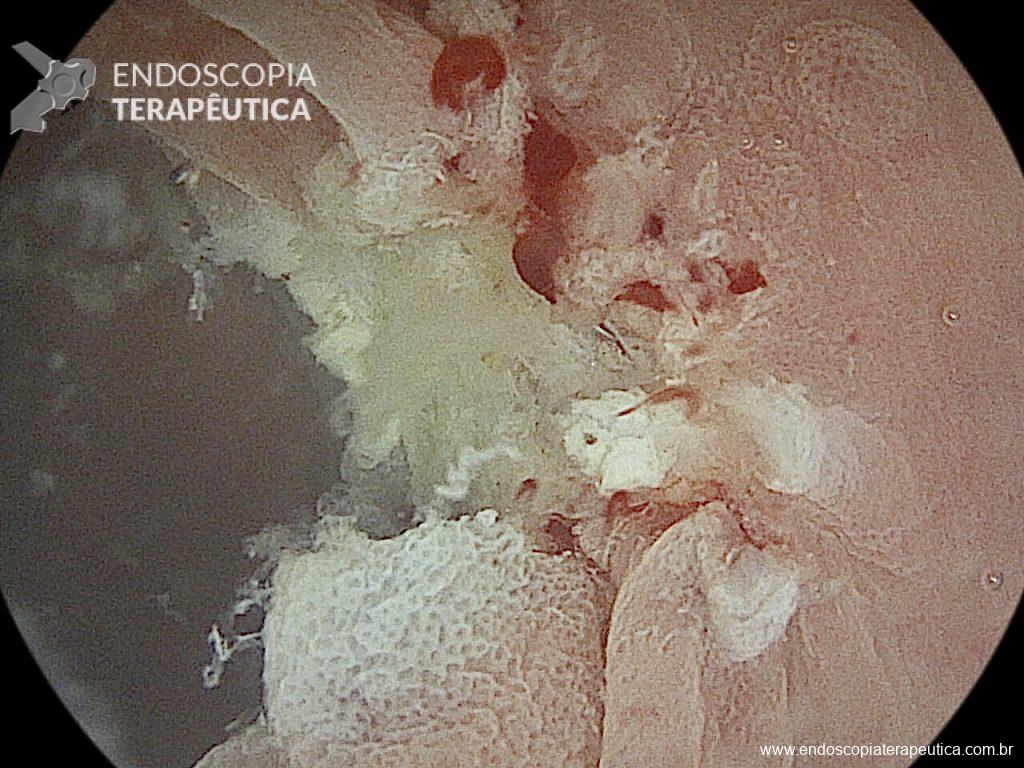
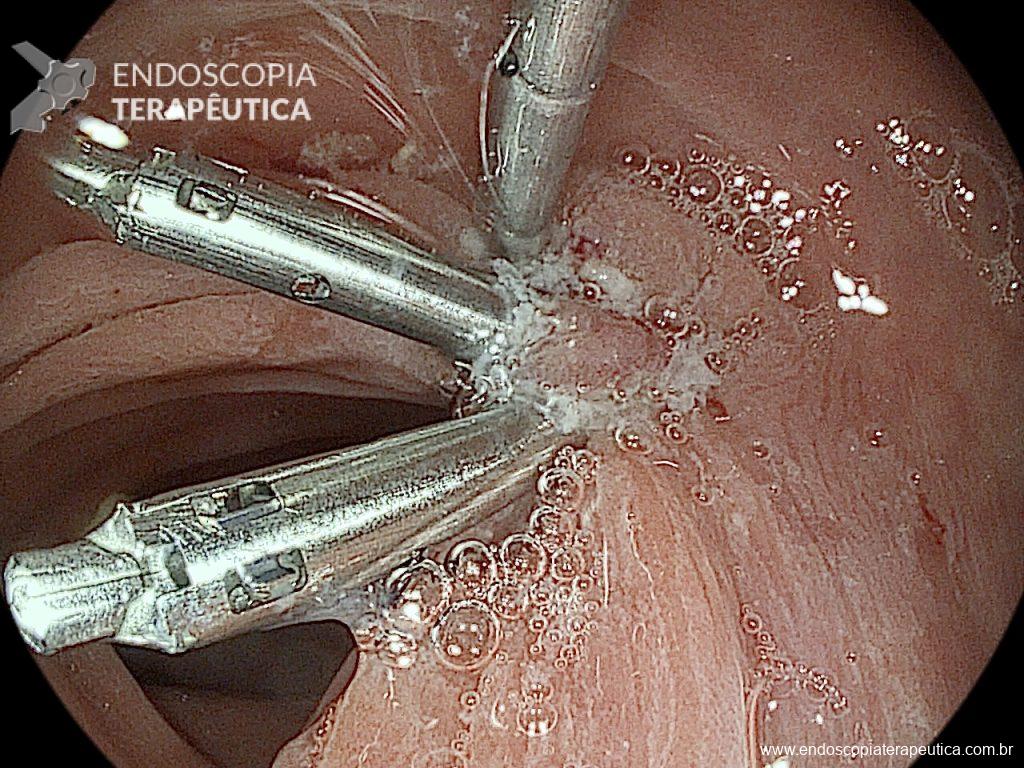
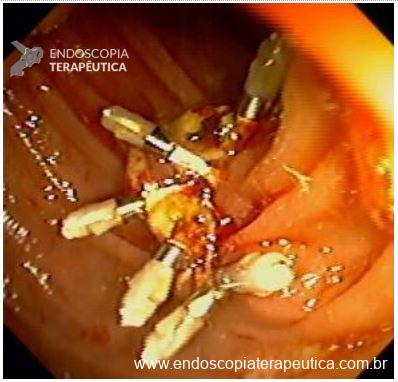
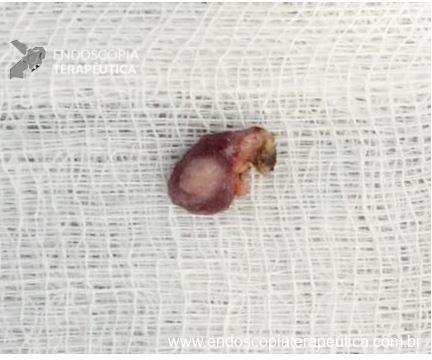
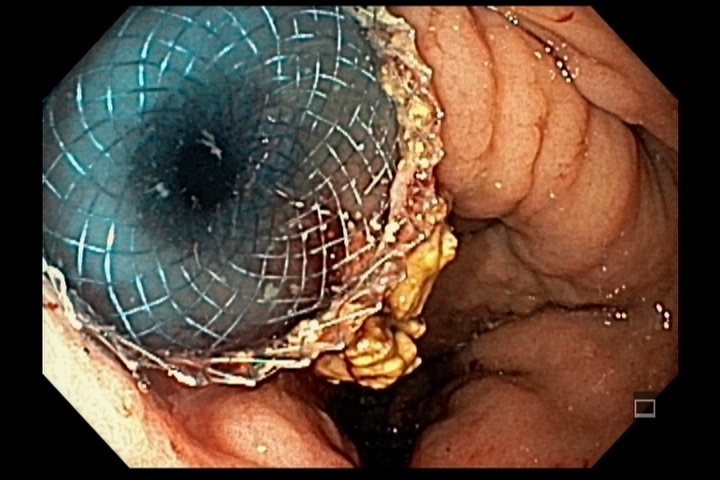
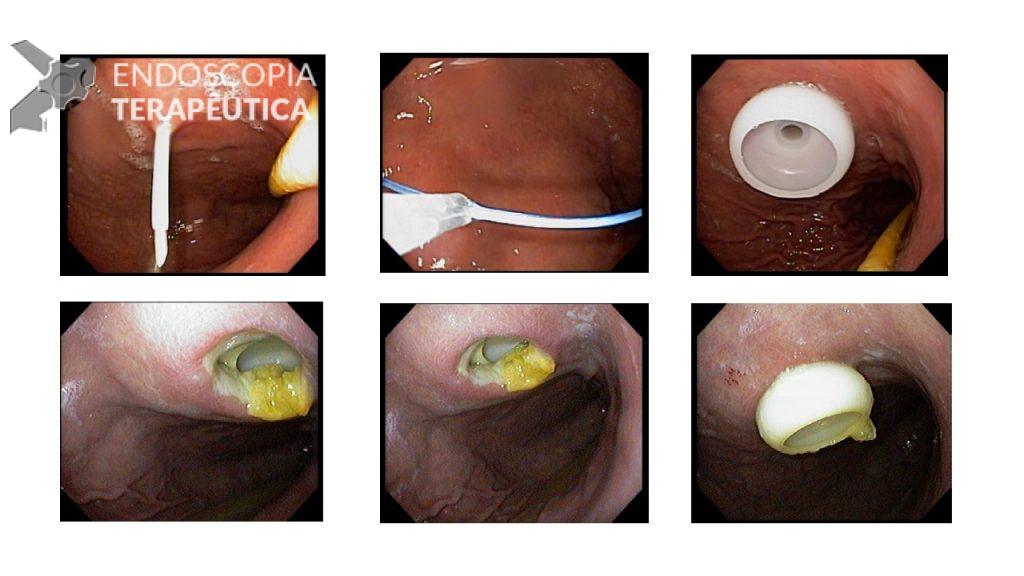
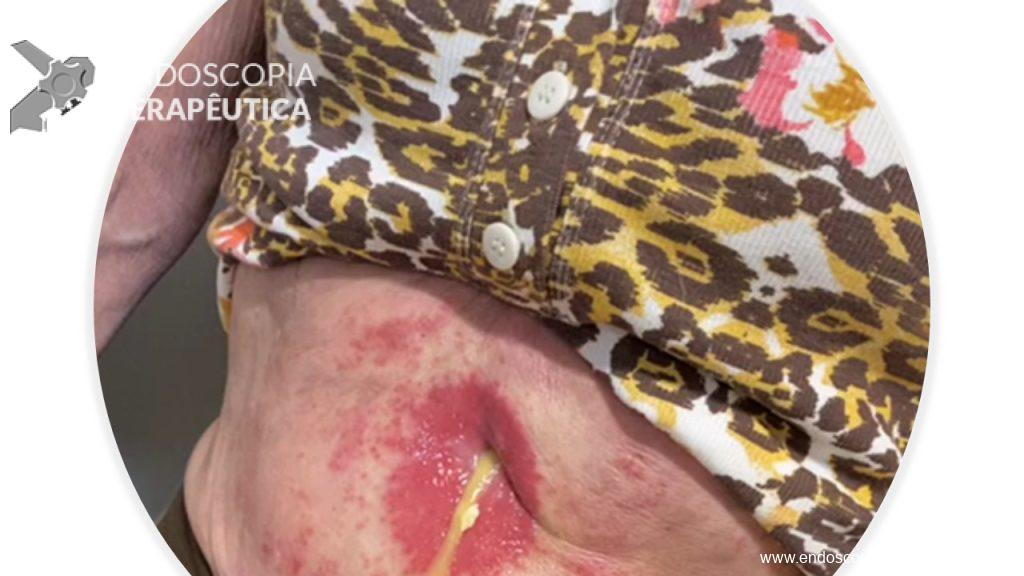
No final de Dezembro optado por fechamento do orifício com uso de clipe Padlock (vídeo). A paciente teve boa evolução pós procedimento com parada de saída de secreção gastroentérica pelo orifício da GTT além de melhora expressiva da dermatite. A figura 4 mostra o aspecto endoscópico e abdominal quatro meses após o procedimento.
A Gastrostomia Endoscópica Percutânea (GEP) ou GTT é um procedimento extremamente comum nas rotinas endoscópicas e usualmente indicado para pacientes que necessitam de uma via nutricional alternativa, de médio e longo prazos. Após a remoção da sonda o orifício da gastrostomia geralmente fecha de forma espontânea em até 48-72h.
Nas situações em que o orifício não fecha após 4 semanas temos a chamada fístula pós GTT. Além dos problemas fisiológicos, bioquímicos (dermatite) e eventualmente infecciosos, a fístula gastrocutânea persistente promove sofrimento psicológico para os pacientes. O tratamento pode incluir desde abordagens mais simplificadas, com a remoção de debris e escarificação do orifício associada ao uso de clipes endoscópicos comuns até mesmo o tratamento cirúrgico com gastrorrafia. Outras opções incluem uso de adaptações da sutura endoscópica, trocartes de sutura, plugs de fístula e o uso de clipes tipo “over the scope”.
Há dados escassos na literatura em relação ao tratamento endoscópico das fístulas gastrocutâneas persistentes pós GTT. O uso do clipe Padlock propiciou o fechamento da fístula com segurança, por meio minimamente invasivo.
Caso 2 – Sangramento digestivo baixo por ectasia vascular
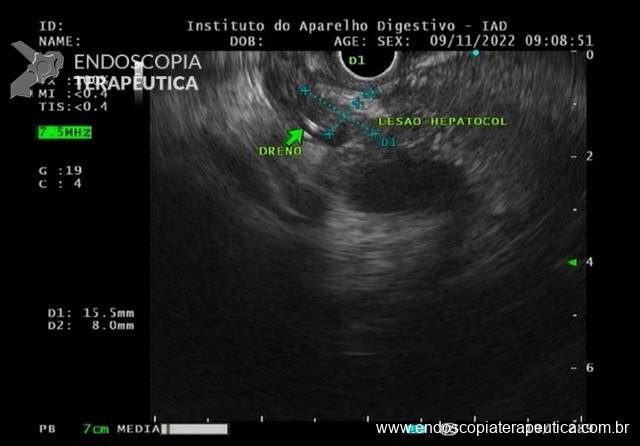
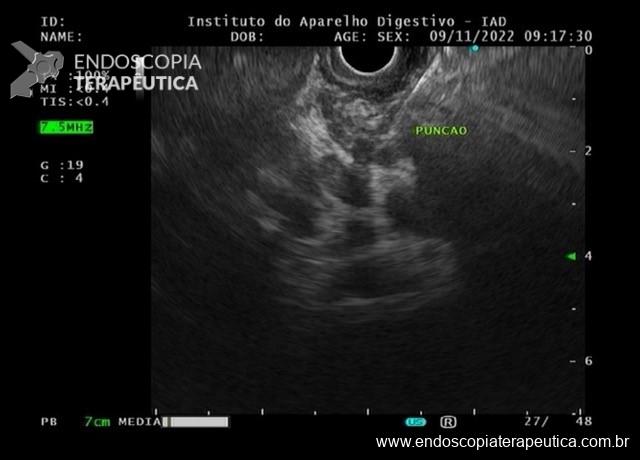
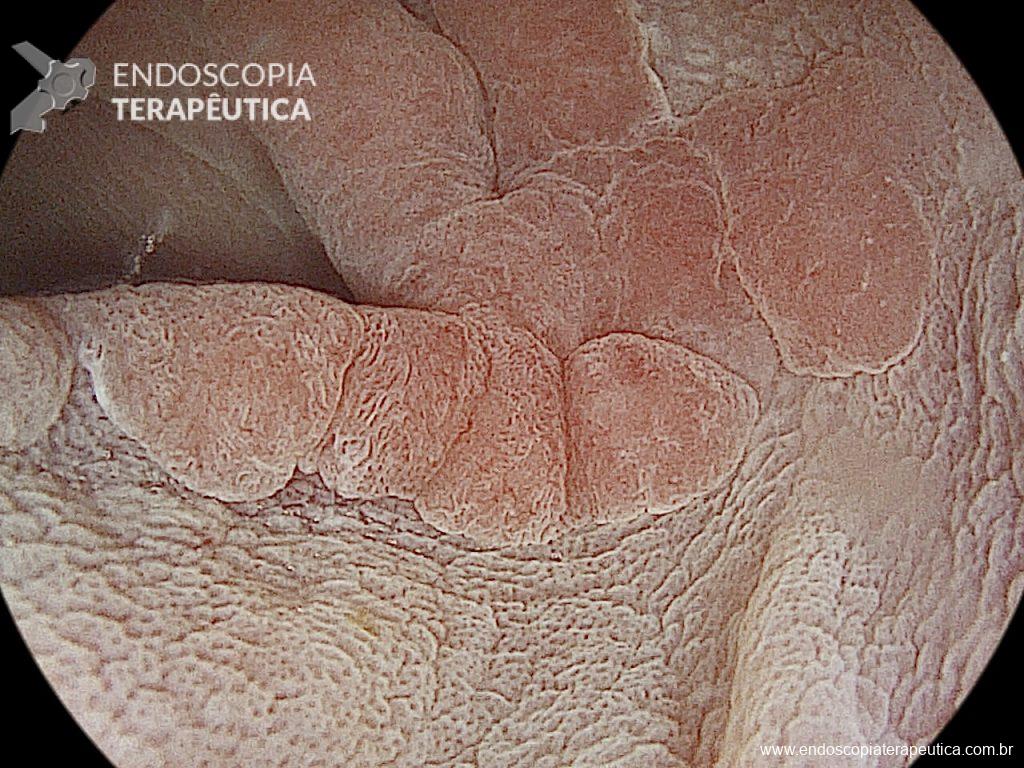
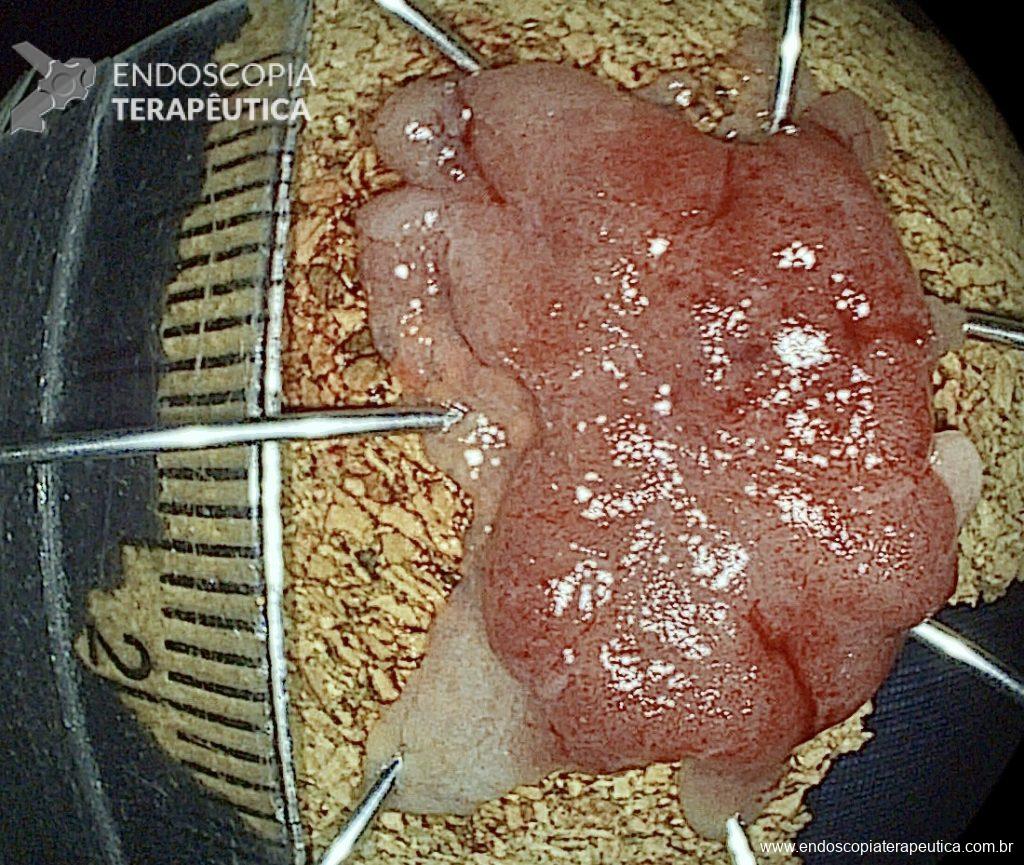
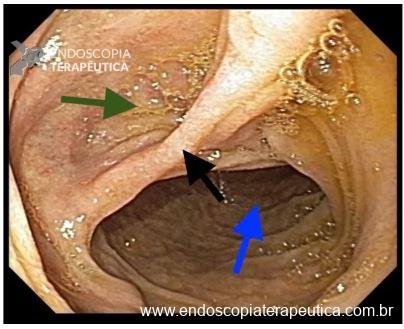
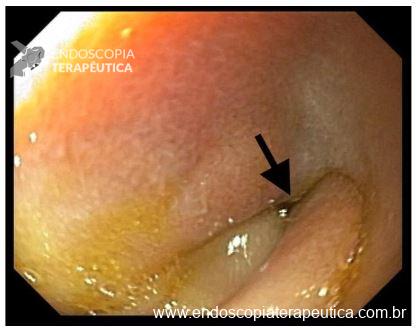
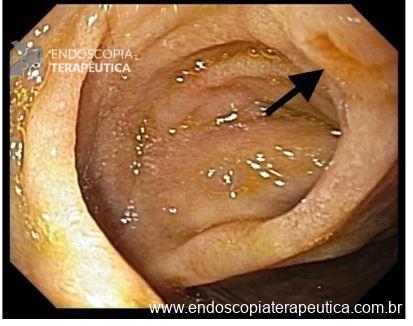
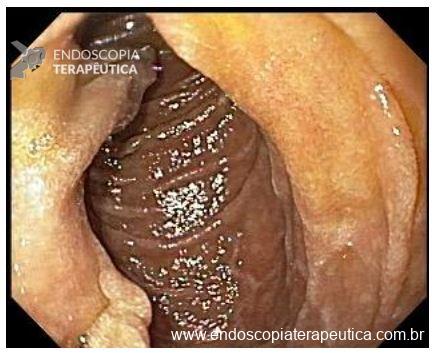
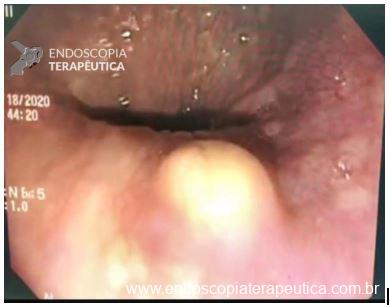
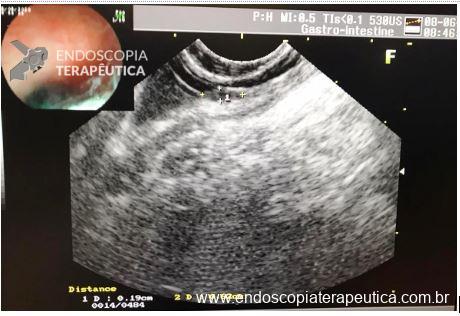
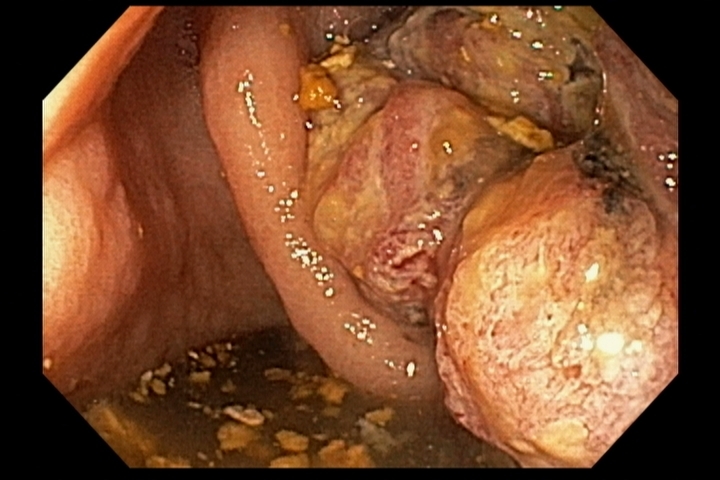
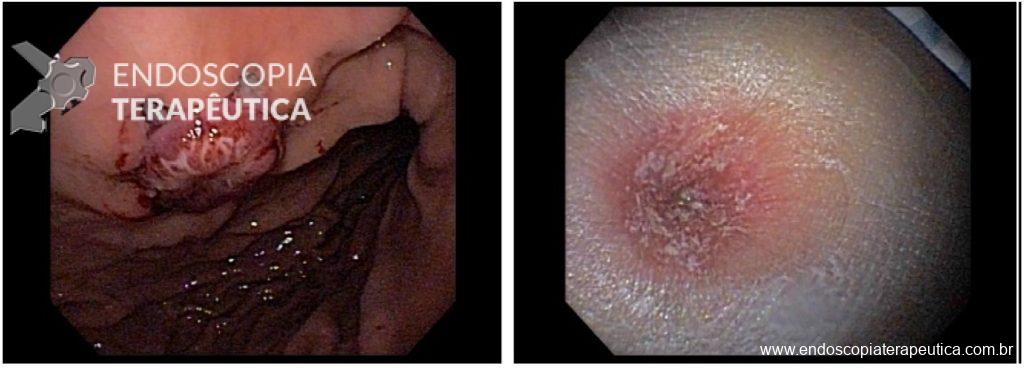
Paciente do sexo feminino, 59 anos, com histórico de enterorragias de repetição, com necessidade de hemotransfusões, apresentando Hb 9,0 mg/dl. A paciente foi submetida a colonoscopia e TC de abdome com o achado de uma ectasia vascular na topografia do cólon descendente (Figuras 5 e 6). A paciente não relatava uso recente de AINEs.
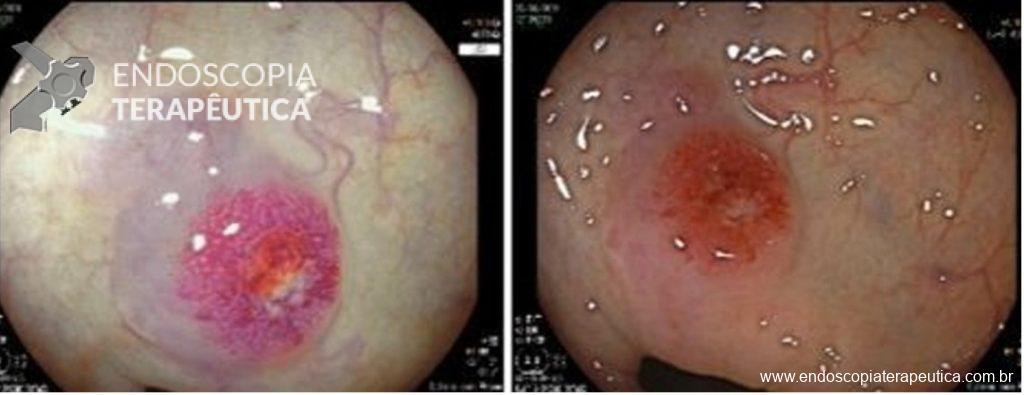
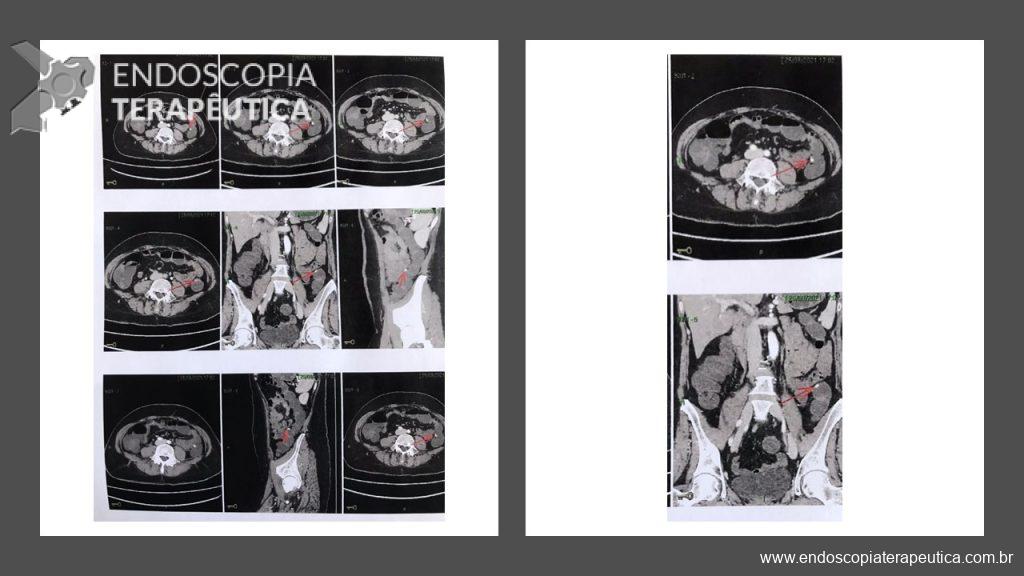
Optado por uma primeira tentativa de abordagem da ectasia vascular com uso de clipe endoscópico convencional sem sucesso, com recidiva do sangramento. Optado, então por tratamento de resgate usando o clipe tipo “over the scope” Padlock (vídeos). O tratamento foi bem sucedido e houve recuperação dos níveis de hemoglobina sem recidiva do sangramento no período de seguimento (15 meses).
Como explicitado no início do texto, os clipes tipo “over the scope” devido ás suas características, se tornaram mais populares no manejo de defeitos da mucosa como perfurações agudas ou fístulas. O papel desses clipes na hemostasia mecânica do TGI vem ganhando interesse recente.
David Villaescusa Arenas e colaboradores avaliaram o uso desses dispositivos em uma análise retrospectiva de onze casos de sangramento por úlcera péptica recidivante ou persistente. Os autores observaram 81,9% de sucesso técnico e 88,9% de sucesso clínico por protocolo, sem efeitos adversos.
A ESGE e ACG já colocam os clipes tipo “over the scope” como alternativas para o resgate em caso de hemorragia de difícil controle ou recidivante, com bons resultados no que diz respeito às taxas de ressangramento.
Shannon Chan e Phillip Chiu conduziram um estudo clínico randomizado e multicêntrico internacional muito interessante e levantaram uma pergunta clínica instigante: seriam os clipes tipo “over the scope” opções interessantes para o tratamento primário das úlceras pépticas de grandes dimensões (> 1,5 cm)? Os autores compararam os desfechos entre pacientes tratados de forma convencional e com clipes tipo “over the scope”. Não houve diferença entre os grupos em relação às taxas de ressangramento (p=0.23 IC 95% 0.61-6.34) mortalidade (p=0.68 IC 95% 0.37-11.95), na permanência hospitalar ou na necessidade de hemotransfusão. Os autores fizeram ressalvas em relação à curva de aprendizagem para aplicação desses clipes e no eventual impacto que a experiência do expert pode ter em futuros estudos.
Há poucos estudos que tratam da hemostasia de cólon com o uso desses dispositivos, sendo que a maioria deles se refere a sangramento diverticular e relatos de casos, mostrando resultados promissores no que diz respeito às taxas de ressangramento e com taxas de complicações inferiores às dos tratamentos convencionais com hemostasia térmica, ligadura elástica e uso de clipes convencionais.
Os casos acima mostram duas situações em que houve falha do tratamento convencional e os clipes tipo “over the scope” foram usados com sucesso, “fechando a questão”.
Se você ainda não conhece, clique aqui para visitar nossa página das empresas parceiras, com informações sobre produtos e acessórios!
Referências:
- Tang S-J. Endoscopic Management of Gastrocutaneous Fistula Using Clipping, Suturing, and Plugging Methods. Video Journal and Encyclopedia of GI Endoscopy (2014) 2, 55–60. http://dx.doi.org/10.1016/j.vjgien.2014.03.001.
- Castro J, Cabral J. Pelosof A, Seraphim A, Zitron c. Combined method for treating gastrocutaneous fistula after percutaneous endoscopic gastrostomy emoval Arq Gastroenterol 2021. v. 58(4): 571-2. doi.org/10.1590/S0004-2803.202100000-101
- Villaescusa Arenas D, Rodríguez de Santiago E, Rodríguez Gandía MA, Parejo Carbonell S, Peñas García B, Guerrero García A et al. Over-the-scope-clip (OTSC®) as a rescue treatment for gastrointestinal bleeding secondary to peptic ulcer disease. Rev Esp Enferm Dig 2023;115(2):70-74
- Chan S, Pittayanon R, Wang H-P, et al. Use of over-the-scope clip (OTSC) versus standard therapy for the prevention of rebleeding in large peptic ulcers (size ≥1.5 cm): an open-labelled, multicentre international randomised controlled trial. Gut 2023; 72:638–643. doi:10.1136/gutjnl-2022-327007
- Gralnek IM, Stanley AJ, Morris AJ, et al. Endoscopic diagnosis and management of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastrointestinal Endoscopy (ESGE) Guideline-Update 2021. Endoscopy 2021;53:300-22. DOI: 10.1055/a-1369-5274 7.
- Laine L, Barkun AN, Saltzman JR, et al. ACG Clinical Guideline: Upper Gastrointestinal and Ulcer Bleeding. Am J Gastroenterol 2021;116:899-17. DOI: 10.14309/ajg.0000000000001245
- Estevinho M M, Pinho R, Gomes C, Correia J, Freitas T. Hemostasis of a bleeding inverted colonic diverticulum. Rev Esp Enferm Dig 2023:115(1):51-52. DOI: 10.17235/reed.2022.9019/2022
Como citar este artigo
Cardoso DMM. “Fechando a questão” com clipes tipo “Over the Scope”. Casos clínicos (com vídeos) e revisão da literatura. Endoscopia Terapêutica 2023, Vol 1. Disponível em:
endoscopiaterapeutica.net/pt/fechando-a-questao-com-clipes-tipo-over-the-scope-casos-clinicos-com-videos-e-revisao-da-literatura/