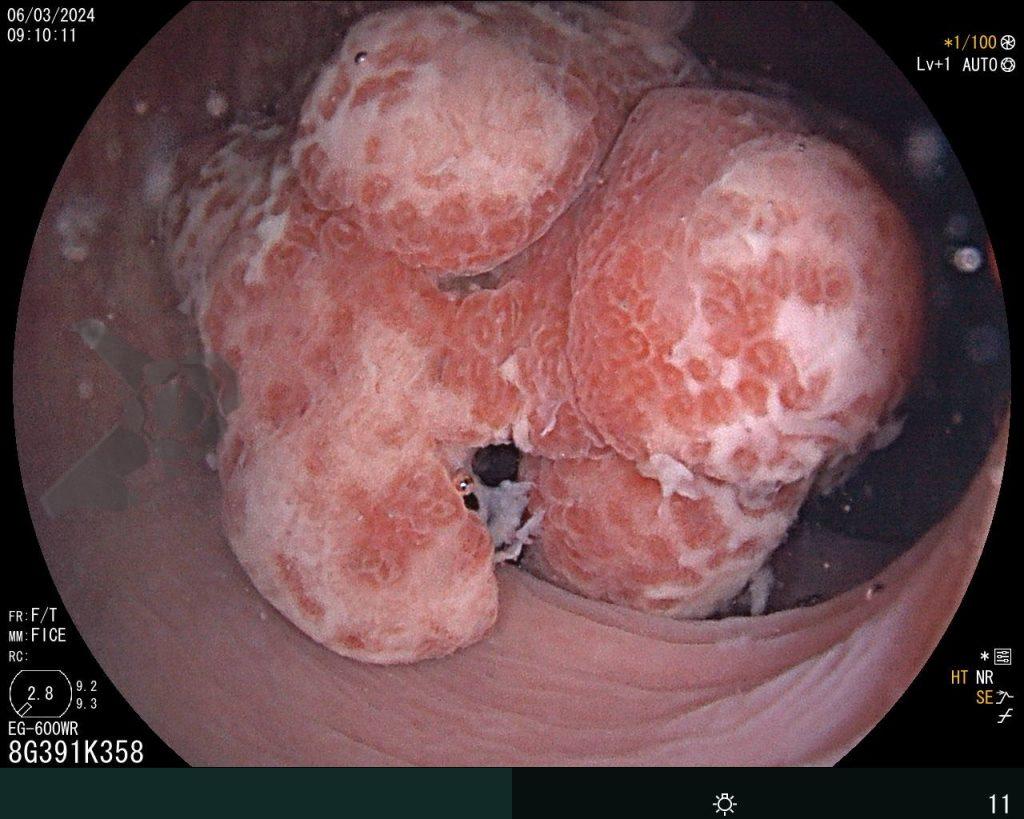
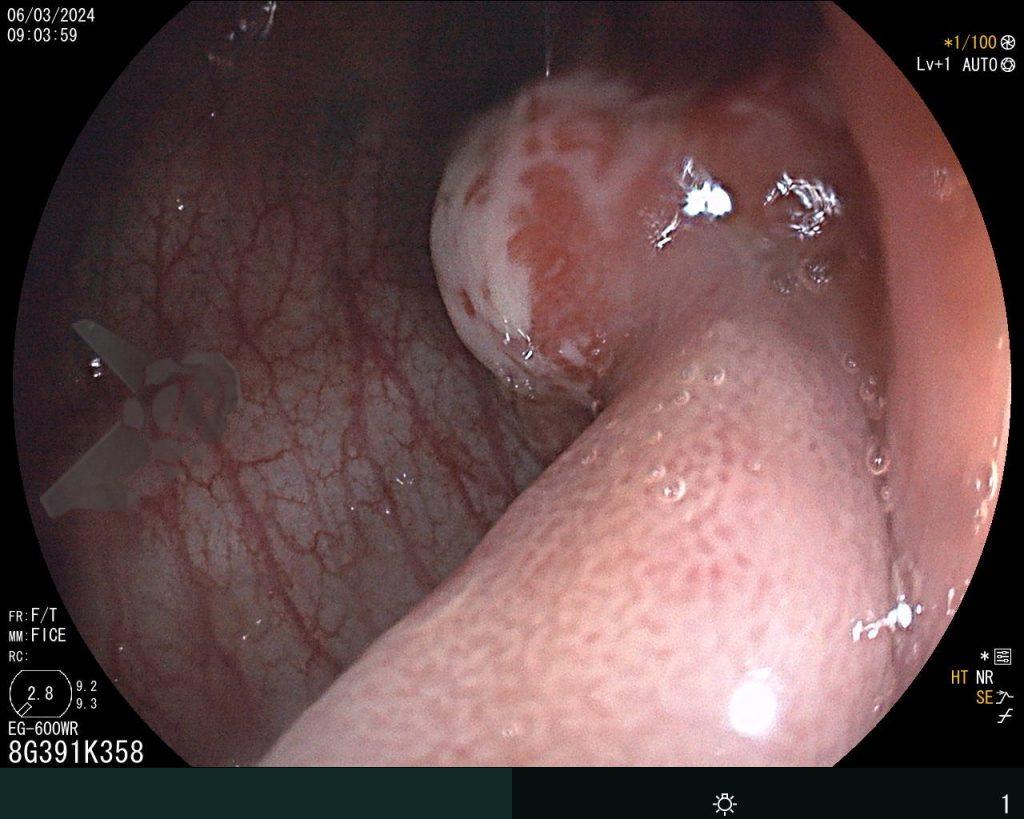
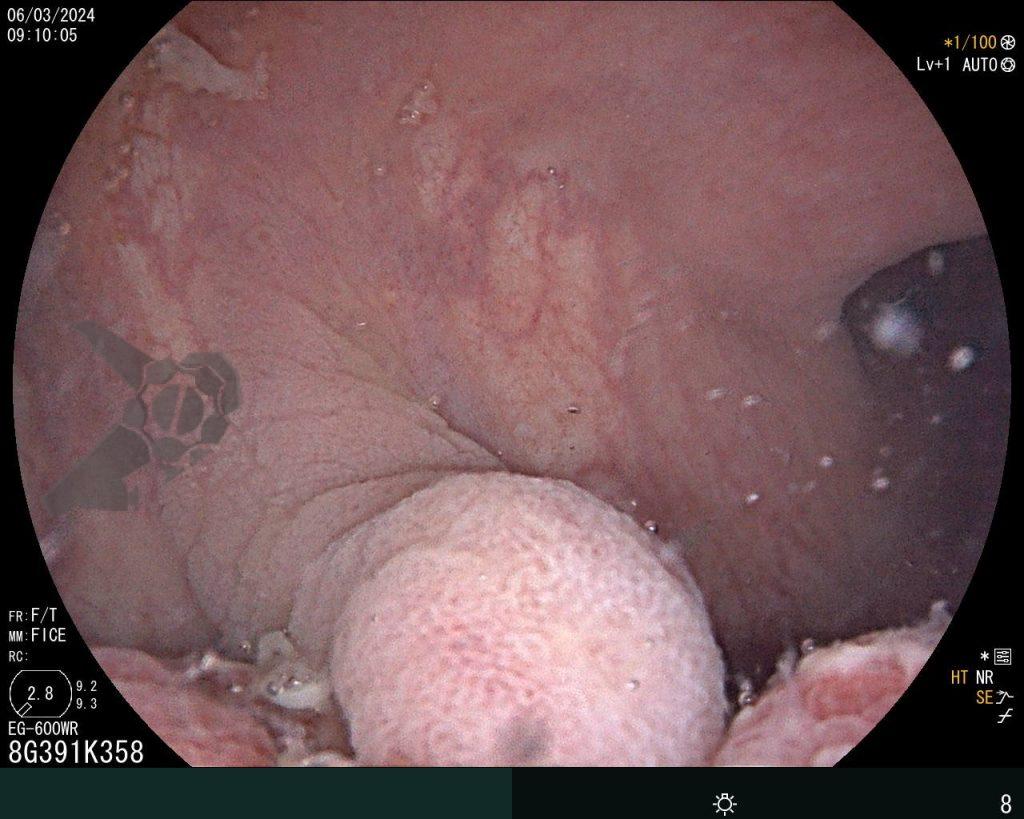
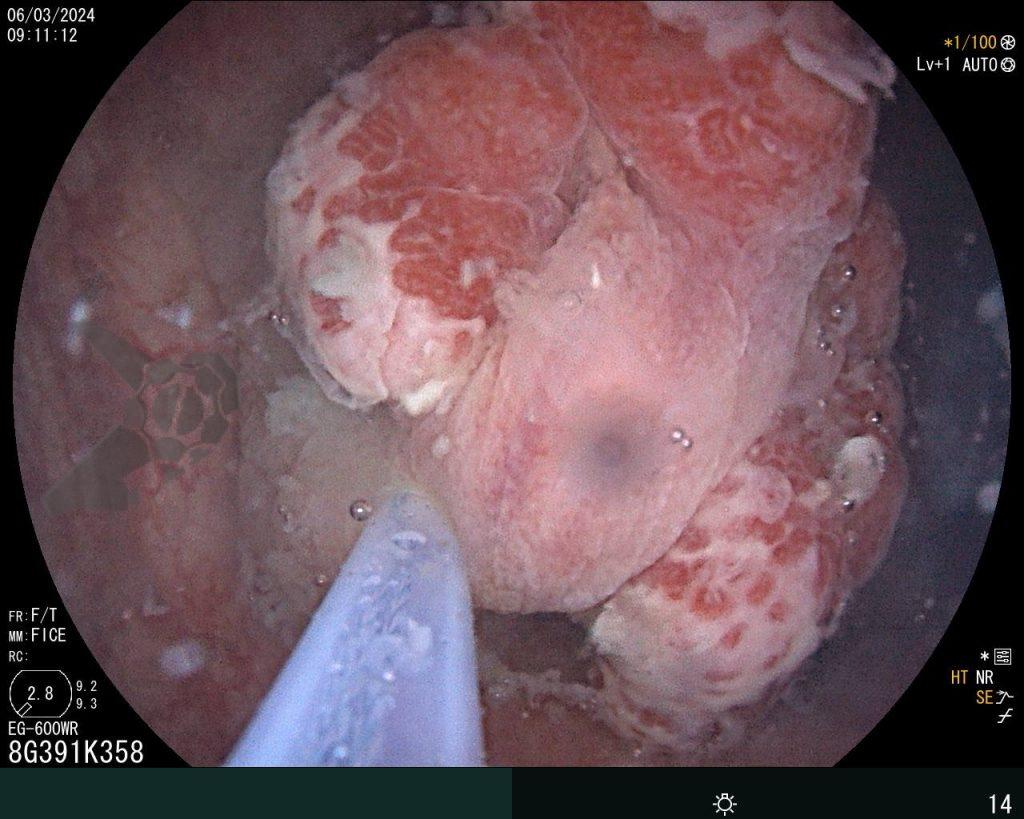
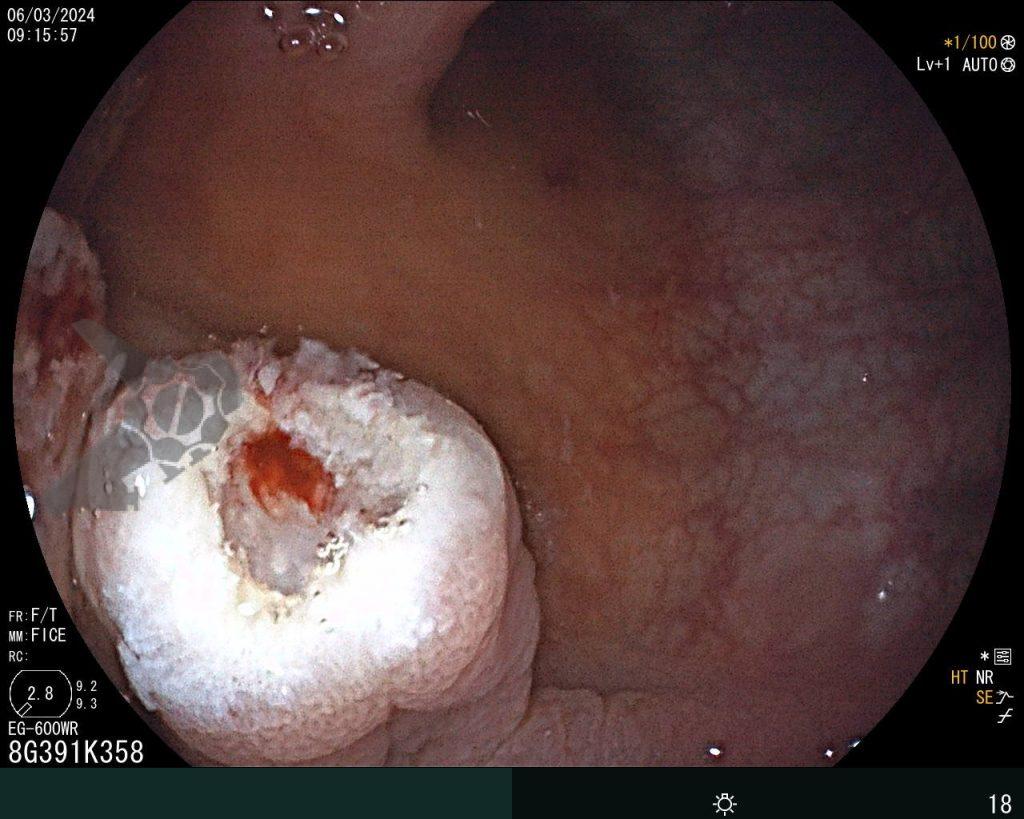
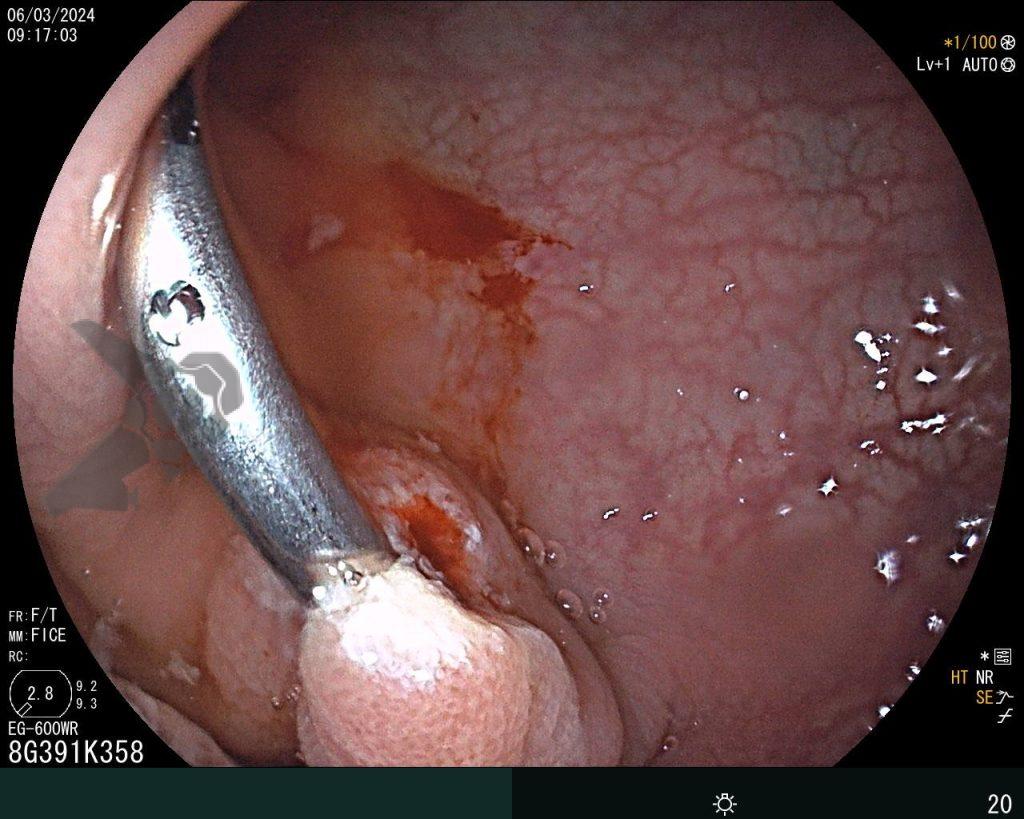
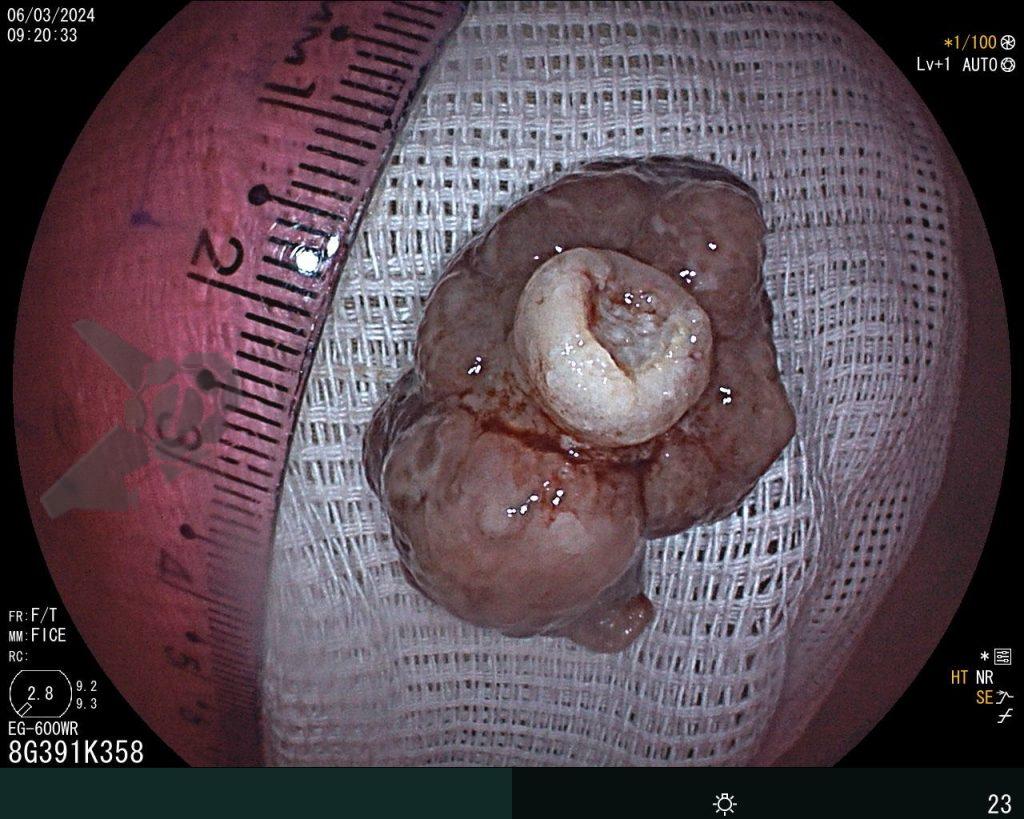
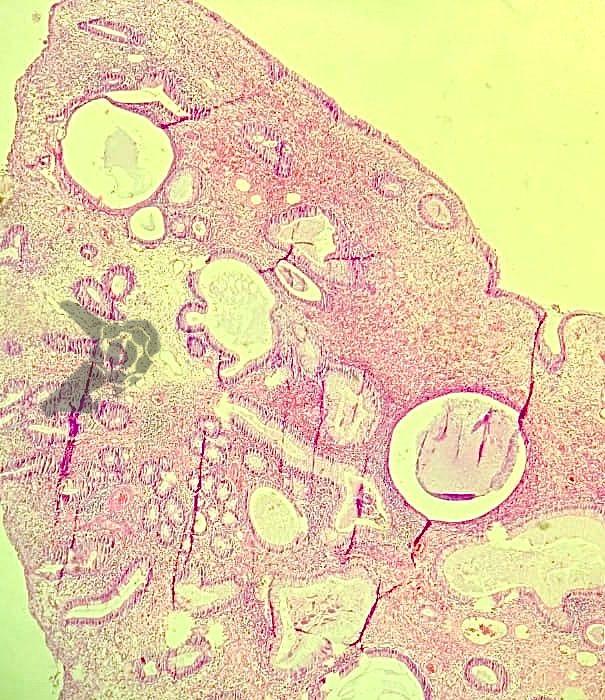
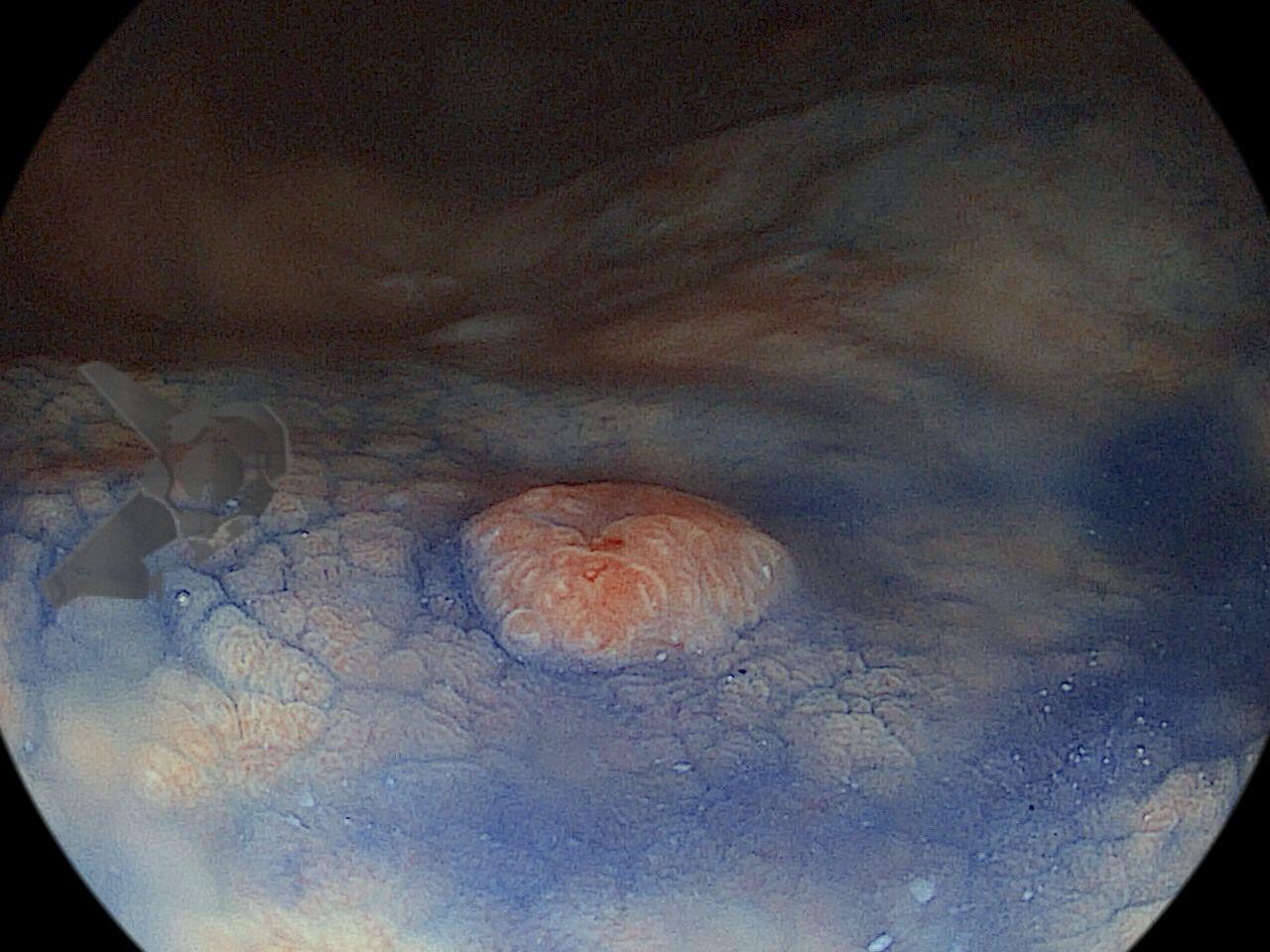
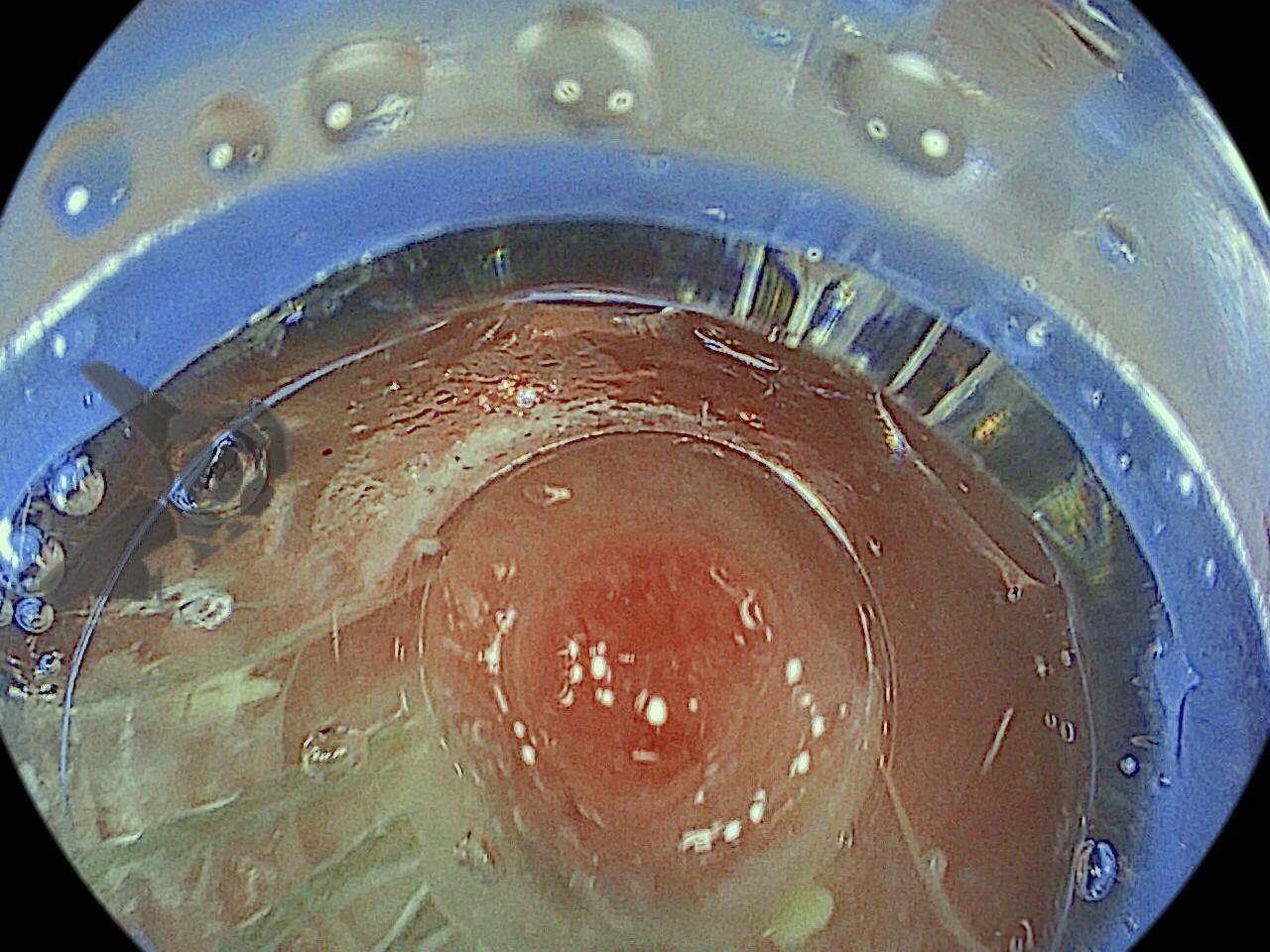
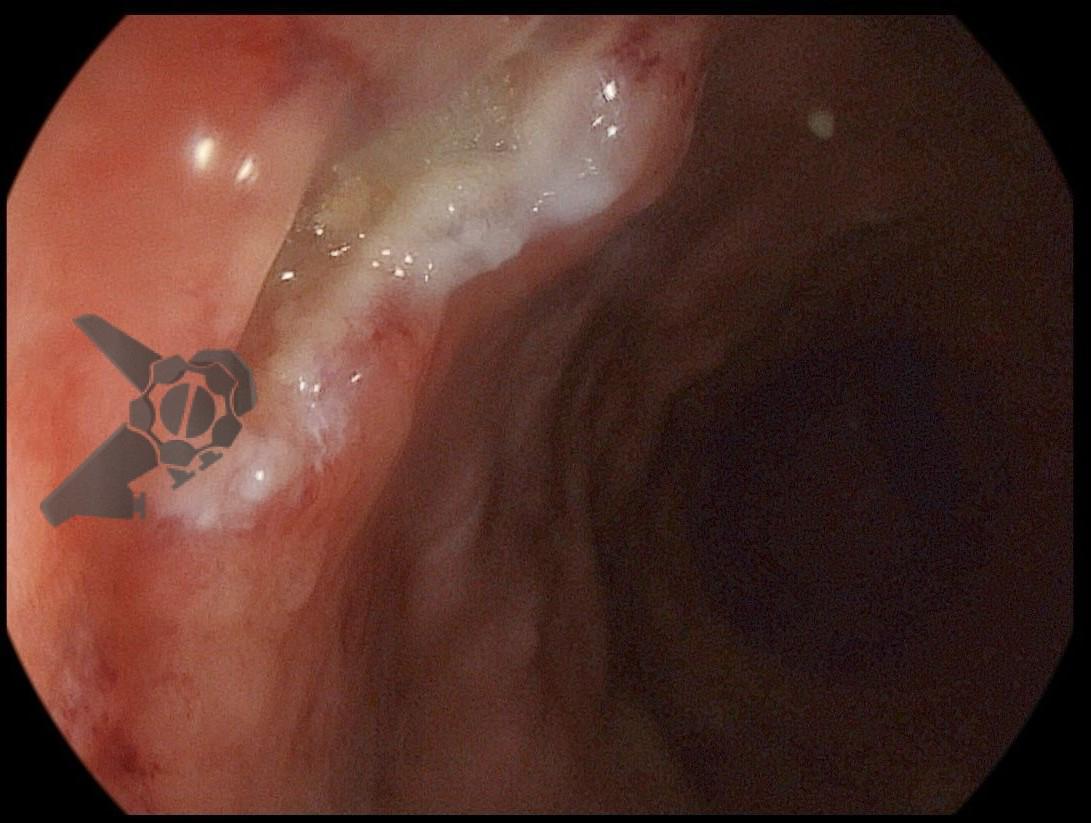
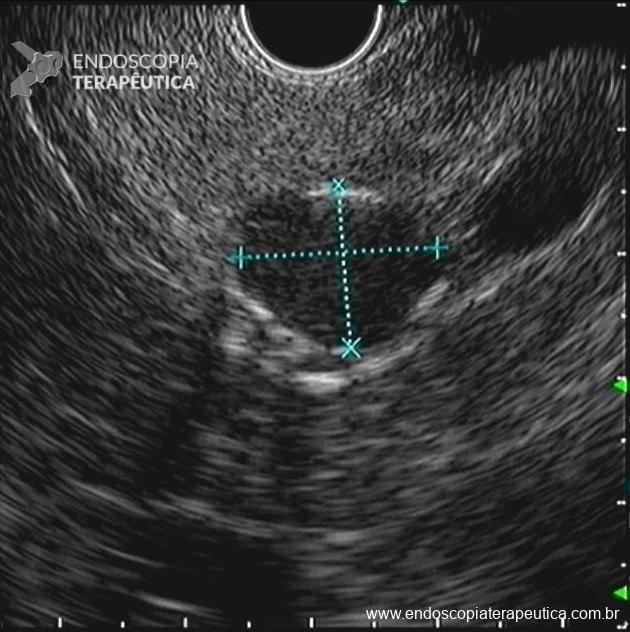
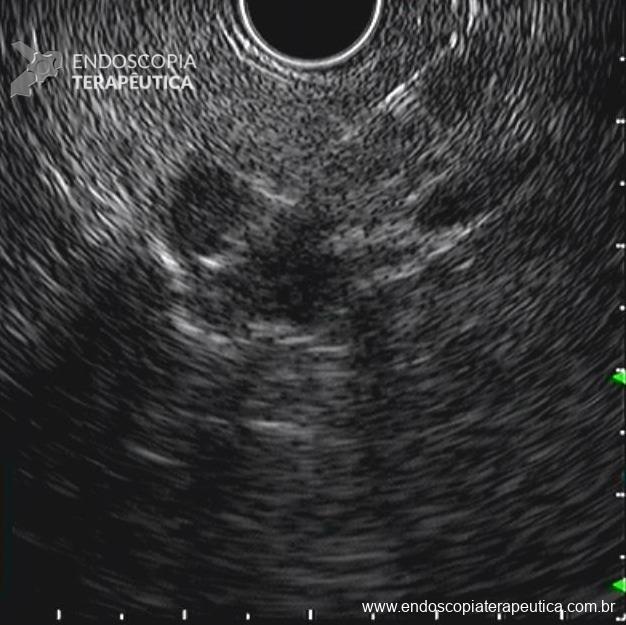
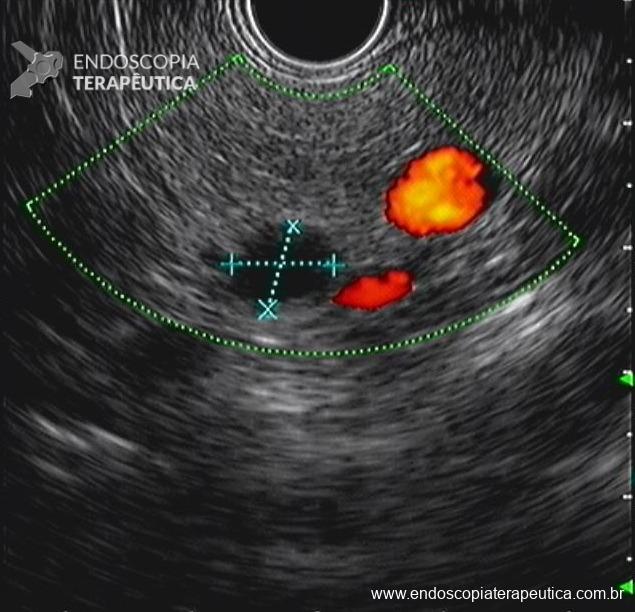
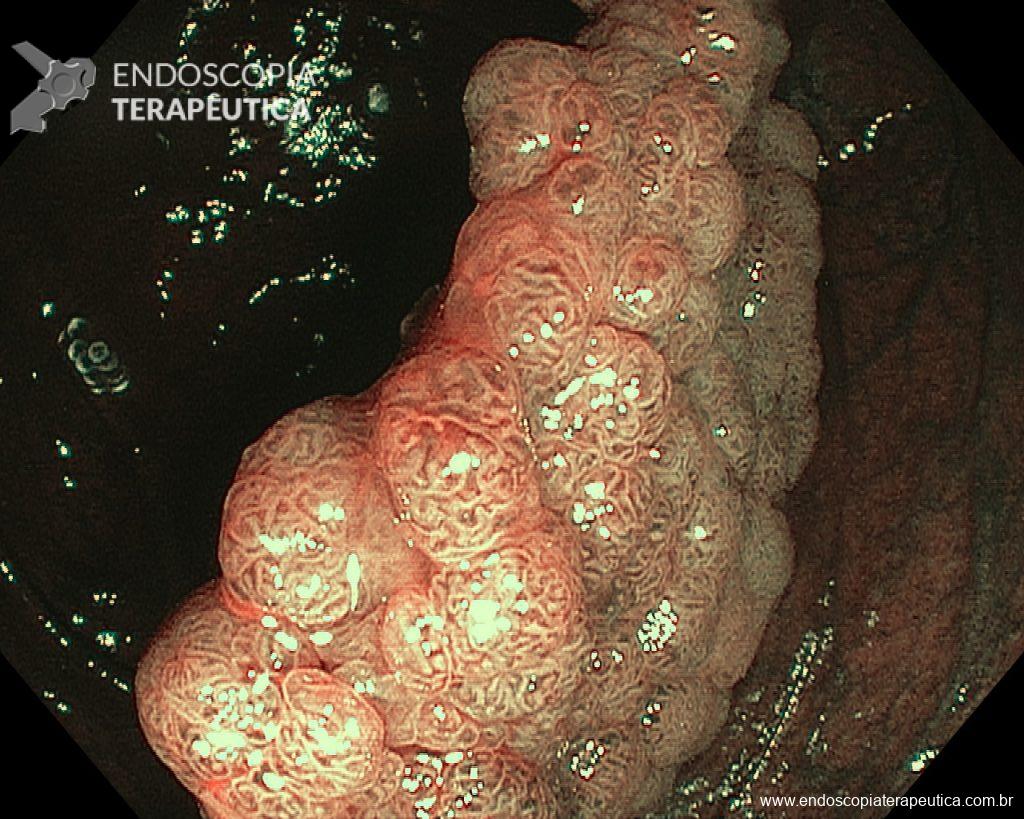
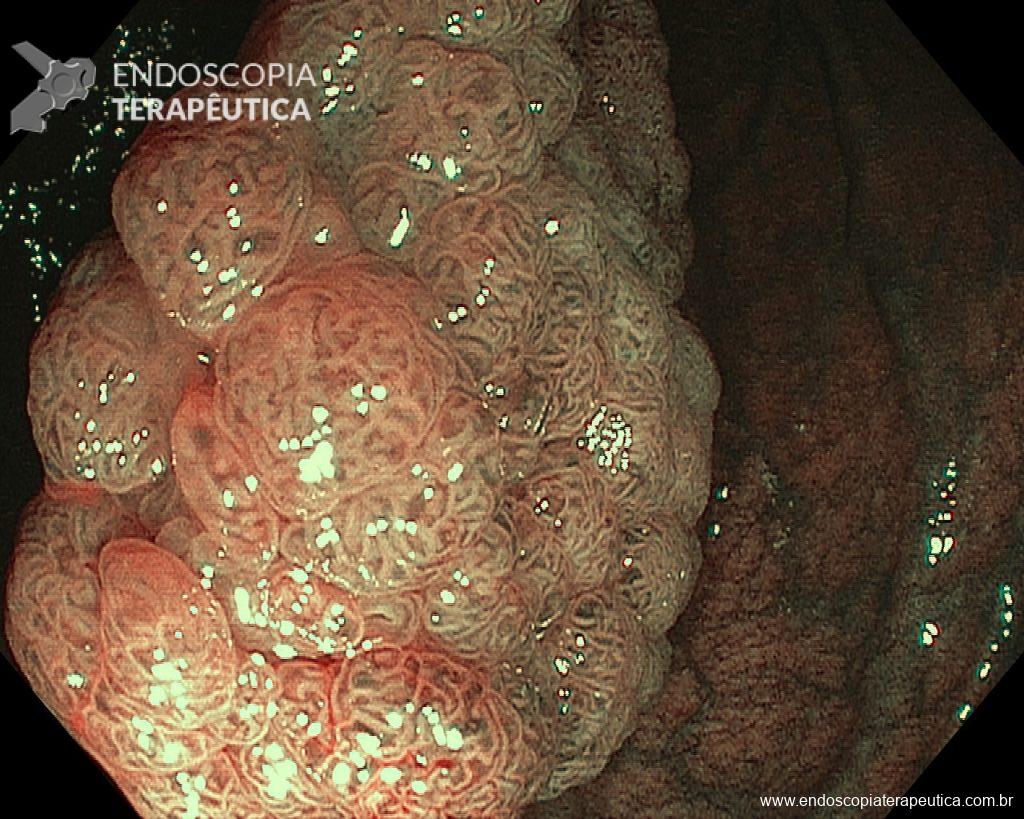
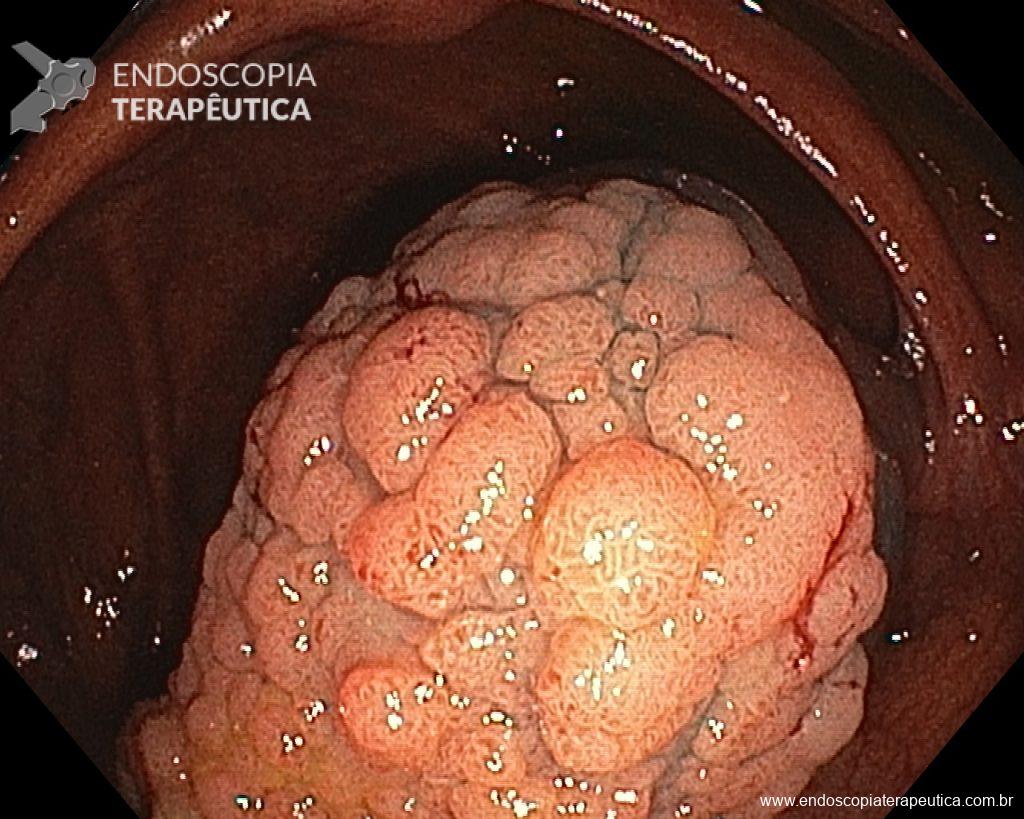
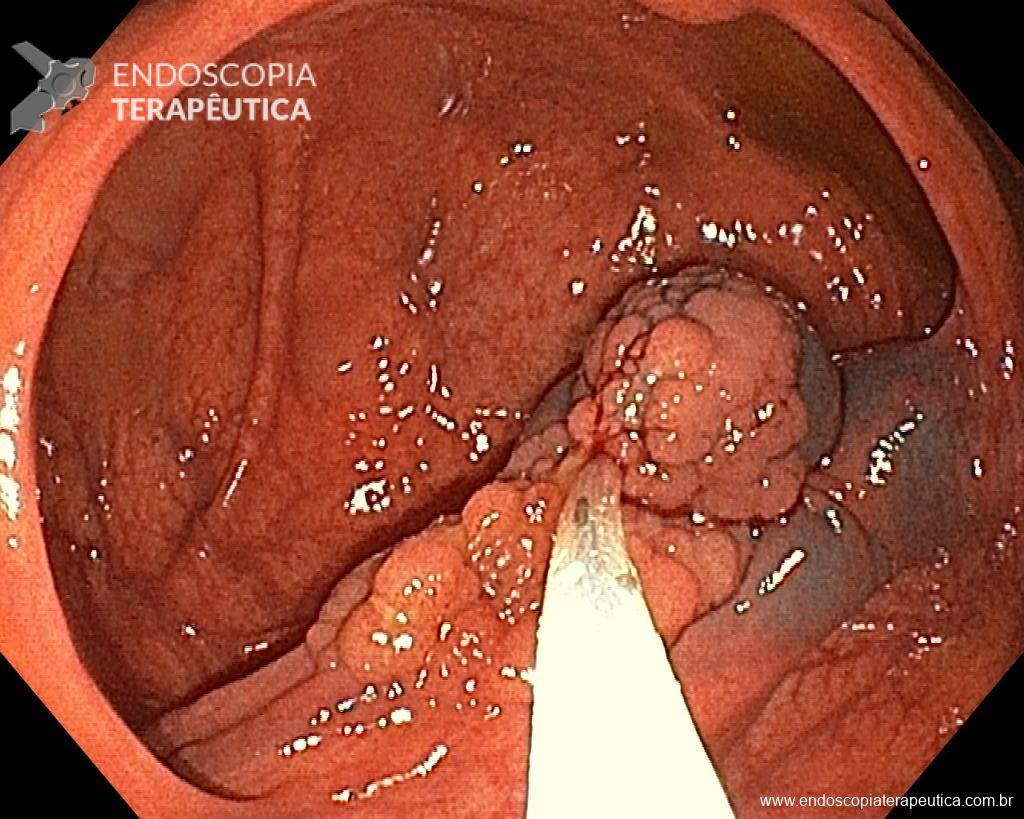
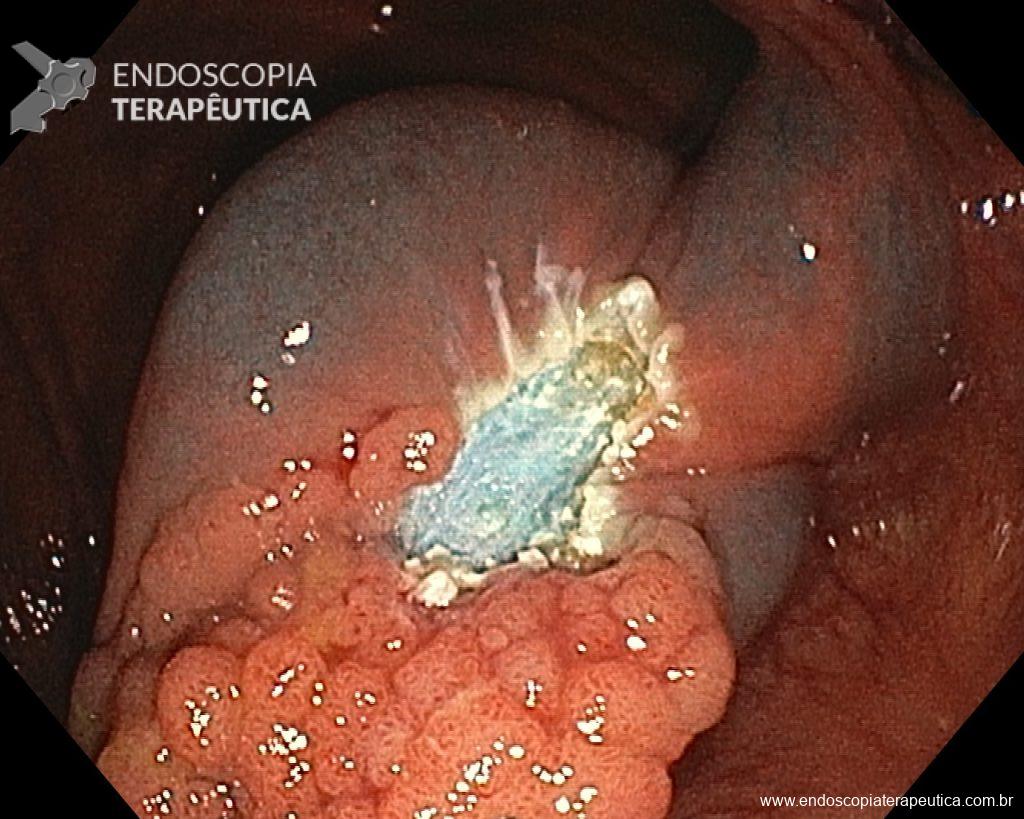
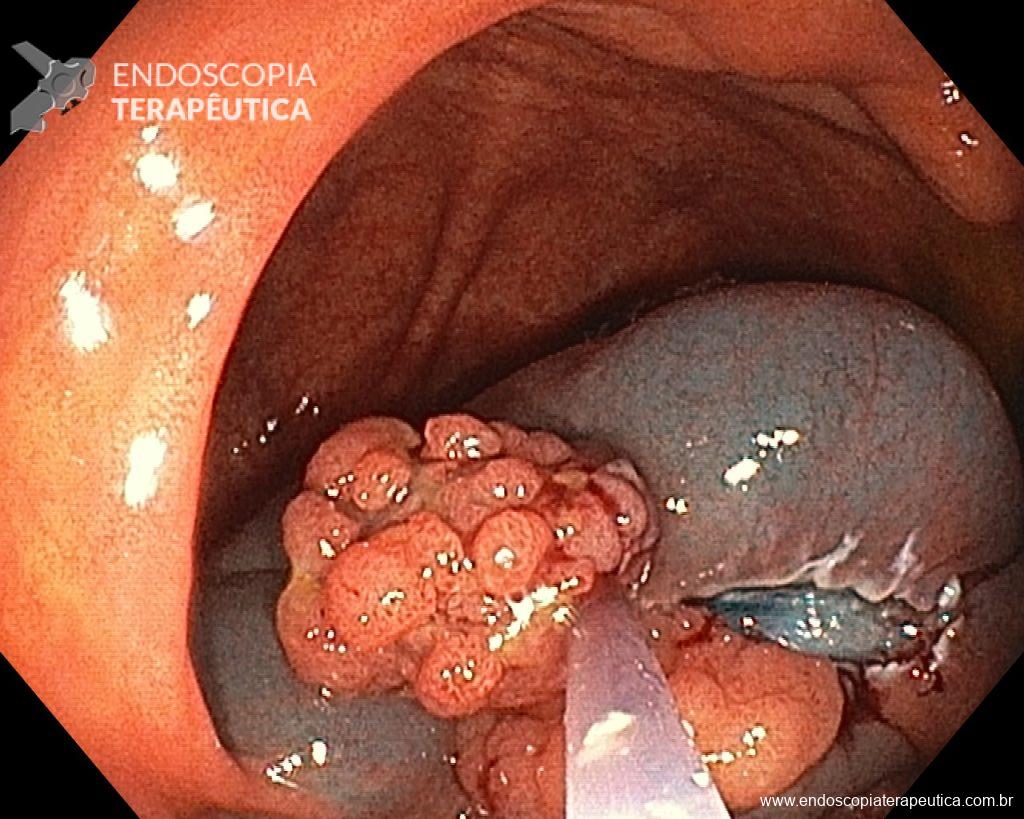
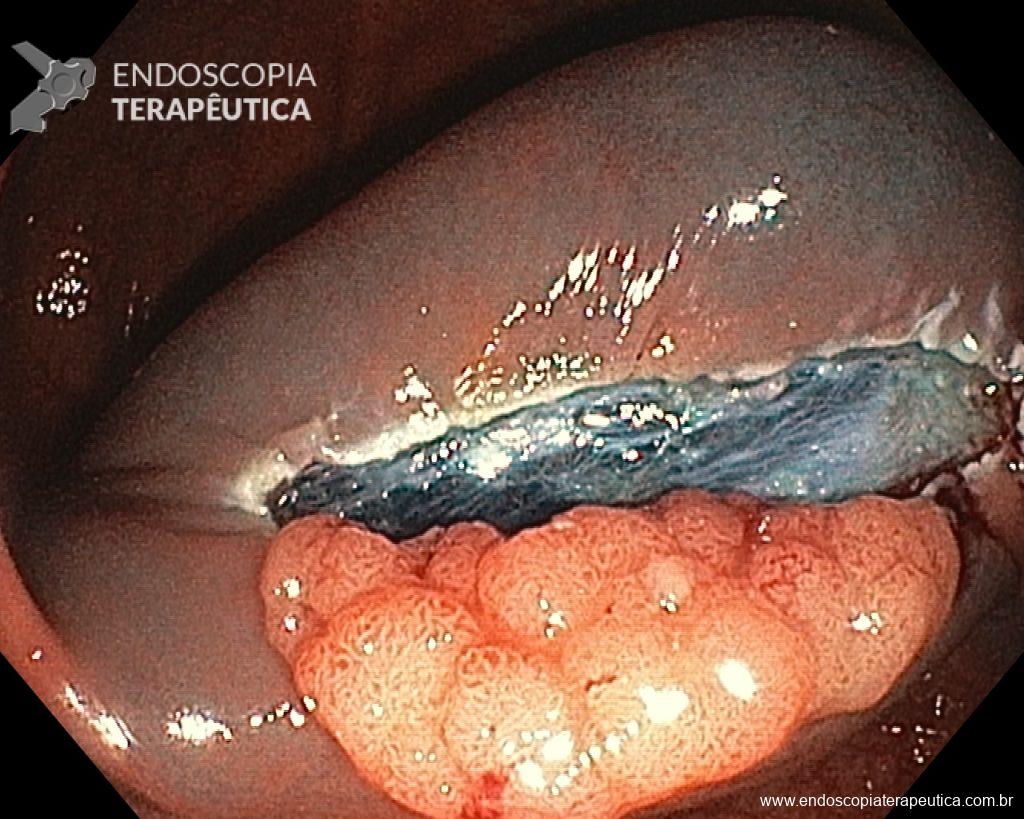
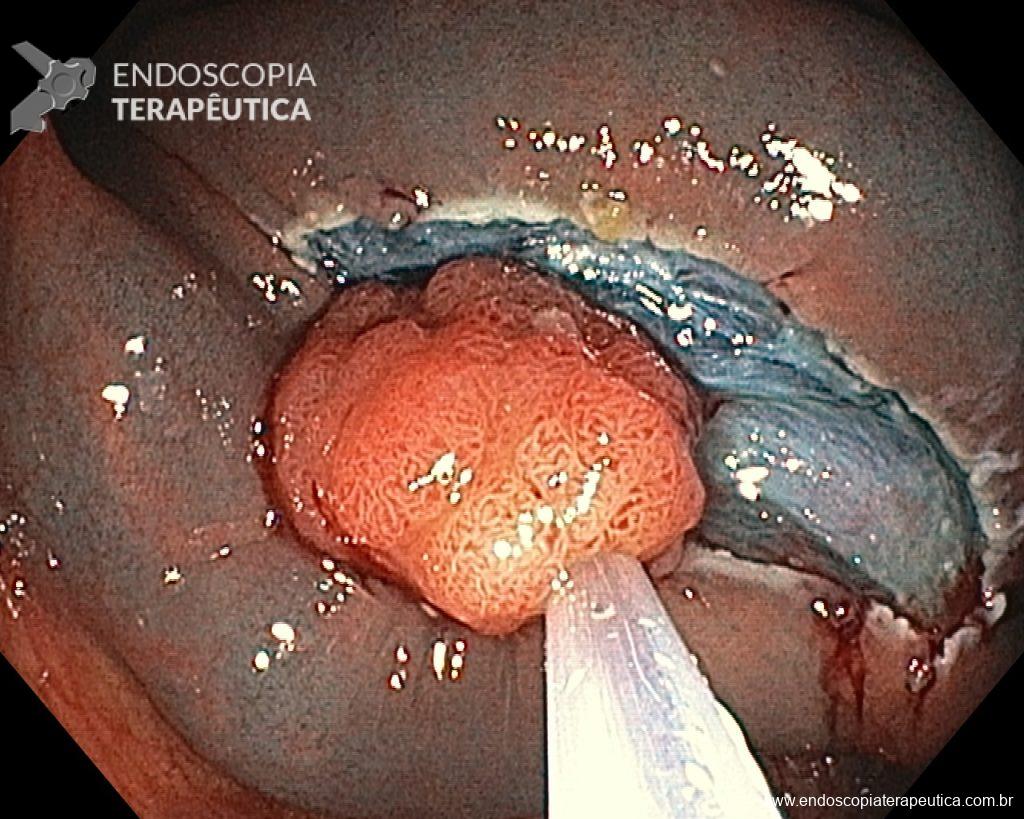
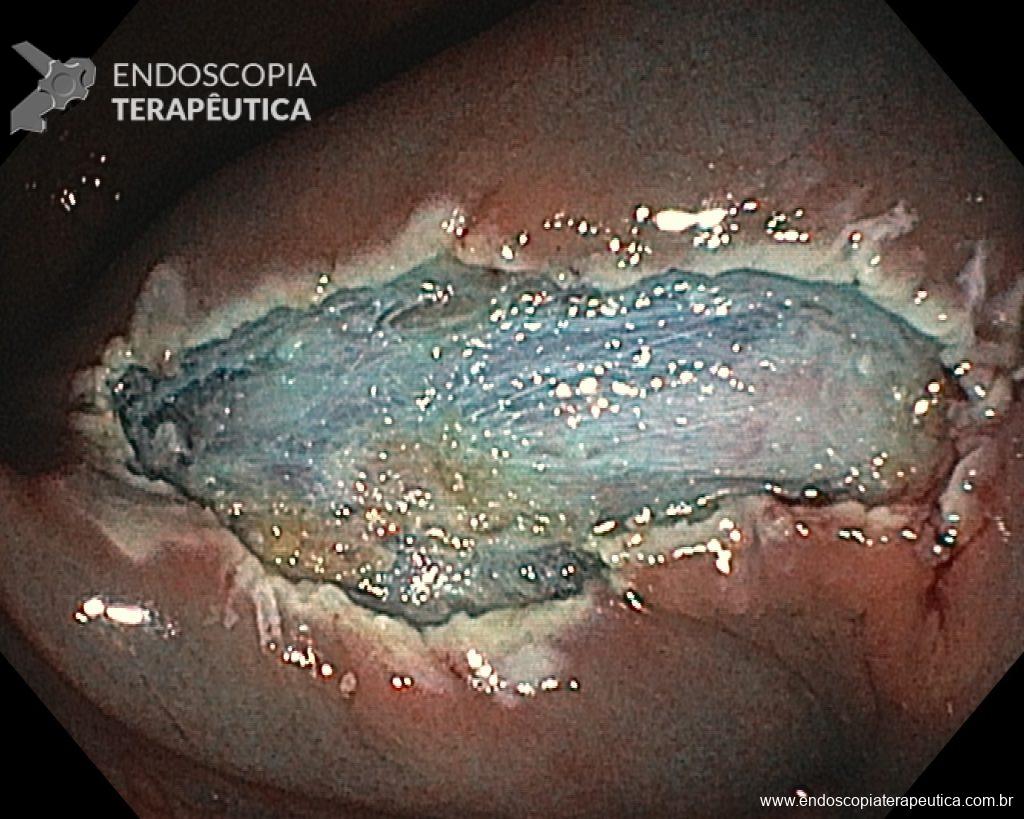
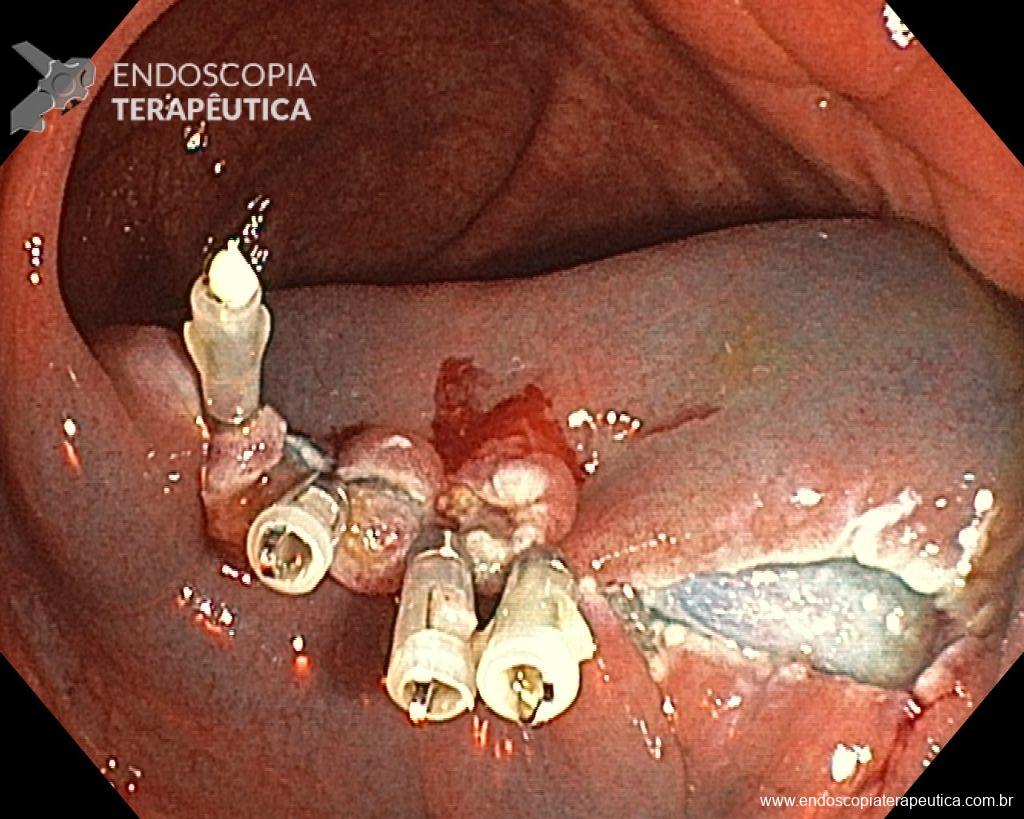
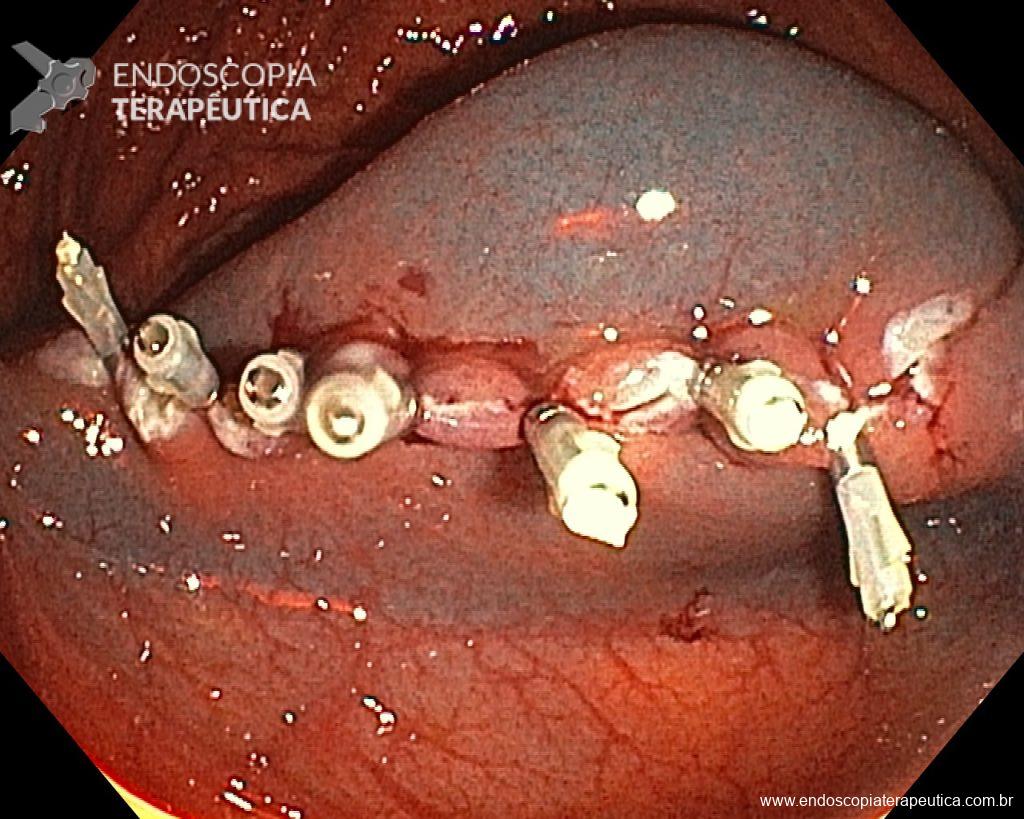
Dissecção Endoscópica Submucosa (ESD) de Lesões Colorretais em Regime Ambulatorial: Viabilidade e Segurança
Introdução
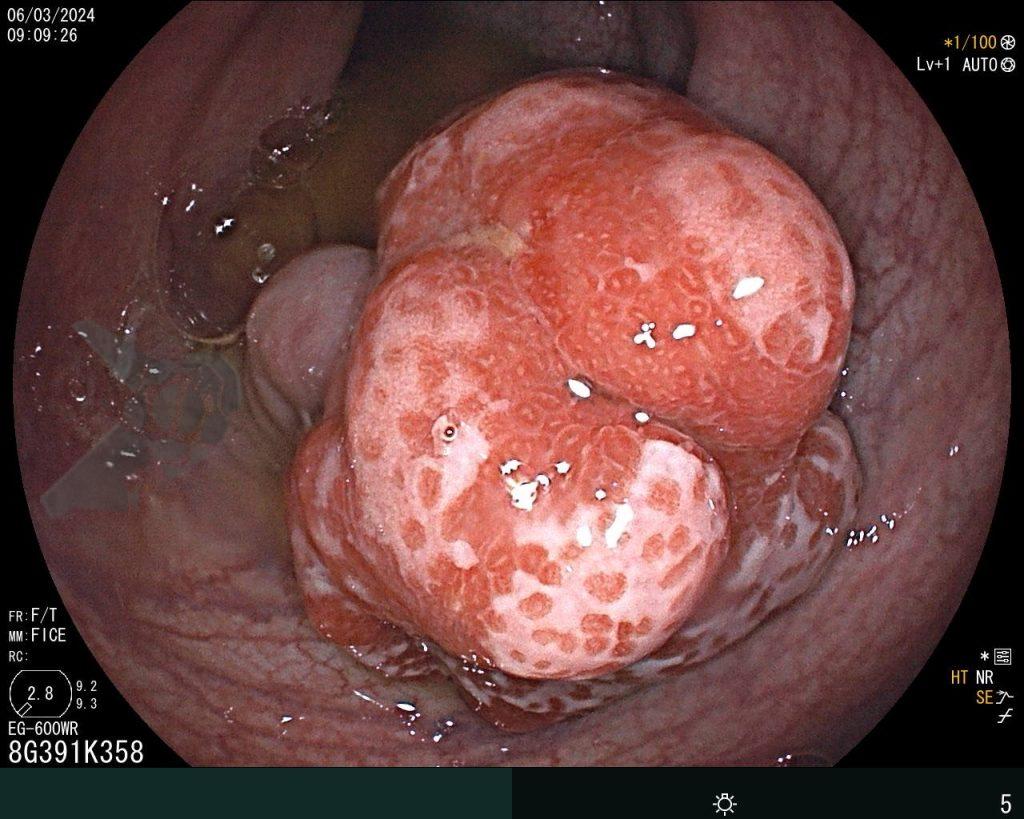
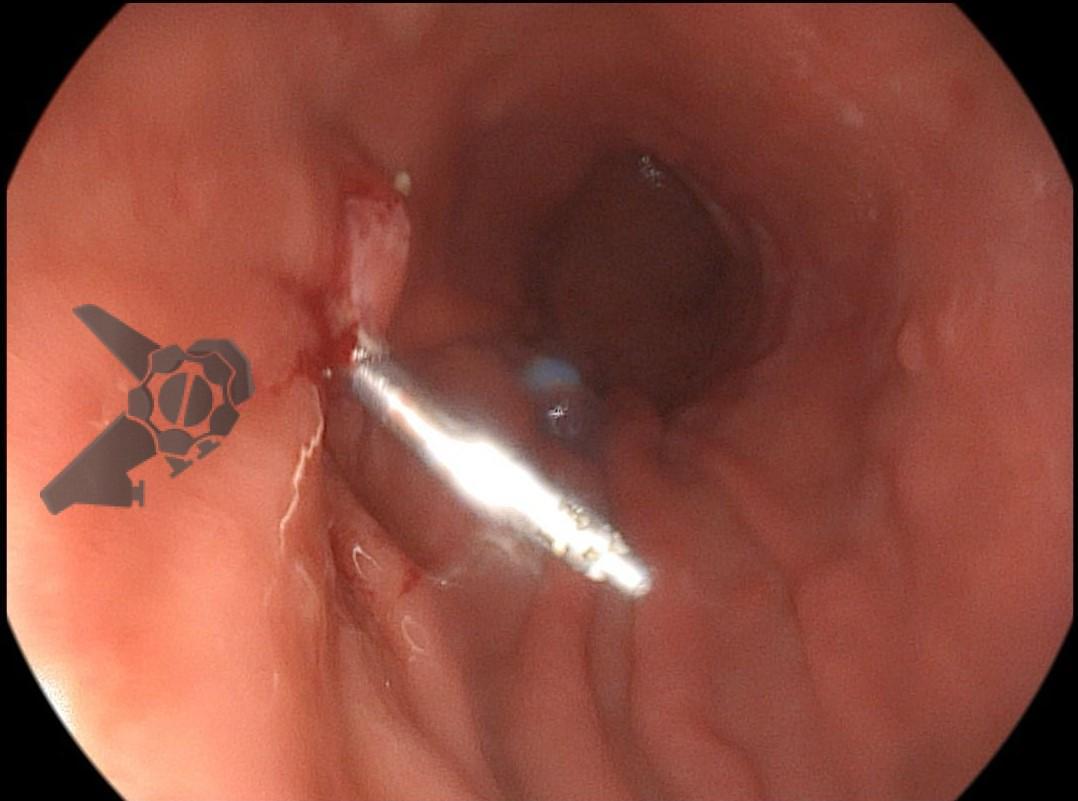
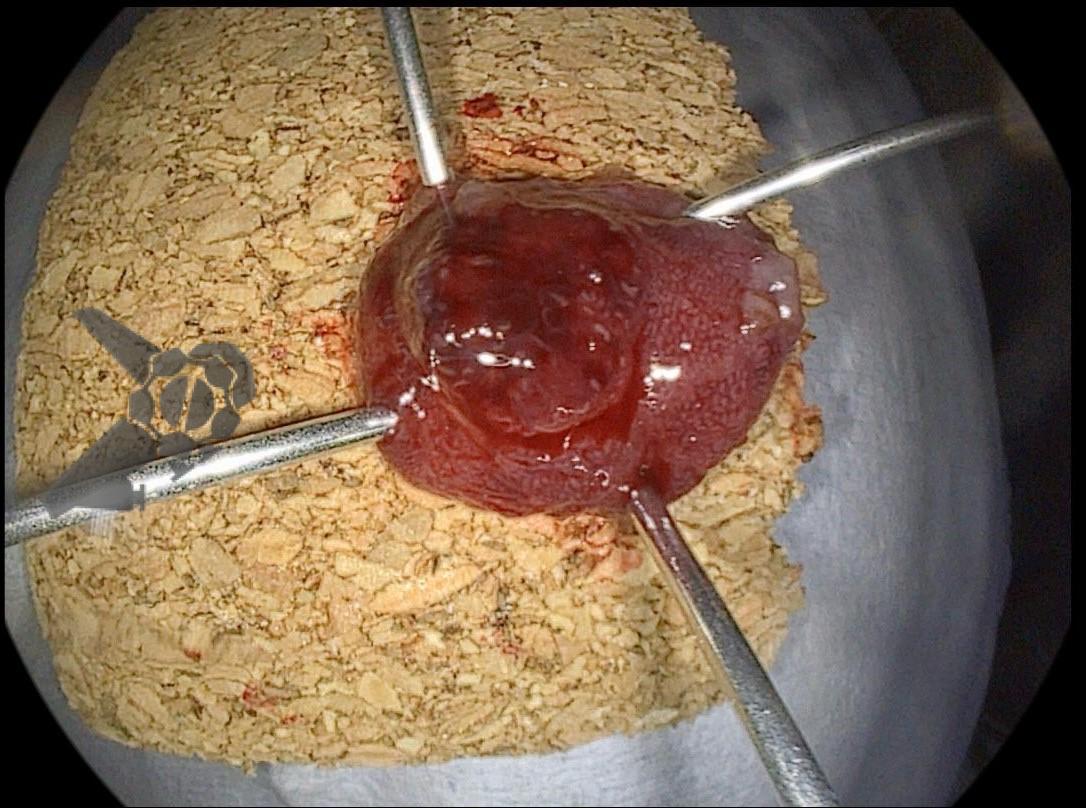
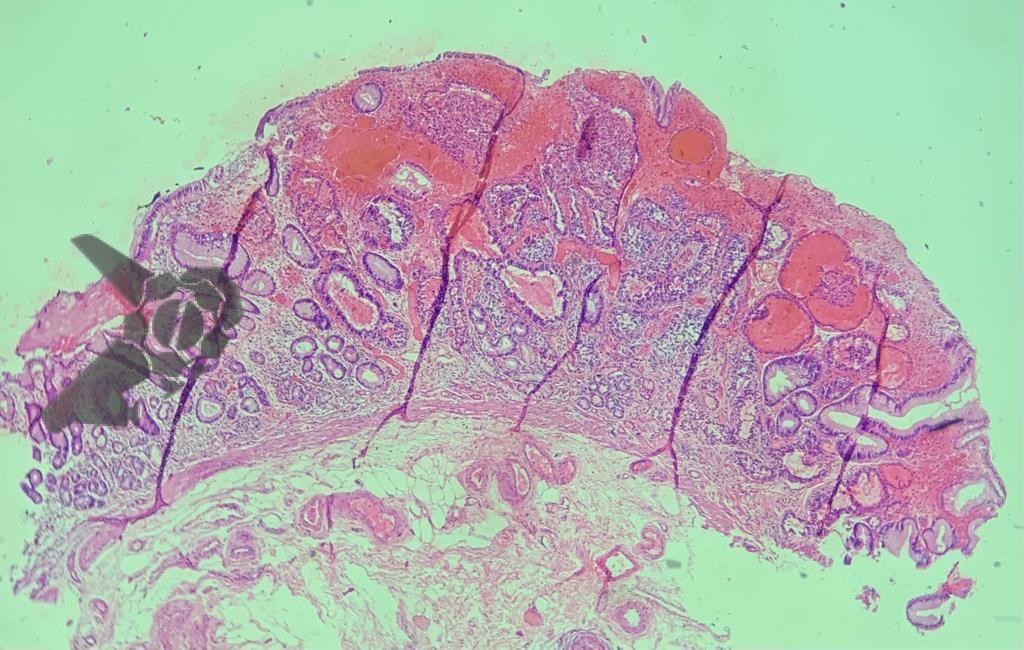
A dissecção endoscópica submucosa (ESD) é a técnica recomendada para ressecção em monobloco de lesões colorretais maiores que 2 cm, sendo essencial para a adequada avaliação anatomopatológica de lesões com possível componente maligno. Embora a ESD ofereça vantagens em relação à mucosectomia, apresenta uma taxa de complicação mais elevada, com a perfuração sendo a complicação mais temida (2-10,7% na ESD vs. 0,8% na mucosectomia) [1].
Com o avanço das indicações e maior expertise dos endoscopistas, a ESD tem se tornado mais comum. No entanto, os custos elevados da técnica motivaram a busca por alternativas, como a realização do procedimento em regime ambulatorial, reduzindo custos e otimizando a ocupação de leitos hospitalares. Este artigo revisa a literatura para avaliar a viabilidade e segurança da ESD ambulatorial em lesões colorretais.
Revisão da Literatura
Maselli et al. (2018) [2]
Um estudo de coorte com 122 pacientes submetidos a ressecção comparou os resultados entre ESD ambulatorial (68%) e internação hospitalar (32%). Os critérios para internação incluíram idade ≥ 80 anos ou ASA ≥ 3. Os pacientes ambulatoriais foram observados por 6 horas, com contato telefônico em 24 e 48 horas.
- Resultados:
- Taxa de ressecção em monobloco e ressecção R0 semelhantes entre os grupos.
- Perfuração intra-procedimento em 3 casos (1 no grupo ambulatorial e 2 no grupo internação), tratados com clipes, sem necessidade de internação.
- Pacientes do grupo internação tiveram custo de 941 euros superior ao grupo ambulatorial.
Conclusão: A ESD ambulatorial para pacientes sem critérios de internação é viável, segura e econômica.
Tidehag et al. (2022) [3]
Análise retrospectiva de 660 pacientes, onde 612 (92,7%) realizaram ESD ambulatorial e 48 (7,3%) necessitaram internação. Os critérios para internação incluíram idade avançada, comorbidades, tempo de procedimento >4 horas e residência a >100 km do hospital.
- Resultados:
- 5,4% dos pacientes ambulatoriais necessitaram internação não programada, principalmente por perfuração intra-procedimento (16 casos).
- 46 pacientes (7,5%) buscaram atendimento em 30 dias, principalmente por sangramento tardio.
- Mediana do tempo da procura por atendimento: 4 dias, indicando que seriam necessários 4 dias de internação para que metade dos eventos adversos ocorressem durante o período de internação.
Conclusão: A ESD colorretal ambulatorial é segura e viável para a maioria dos pacientes.
Wei e Friedland (2024)[4]
Análise de 105 pacientes submetidos à ESD ambulatorial no Stanford Hospital, onde todos os pacientes eram tratados ambulatorialmente independentemente da idade e comorbidades. Os pacientes eram observados por 2-4 horas, com internação apenas se houvesse sintomas persistentes.
- Resultados:
- 2 casos de perfuração intra-procedimento, tratados com clipes e alta após 2 horas de observação.
- 1 paciente internado por dor abdominal persistente, com alta no dia seguinte.
- 1 paciente reinternado por sangramento tardio, sem necessidade de transfusão.
- Maior taxa de sangramento em pacientes cujo leito de ressecção não foi fechado (41,7% vs. 1%, p<0,0001).
Conclusão: Fechar o leito de ressecção reduz significativamente o risco de sangramento, aumentando a segurança da ESD ambulatorial.
Diretriz Japonesa (JGES, 2022)[1]
A Japan Gastroenterological Endoscopy Society (JGES) recomenda a internação para lesões > 2 cm, enquanto lesões menores podem ser tratadas ambulatorialmente. Essa abordagem mais conservadora contrasta com a tendência ocidental de ampliar os critérios para ESD ambulatorial.
Discussão
O Japão adota uma abordagem mais conservadora, realizando ESD colorretal predominantemente com internação hospitalar. Em contraste, os países ocidentais expandiram os critérios para ESD ambulatorial, priorizando redução de custos e otimização de recursos hospitalares.
No Brasil, onde a disponibilidade de leitos é limitada, especialmente no Sistema Único de Saúde (SUS), a ESD ambulatorial pode ser uma solução viável. Para garantir segurança, os critérios de seleção devem considerar:
- Idade e comorbidades do paciente.
- Tamanho da lesão e tempo de procedimento.
- Intercorrências intra-procedimento.
- Distância da residência ao hospital.
- Sintomas no pós-operatório imediato.
Dado que a maioria das complicações tardias ocorrem em até 10 dias após o procedimento, é fundamental garantir contato imediato com a equipe médica e acesso fácil ao hospital para pacientes que apresentem sinais de complicações.
Conclusão
O ESD colorretal ambulatorial é viável e seguro em pacientes selecionados, proporcionando redução de custos e melhor alocação dos recursos hospitalares. A seleção dos pacientes deve considerar fatores como idade, comorbidades, tamanho da lesão e intercorrências intra-procedimento. O contato com a equipe médica e acesso ao hospital é essencial para manejo adequado de eventuais complicações tardias.
Clique aqui para mais informações de ESD de Cólon – Dicas e Truques.
Referências
- Tanaka S, Kashida H, Saito Y, et al. Japan Gastroenterological Endoscopy Society guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Dig Endosc. 2020;32(2):219-239. doi:10.1111/den.13545
- Maselli R, Galtieri PA, Di Leo M, et al. Cost analysis and outcome of endoscopic submucosal dissection for colorectal lesions in an outpatient setting. Dig Liver Dis. 2019;51(3):391-396. doi:10.1016/j.dld.2018.09.023
- Tidehag, V., Törnqvist, B., Pekkari, K., & Marsk, R. (2022). Endoscopic submucosal dissection for removal of large colorectal neoplasias in an outpatient setting: a single-center series of 660 procedures in Sweden. Gastrointestinal endoscopy, 96(1), 101–107. https://doi.org/10.1016/j.gie.2022.02.017
- Wei M, Friedland S. EVALUATION OF THE SAFETY AND FEASIBILITY OF OUTPATIENT COLORECTAL ENDOSCOPIC SUBMUCOSAL DISSECTION. Gastrointest Endosc [Internet]. 2024 Jun 1;99(6):AB505–6. Available from: https://doi.org/10.1016/j.gie.2024.04.1519
Como citar este artigo
Proença IM. Dissecção Endoscópica Submucosa (ESD) de Lesões Colorretais em Regime Ambulatorial: Viabilidade e Segurança. Endoscopia Terapeutica. Ano 2025. Vol. I. Disponível em: https://endoscopiaterapeutica.net/uncategorized/rascunho-automatico/