Papel da ecoendoscopia na pancreatite aguda idiopática
Introdução
A pancreatite aguda é uma das doenças responsáveis pelo maior número de internações de urgência na gastroenterologia. Sua incidência é de 13 a 45 casos por 100 mil pessoas, sendo responsável por 270 mil internações por ano nos Estados Unidos 1. A maioria dos casos é de pouca gravidade, mas pode evoluir para formas graves, com necessidade de internação em centro de terapia intensiva e até óbito. Sua mortalidade chega a próximo de 5%, sendo significativamente maior quando analisados somente os quadros mais graves 2.
A doença biliar litiásica e o etilismo são os principais agentes causais, sendo responsáveis por cerca de 60% a 80% dos casos 3. Outras causas menos comuns são alterações anatômicas, metabólicas, tumores, doenças autoimunes, entre outras. No entanto, em uma porcentagem significativa dos casos, cerca de 10% a 30%, não é possível se identificar um fator causal após a avaliação inicial 3-4. Ela é definida, então, como pancreatite aguda idiopática, sendo a 3ª causa mais comum em algumas séries 3.
É de fundamental importância uma avaliação detalhada nesses pacientes com pancreatite aguda idiopática, uma vez que 14% a 26% podem apresentar episódios recorrentes, evoluindo até para pancreatite crônica 5-6. Em alguns casos, após a realização de exames especializados, pode se identificar um agente causal tratável, evitando, assim, novas crises.
A ecoendoscopia é um procedimento minimamente invasivo e que, devido à proximidade do estômago e do duodeno com o pâncreas e as vias biliares, permite um exame detalhado dessa região. Vários estudos têm mostrado o seu benefício na investigação de pacientes com pancreatite aguda idiopática, no entanto o momento da sua realização ainda não está bem definido 1,2-8.
Acurácia da ecoendoscopia
A acurácia da ecoendoscopia na identificação de um agente causal em pacientes com pancreatite aguda idiopática varia muito entre os estudos, de 29% a 88% 4. Essa grande diferença se deve aos critérios de inclusão utilizados em cada estudo. Naqueles que os pacientes eram submetidos a um maior número de exames diagnósticos antes da realização da ecoendoscopia a acurácia foi mais baixa. Nos que os pacientes eram encaminhados mais precocemente para realização da ecoendoscopia a acurácia foi mais alta.
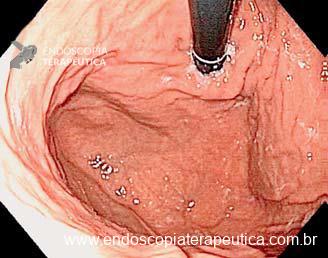
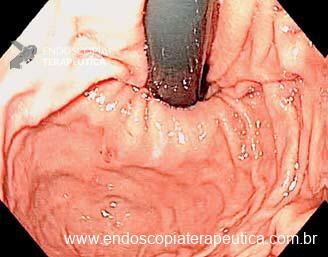
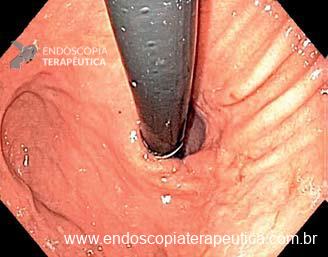
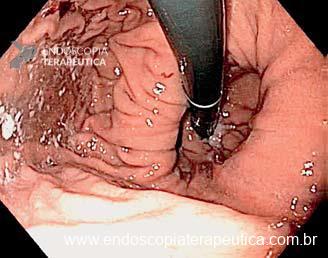
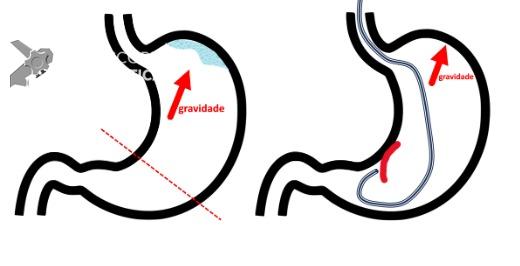
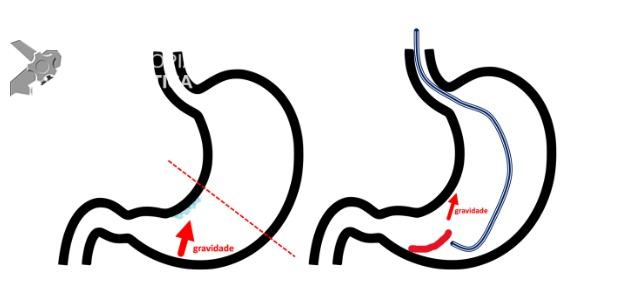
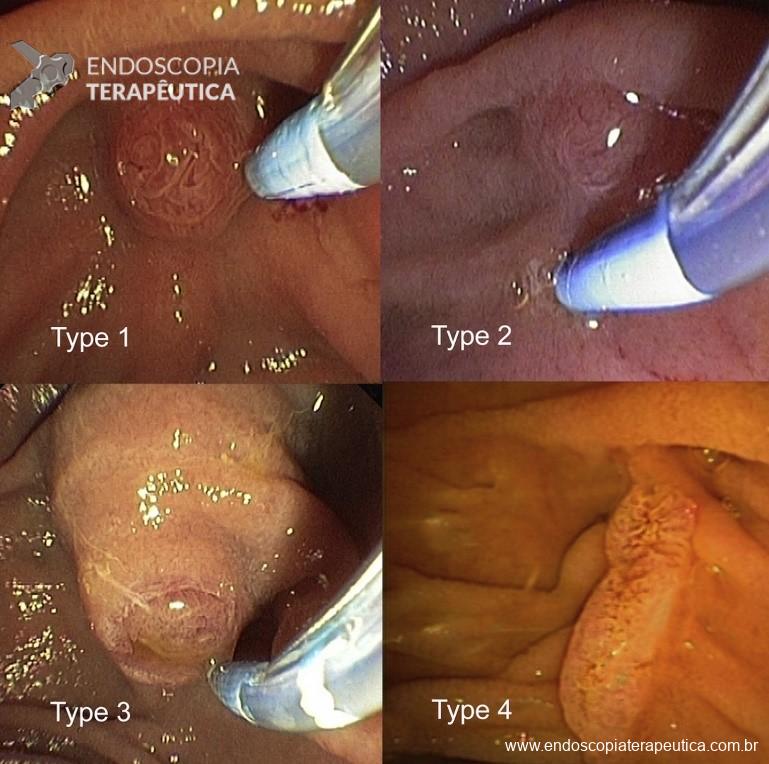
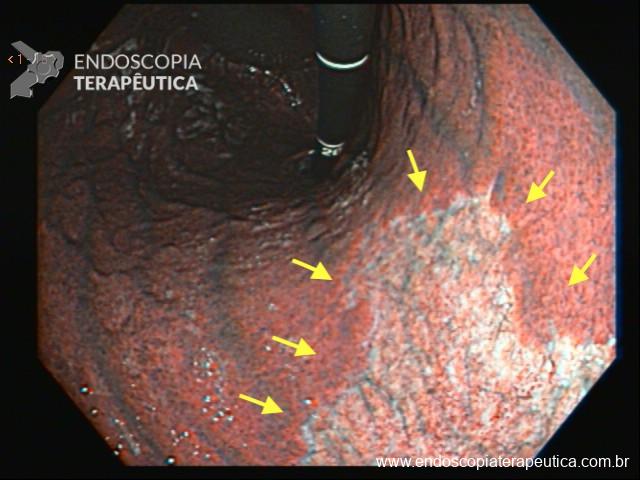
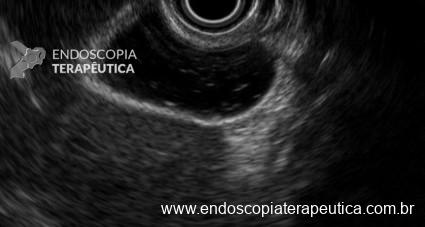
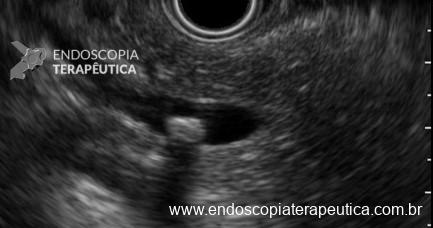
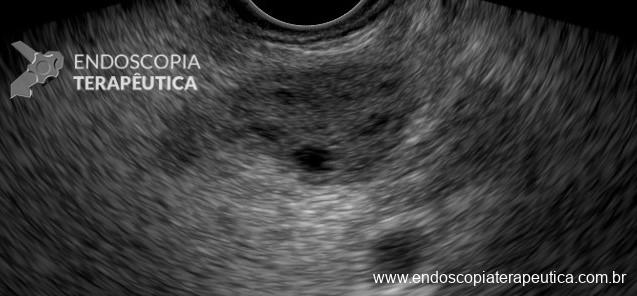
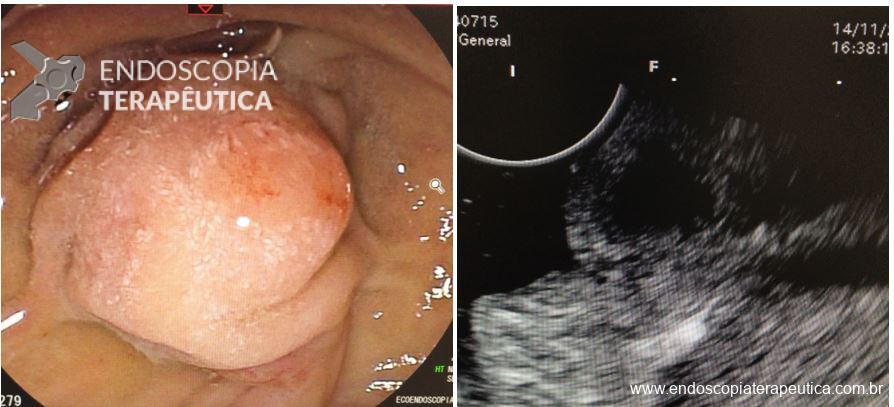
Umans e colaboradores em uma meta-análise recente chegaram a uma acurácia de 59% 7. A litíase biliar, presença de cálculos, microcálculos ou barro biliar na vesícula ou no colédoco, foi a causa mais comum, sendo responsável por 30% dos casos (Figuras 1 e 2). Em segundo lugar veio a pancreatite crônica com 12% e em terceiro o pancreas divisum com 5%. É importante salientar que em 2% dos pacientes foi detectada uma neoplasia que não havia sido diagnosticada nos exames prévios. As lesões identificadas foram neoplasias papilares intraductais mucinosas (IPMN), carcinomas de pâncreas, tumores neuroendócrinos (Figura 3), adenomas e carcinomas de papila. Outras causas menos comuns foram pancreatite autoimune, ascaridíase, coledococele (Figuras 4 e 5), anomalia da junção biliopancreática e divertículo.
Nesta mesma meta-análise, quando se comparou a acurácia da ecoendoscopia nos pacientes já submetidos a colecistectomia prévia com os não colecistectomizados, o resultado foi diferente entre os dois grupos, sendo de 50% e 64%, respectivamente 7. Demonstrando assim como a litíase na vesícula biliar é, de fato, uma das causas mais comuns.
Quando realizar a ecoendoscopia após o episódio de pancreatite?
Existe controvérsia na literatura de quando seria o momento ideal para realização da ecoendoscopia após um episódio de pancreatite aguda 5. Os autores que sugerem a realização do procedimento de forma mais precoce, às vezes com o paciente ainda internado, defendem que um possível diagnóstico poderia ser feito de forma mais rápida, evitando a possibilidade de uma recorrência e evitando também que o paciente perca o seguimento 5. Já os que preferem a realização do procedimento mais tardiamente, após cerca de 4 semanas da resolução do caso, defendem que as alterações inflamatórias secundárias à pancreatite poderiam dificultar o diagnóstico, diminuindo a acurácia da ecoendoscopia 5.
Na meta-análise de Umans e colaboradores, a acurácia da ecoendoscopia após a melhora da pancreatite aguda e antes da melhora foi de 61% e 48%, respectivamente 7.
Realizar a ecoendoscopia após o primeiro episódio de pancreatite aguda idiopática ou somente nos casos recorrentes?
Não existe consenso na literatura de qual seria a indicação ideal para realização da ecoendoscopia 5. Parece haver uma acurácia semelhante quando realizada após o primeiro episódio ou quando realizada após episódios recorrentes 5,7. Uma vez que muitas das causas identificadas são tratáveis e evitaria novas crises, existe uma tendência de já se indicar a ecoendoscopia após o primeiro episódio.
Ecoendoscopia X Colangiorressonância
Uma meta-análise de Wan e colaboradores, comparando a acurácia da ecoendoscopia com a colangiorressonância, demostrou uma melhor performance com a ecoendoscopia, 64% e 34%, respectivamente 8. O principal benefício ocorreu na litíase biliar (34% x 9%) e na pancreatite crônica (10% x 1%). No pancreas divisum a acurácia foi semelhante com as duas técnicas (2% x 2%). Quando se associou o uso de secretina, que não está disponível no Brasil, a colangiorressonância foi melhor (12%). Já Hallenslebem e colobaradores demostraram acurácia semelhante entre a ecoendoscopia (36%) e a colangiorressonância (33%) 8.
Conclusão
A ecoendoscopia tem papel fundamental na investigação de pacientes com pancreatite aguda idiopática. Ela apresenta uma alta acurácia para o diagnóstico de fatores causais, sendo vários deles tratáveis, evitando assim crises recorrentes.
Ainda não está bem estabelecido na literatura qual seria o momento ideal para a realização do procedimento, mas a maioria dos estudos tendem a aguardar cerca de 4 semanas após a melhora da pancreatite para sua realização, minimizando assim a dificuldade diagnóstica secundária a alterações inflamatórias. A maioria dos autores recomendam, também, a realização da ecoendoscopia já após a primeira crise. Importante salientar que o diagnóstico de neoplasias não detectadas por outros métodos pode chegar a 7% 6.
A colangiorressonância e a ecoendoscopia devem ser usadas em conjunto. Uma vez que a litíase biliar seria a causa mais comum e a ecoendoscopia teria uma melhor acurácia para este diagnóstico, existe uma tendência de indica-la como primeira opção após a investigação inicial negativa.
Referências
- Working Group IAPAPAAPG. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13: e1–e15.
- Crockett SD, Wani S, Gradner TB, et al. American Gastroenterological Association Institute Guideline on Initial Management of Acute Pancreatitis. Gastroenterology 2018; 154(4): 1096-1101.
- Blanco GDV, Gesuale C, Varanese M, et al. Idiopathic acute pancreatitis: a review on etiology and diagnostic work-up. Clin J Gastroenterol 2019; 12(6): 511-524.
- Tepox-Padrón A, Bernal-Mendez RA, Duarte-Medrano G, et al. Utility of endoscopic ultrasound in idiopathic acute recurrent pancreatitis. BMJ Open Gastroenterol 2021; 8(1): e000538.
- Somani P, Sunkara T, Sharma M. Role of endoscopic ultrasound in idiopathic pancreatitis. World J Gastroenterol 2017; 14: 6952-6961.
- Hallensleben ND, Umans DS, Bouwense SA, et al. The diagnostic work-up and outcomes of “presumed” idiopathic pancreatitis: A post-hoc analysis of a multicentre observational cohort. United European Gastroenterol J. 2020; 8(3): 340-350.
- Umans DS, Rangkuti CK, Weiland CJS, et al. Endoscopic ultrasonography can detect a cause in the majority of patients with idiopathic acute pancreatitis: a systematic review and meta-analysis. Endoscopy 2020; 52(11): 955-964.
- Wan J, Ouyang Y, Yu C, et al. Comparison of EUS with MRCP in idiopathic acute pancreatitis: a systematic review and meta-analysis. Gastrointest Endosc 2018; 87(5): 1180–8.
Como citar este artigo
Retes FA. Papel da ecoendoscopia na pancreatite aguda idiopática. Endoscopia Terapeutica 2023, Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/papel-da-ecoendoscopia-na-pancreatite-aguda-idiopatica