“BURIED BUMPER SYNDROME” : Diagnóstico e manejo.
INTRODUÇÃO
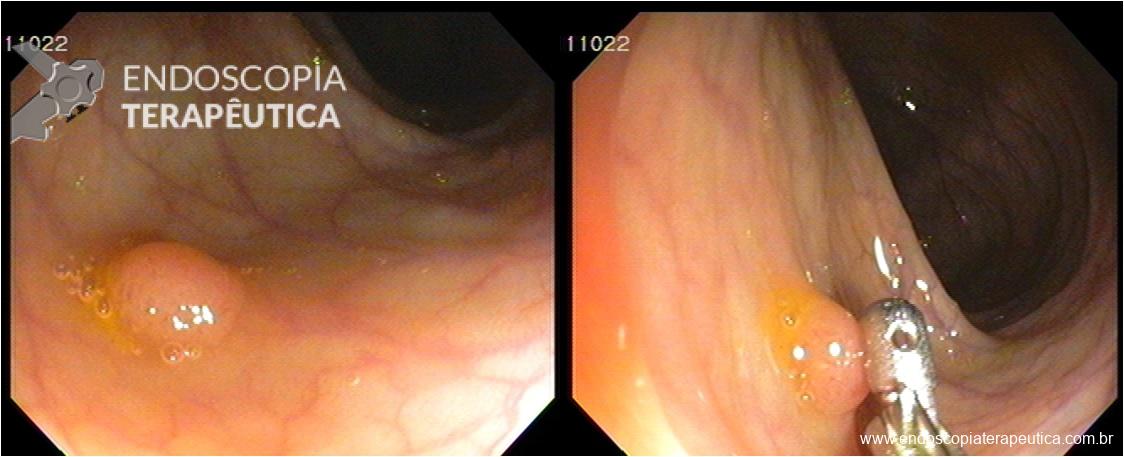
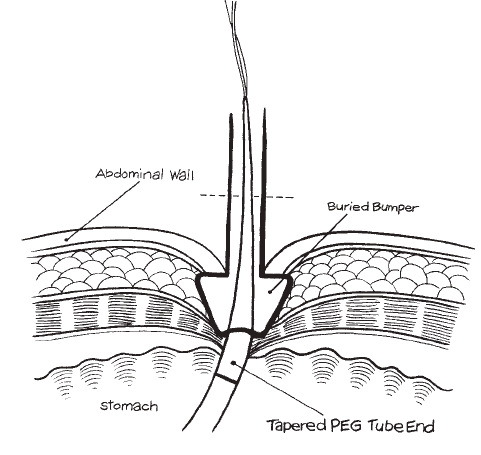
A buried bumper syndrome (BBS) é uma complicação decorrente da gastrostomia endoscópica percutânea, e consiste no crescimento de mucosa gástrica sobre o anteparo interno da gastrostomia com alojamento do mesmo em qualquer local no trajeto formado pela sonda, desde as camadas da parede gástrica até as da parede abdominal. Com incidência variando de 0,9 a > 8,8%, é tipicamente tardia (após 3 a 6 meses), mas também foram descritos casos precoces, após 15 a 30 dias da gastrostomia. (1,2)
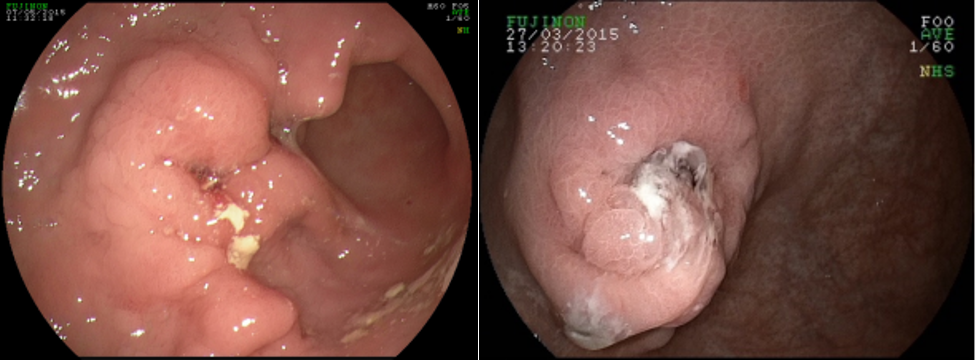
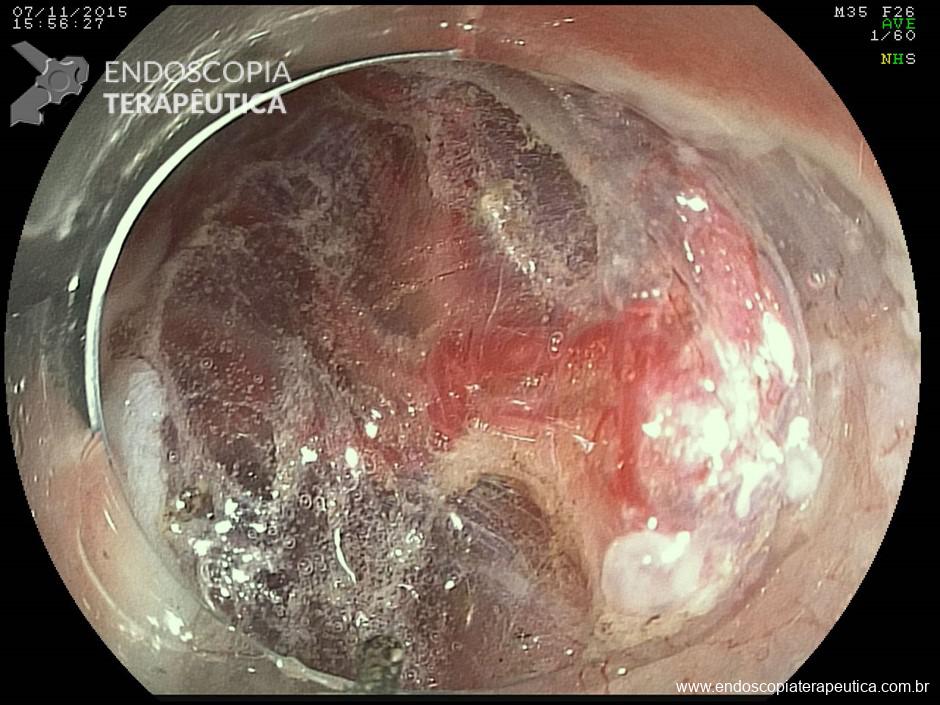
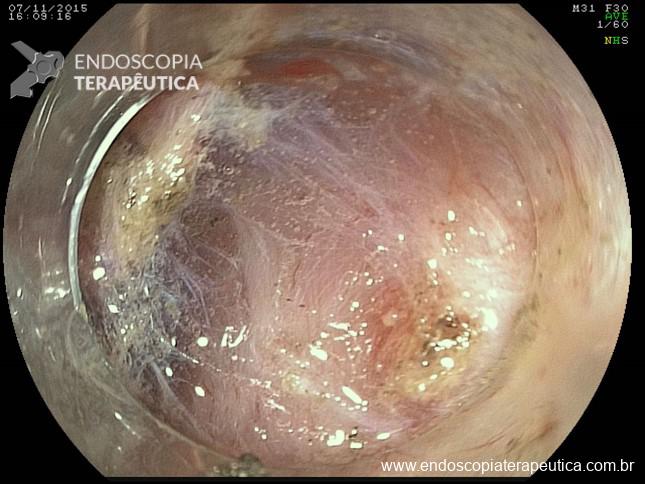
Clinicamente se caracteriza pela progressiva oclusão do orifício interno do anteparo pela mucosa gástrica, com consequente dificuldade/parada completa na infusão da dieta, dor abdominal durante a infusão, sinais flogísticos no orifício da pele e dificuldade na mobilização manual do anteparo na tentativa de empurrá-lo para a cavidade gástrica ou realizar movimento rotacional.
Tração excessiva é o principal fator causal, mas outros também devem ser considerados, como ganho de peso em resposta à alimentação enteral, tosse severa, etc. Na presença dos sinais e sintomas sugestivos, a endoscopia deve ser realizada para diagnóstico e planejamento terapêutico.
Na maioria dos casos o anteparo interno sepultado é retirado através de uma incisão externa no local da entrada da sonda na pele sob anestesia local ou laparotomia. Essa abordagem pode resultar em dor local, infecção de ferida ou fístula gastrocutânea.
Tendo em vista um tratamento menos invasivo nestes pacientes, foram propostas uma série de alternativas endoscópicas.
TÉCNICAS
As técnicas já descritas consistem em:
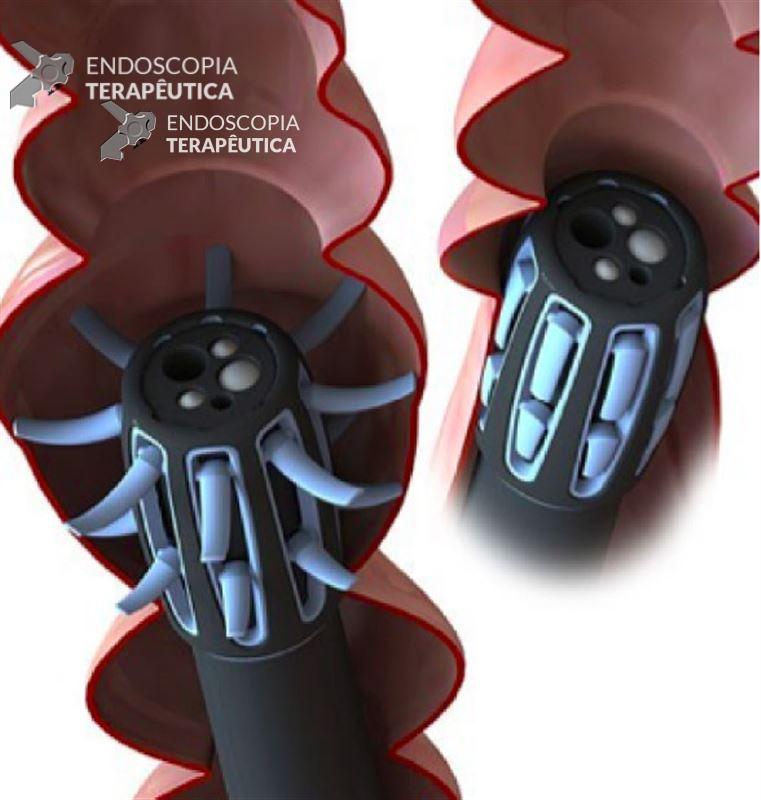
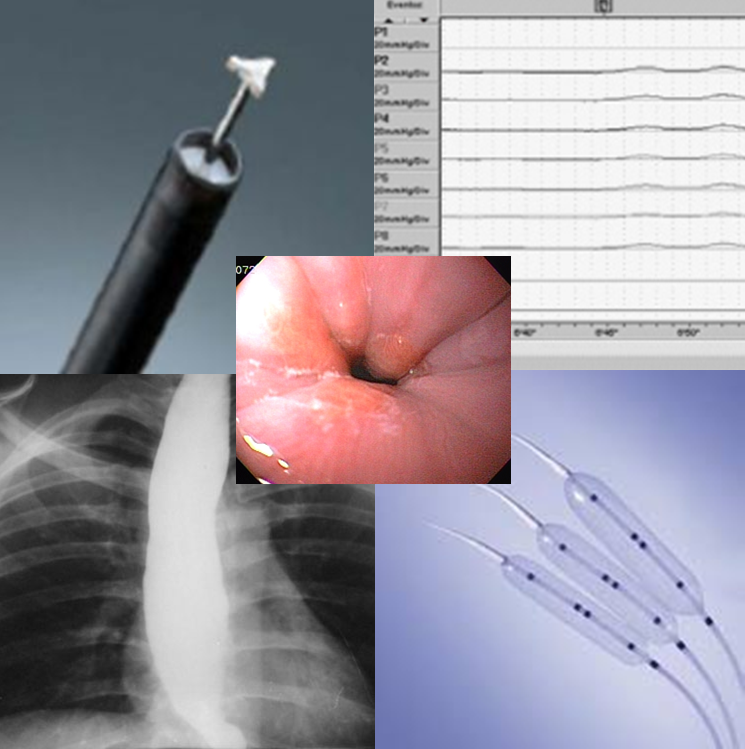
- Passagem de fio guia através da sonda até o orifício do anteparo interno servindo de guia para dilatadores de Savary-Gilliard introduzidos pelo tubo já previamente cortado próximo à pele para aplicar pressão externa no anteparo e empurrá-lo pra a câmara gástrica (3,4).
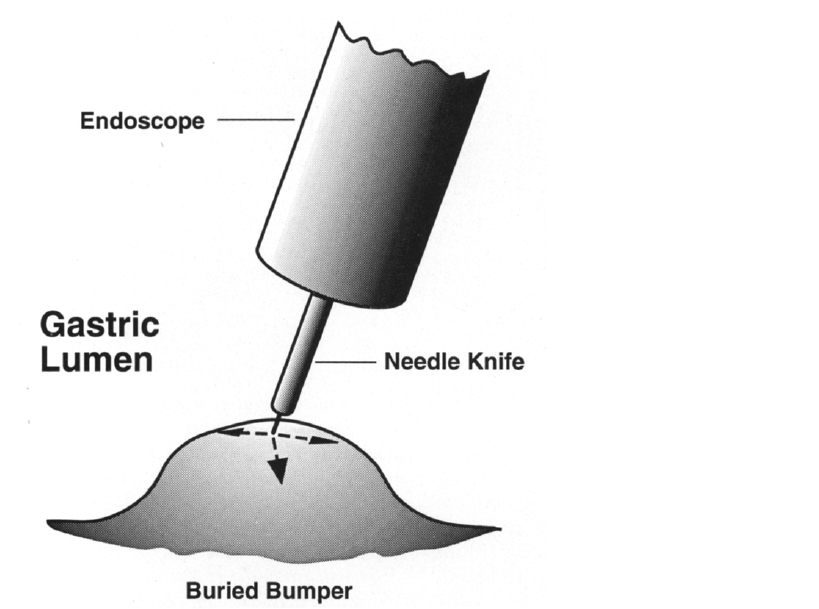
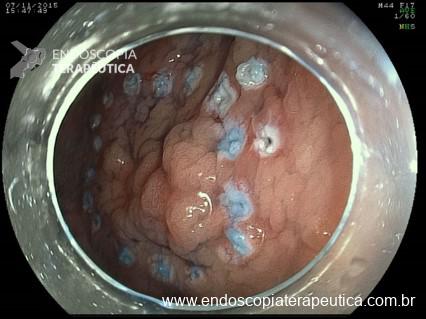
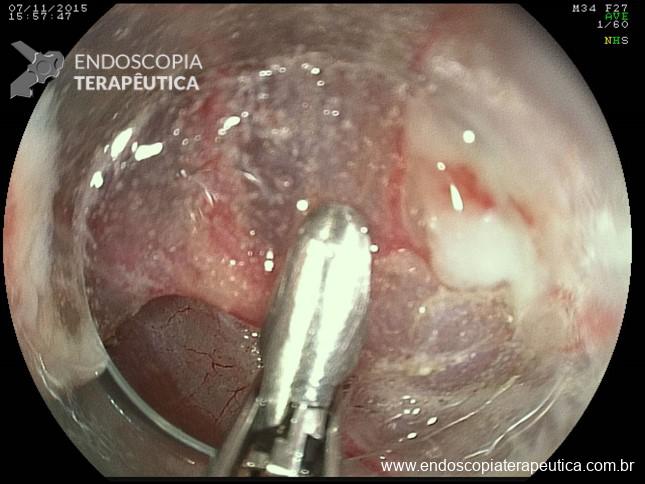
- Incisões radiais da mucosa gástrica com needle-knife para exposição do anteparo quando este está pouco visível (utilizando-se fio guia, azul de metileno, pinça de biópsia, etc para identificação do orifício interno como referência), e posterior apreensão do mesmo. Se necessário o orifício feito através das incisões pode ser ampliado com dilatação por balão (5,6,10).
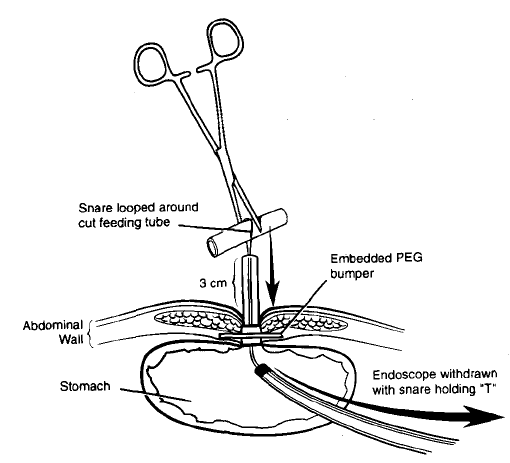
- “Push-pull T technique“ – uma alça de polipectomia é passada através do orifício interno do anteparo (com ou sem ajuda de um fio guia) e se exterioriza pelo tubo na parede abdominal previamente cortado. A alça captura um pedaço do tubo removido e é realizada uma tração do conjunto para dentro do estômago e ele é retirado pela boca (7)
- Uso de novo kit de gastrostomia para retirada do anteparo e troca no mesmo tempo. Realiza-se corte da sonda de gastrostomia a 3 cm da pele e introdução por ela da agulha disponível no kit para passagem do fio guia pelo orifício do anteparo interno para a cavidade gástrica. Captura do fio com alça, retirada do mesmo pela boca e introdução de nova sonda guiada para o estômago, cuja extremidade afilada se encaixa na sonda antiga e é realizada a tração do fio guia ao nível da pele (podendo ser realizada incisão na pele para saída do anteparo se necessário) (8,9).
- Uso de balão dilatador. Corte da sonda de gastrostomia 3 cm acima da pele e introdução de fio guia. Passagem de balão dilatador de 18 mm por sobre o guia, através do endoscópio, com insuflação do mesmo dentro do orifício do anteparo interno até sua retenção total dentro da sonda. Tração do conjunto endoscópio + balão permite a tração do anteparo para dentro do estômago, posterior retirada pela boca, com introdução de nova sonda de gastrostomia com o mesmo fio guia durante o mesmo procedimento (11,12).
- Uso de papilótomo. Introdução do papilótomo via sonda de gastrostomia cortada para realizar incisões radiais na mucosa recobrindo o anteparo para expô-lo (13,14).
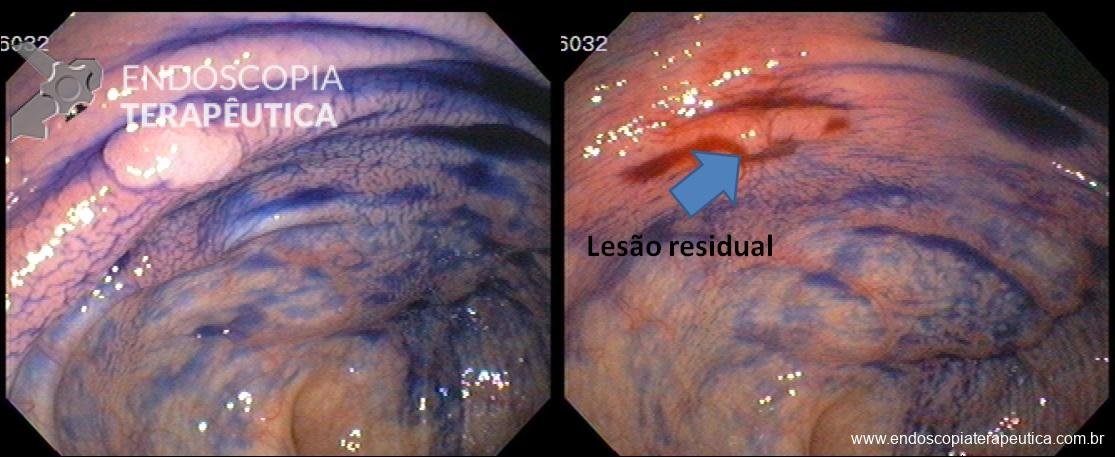
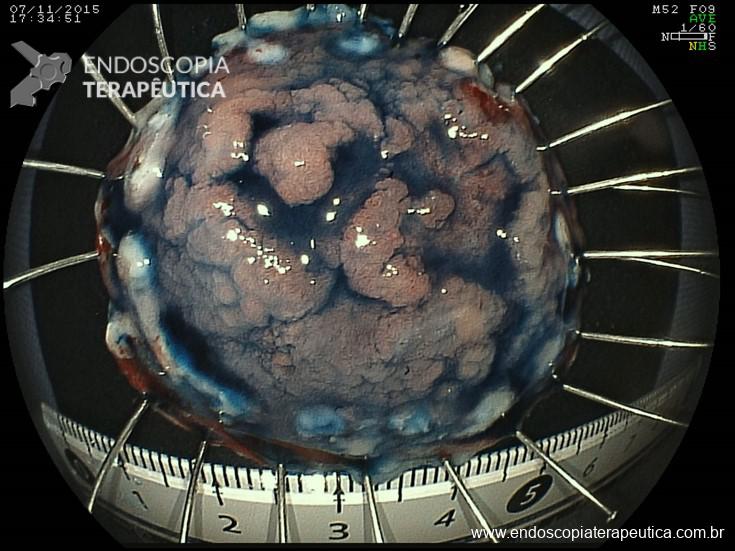
- ESD (endoscopic submucosal dissection). Dissecção submucosa até exposição do anteparo (16).
Foram propostas formas de avaliação do grau de migração do anteparo para planejamento terapêutico pelo possível risco de perfuração dependendo de sua localização. Branden et al. e Tanaka et al. (6,17) sugeriram avaliação por ultrassom endoscópico para determinação de posição intramural (profundamente na mucosa hipertrofiada ou dentro das camadas musculares) ou extramural (entre as paredes gástrica e abdominal), para decisão de tratamento endoscópico ou cirúrgico respectivamente.
Publicação recente (15) sugere uma classificação (Richter-Schrag) baseada nos achados endoscópicos para planejamento terapêutico:
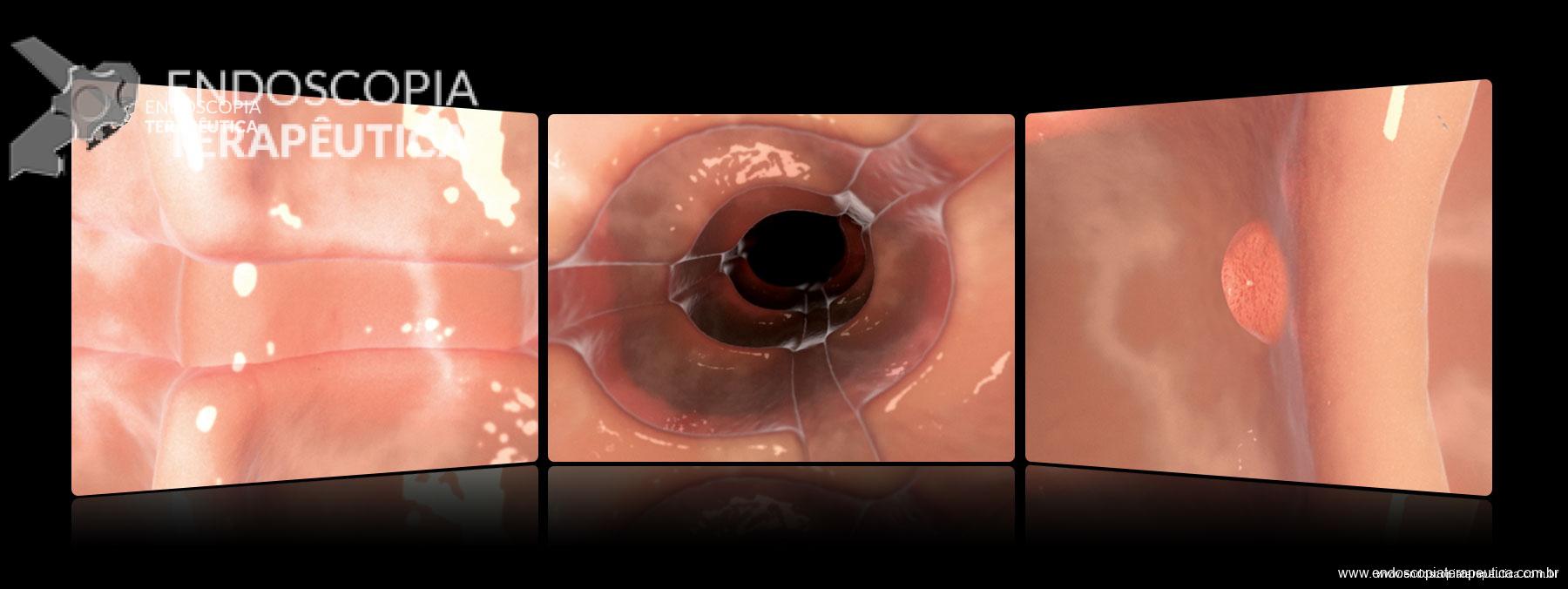
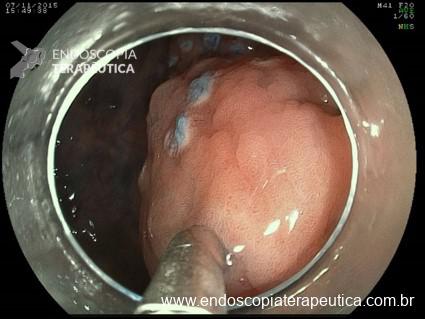
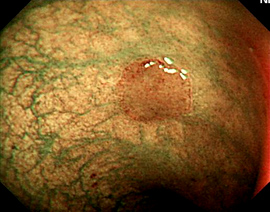
IA – Extracorporal parcial, localizada no subcutâneo / IB – Extracorporal total : Incisão para retirada, com cicatrização e conduta dependendo da presença ou não de fístula gastrocutânea.
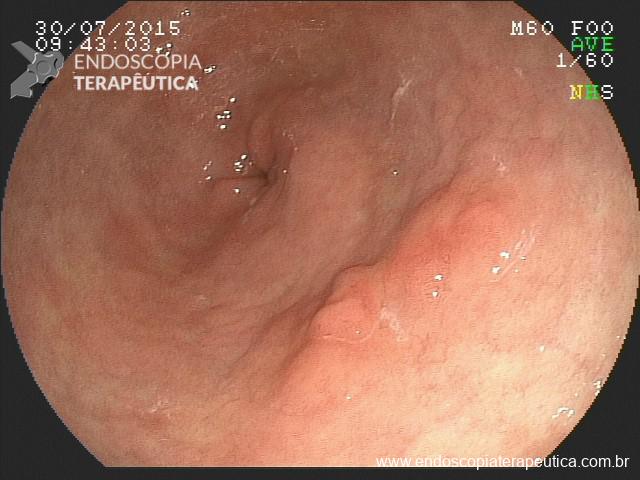
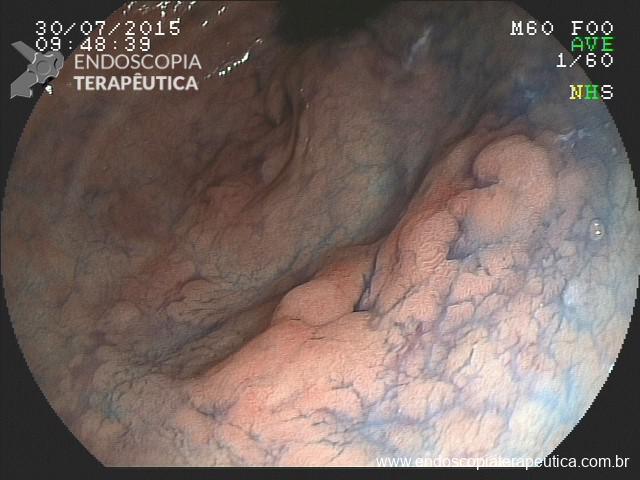
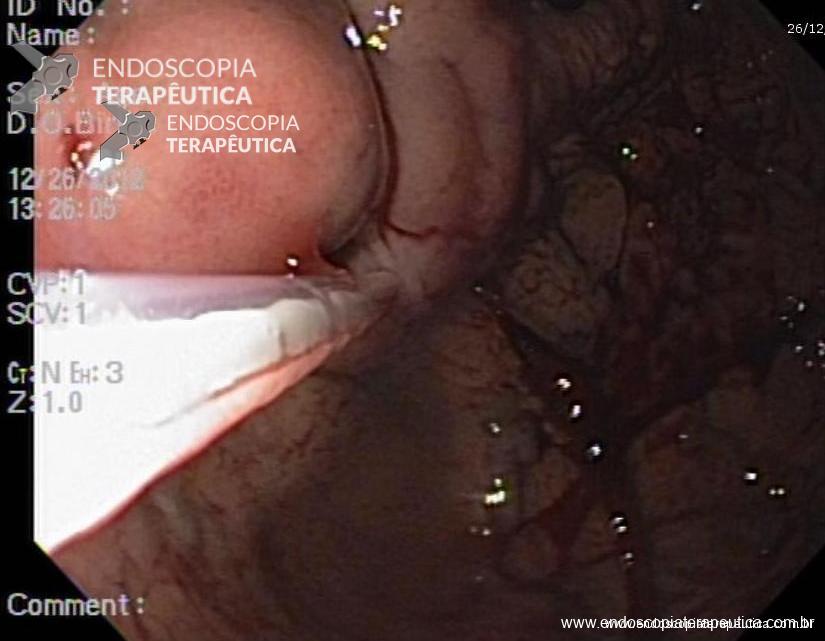
II – Localizada na submucosa gástrica, anteparo parcialmente visível pela EDA, bom grau de mobilização por pressão externa. Tratamento endoscópico – geralmente a retirada é possível com enrijecimento da sonda (guia ou balão) e pressão para lúmen gástrico.
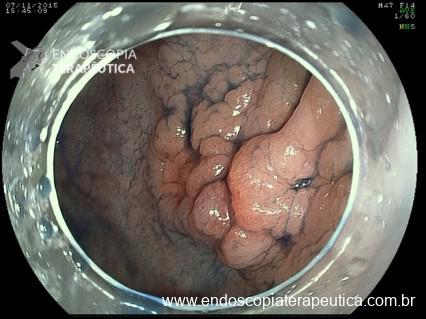
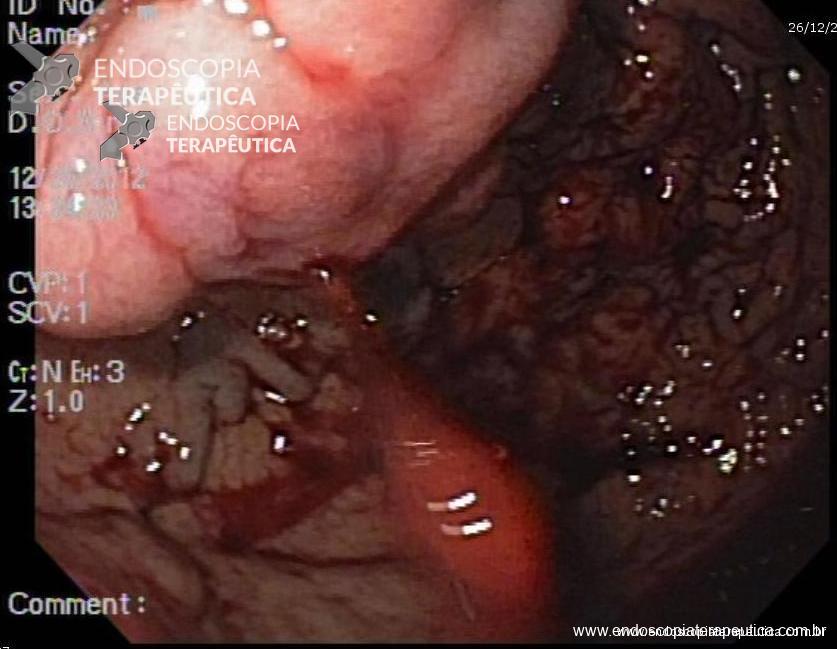
III – Localizado na submucosa gástrica podendo envolver parcialmente muscular, anteparo não visível, com ou sem fistula interna, boa mobilização. Tratamento endoscópico – dissecção da mucosa/submucosa para exposição do anteparo e realização de manobra descrita na classificação anterior.
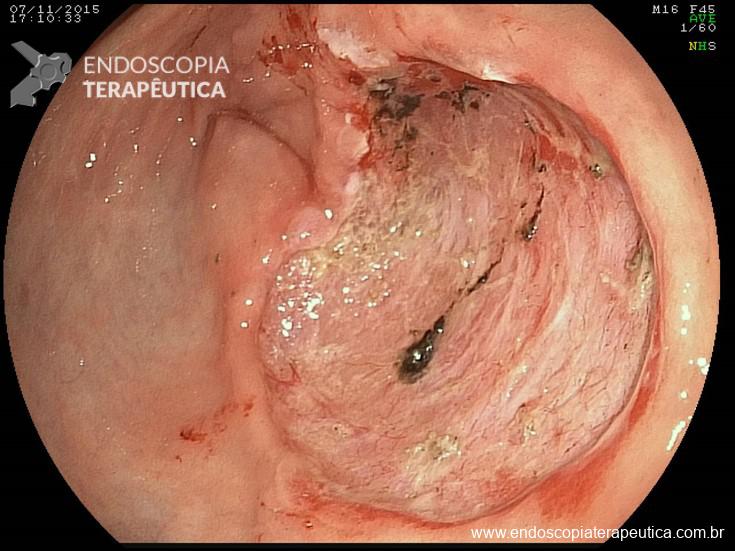
IV – Localização fora da parede gástrica, anteparo não visível, com ou sem fístula interna (que pode ser tangencial ao óstio do anteparo), mobilização ruim ou inexistente. Tratamento – devido à sua localização profunda e muitas vezes imprecisa, tem alto risco de complicações no tratamento endoscópico (perfuração, sangramento de difícil controle, etc). Geralmente optado por tratamento cirúrgico.
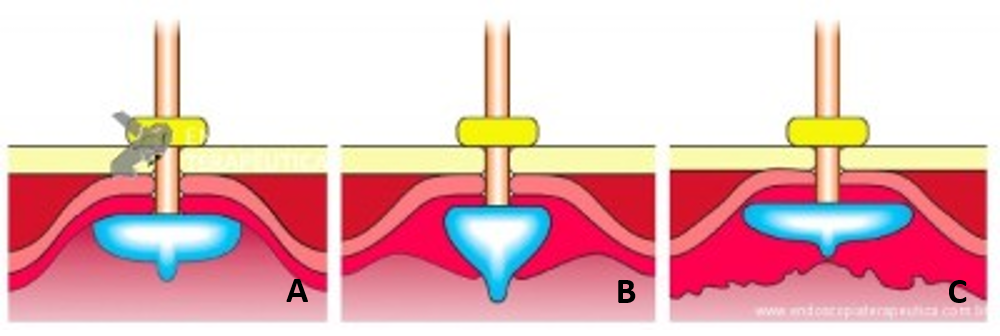
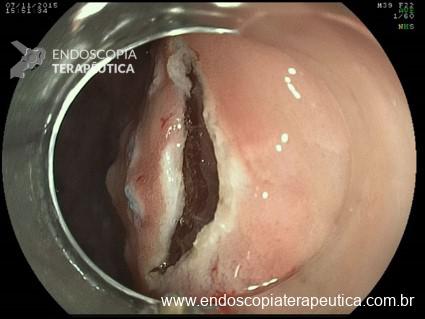
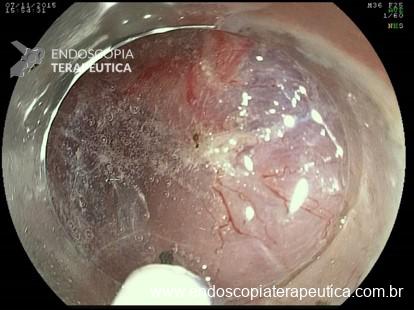
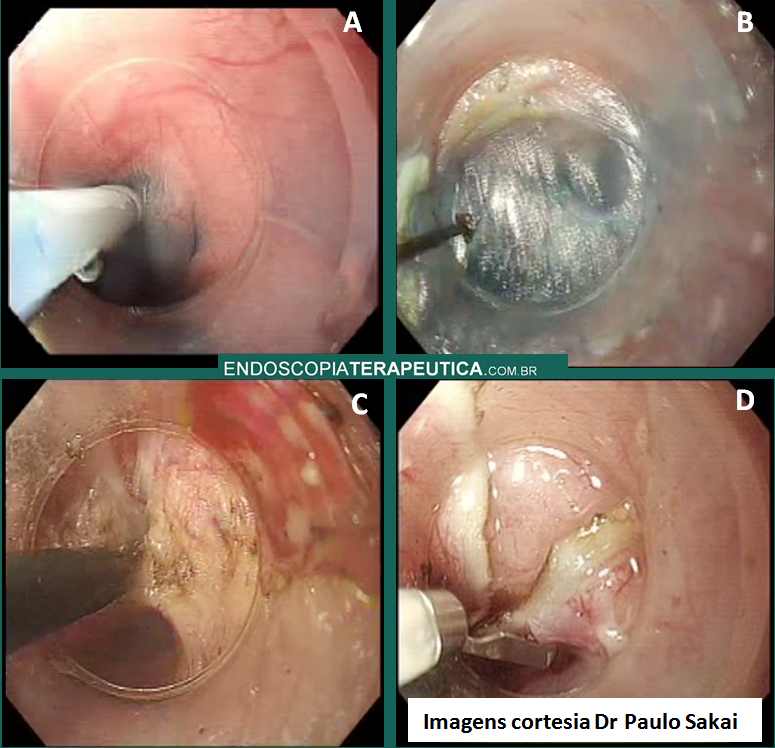
A: Sonda de GTT com posicionamento adequado. B: Sonda localizada na submucosa gástrica, anteparo parcialmente visível, classificação II de Richter-Schrag. C: Sonda localizada na submucosa gástrica, anteparo não visível, classificação III de Richter-Schrag.
PREVENÇÃO
Para prevenir tal complicação, são recomendadas as seguintes medidas (5,6):
- No momento da confecção da PEG, o anteparo externo deve ser fixado justo à pele (mas o suficiente para ainda ser possível realizar movimento de rotação com o anteparo interno na visão endoscópica) para boa aposição da parede gástrica na abdominal. Nos próximos dias o anteparo deve ser afastado aproximadamente 0,5 a 1 cm da pele para evitar isquemia e necrose por pressão.
- Os cuidadores devem ser orientados a, no momento da limpeza do local, se assegurar que a sonda se move para dentro e para fora por no mínimo 1 cm e que realiza movimentos rotacionais com um mínimo de resistência.
- Quando a sonda não está em uso ela deve ser coberta para prevenir tração inadvertida por parte do paciente.
- Qualquer restrição de movimento da sonda, dificuldade de passagem da dieta, vazamento ou dor local devem ser prontamente avaliados.
REFERÊNCIAS
- Lee TH, Lin JT. Clinical manifestations and management of buried bumper syndrome in patients with percutaneous endoscopic gastrostomy. Gastrointest Endosc. 2008;68:580–584
- Ma MM, Semlacher EA, Fedorak RN et al. The buried gastrostomy bumper syndrome: prevention and endoscopic approaches to removal. Gastrointest Endosc 1995;41:505–508
- Klein S, Heare BR, Soloway RD. The “buried bumper syndrome”: a complication of percutaneous endoscopic gastrostomy. Am J Gastroenterol 1990;85:448–450
- Gumaste VV, Krachman M, Pottipati A, Dave P. Removal of an embedded PEG bumper. Gastrointest Endosc 1993;93:598-9.
- Ma MM, Semlacher EA, Fedorak RN et al. The buried gastrostomy bumper syndrome: prevention and endoscopic approaches to removal. Gastrointest Endosc 1995;41:505–508
- Braden B, Brandstaetter M, Caspary WF et al. Buried bumper syndrome: treatment guided by catheter probe US. Gastrointest Endosc 2003;57:747–751
- Boyd JW, DeLegge MH, Shamburek RD et al. The buried bumper syndrome: a new technique for safe, endoscopic PEG removal. Gastrointest Endosc 1995;41:508–511
- Venu RP, Brown RD, Pastika BJ, Erikson LW (2002) The buried bumper syndrome: a simple management approach in two patients. Gastrointest Endosc 56:582–584
- Fay DE, Luther R, Gruber M. A single procedure endoscopictechnique for replacing partially extruded percutaneousendoscopic gastrostomy tubes. Gastrointest Endosc 1990;36:298-300.
- Sauer B, Staritz M. Buried bumper: a new method of non-surgical removal. Z Gastroenterol 2004;42:227–232
- Strock P, Weber J (2005) Buried bumper syndrome: endoscopic management using a balloon dilator. Endoscopy 2005;37:279
- Christiaens P, Bossuyt P, Cuyle P-J et al (2014) Buried bumper syndrome: single-step endoscopic management and replacement. Gastrointest Endosc 2014;80:336
- Müller-Gerbes D, Aymaz S, Dormann AJ. Management of the buried bumper syndrome: a new minimally invasive technique – the push method. Z Gastroenterol 2009;47:1145–1148
- Cyrany R, Repak T, Douda T et al. Cannulotome introduced via a percutaneous endoscopic gastrostomy (PEG) tube. Endoscopy 2012;44:E422–E423
- Richter-Schrag H J, Fischer A. Buried bumper syndrome: a new classification and therapy algorithm. Chirurg 2015;86(10):963-9
- Curcio G, Granata A, Ligresti D, Tarantino I, Barresi L, Traina M. Buried bumper syndrome treated with HybridKnife endoscopic submucosal dissection. Gastrointest Endosc 2014; 80: 916-7
- Tanaka Y, Akahoshi K, Motomura Y et al. Pretherapeutic evaluation of buried bumper syndrome by endoscopic ultrasonography. Endoscopy 2012;44:E162
Postado por
Thienes Maria da Costa Lima
Médica do Serviço de Endoscopia Digestiva do Hospital Nossa Senhora das Graças – Curitiba/PR
Especialização em Endoscopia Digestiva pelo Hospital das Clínicas da Universidade de São Paulo (USP)