Desde o inicio de sua utilização na década de 80, ainda numa forma bastante rudimentar, o balão intragástrico proporciona bons resultados. Entretanto, no início da experiência, as complicações eram frequentes e preocupantes.
Com os constantes estudos realizados e o aperfeiçoamento do material do balão, o número e gravidade das complicações caíram significativamente ao longo dos anos. Entretanto, a difusão mundial e crescente utilização do método, trouxeram novas formas de complicações e aumentaram as antigas ocorrências.
Dessa forma é muito importante que os médicos endoscopistas e das demais áreas que acompanham estes pacientes, conheçam e saibam manejar suas complicações.
Faremos um breve tour pelas complicações mais comuns do BIG
Náuseas e vômitos: as complicações menores e também as mais comuns são as de ocorrência precoce, ou seja, nos primeiros 3 a 5 dias pós implante do acessório. Náuseas e vômitos, acompanhados ou não de dor abdominal e de graus variados ocorrem em cerca de 70% dos casos segundo meta-análise publicada em 2015 (Zheng, Wang et al. 2015). Importante ressaltar que os dados apresentados são semelhantes a experiência de nosso grupo com cerca de 1500 balões implantados.
Entre os pacientes que apresentam os sintomas descritos, cerca de 7 – 15% necessitarão de medicação e hidratação endovenosa. Apesar de muito comum, esses sintomas merecem atenção especial já que além de serem a maior causa de retirada precoce do acessório, pode acarretar complicações graves como desidratação, distúrbios hidroeletrolíticos e insuficiência renal aguda, potencialmente fatais. Alguns estudos mostram taxa de retirada precoce por esse tipo de sintomas de até 20% (De Castro, Morales et al. 2010).
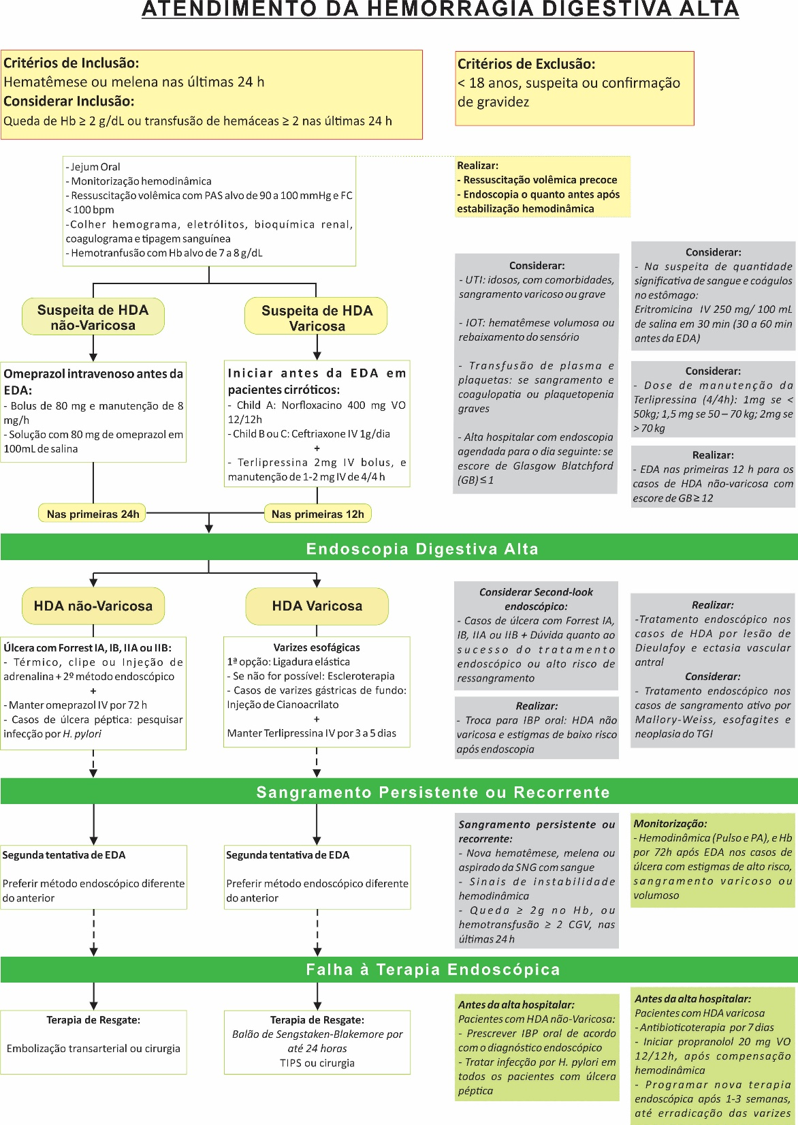
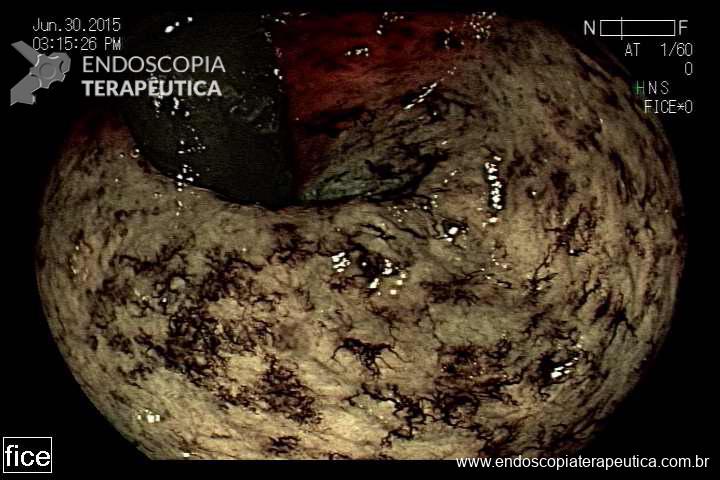
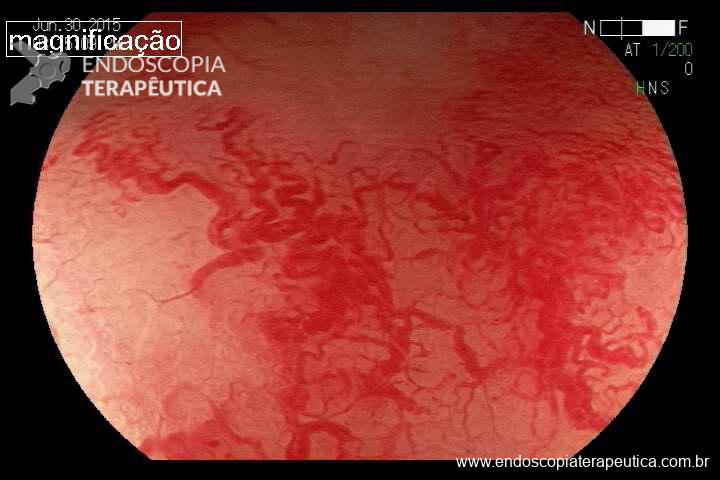
Sangramento: Relatos de pequenos sangramentos durante os primeiros dias são corriqueiros entre médicos com algum volume de procedimentos, mas quando persistentes, os vômitos podem causar lesões como síndrome de Mallory-Weiss com sangramento maciço e necessidade de terapêutica endoscópica. Outra causa rara, mas que não podemos deixar de pensar em casos de HDA em pacientes com BIG é a lesão de Dieulafoy. Nos últimos 3 anos foram relatados 4 casos dessa patologia em pacientes em uso do balão intragástrico no estado de São Paulo.
Soluços: ainda com pouca descrição na literatura, mas de grande incomodo para o paciente, são os soluços. Raros pacientes apresentam crises de soluços que podem durar minutos até dias e nesses casos o manejo é bastante complicado, sendo usados medicações variadas inclusive benzodiazepínicos para debelar o sintoma.
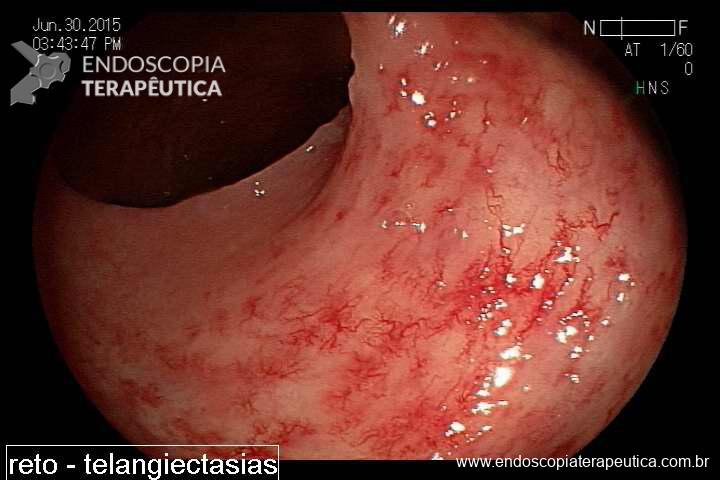
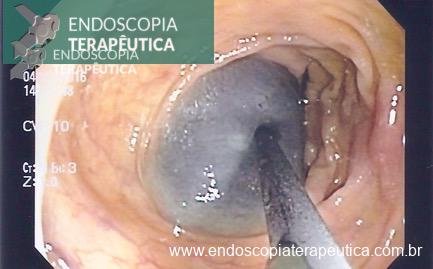
Impactação no antro: mais comum nos primeiros meses após implante. Quando impactado, o balão ocasiona o represamento do conteúdo provocando distensão abdominal, dor , náuseas, vómitos até com pequenas quantidades de líquido, pirose retroesternal, podendo cursar até com broncoaspiração. Essa complicação é importante pois frequentemente causa a retirada precoce do acessório.
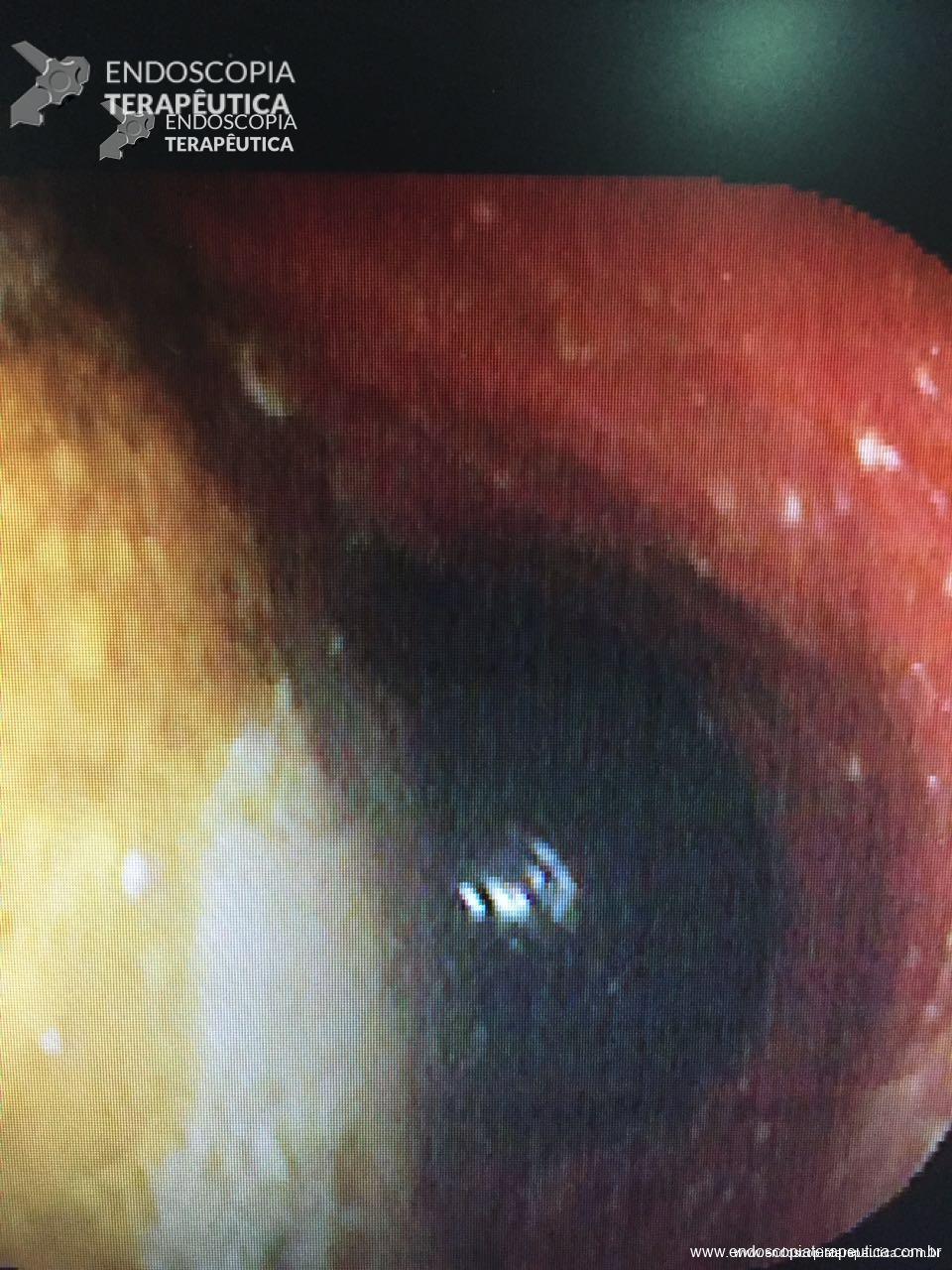
Balão impactado no antro com muito resíduos
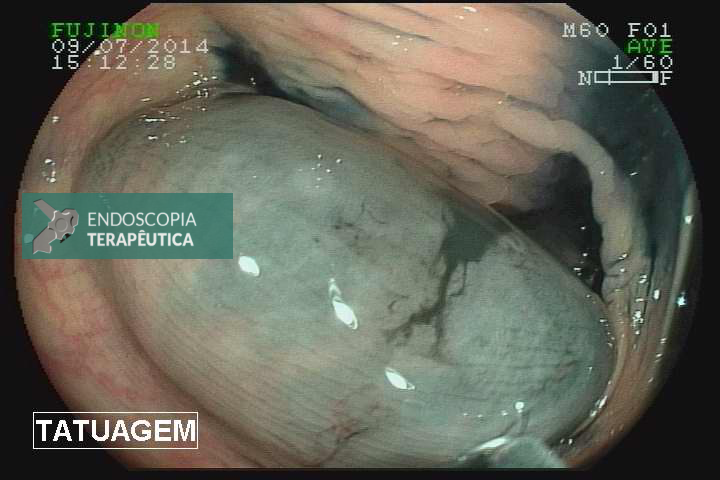
Hiperinsuflação espontânea:, complicação rara, que simula a impactação antral. A causa ainda não está bem determinada, mas a principal hipótese é a colonização fúngica e/ou bacteriana. Os sintomas são muito semelhantes aos descritos quando da impactação antral, entretanto a troca do acessório se faz necessária quando diagnosticado, e em muitos casos o mesmo paciente pode apresentar nova hiperinsuflação do balão.
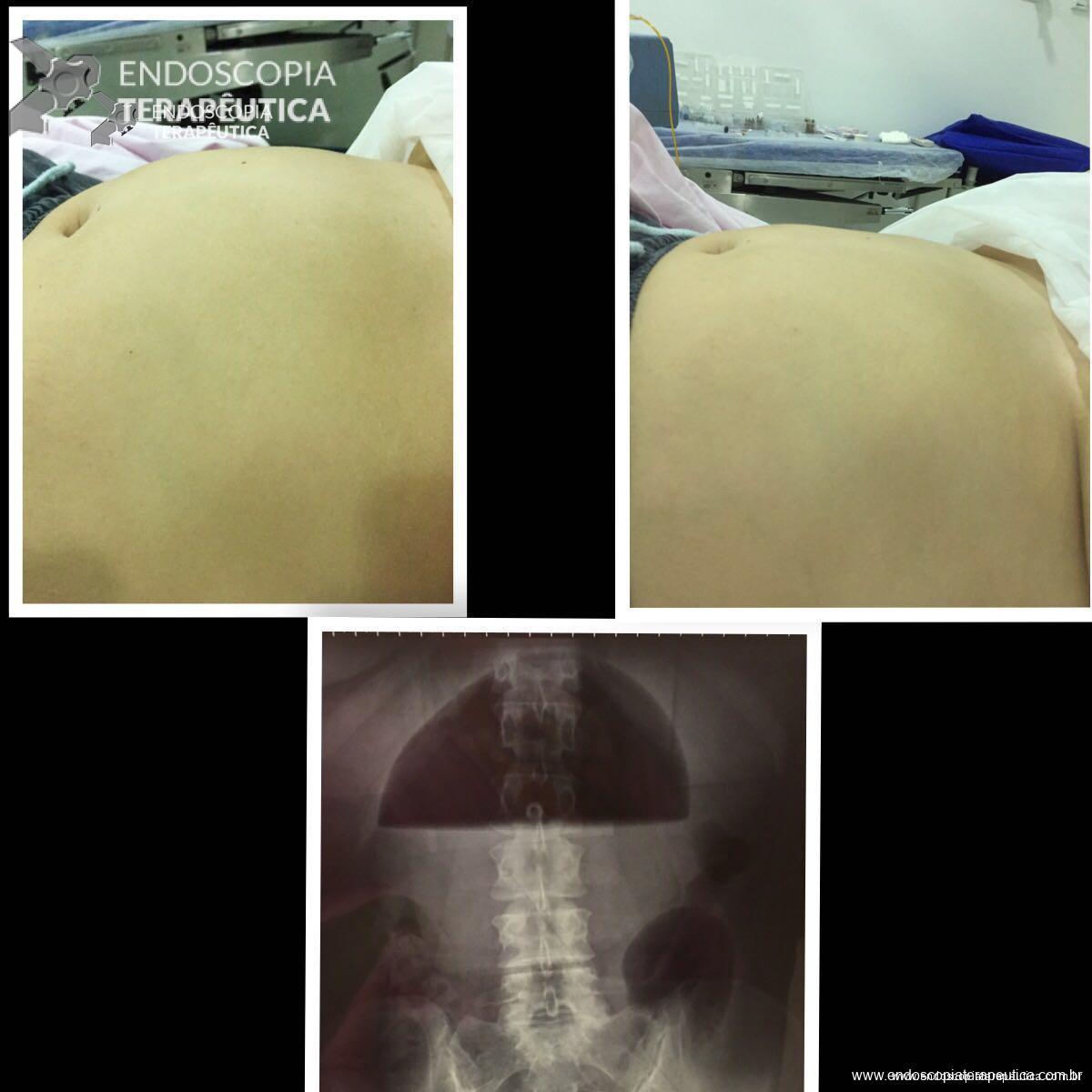
Hiperinsuflação espontânea
Colonização fúngica: ainda não se sabe exatamente as razões que levam a formação de uma camada muitas vezes grosseira de fungos sobre o balão, a hipótese atualmente mais considerada é que o ambiente básico devido ao uso de IBPs possa ser a causa da presença dessa ocorrência. Observamos na prática diária, em concordância com a literatura a grande prevalência de candida albicans nos casos de fungos em BIG. (Kotzampassi, K., et al. 2013).
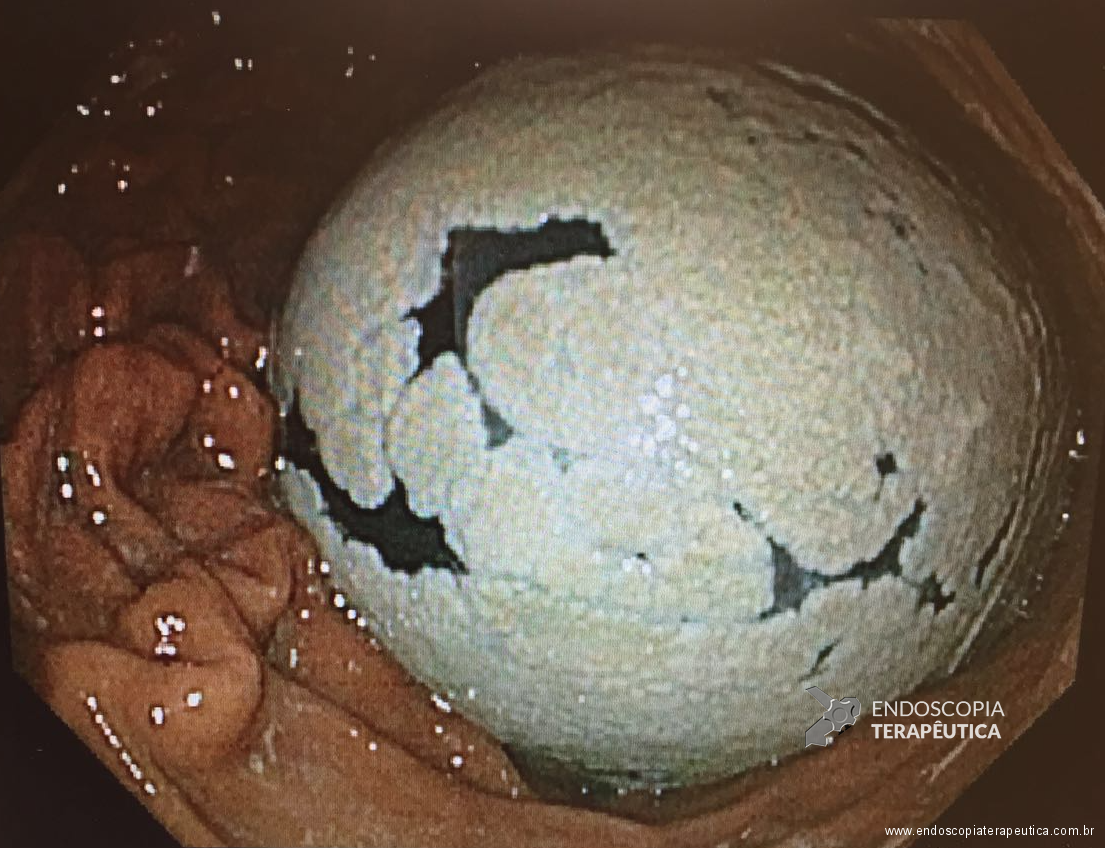
Colonização por fungos
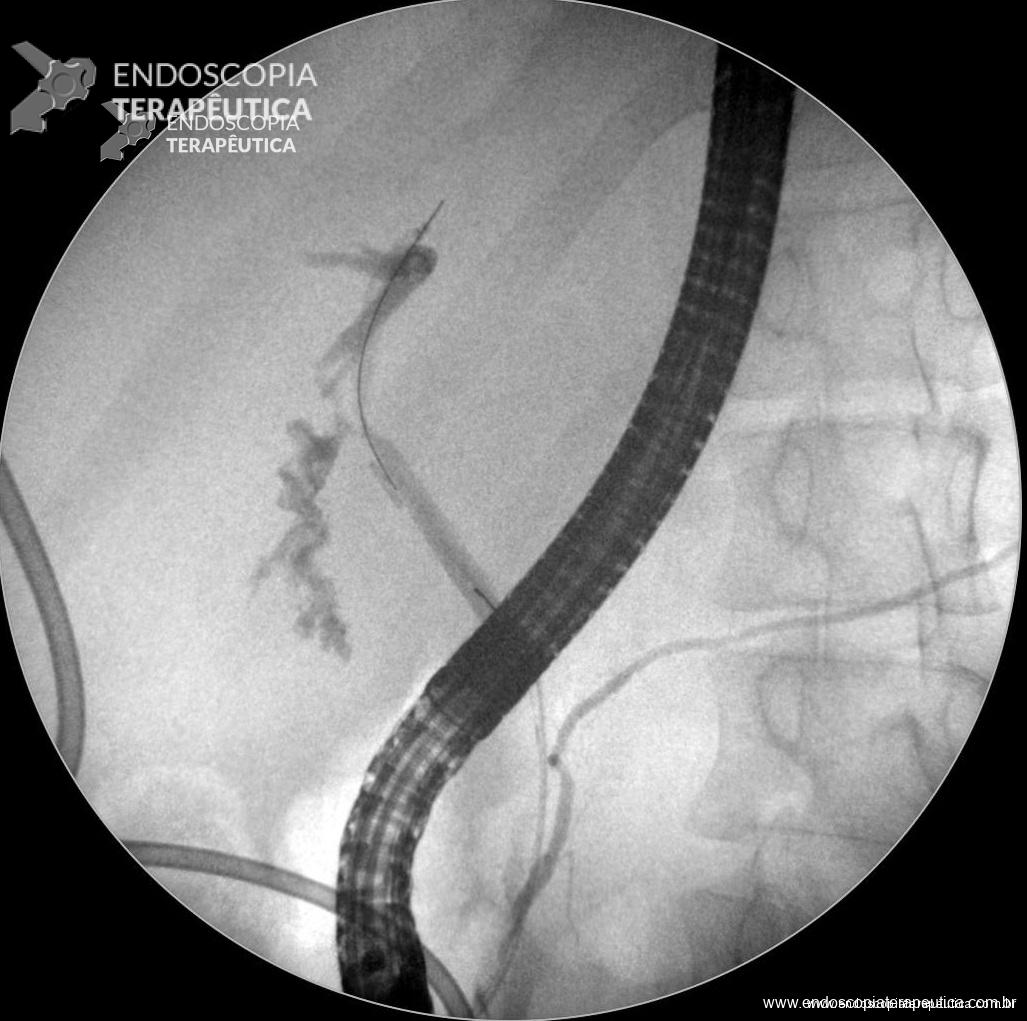
Vazamento do balão: nos EUA o balão intragástrico habitualmente não é preenchido com o marcador azul de metileno para identificação de eventual vazamento, já em nosso país a utilização desse marcador é amplamente difundida. Dessa forma a ocorrência da complicacão é amplamente documentada em terras brasileiras, e a incidência gira em torno de 0,35 a 1,5%, valores correspondentes com a literatura internacional.(Genco, Bruni et al. 2005). Quando do vazamento o medico responsavel deve estar atento pois casos de migração para o intestino causando obstrução aguda são relatados na literatura (Di Saverio, Bianchini Massoni et al. 2014, Daghfous, Baraket et al. 2015).
Pancreatite aguda: Nas condições de represamento de conteúdo e distensão da câmara gástrica como as referidas anteriormente, mas não só nelas, existem chances de uma intercorrência relativamente comum, a pancreatite leve. Trata-se de um quadro de dor abdominal seguida de elevação das enzimas pancreáticas e sinais tomográficos de pancreatite leve , principalmente caudal. Em alguns casos causando a retirada do BIG. Existem raros relatos de pancreatite aguda grave na literatura (Vongsuvanh, Pleass et al. 2012).
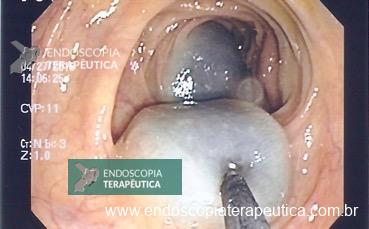
Úlceras: são eventos de ocorrência pouco frequente, entretanto podem ocasionar cenários catastróficos com HDA, exigindo retirada do BIG e terapêutica endoscópica imediata.
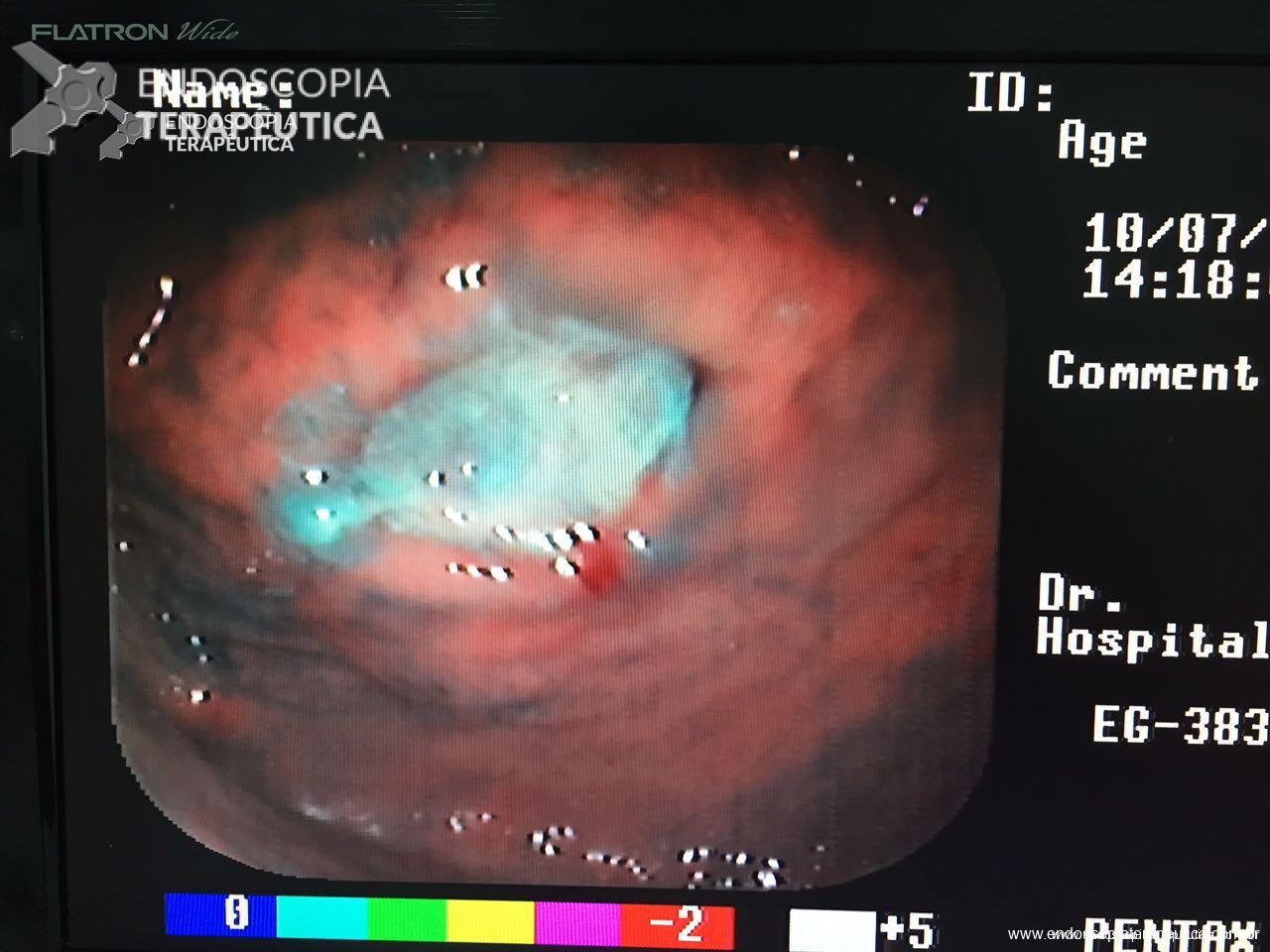
Úlcera pós-BIG
Perfurações gástricas: a causa ainda é desconhecida, sendo a principal hipótese a isquemia da parede do órgão por compressão do acessório, ou por abrasão, formando úlcera e evoluindo para perfuração. A incidência relatada de perfurações gástricas em pacientes usando balão intragástrico na literatura é de 0,2% (Genco, Bruni et al. 2005).
Complicações relacionadas ao procedimento: as complicações oriundas do implante e da retirada do acessório incluem eventos durante a sedação e/ou anestesia, além de lesões agudas do TGI. A necessidade de realizar o procedimento em ambiente controlado, com suporte avançado de vida, todo o arsenal de acessórios, como pinça, tesoura endoscópica, alça grande, cateter de perfuração, overtube, etc… é mandatório para fazer de um procedimento simples também um procedimento seguro.
Conclusão: A eficiência comprovada da abordagem (Moura, Oliveira et al. 2016) e a aparente simplicidade do método, despertou o interesse dos endoscopistas. O manejo do balão intragástrico enquanto não há complicações é bastante prático e tranquilo, entretanto a variedade de eventos e a gravidade dos mesmos, fazem com que os profissionais que trabalham com esse acessório, devam estar treinados e preparados para enfrentar as possíveis complicações .
Clique aqui e confira nossa galeria de imagens de complicações de balão intragástrico
Referências:
Daghfous, A., et al. (2015). “[Intestinal obstruction caused by migration of intragastric balloon. A case report].” Tunis Med 93(4): 272-274.
De Castro, M. L., et al. (2010). “Efficacy, safety, and tolerance of two types of intragastric balloons placed in obese subjects: a double-blind comparative study.” Obes Surg 20(12): 1642-1646.
Di Saverio, S., et al. (2014). “Complete small-bowel obstruction from a migrated intra-gastric balloon: emergency laparoscopy for retrieval via enterotomy and intra-corporeal repair.” Obes Surg 24(10): 1830-1832.
Genco, A., et al. (2005). “BioEnterics Intragastric Balloon: The Italian Experience with 2,515 Patients.” Obes Surg 15(8): 1161-1164.
Kotzampassi, K., et al. (2013) “Candida albicans colonization on an intragastric balloon.” Asian J Endosc Surg 6(3): 214-216.
Milone, M., et al. (2014). “An early onset of acute renal failure in a young woman with obesity and infertility who underwent gastric balloon positioning. A case report.” G Chir 35(3-4): 73-74.
Moura, D., et al. (2016). “Effectiveness of intragastric balloon for obesity: A systematic review and meta-analysis based on randomized control trials.” Surg Obes Relat Dis 12(2): 420-429.
Vongsuvanh, R., et al. (2012). “Acute necrotizing pancreatitis, gastric ischemia, and portal venous gas complicating intragastric balloon placement.” Endoscopy 44 Suppl 2 UCTN: E383-384.
Zheng, Y., et al. (2015). “Short-term effects of intragastric balloon in association with conservative therapy on weight loss: a meta-analysis.” J Transl Med 13: 246.
Autor
Dr. Sergio Barrichello