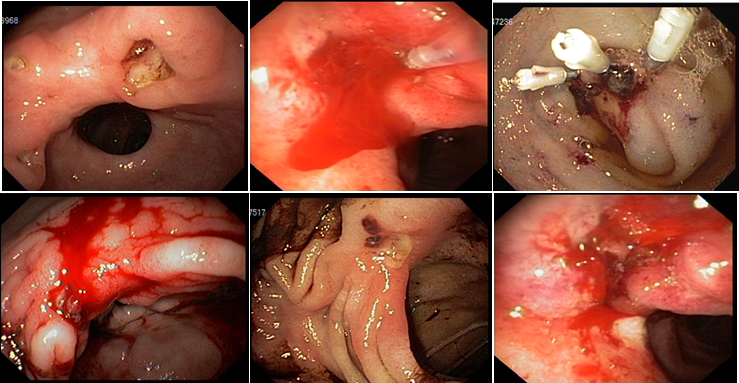
Novo Modelo de Treinamento em ESD Supervisionado por Vídeos
Apesar das vantagens adquiridas com a realização da dissecção endoscópica submucosa (ESD) no tratamento dos cânceres precoces do trato digestivo, até o presente essa técnica tem sido pouco adotada nos países ocidentais. Muito se deve à longa e desafiadora curva de aprendizado da ESD.
A ESD foi desenvolvida há mais de uma década e se tornou o padrão para ressecção de lesões precoces no Japão e em outros países asiáticos (Coréia e China). No Japão, a ESD é ensinada de forma “prática”, através da tradicional passagem de conhecimentos entre mentor-aprendiz. Similar àquela que é aplicada ao treinamento de colangiopancreatografia retrógrada endoscópica (CPRE) no Ocidente. Os endoscopistas japoneses inicialmente ganham competência nos casos de ESD gástrica, onde é mais seguro e mais fácil de executar, antes de tentar lesões tecnicamente mais desafiadoras no esôfago e cólon. Entretanto a abordagem “mentor-aprendiz” atualmente não é viável no Ocidente, pois há apenas poucos endoscopistas com expertise para realizar e ensinar ESD. Além disso, o câncer gástrico precoce é mais raro no Ocidente. Assim endoscopistas ocidentais têm de começar a realizar a ESD nos locais tecnicamente mais difíceis com o esôfago e cólon.
Desenvolvimento de um novo modelo de treinamento para realização de ESD
Diante dos desafios que têm sido observados para introdução e ensino da técnica de ESD no Ocidente, um grupo de endoscopistas da Cleveland Clinic, Ohio, US, desenvolveram uma metodologia para treinamento em ESD em que a tradicional forma de aprendizado “mestre-aprendiz” pudesse ser realizada mesmo à distância. O método consistia, basicamente, da realização de casos simulados em modelo animal (porco) supervisionados por experts japoneses por meio de vídeos.
Esse novo modelo de treinamento foi avaliado prospectivamente e seu resultados publicados recentemente. Abaixo descrição e resultados desse estudo.
Avaliação do treinamento em ESD com supervisão através de vídeos
Dois endoscopistas receberam o treinamento proposto:
- (1) Um endoscopista experiente com mais de 10.000 procedimentos avançados.
- (2) Um residente do terceiro ano do programa de gastroenterologia.
Antes da realização da técnica de ESD em modelo porcino, ambos os endoscopistas receberam treinamento teórico/prático com os acessórios utilizados para ressecção endoscópica, aulas com descrição sobre a técnica de ESD, e assistiram vídeos de procedimentos de ESD realizados por experts.
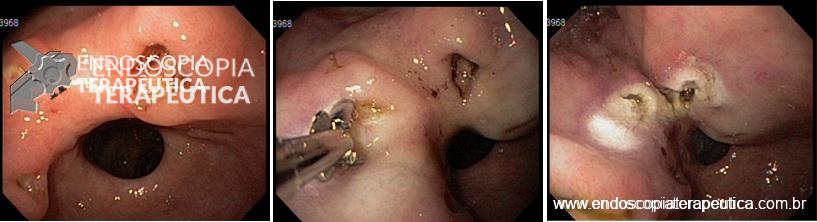
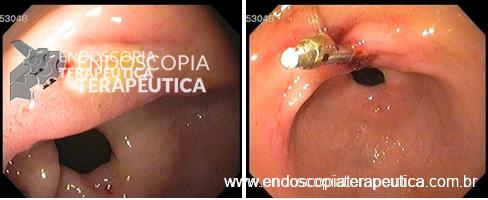
O passo seguinte foi a realização de ESD em modelo porcino. Todas as sessões de treinamento de ESD em modelo porcino foram supervisionadas por um endoscopista ocidental (Amit Bhatt) com a seguinte experiência em ESD: cerca de 200 casos em modelo animal e 20 casos em pacientes. Todos os procedimentos de ESD em cada sessão de treinamento foram gravados em vídeo e enviados para análise por um expert do National Cancer Center de Tóquio, que já realizou mais de 700 ESDs (Seiichiro Abe). O expert oriental em ESD, que não dispunha de informações com relação ao endoscopista que realizava o procedimento, forneceu uma análise crítica para melhoria da técnica de cada endoscopista antes da próxima sessão de treinamento em ESD.
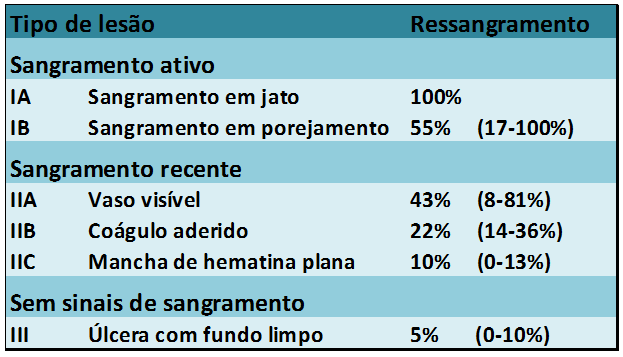
Os procedimentos foram graduados de 0 a 100 em uma escala visual, com pontuações referentes a incisão da mucosa, dissecção da submucosa e qualidade geral do procedimento. A competência técnica foi definida quando se obteve ao menos 3 casos consecutivos de ressecção em bloco de uma área pré-definida de 3 cm em 30 minutos, sem perfuração, e com pontuação geral de pelo menos 70.
Resultados
Ambos endoscopistas alcançaram competência na realização de ESD. O endoscopista 1 com 23 procedimentos e endoscopista 2 com 25.
A análise dos resultados foi realizada por períodos, sendo o primeiro período de 1 a 10 procedimentos; o segundo de 11 a 20; e o terceiro de 21 a 30. Houve progressivo e significativo desenvolvimento da técnica com redução no tempo de realização, redução do número de perfurações, aumento da taxa de ressecção em bloco, e aumento nos escores de desempenho para ambos os endoscopistas.
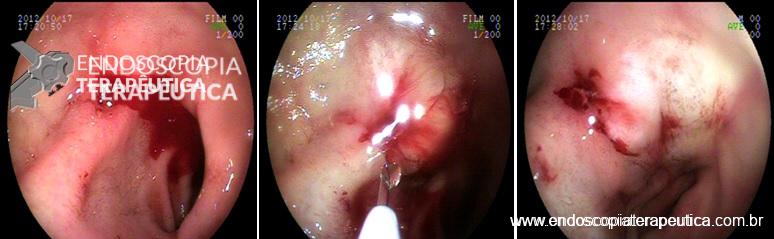
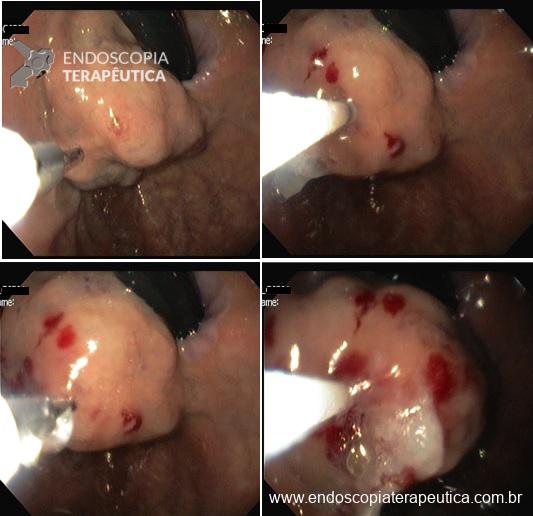
Vídeos demonstrando a evolução após o treinamento proposto
Tempo do procedimento: 60 min (incompleto).
Escore: 65
Análise crítica: A bainha foi avançada em excesso. Entrar na submucosa com a ponta do endocap (40min).
Tempo do procedimento: 24 min.
Escore: 90
Após o treinamento descrito, o endoscopista 1 iniciou a realização ESD em seus pacientes, obtendo resultados satisfatórios (8 casos com ressecção em bloco, sem perfurações, com mediana de tempo de 184 min, e mediana do tamanho da lesão de 3 cm).
Considerações reportadas pelos autores no estudo
Existem diferenças significativas entre o modelo suíno e a ESD em pacientes e, portanto, a transição deve ser feita com cuidado. O domínio da técnica em modelo porcino pode não resultar no domínio da técnica em humanos. O maior desafio que os autores encontraram na trânsito de modelo porcino para casos em humanos foi a dissecção através de fibrose. Infelizmente, a fibrose não é encontrada em estômagos de porcinos saudáveis, mas é freqüentemente observada em seres humanos como resultado de procedimentos anteriores, como biópsia ou terapia térmica. Devido a essas diferenças significativas entre ESD porcino e em humano, os autores ainda recomendam que os casos iniciais de ESD em pacientes sejam realizados sob a supervisão de um expert em ESD.
Ao final, os autores concluem que o desenvolvimento de programas de supervisão baseados em vídeo em associação ao treinamento em modelo porcino pode ser uma ferramenta importante para a aprendizagem e transmissão da técnica de ESD no Ocidente.
Artigo com link:
Confira a seguir, a tradução de uma pequena entrevista com os autores deste estudo.
Clique aqui para ver a entrevista em inglês.
Amit Bhatt, MD.
Department of Gastroenterology and Hepatology, Cleveland Clinic, Ohio, USA.
Seiichiro Abe, MD.
Attending endoscopist, Endoscopy Division, National Cancer Center Hospital, Tokyo, Japan.
1. A análise dos resultados mostrou um desempenho semelhante entre o endoscopista experiente e o colega residente. Você acredita que, a despeito do desafio técnico que a ESD representa, esse técnica poderá ser difundida e realizada por crescente parte dos endoscopistas?
Amit Bhatt: Enquanto nosso estudo não detectou uma diferença de desempenho em um modelo suíno entre um endoscopista experiente e um estagiário, acreditamos que a experiência provavelmente terá um impacto maior na ESD em humanos, onde as lesões nem sempre estão em posição ótima e o endoscopista tem que lidar com movimentos respiratórios, peristaltismo e sangramento.
A ESD é tecnicamente desafiadora e deve ser realizada por endoscopistas qualificados. Esperamos que, à medida que a primeira geração de endoscopistas ocidentais que realizam ESD se estabelecerem, eles ensinarão e compartilharão a técnica com outros levando à expansão da ESD fora da Ásia. Estamos agora começando a treinar nosso estagiário de endoscopia avançada em ESD.
Seiichiro Abe: Os resultados do nosso estudo indicaram que as manobras endoscópicas da ESD eram totalmente diferentes das de outras endoscopias avançadas, mas que poderiam ser adquiridas por uma supervisão com um expert mesmo que através de vídeos. Na verdade, alguns endoscopistas ocidentais que tiveram a supervisão de especialistas japoneses introduziram com êxito a ESD humana em seus países. Assim, sistemas de treinamento padronizados em ESD devem ser estabelecidos com colaboração entre países ocidentais e o Japão.
2. A gravação de vídeos com posterior análise de um expert poderia substituir ou minimizar a presença de um supervisor na sala de treinamento?
Nós ainda acreditamos que a melhor maneira de aprender ESD é uma abordagem do mentor com o aprendiz como realizada no Japão, mas percebe-se que esta opção não está disponível para a maioria. Para aqueles sem a opção de supervisão de um mentor, a supervisão através de vídeos pode ser uma ótima opção para aprender a técnica.
3. Como você tem enxergado a expansão da ESD nos EUA? Quais as principais indicações?
Nós iniciamos nosso programa de ESD na Cleveland Clinic em 2013 e, desde então, vimos um rápido crescimento em nossos casos de ESD. Realizamos ESD principalmente em adenocarcinoma esofágico, câncer da junção esofagogástrica e tumores LST no cólon. Embora o câncer gástrico seja menos comum no Ocidente, há populações específicas de pacientes em risco (descendentes asiáticos, pacientes com polipose hereditária) que desenvolvem câncer gástrico e em que nós realizamos a ESD. Uma indicação crescente para a ESD tem sido os tumores submucosos indiferenciados que não envolvem a muscular própria. Muitos pacientes preferem a ressecção ao invés da vigilância contínua com EUS. Também temos tido um bom sucesso com ESD para tumores carcinóides, com ressecção com margens negativas melhor do que a ressecção endoscópica da mucosa.
4. Nos EUA os aparelhos com magnificação não são aprovados para uso pela FDA, qual o impacto disto para os médicos que estão aprendendo ou realizando ESD nos EUA?
Amit Bhatt: No Japão, a avaliação endoscópica magnificada é utilizada para diferenciar tumores colorretais não-neoplásicos de tumores neoplásicos e para estimar a profundidade de invasão com um alto grau de precisão. Isto permite a triagem adequada dos pacientes para ESD colorretal ou para a cirurgia. Infelizmente, os aparelhos com magnificação com zoom óptico (de 80x a 100x) não são comumente disponíveis fora da Ásia, levando muitos endoscopistas ocidentais a perder esta importante avaliação pré-procedimento. Mas há uma crença crescente de que o sistema Near Focus da Olympus (50x) é capaz de fornecer análises de padrão de cripta e de vascularização com magnificação semelhante, mas isso ainda não foi validado.
Seiichiro Abe: Como a endoscopia magnificada permite uma estratégia de tratamento adequada com base na predição precisa da histologia e da profundidade da invasão, ela pode evitar indicação cirúrgica excessiva e ESD desnecessária. No entanto, a endoscopia com magnificação tem pouco impacto no desempenho técnico e curva de aprendizagem da ESD.
5. Existe alguma evidência sobre manutenção da habilidade adquirida após treinamento com um número mínimo de procedimentos de ESD que devam ser realizados em determinado período?
Acreditamos que, assim como a CPRE, a ESD precisa ser executada regularmente para manter e melhorar os níveis de habilidade. Como a ESD está apenas começando seu desenvolvimento e estabelecimento fora da Ásia, é difícil dizer qual “número de procedimentos por ano” é necessário para manter a proficiência. Quando começamos a realizar ESD pelo menos mensalmente, permitiu-nos continuar a desenvolver a nossa habilidade na técnica, e isso poderia ser usado como um guia grosseiro
6. Parabéns pela excelente publicação! Agradecemos muito a oportunidade de ter sua participação em nosso blog. Gostaria de acrescentar mais algum comentário?
Obrigado pela oportunidade de participar do blog. Esperamos que nosso estudo seja benéfico para aqueles que estão aprendendo a ESD.