Manitol e explosão do cólon: teoria versus prática.
O preparo de cólon deve idealmente ser efetivo, barato, seguro, de fácil administração e bem tolerado pelo paciente. O manitol atende a todos esses quesitos, e talvez por isso, seja a droga mais comumente utilizada no preparo de cólon para colonoscopia no nosso e em outros países.
O efeito laxativo do manitol se baseia na sua não absorção e na promoção de diarreia osmótica, com excelente qualidade de preparo, necessidade de ingesta de volumes relativamente pequenos, quando comparado a outras alternativas, como o polietilenoglicol (PEG).
Curiosamente, este monossacarídeo é ignorado há décadas nos Estados Unidos e Europa para esse propósito. A razão do criticismo é a associação do manitol a episódios de explosão do cólon em relatos remotos.
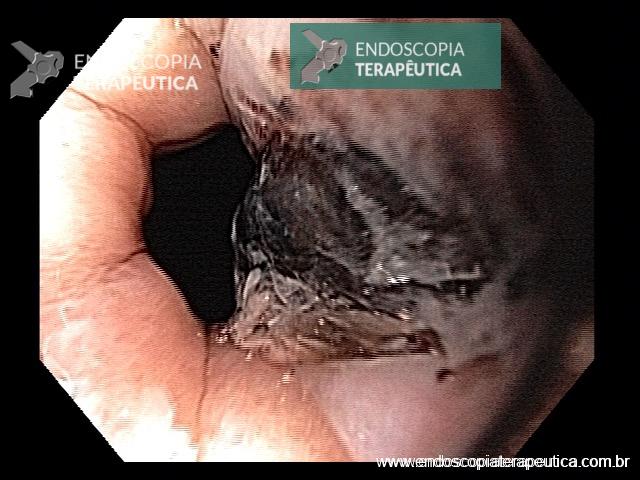
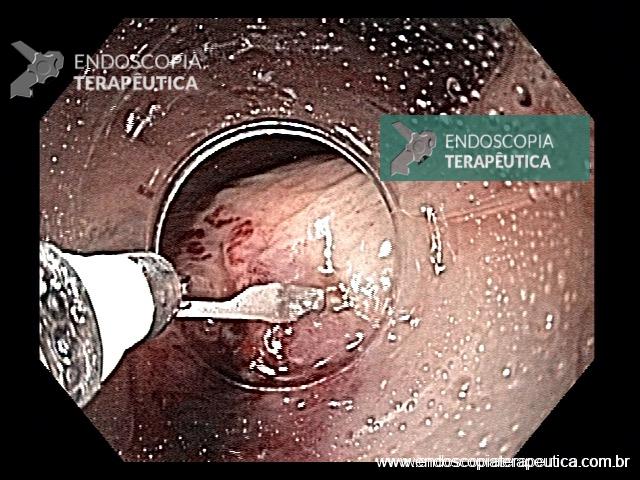
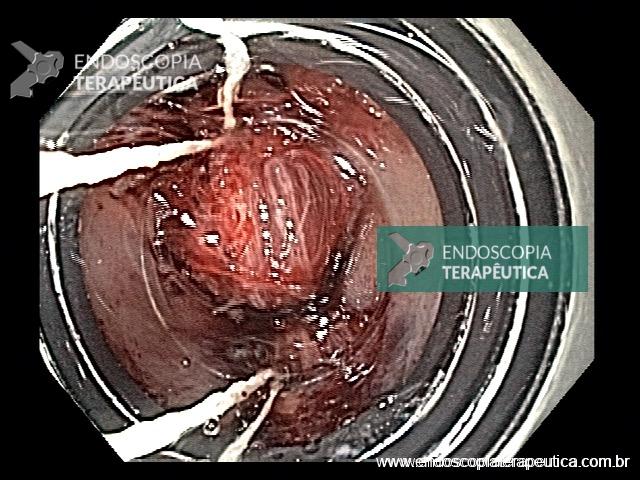
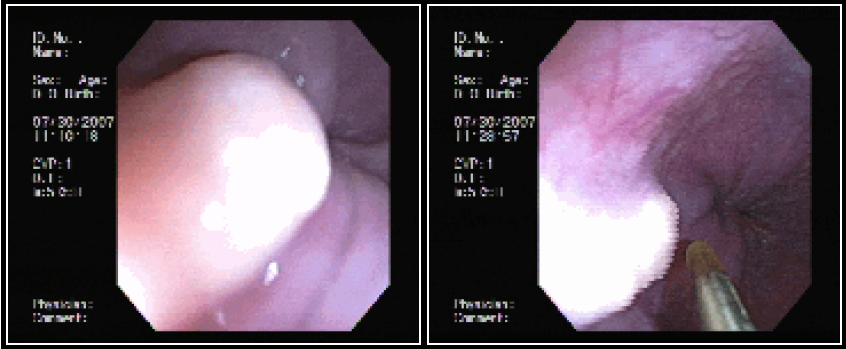
Na luz do cólon, cinco principais gases são encontrados: nitrogênio (N2, 23–80%), oxigênio (O2, 0,1–2,3%), hidrogênio (H2, 0,06-47%), metano (CH4, 0-26%) e dióxido de carbono (CO2, 5,1-29%). Para que ocorra explosão do cólon é necessária a combinação de três elementos: presença de gases combustíveis como CH4 ou H2, com concentrações maiores que 5 e 4%, respectivamente; presença de um gás comburente (O2), com pelo menos 5%; e uma fonte de calor (eletrocautério ou plasma de argônio).
Uma vez não absorvido, o manitol intra-luminal serviria de substrato para colônias de bactérias produtoras de H2 e CH4 (especialmente E. coli), com potencial explosivo durante o uso de eletrocautério, na presença de O2 (ar ambiente como meio de insuflação), especialmente em preparos de baixa qualidade, com certa quantidade de resíduos fecais. Alguns autores acreditam que a insuflação com CO2 possa reduzir o risco de explosão por ser um gás inerte e por suprimir o percentual de O2 na luz de cólon.
Ora, a utilização de CO2 como meio de insuflação ainda é rara em nosso país. Por outro lado, o manitol segue sendo amplamente usado no preparo para o exame do cólon e suas intervenções terapêuticas. E onde estão os relatos de explosão do cólon em nosso meio? Ainda que existam, são pontuais e desproporcionais à utilização da droga.
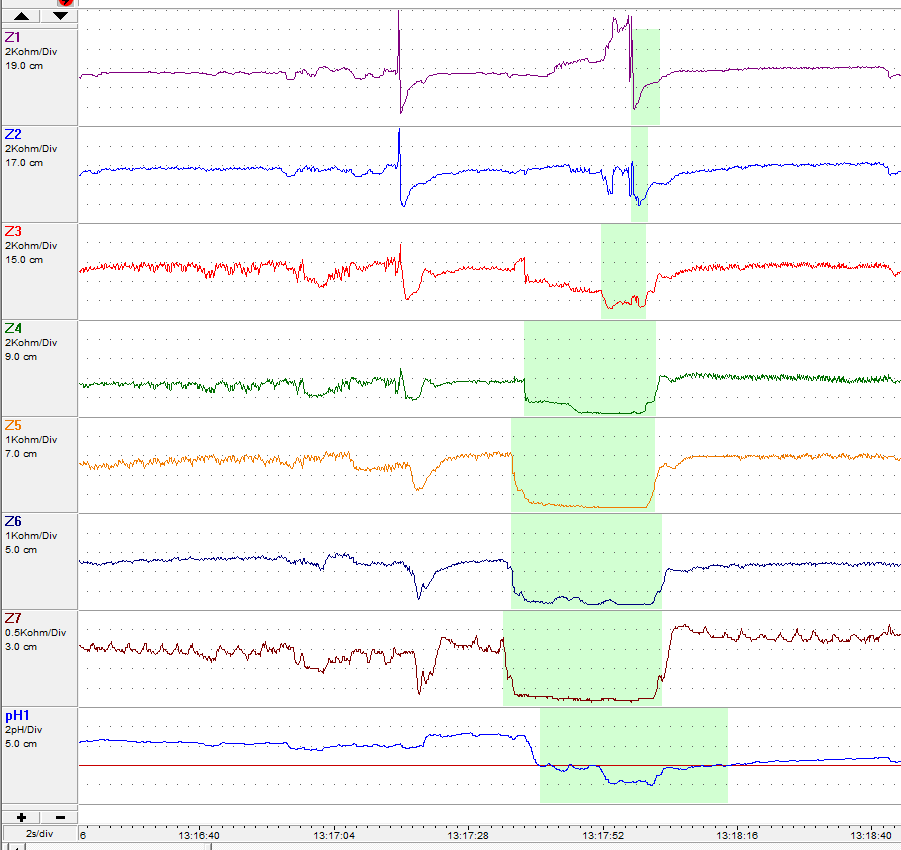
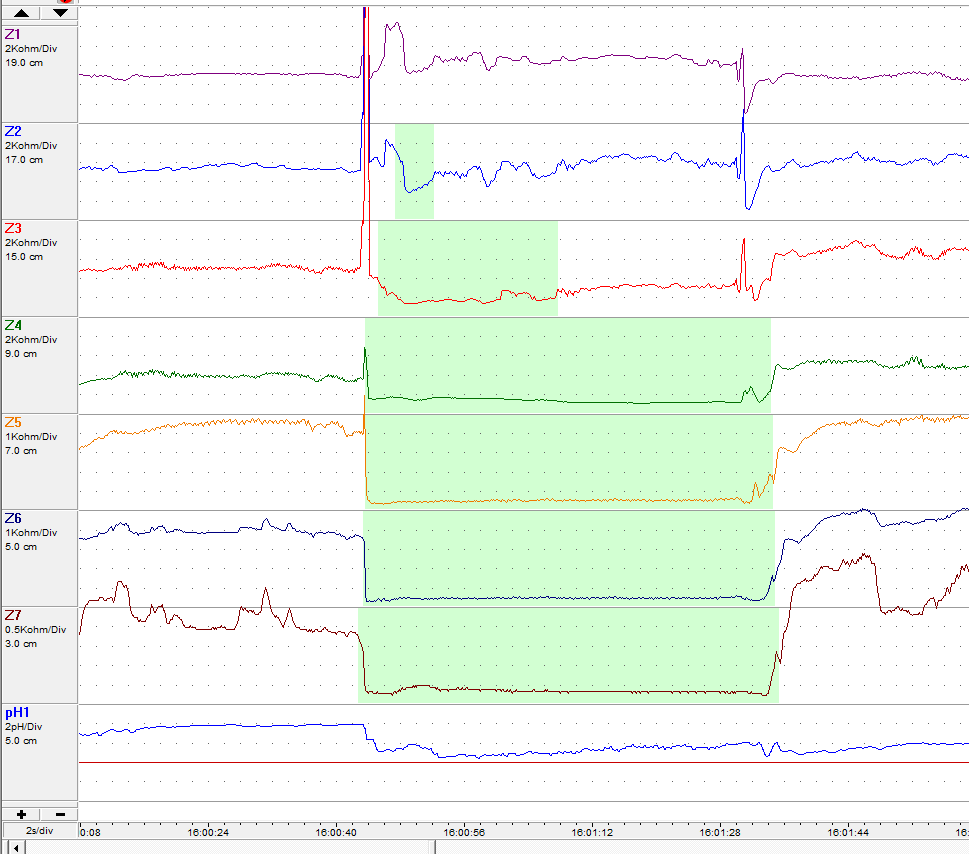
Essa baixa associação na prática pode ser explicada por alguns fatores. Acredita-se que a troca gasosa promovida pela insuflação e aspiração durante o exame ofereça proteção, pois traria uma rarefação dos gases com potencial explosivo. Na tentativa de demonstrar tal efeito, um estudo nacional recente, dosou as concentrações de CH4 ao longo de 250 colonoscopias preparadas com manitol (n=50) ou fosfato de sódio (n=200). Os autores esperavam encontrar altos níveis de CH4 no início dos exames do grupo manitol e o decréscimo progressivo do gás ao longo do exame. Curiosamente, em nenhum dos pacientes do grupo manitol houve detecção de metano, o que ocorreu em sete pacientes (3,5%) do grupo fosfato de sódio. Nestes, foi sim observada a queda nas dosagens do gás ao longo do procedimento.
Recentemente, a produção de metano no cólon tem sido associada a um trânsito intestinal lentificado. A aceleração do trânsito promovida pelo manitol, bem como por outros laxativos, poderia explicar a baixa produção de metano observada no estudo, bem como a maior presença do gás em pacientes com preparo ruim. Parece ainda haver variação individual na produção de metano, sendo que no ocidente, 65% dos indivíduos podem ser classificados como não produtores de metano.
No início dos anos 80, o manitol era um agente amplamente utilizado em todo o mundo. Relatos de explosão do cólon motivaram estudos sobre a concentração de gases após preparos com polissacarídeos não absorvíveis. Esses estudos demonstraram maiores concentrações destes gases quando comparados a outros agentes de preparo utilizados na época. Estes trabalhos cristalizaram a idéia da associação entre manitol e risco de explosão do cólon.
Uma revisão identificou, de 1956 a 2006, 9 casos de explosão de cólon em colonoscopias na literatura médica em língua inglesa, e outros 11 observados durante cirurgias. Das 9 colonoscopias, 6 cursaram com perfuração do cólon. A revisão não deixa claro quantas delas haviam sido preparadas com manitol. Em cinco a fonte de calor foi a utilização de argônio. Os autores ainda descrevem um caso próprio de explosão sem perfuração, utilizando argônio, após preparo com enema.
Embora dados da literatura destaquem o risco do uso do manitol para o preparo de cólon, a ponto de proscrever uma medicação de baixo custo e que atende a todos os outros quesitos desejáveis, a ampla utilização da droga em diversos países e a baixa incidência global de relatos de explosão de cólon nos permitem suspeitar que ainda não conhecemos a total verdade dos fatos sobre este assunto.
Características individuais na produção de gases combustíveis, variações na flora bacteriana do cólon, qualidade do preparo e técnica do exame com maior troca gasosa e a fonte de calor utilizada são apenas alguns fatores que podem explicar a baixa ocorrência de acidentes ligados ao manitol no mundo, apesar de sua ampla utilização.
E na sua rotina? Qual preparo você utiliza ? Já observou alguma intercorrência com o manitol ou outro tipo de preparo ? Participe dando sua opinião no campo de comentários, ou em nosso mural !
Referencias
- Macedo EP, Ferrari AP. COMPARATIVE STUDY AMONG THREE METHODS FOR ORAL COLONOSCOPY PREPARATION: MANITOL, POLYETHYLENE GLYCOL and ORAL SODIUM PHOSPHATE ENEMA. Dig Endosc [Internet]. 2003 Jan;15(1):43–7. Available from: http://doi.wiley.com/10.1046/j.1443-1661.2003.00209.
- Habr-Gama A, Bringel RW, Nahas SC, Araújo SE, Souza Junior AH, Calache JE, et al. Bowel preparation for colonoscopy: comparison of mannitol and sodium phosphate. Results of a prospective randomized study. Rev Hosp Clin Fac Med Sao Paulo [Internet]. 54(6):187–92. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10881066
- Belsey J, Epstein O, Heresbach D. Systematic review: oral bowel preparation for colonoscopy. Aliment Pharmacol Ther [Internet]. 2007 Feb 15;25(4):373–84. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17269992
- Johnson DA, Barkun AN, Cohen LB, Dominitz JA, Kaltenbach T, Martel M, et al. Optimizing adequacy of bowel cleansing for colonoscopy: recommendations from the U.S. Multi-Society Task Force on Colorectal Cancer. Gastrointest Endosc [Internet]. 2014 Oct;80(4):543–62. Available from : http://linkinghub.elsevier.com/retrieve/pii/S0016510714020719
- Ladas SD. Colonic gas explosion during therapeutic colonoscopy with electrocautery. World J Gastroenterol [Internet]. 2007;13(40):5295. Available from: http://www.wjgnet.com/1007-9327/13/5295.asp
- PAULO GA de, MARTINS FPB, MACEDO EP de, GONÇALVES MEP, FERRARI AP. SAFETY OF MANNITOL USE IN BOWEL PREPARATION: a prospective assessment of intestinal methane (CH4) levels during colonoscopy after mannitol and sodium phosphate (NaP) bowel cleansing. Arq Gastroenterol [Internet]. 2016 Sep;53(3):196–202. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032016000300196&lng=en&tlng=en
Conheça o Portal Endoscopia Terapêutica
O portal Endoscopia Terapêutica tem como objetivo compartilhar experiências da prática diária, além de prover atualizações por meio de Artigos comentados, Casos clínicos, Diretrizes e discussões sobre endoscopia digestiva.
Clique para visualizar outras classificações