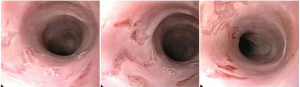
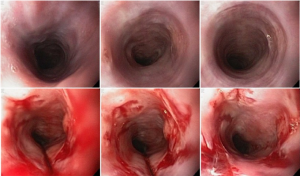
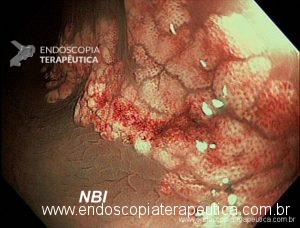
Hemorragia digestiva é a principal causa de hospitalização devido a doenças do trato gastrointestinal nos Estados Unidos, sendo 30 a 40% dos casos devido a hemorragia digestiva baixa (HDB). Na maioria dos pacientes, a HDB aguda é resolvida de forma espontânea, sem necessidade de intervenção e sem complicações. Entretanto, a idade avançada e a presença de múltiplas comorbidades estão relacionadas com o aumento da morbi-mortalidade neste grupo de pacientes.
Classicamente, a HDB aguda manifesta-se com hematoquezia (sangue vermelho vivo ou marrom pelo reto). Porém, raramente, pode manifestar-se também com melena.
Anteriormente, a HDB era definida como hemorragia originada distalmente ao ângulo de Treitz. Atualmente, com a definição de hemorragia digestiva média, a HDB é definida como sangramento originado do cólon e do reto.
- Hemorragia Digestiva Alta: Sangramento que ocorre até o ângulo de Treitz
- Hemorragia Digestiva Média: Sangramento originado entre o ângulo de Treitz e a válvula ileocecal
- Hemorragia Digestiva Baixa: Sangramento originado do cólon e do reto
Etiologia:
As causas de HDB incluem: doença diverticular (30-65%), colite isquêmica (5-20%); doença hemorroidária (5-20%), pólipos ou neoplasias colorretais (2-15%), angiectasias (5-10%), sangramento pós-polipectomia (2-7%), doença inflamatória intestinal (3-5%), colite infecciosa (2-5%), úlcera retal solitária (0-5%), varizes colorretais (0-3%), proctopatia actínica (0-2%), colopatia induzida por AINEs (0-2%), lesão de Dieulafoy (raro);
É importante atentar para situações em que o paciente apresenta hematoquezia com instabilidade hemodinâmica: pode representar um sangramento digestivo alto. Nestes casos, deve-se considerar a realização de endoscopia digestiva alta e esta deve ser realizada imediatamente antes da colonoscopia;
Manejo inicial:
O manejo não é distinto da hemorragia digestiva de qualquer topografia e/ou etiologia: anamnese direcionada à investigação da etiologia, exame físico detalhado (inclusive com toque retal) e avaliação laboratorial devem ser realizados assim que o paciente se apresentar. A ressuscitação hemodinâmica também deve ser efetuada de imediato.
Deve-se atentar para presença de comorbidades (que podem mudar o desfecho) e uso de medicações como AINEs, antiagregantes e anticoagulantes. Entre os fatores de risco para desfechos adversos (ressangramento, necessidade de intervenção e óbito) incluem: hipotensão, taquicardia, vigência de sangramento ativo, idade maior que 60 anos, creatinina maior que 1,7 mg/dl e instabilidade ou presença de várias dessas condições;
Atentar para a necessidade de transfusão sanguínea: os guidelines recentes recomendam transfusão com o intuito de manter a hemoglobina acima de 7g/dl na maioria dos pacientes e, em pacientes com comorbidades clinicamente significantes (especialmente isquemia miocárdica), em torno de 9 g/dl.
Investigação diagnóstica:
1. Colonoscopia
- A colonoscopia é o procedimento inicial para quase todos os pacientes que se apresentam com HDB aguda – é diagnóstica e também terapêutica, se houver necessidade;
- O guideline do Colégio Americano de Gastroenterologia sugere que a colonoscopia deve ser a modalidade diagnóstica de primeira linha para avaliação e tratamento da HDB;
- Estudos indicam que a colonoscopia identifica de forma definitiva o sítio de sangramento em 45 – 90% dos pacientes.
A colonoscopia deve ser realizada nas primeiras 24 horas da chegada do paciente, após estabilização hemodinâmica e preparo adequado do cólon;
Estudos observacionais têm demonstrado uma alta frequência de definição diagnóstica e baixo tempo de internação em pacientes com HDB submetidos a colonoscopia precoce (entre 12 e 24 horas após a entrada) em comparação com pacientes submetidos a colonoscopia tardia, embora dois estudos randomizados pequenos comparando colonoscopia precoce com tardia não tenham mostrado diferença significativa no tempo de internação, ressangramento ou necessidade de cirurgia;
- O preparo do cólon é essencial para a adequada visualização endoscópica, diagnóstico e tratamento. Colonoscopia ou retossigmoidoscopia sem preparo adequado geralmente não são realizadas, entretanto podem ser consideradas em casos selecionados (por exemplo, suspeita de sangramento do cólon esquerdo distal) com limpeza e inspeção cuidadosas do cólon durante do procedimento;
- Em pacientes com preparo do cólon inadequado, a sensibilidade cai significativamente e o sucesso do tratamento é obtido em menos de 21% dos pacientes;
- Em pacientes em vigência de sangramento sem condições de ingesta oral do preparo, a passagem de sonda nasogástrica deve ser considerada se o risco de aspiração for baixo. Os pacientes devem evitar alimentos sólidos pelo menos 8 horas antes do procedimento. Líquidos claros, inclusive o preparo para colonoscopia, são permitidos até 2 horas antes do procedimento;
2. Exames de imagem
2.1. Cintilografia com hemácias marcadas
- Pode identificar sangramento com o fluxo muito baixo (0,1 ml/ minuto),
- Sua utilidade é controversa: um estudo retrospectivo sugere que a realização da cintilografia antes da angiografia está associada a um alto rendimento diagnóstico da angiografia quando comparado a angiografia sem cintilografia e permite o uso do contraste de forma mais seletiva.
- Entretanto outros estudos não confirmaram estes achados e tem sugerido maior utilidade da angioTC.
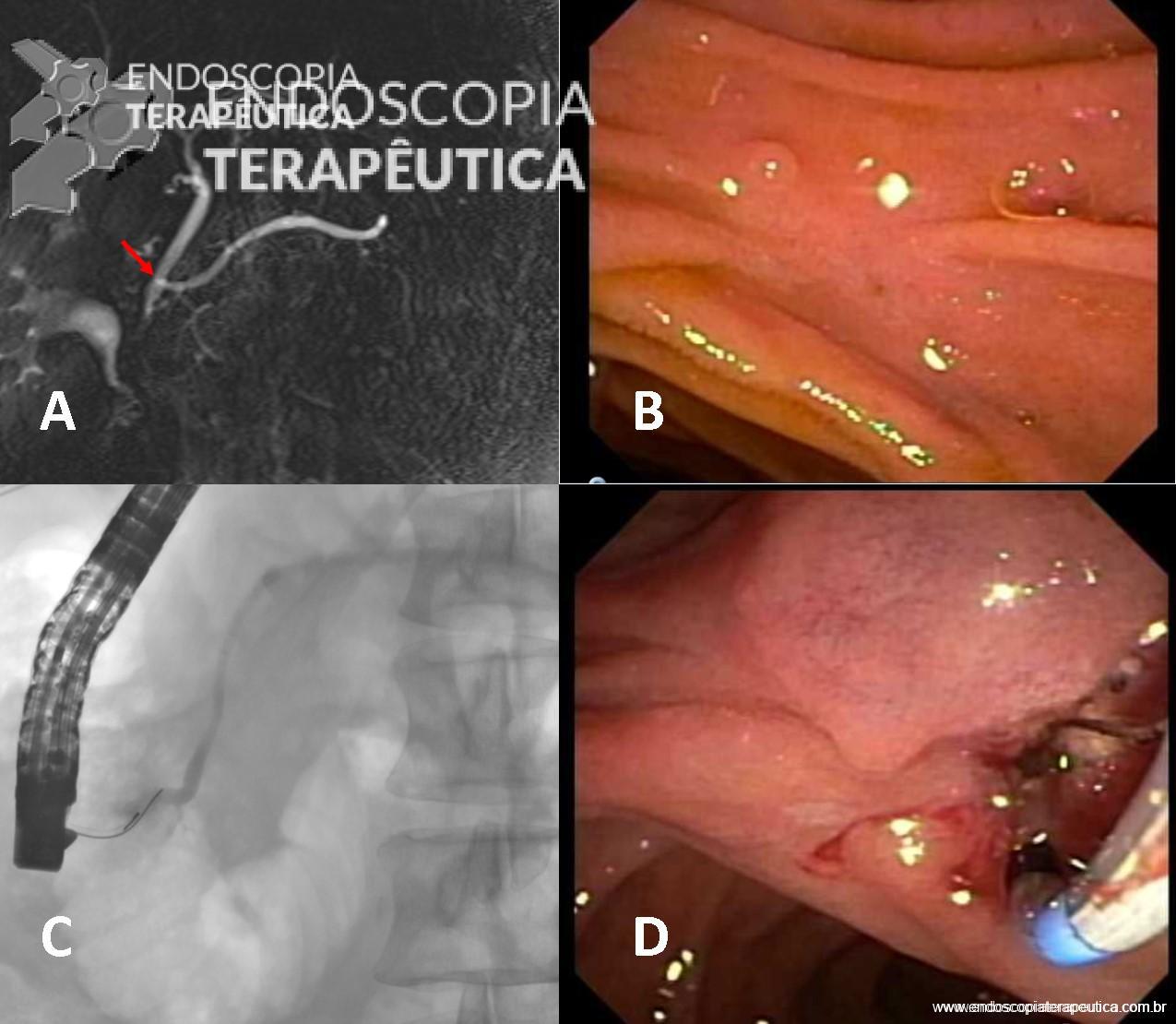
2.2. AngioTC
- Detecta sangramentos com fluxo de 0,3 ml/minuto,
- Alta acurácia na localização do sítio de sangramento (próximo a 100%)
- Pode ser usada imediatamente antes da angiografia para guiar a injeção de contraste de forma seletiva ou superseletiva.
- Seu principal problema é a necessidade de injeção de contraste intravenoso, com seu risco associado de nefrotoxicidade;
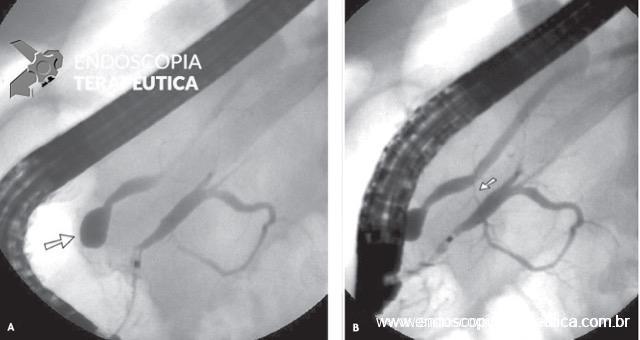
2.3 Angiografia
- Deve ser realizada assim que possível para realizar com precisão a localização do sangramento, seguida de sua terapêutica, visto que a HDB aguda é intermitente por natureza;
- De acordo com o Colégio Americano de Radiologia, a colonoscopia deve ser realizada nos pacientes estáveis hemodinamicamente que fizeram o preparo adequado e a angiografia em pacientes instáveis hemodinamicamente, em vigência de sangramento ativo.
Terapêutica
Endoscópica
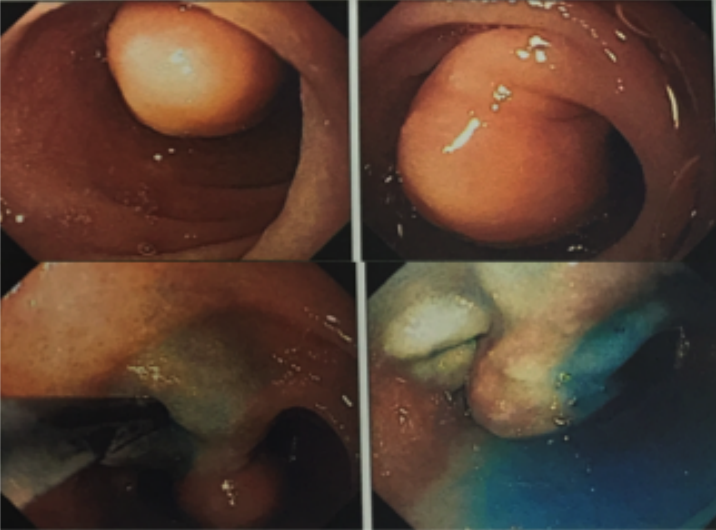
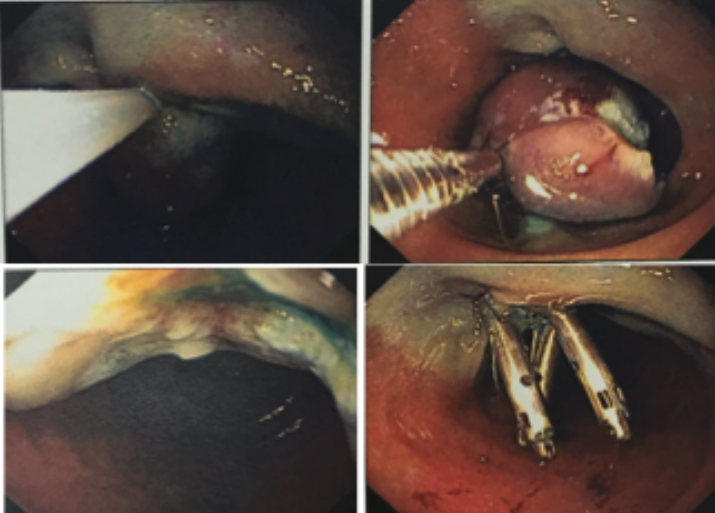
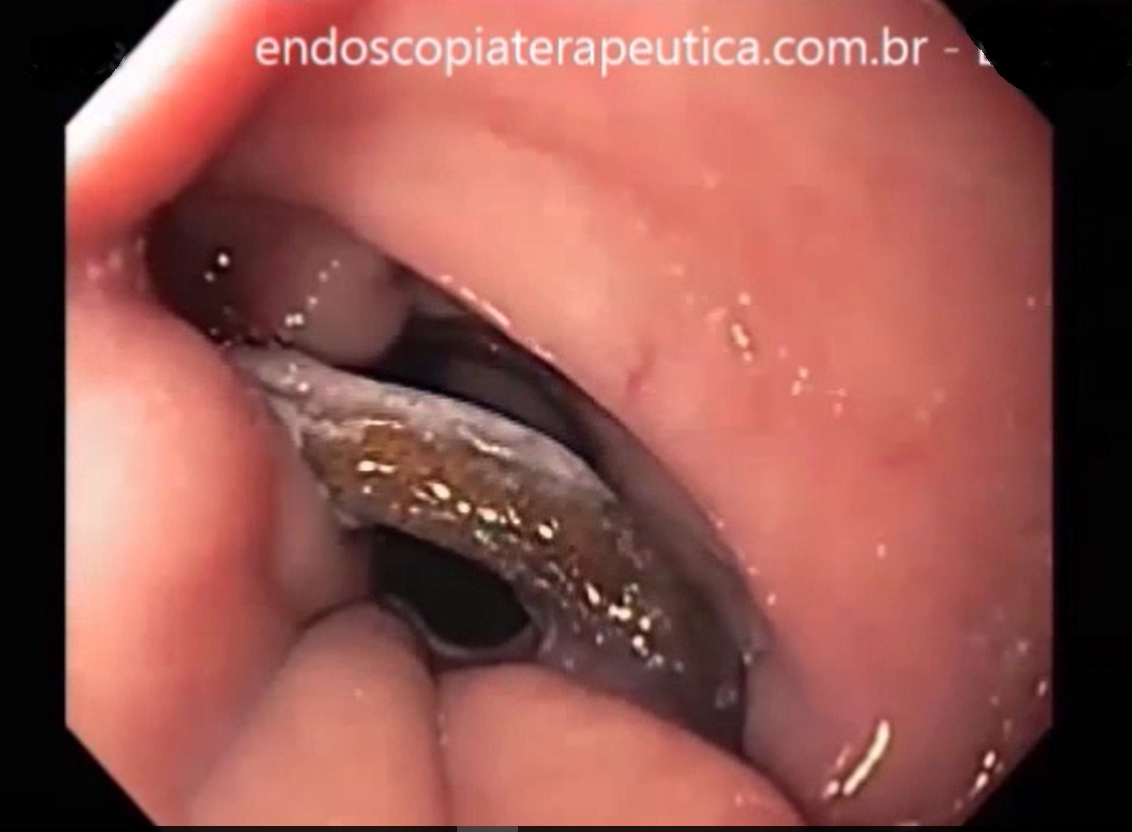
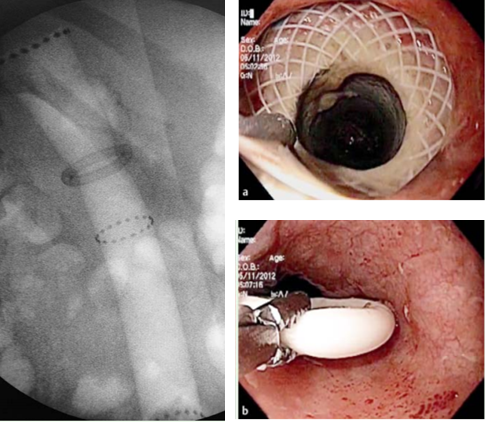
Métodos endoscópicos de hemostasia incluem métodos de injeção, métodos térmicos (eletrocoagulação bipolar, heater probe e coagulação com plasma de argônio) e terapia mecânica (clipes e ligadura elástica);
O uso do método de injeção (solução de adrenalina 1:10.000 ou 1:20.000) facilita a hemostasia primária em sangramento agudo, mas deve ser realizada sempre em combinação com um segundo método (mecânico ou térmico) para alcançar a hemostasia definitiva;
A escolha do método é geralmente guiada pela causa e localização do sangramento, a habilidade para acessar o sítio e a experiência do endoscopista;
Diverticulose, angiectasia e sangramento pós-polipectomia são as fontes de sangramento que provavelmente mais se beneficiam da terapêutica endoscópica;
Os guidelines recomendam que o sangramento diverticular deve ser tratado endoscopicamente se houver estigmas de sangramento recente (sangramento ativo, vaso visível ou coágulo aderido). A terapia mecânica com uso de clipes é o método de escolha por teoricamente diminuir o risco de lesão transmural;
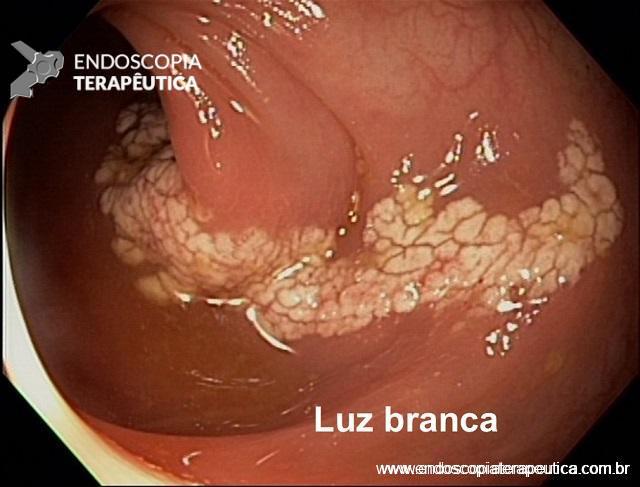
- Angiectasias colônicas, inclusive a proctopatia actínica, são comuns em idosos e embora manifestem-se com sangramento leve, pode ocorrer hematoquezia grave especialmente em pacientes em uso de antitrombóticos. O tratamento de escolha para essas lesões é a coagulação com plasma de argônio;
- A abordagem endoscópica para tratamento de sangramento pós-polipectomia inclui o uso de métodos mecânicos e térmicos, com ou sem injeção de solução de adrenalina prévia;
- Sangramentos secundários a colite isquêmica, doença inflamatória intestinal ou neoplasias colorretais geralmente não são passíveis de tratamento endoscópico e são normalmente tratados com suporte clínico, cirurgia ou ambos;
Em pacientes com recorrência do sangramento, deve-se repetir a colonoscopia, com hemostasia endoscópica se houver necessidade;
Endovascular
A angiografia permite tanto identificar o sítio de sangramento quanto a intervenção terapêutica. Entretanto, ela pode ser negativa quando o sangramento tem fluxo baixo (menor que 0,5ml/minuto) ou intermitente;
Série de casos mostra alto índice de sucesso em embolização (ausência de extravasamento de contraste) na HDB (73 a 100%). O índice de sucesso clínico (cessação do sangramento) varia de 63 a 96%, com taxa de ressangramento de 11 a 50%.
Cirurgia
A avaliação cirúrgica é indicada em caso de falha do tratamento endoscópico e vascular;
A localização do sítio de sangramento é essencial antes da ressecção cirúrgica para evitar a necessidade de colectomia subtotal e prevenir o ressangramento após a cirurgia, o que indica que a localização da lesão foi incorreta;
HDB e agentes antiplaquetários
O uso de agentes antiplaquetários aumentam o risco de sangramento gastrointestinal inferior, sendo o risco de sangramento baixo três vezes maior que o alto;
- Uma coorte retrospectiva envolvendo pacientes com HDB mostrou que aqueles que continuaram o uso de aspirina após o sangramento tiveram significativo aumento da recorrência de sangramento em 5 anos que aqueles que descontinuaram o uso (19,9% x 6,9%), entretanto tiveram baixo risco de eventos cardiovasculares sérios e morte. Para minimizar o risco de eventos cardiovasculares, a aspirina como profilaxia secundária não deve ser interrompida em pacientes com HDB. Entretanto, tem sido mostrado que baixas doses de aspirina como profilaxia primária oferece uma redução limitada no risco absoluto de eventos cardiovasculares sérios e morte e, em geral, devem ser evitadas em pessoas com HDB;
- Há falta de dados para guiar o cuidado com os pacientes que têm HDB em vigência de dupla antiagregação plaquetária. Pacientes submetidos a angioplastia com stent nos últimos 30 dias ou que tenham tido síndrome coronariana aguda (SCA) nos últimos 90 dias têm alto risco para infarto agudo do miocárdio e morte após descontinuarem o uso da dupla antiagregação e portanto são normalmente orientados a manter o uso das medicações;
- Naqueles pacientes em uso de stent ou com SCA há mais tempo, a descontinuação do segundo agente antiplaquetário é recomendada de 1 a 7 dias, pois a descontinuação desse segundo agente parece estar associada com um relativo baixo risco se o uso da aspirina for mantido.
Conclusão e recomendações
- Os pacientes que apresentam HDB devem ser submetidos a colonoscopia dentro das primeiras 24 horas, após estabilidade hemodinâmica e preparo adequado do cólon;
- Se sangramento volumoso e/ou instabilidade hemodinâmica, endoscopia digestiva alta deve ser realizada imediatamente antes da colonoscopia;
- A causa mais comum de HDB é a diverticulose (30-65%);
- A HDB tem resolução espontânea na maioria das vezes (70 a 80% em doença diverticular);
- Hemostasia endoscópica deve ser realizada quando a lesão for identificada com sangramento ativo ou sinais de sangramento recente (vaso visível e coágulo aderido);
- Em pacientes em vigência de sangramento ou sem resposta à ressuscitação hemodinâmica e que não podem ser submetidos à colonoscopia, deve ser realizada angioTC seguida de angiografia com embolização se houver indicação;
- A interrupção do uso de antiagregantes plaquetarios deve ser individualizada.
Referências:
- Acute Lower Gastrointestinal Bleeding. N Engl J Med 2017; 376: 1054-63;
- Diagnosis of Gastrointestinal Bleeding: A practical guide for clinicians. World J Gastrointest Pathophysiol. Nov 15, 2014; 5(4): 467-478
…………………………………………………………………………………………………………..
Como citar esse artigo:
Arraes L. Manejo e Tratamento da Hemorragia Digestiva Baixa Aguda. Endoscopia Terapêutica; 2018. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/hemorragia-digestiva-baixa-aguda
…………………………………………………………………………………………………………..
Leia mais sobre Hemorragia Digestiva Baixa:
– DIRETRIZES – ACG Clinical Guideline: Diagnosis and Management of Small Bowel Bleeding https://endoscopiaterapeutica.net/pt/diretriz/diretrizes-acg-clinical-guideline-diagnosis-and-management-of-small-bowel-bleeding/
– DIRETRIZES – Papel da endoscopia no paciente com sangramento gastrointestinal baixo https://endoscopiaterapeutica.net/pt/diretriz/diretrizes-papel-da-endoscopia-no-paciente-com-sangramento-gastrointestinal-baixo/
Confira também: Hemorragia digestiva média