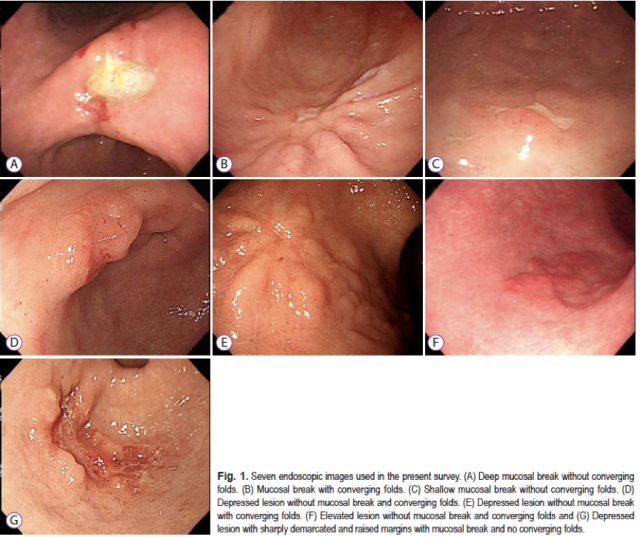
Introdução
A mucosectomia é um procedimento endoscópico amplamente realizado em todo o mundo para o tratamento de lesões superficiais do TGI. Consiste basicamente na injeção submucosa de fluidos para elevação da lesão, seguida do corte e consequente remoção da mesma usando alças diatérmicas.
A grande maioria desses procedimentos é realizada de forma ambulatorial, com altas taxas de sucesso e baixa incidência de complicações imediatas e tardias. As complicações mais comuns são o sangramento, perfuração e a síndrome pós-polipectomia, de injúria térmica dos tecidos.
Sangramento
O sangramento é o evento adverso tardio mais comum associado ao procedimento de mucosectomia de cólon, com uma incidência que varia entre 2 e 10%. Na maioria das vezes ocorre até 7 dias após a mucosectomia, com alguns autores descrevendo sangramento até 30 dias após o procedimento.
Os sangramentos tardios geralmente são de grande monta e podem acarretar consequências clínicas importantes como choque hipovolêmico e instabilidade hemodinâmica, com necessidade de admissão hospitalar, hemotransfusões, reintervenções endoscópicas e, por vezes, intervenção radiológica ou cirúrgica.
Um fato interessante em relação aos sangramentos tardios, é que não há nenhum tipo de profilaxia com eficácia comprovada, para sua prevenção. Será que existem meios para prever os quadros de sangramento pós mucosectomia e, dessa maneira, evitar esses eventos?
Fatores de risco para sangramento
Vários autores em diferentes países vêm fazendo esses mesmos questionamentos e vamos fazer aqui uma compilação dos estudos mais recentes.
No passado, vários fatores foram relacionados aos quadros de sangramento tardio, como por exemplo, ocorrência de sangramento imediato, tamanho e localização das lesões, uso de antitrombóticos, experiência do endoscopista, técnica de mucosectomia utilizada, dentre outros.
Nos últimos anos, no entanto, diferentes grupos que se dedicam ao estudo de desfechos pós ressecções endoscópicas têm observado que o aspecto do leito de ressecção imediatamente após o procedimento é, talvez, o fator mais importante associado aos quadros de sangramento tardio.
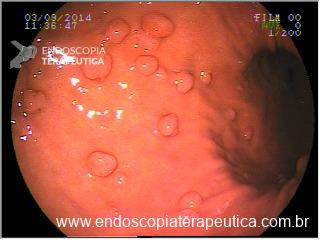
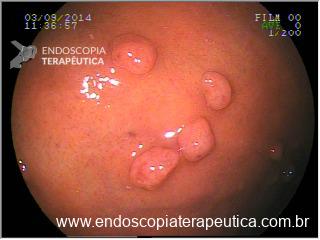
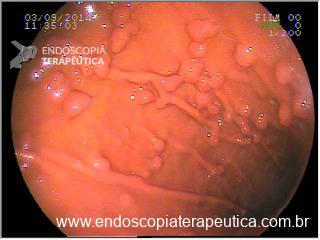
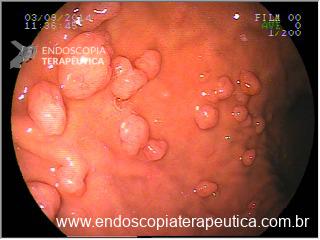
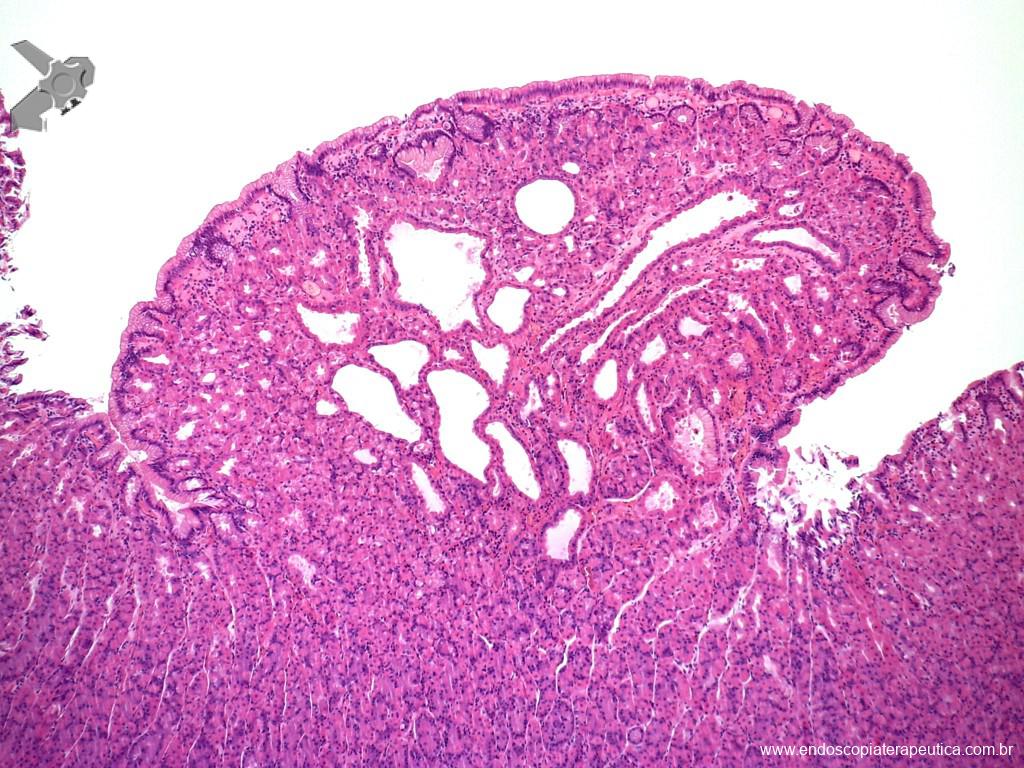
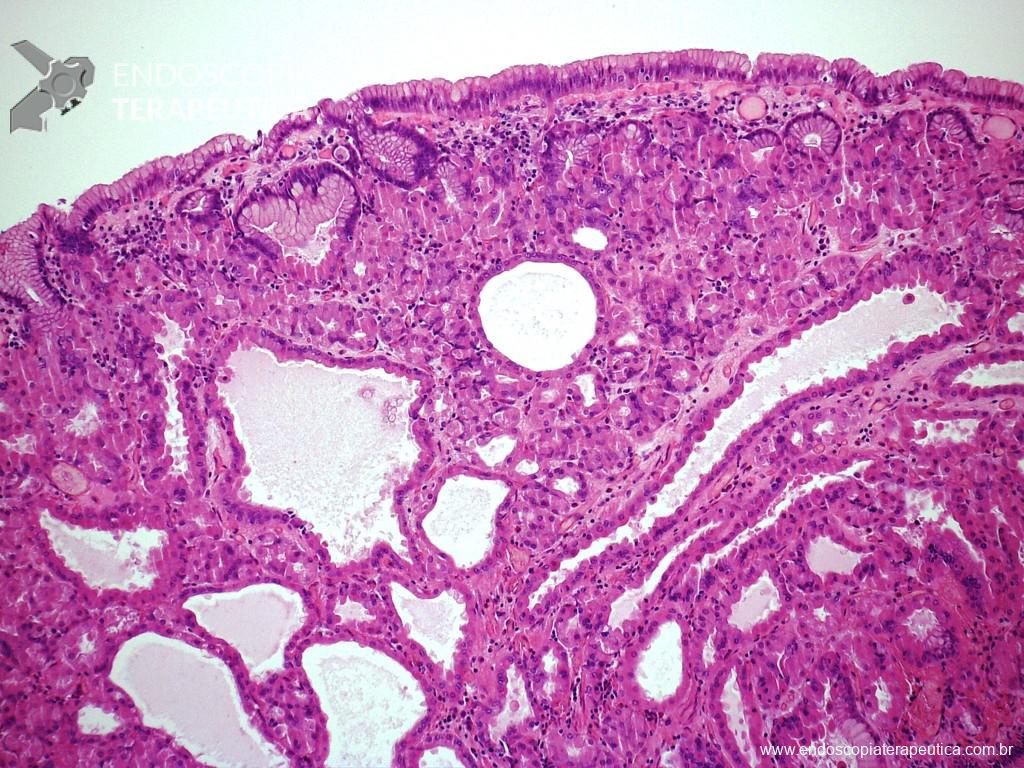
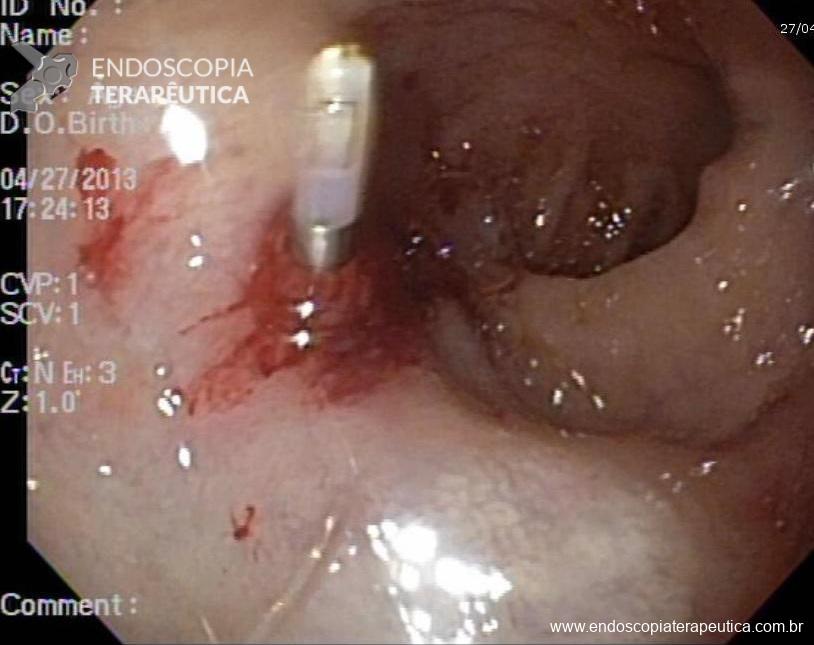
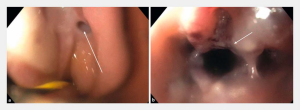
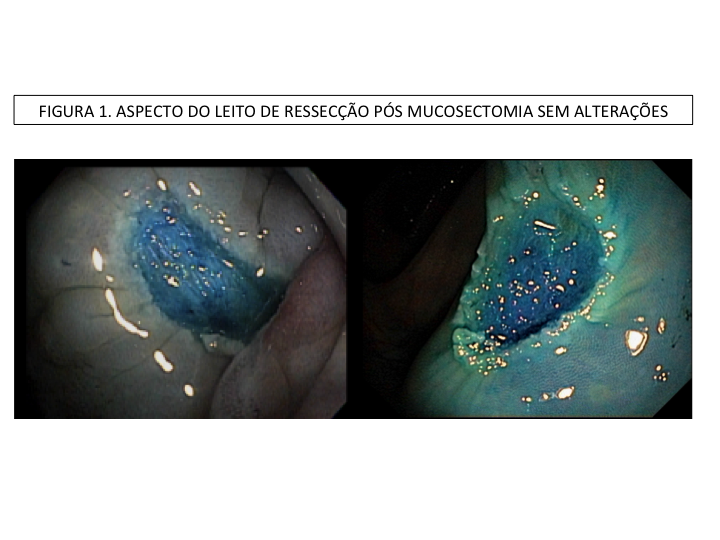
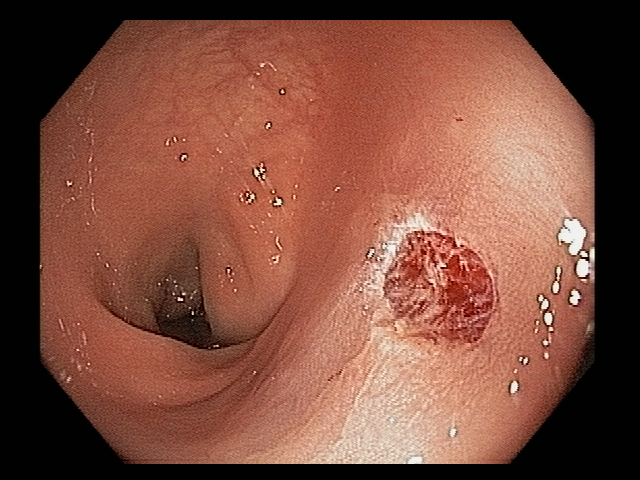
A aparência dos leitos de ressecção pode variar bastante. Podemos ter leitos aparentemente “limpos” aonde é possível observar somente o aspecto das fibras submucosas, orientadas obliquamente, com aspecto areolar, que se cruzam no leito de ressecção. Essas fibras podem, por vezes, exibir corantes azuis (índigo carmine e azul de metileno) como mostrado na Figura 1.
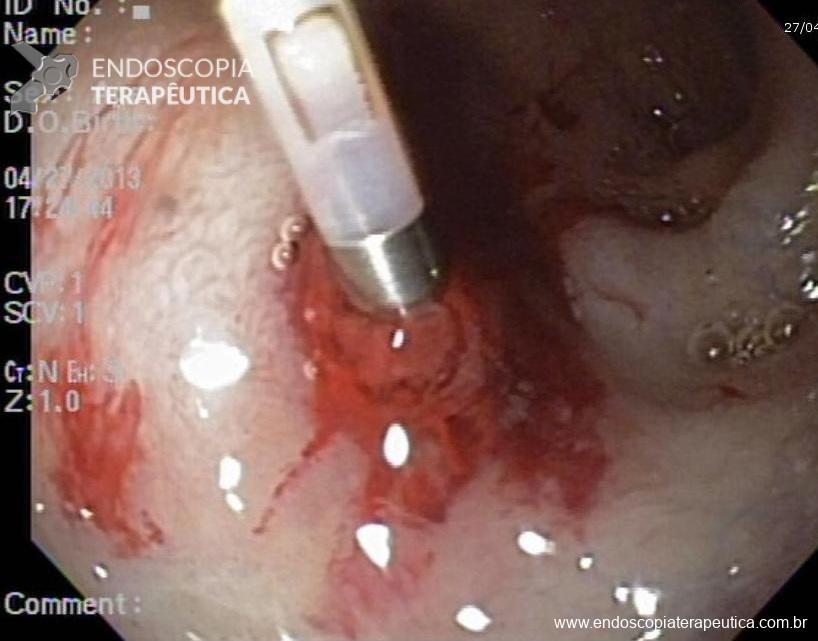
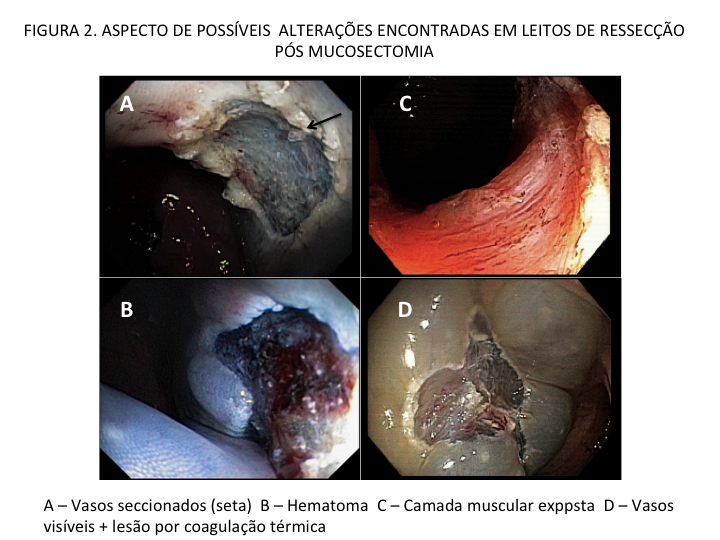
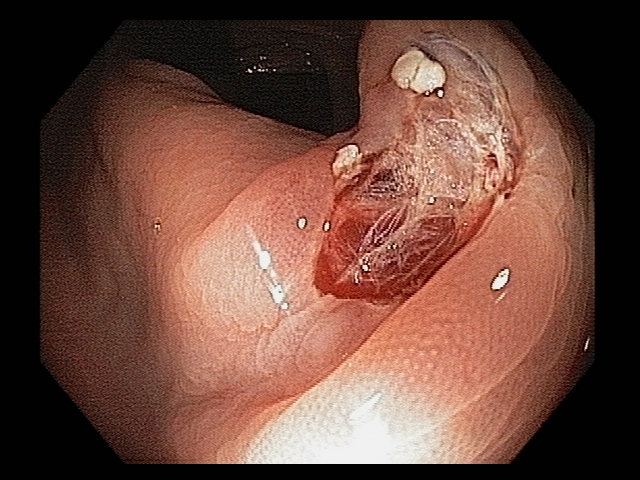
Podemos, contudo, observar leitos de ressecção com inúmeras alterações como vasos visíveis, exibindo diferentes calibres, vasos seccionados, áreas de fibrose, exposição e lesões da camada muscular, além de estigmas de coagulação (Figura 2).



Kim e colaboradores mostraram em um estudo publicado em 2017, que envolveu 505 pacientes, que o aspecto alterado do leito de ressecção teve forte associação com episódios de sangramento tardio (que ocorreu em 2,7% dos casos do estudo). Os autores identificaram duas situações distintas, que mereceram destaque:
- presença de estigmas ou injúrias por coagulação – graduadas em leve (sem estigmas), moderada (pequena quantidade de debris brancos no leito de ressecção) e acentuadas (debris brancos cobrindo o leito de ressecção)
- presença de vasos visíveis e seccionados.
Lesões por coagulação acentuadas (OR 16,79 95% CI 1,82-145,55) e presença de vasos seccionados (OR 18,91 95% CI 3,10-115,18) foram as variáveis que associaram-se de forma independente a episódios de sangramento tardio.
Timothy Elliot e colaboradores, conduziram um estudo interessante que foi publicado em 2018 na Endoscopy, para investigar fatores envolvidos com sangramento tardio pós-mucosectomias. O estudo envolveu 330 pacientes, com uma taxa de sangramentos tardios de 6,7% (necessidade de internação hospitalar), sendo que metade dos pacientes internados precisaram de hemotransfusões.
Os autores destacaram que nenhuma variável clínica (gênero, idade, presença de comorbidades, uso de anti-trombóticos), ou associada à lesão (tamanho, localização, técnica utilizada para mucosectomia) teve associação com sangramento tardio. As variáveis que tiveram associação foram as alterações do leito de ressecção, como presença de fibras musculares expostas (p = 0,03) e presença de hematomas na submucosa (chamados pelos autores de “red spots” – p = 0,05). Essas duas alterações, de acordo com os autores, estão associadas a lesões térmicas e mecânicas de vasos submucosos, o que eleva o risco de sangramento tardio.
Na edição de Março de 2019 da revista Gastrointestinal Endoscopy, foi publicado um artigo original do serviço de endoscopia do grupo de New South Wales de Sydney na Austrália, dedicado a descrever quais alterações observadas nos leitos de ressecção pós-mucosectomias, estariam relacionadas ao sangramento tardio.
O grupo, com grande experiência em mucosectomias colorretais, conduziu um estudo prospectivo que envolveu 501 lesões ressecadas em 501 pacientes, com uma taxa de sangramento tardio de 6% (30 casos).
Foi observada que a presença de três ou mais vasos visíveis no leito de ressecção, independente do calibre dos mesmos, foi um forte preditor de sangramento tardio (p=0,016) e que nenhuma outra característica do leito de ressecção (herniação de vasos, calibre, presença de fibrose, dentre outras) se correlacionou com sangramento tardio. Vasos submucosos visíveis foram mais frequentes em lesões de cólon esquerdo e, nessa localização os vasos eram mais calibrosos, numerosos e herniados, em relação a lesões ressecadas em cólon direito.
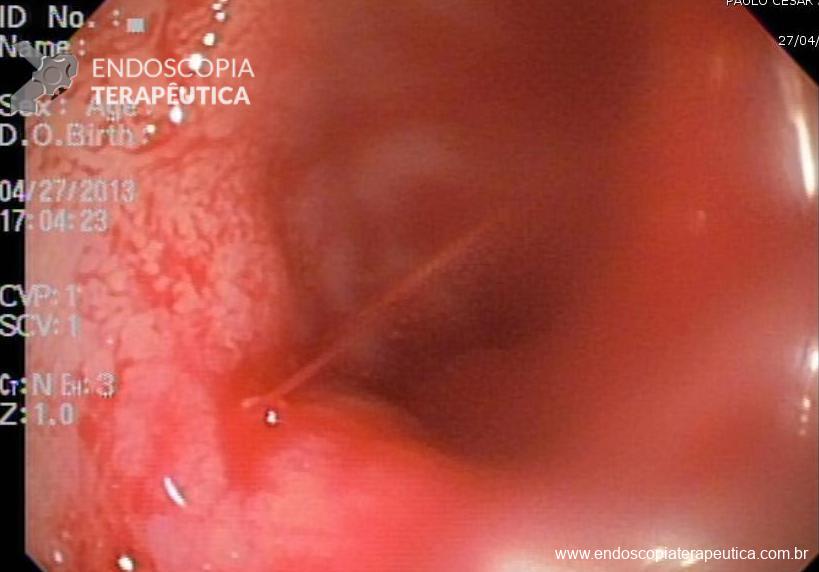
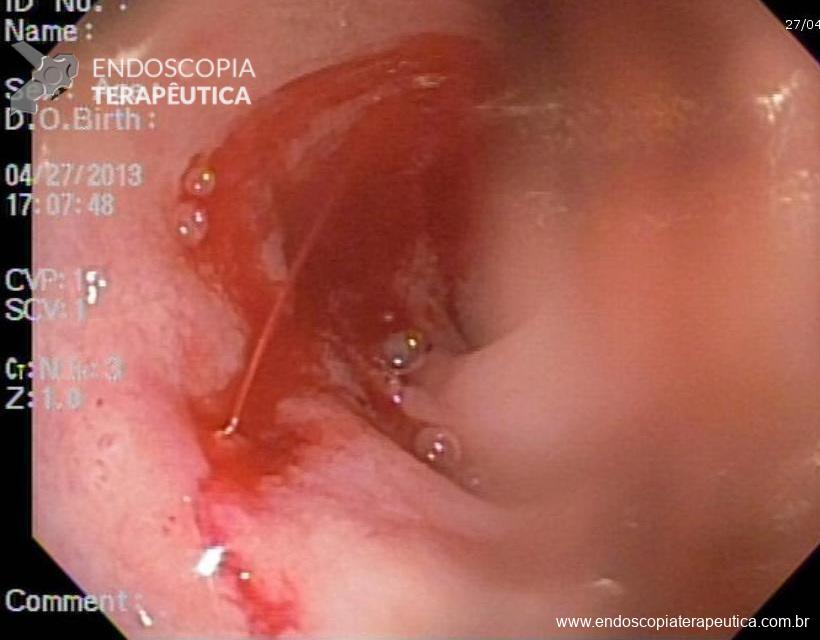
Como resultado dos procedimentos habituais de mucosectomia, temos a formação de um leito de ressecção que se assemelha a uma úlcera. A inspeção cuidadosa dessas úlceras artificiais, ou seja, desses leitos de ressecção, não faz parte das rotinas da maioria dos serviços e parece trazer informações preciosas em relação ao risco de sangramento tardio. Não há, até o momento, nenhuma recomendação estabelecida em relação a cuidados com leito de ressecção pós mucosectomias, diferente do que ocorre com ESD (dissecção submucosa).
A avaliação das alterações nos leitos de ressecção (presença de vasos, aspecto e quantidade de vasos, além da presença de estigmas de coagulação), pode ser extremamente útil para guiar medidas preventivas de sangramento instituindo rotinas para o uso racional de clipes endoscópicos, de coagulação com plasma de argônio, dentre outros. A adoção da prática de inspeção detalhada dos leitos de ressecção pode, ainda, melhorar um aspecto pouco valorizado no Ocidente: a documentação fotográfica sistemática e adequada dos procedimentos realizados.
Essas medidas têm potencial para reduzir o impacto do sangramento tardio, tanto em termos de repercussões clínicas para os pacientes, quanto em termos de custos para o sistema de saúde.
REFERÊNCIAS:
Gwang-Un Kim, Myeongsook Seo, Eun Mi Song, et al. Association between the ulcer status and the risk of delayed bleeding after the endoscopic mucosal resection of colon J Gastroenterol Hepatol.2017 32(11):1846-1851.
Timothy R. Elliott, Zacharias P. Tsiamoulos, Siwan Thomas-Gibson et al. Factors associated with delayed bleeding after resection of large nonpedunculated colorectal polyps. Endoscopy 2018 50(8): 790-99.
Lobke Desomer, David J. Tate, Farzan F. Bahin et al. A systematic description of the post-EMR defect to identify risk factors for clinically significant post-EMR bleeding in the colon. Gastrointest Endosc 2019 89(3): 614-24.
Fotos para discussão
EMR 1
EMR 2