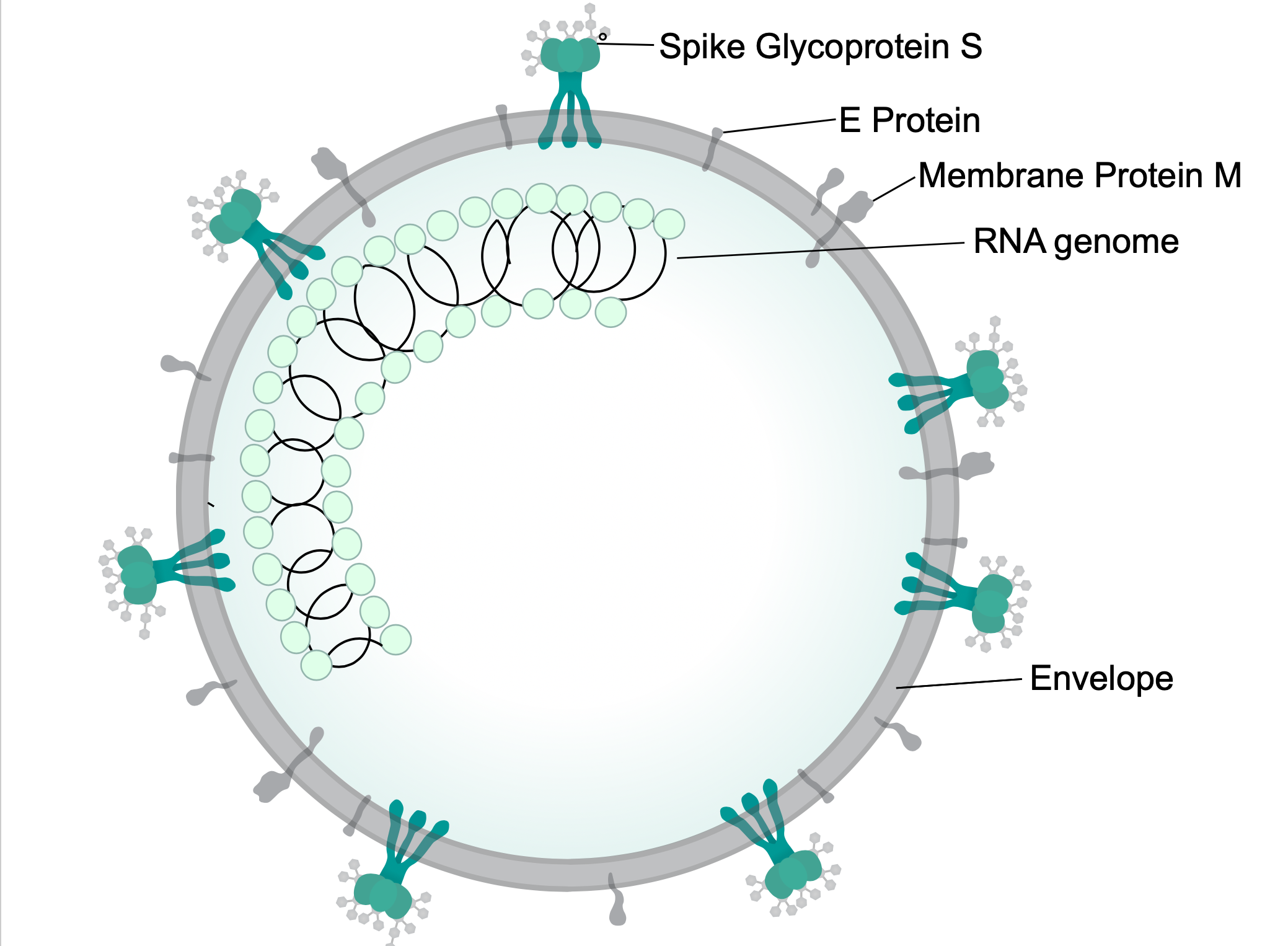
MEDIDAS DE PREVENÇÃO CONTRA O CORONAVÍRUS
ATENÇÃO: esse artigo é dedicado a proteção dos profissionais envolvidos com os procedimentos de endoscopia digestiva
MEDIDAS DE PREVENÇÃO
Casos suspeitos ou confirmados
Indivíduos com suspeita de infecção na comunidade devem usar uma máscara médica para conter suas secreções respiratórias.
As recomendações da OMS e do CDC diferem ligeiramente quanto as recomendações para a equipe médica.
A OMS recomenda [1]:
- Precauções padrão, de contato e de gotículas (ou seja, avental, luvas e máscara), com proteção para os olhos ou para a face.
- Uso de máscaras tipo respiradores durante os procedimentos de geração de aerossóis
O CDC recomenda que [2]:
- pacientes com suspeita ou confirmação de COVID-19 sejam colocados em um quarto isolado com porta fechada.
- O paciente deve usar uma máscara facial se for transportado para fora da sala (para estudos que não possam ser realizados na sala).
- Pacientes submetidos a procedimentos de geração de aerossóis devem realiza-los em sala de pressão negativa.
- Qualquer pessoa que entre no quarto de um paciente com suspeita ou confirmação de COVID-19 deve usar o equipamento de proteção individual (EPI) apropriado: avental, luvas, proteção para os olhos e um respirador (por exemplo, um respirador N95).
- Se o suprimento de respiradores for limitado, o CDC reconhece que as máscaras faciais são uma alternativa aceitável (além das precauções de contato e proteção ocular), mas os respiradores devem ser usados durante os procedimentos de geração de aerossóis.
Procedimentos geradores de aerossóis
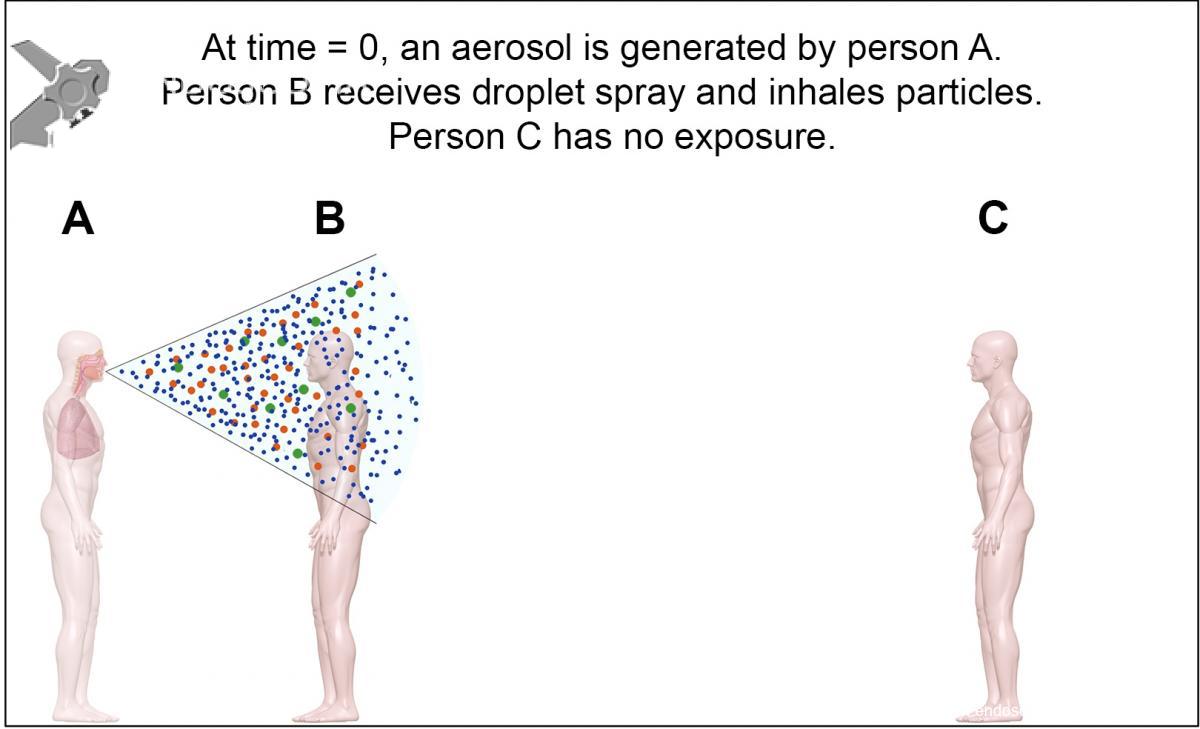
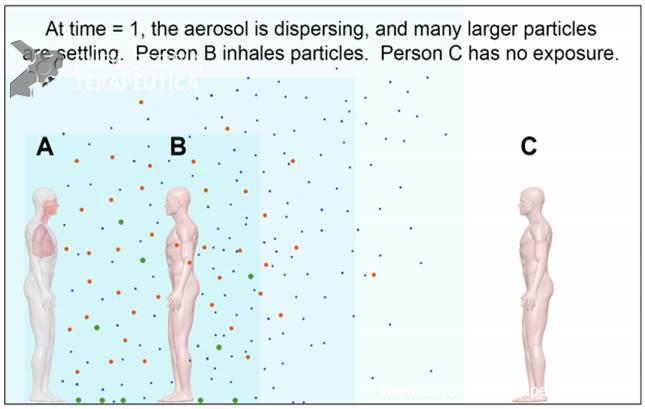
Alguns procedimentos realizados em pacientes com COVID-19 podem gerar aerossóis infecciosos. Em particular, os procedimentos que provavelmente induzem a tosse (por exemplo, indução de escarro, aspiração aberta de vias aéreas) devem ser realizados com cautela e evitados, se possível.
Se realizado, o seguinte deve ocorrer:
- O profissional de saúde na sala deve usar um respirador N95 ou de nível superior, proteção para os olhos, luvas e avental.
- O número de profissionais de saúde presentes durante o procedimento deve ser limitado apenas aos essenciais para o atendimento ao paciente e suporte ao procedimento.
- Idealmente, os procedimentos devem ocorrer em salas com pressão negativa com o mínimo de 6 trocas de ar por hora.
- Limpar e desinfectar as superfícies da sala de procedimentos imediatamente.
Endoscopia digestiva é um procedimento gerador de aerossol?
Essa é outra grande discussão.
Classicamente, a endoscopia digestiva não está listada pela WHO e CDC como procedimento gerador de aerossol. Os procedimentos geradores de aerossóis incluem intubação traqueal, ventilação não-invasiva, traqueostomia, ressuscitação cardiopulmonar, ventilação manual (pré-intubação) e broncoscopia.
No entanto, vários experts, alguns artigos e recomendações de sociedades (inclusive a SOBED) consideram a endoscopia como procedimento gerador de aerossol. [3-6]
A definição do CDC na página dedicada ao paciente com suspeita ou confirmação de COVID é um pouco mais ampla: “Some procedures … could generate infectious aerosols. In particular, procedures that are likely to induce coughing (e.g., sputum induction, open suctioning of airways).…”
Nesse contexto, entendo que a endoscopia digestiva alta tem a possibilidade de gerar aerossóis, caso o paciente apresente reatividade de vias aéreas durante o procedimento, levando a tosse. Essa é uma cena bem comum, especialmente no início do exame durante a passagem pelo cricofaríngeo. Cumpre salientar a proximidade do endoscopista com a boca aberta do paciente (com bucal) nesse momento.
Outra possibilidade de geração de aerossóis seria pelo canal de trabalho e canal de ar e água do aparelho. Um artigo de 2010 [7] mediu a quantidade de bioaerosol coletado durante procedimentos de colonoscopia, mostrando que a aspiração contínua do canal de trabalho durante a remoção da pinça de biópsia reduz significativamente a quantidade de bactérias aerossolizadas. Esse é o único estudo focado na geração de aerossóis durante os exames de endoscopia, mostrando que a aerossolização existe, apesar de ainda não sabermos suas consequências clínicas.
Vídeo: como reduzir saída de secreções pelo canal de trabalho
Quais EPIs devemos utilizar durante procedimentos endoscópicos?
A SOBED recomenda o uso dos seguintes EPIs durante os procedimentos endoscópicos [4]:
| · Uso de roupa privativa
· Calçados fechados e impermeáveis · Touca · Propé descartável · Máscara N95 ou PFF2 · Óculos de proteção ou “face shield” · Avental impermeável com mangas longas · Luvas que cubram inclusive a região do punho, pode-se usar uma fita de micropore ou esparadrapo para fixar a primeira luva ao avental
|
- .
- Aventais, luvas e máscaras devem ser descartados ao término de cada procedimento.
- Se paciente suspeito ou confirmado para COVID, deve-se descartar também a touca e o propé.
- Óculos de proteção e face shield devem ser higienizados ao término de cada procedimento.
Como me paramentar e desparamentar para realizar exame de um paciente com COVID-19?
Adotar a seguinte sequência de paramentação:
- Colocar o propé
- Colocar a máscara N95
- Colocar a touca
- Colocar o avental impermeável
- Colocar os óculos de proteção ou protetor facial
- Colocar dois pares de luvas
Ao término do exame:
A maioria das contaminações entre os profissionais de saúde ocorre durante a retirada dos EPIs. Portanto, fique atento a esta etapa e treine a sequência em todos os exames, mesmo nos pacientes assintomáticos! Se possível peça ajuda para fazer a desparamentação.
- Retirada do primeiro par de luvas
- Retire o propé
- Retirada do avental e do segundo par de luvas
- Agarre o avental pela frente e afaste-o do corpo para que os laços de trás se quebrem, tocando-o apenas com as mãos enluvadas.
- Ao remover, dobre ou enrole o avental de dentro para fora em um pacote.
- Retire as luvas ao mesmo tempo, apenas tocando no interior das mesmas.
- Higienizar as mãos
- Saia do quarto do paciente
- Retirada dos óculos ou face shield
- Retirada da touca
- Retirada da máscara (remova a máscara por trás sem tocar na parte da frente)
- Lavar as mãos ou usar um sanitizador de mãos à base de álcool imediatamente após a remoção de todos os EPI.
Assista a este vídeo feito pelo grupo de Infectologia do Hospital Marieta Bornhausen de Itajaí, mostrando a correta sequencia de colocação e retirada dos EPIs. Única ressalva seria a colocação do avental impermeável, se disponível.
Estratégias para uso estendido das máscaras N95 na falta de EPIs
Muito se discute a respeito das máscaras tipo respiradores, visto que não há disponibilidade em larga escala e os casos no Brasil ainda vão aumentar bastante.
Neste contexto, existem algumas opções para reuso e/ou uso estendido das máscaras N95/PFF2 [8]:
- Utilizar um protetor facial (face shield) para barrar as gotículas.
- Utilizar uma máscara cirúrgica descartável tentando cobrir a maior parte da máscara N95.
Uma outra alternativa seria utilizar a máscara tipo respirador durante o turno inteiro, sem tirar e por entre os exames, descartando-a ao final do turno (existem métodos off label para esterilizar a máscara, vide abaixo). No entanto, esse tipo de máscara gera desconforto e na prática é muito difícil utilizar o turno inteiro sem levar a mão no rosto para ajustá-la de vez em quando.
Em breve teremos mais um post dedicado às máscaras N95. Aguarde!
Como retirar e higienizar o protetor facial (face shield)?
- Limpe uma superfície com um germicida sobre a qual o protetor facial será colocado.
- Com as mãos higienizadas ou com luvas limpas, retire o face shield
- Limpe o face shield com germicida, ou água e sabão ou álcool 70%
- Coloque-o sobre a superfície que você preparou
- Higienização das mãos
- Retirada da máscara tipo respirador
- Higienização das mãos
Assista a este video sobre cuidados com o face shield, incluindo colocação, retirada e higienização:
Na impossibilidade de adquirir um protetor facial alguns profissionais estão fabricando conforme o video abaixo, disponibilizado pela Dra. Ana Paula Kotinda, residente do serviço de endoscopia do HCFMUSP:
Link para documento do CDC com intruções para colocação e retirada dos EPIs (documento gerado pré-COVID): https://www.cdc.gov/hai/pdfs/ppe/ppe-sequence.pdf
REFERÊNCIAS
- WHO – Rational use of personal protective equipment for coronavirus disease 2019 (COVID-19). Disponível em https://apps.who.int/iris/bitstream/handle/10665/331215/WHO-2019-nCov-IPCPPE_use-2020.1-eng.pdf
- Interim Infection Prevention and Control Recommendations for Patients with Suspected or Confirmed Coronavirus Disease 2019 (COVID-19) in Healthcare Settings. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/infection-control/control-recommendations.html
- Endoscopy activity and COVID-19: BSG and JAG guidance. Disponível em:https://www.bsg.org.uk/covid-19-advice/endoscopy-activity-and-covid-19-bsg-and-jag-guidance/
- Recomendações SOBED para Endoscopia Segura durante a pandemia por Coronavírus. Disponível em: https://www.sobed.org.br/sobed-comunica/noticias/single/nid/atualizacao-003-das-recomendacoes-sobed-para-endoscopia-segura-durante-a-pandemia-por-coronavirus/
- Soetikno R, Teoh AYB, Kaltenbach T. Considerations in performing endoscopy during the COVID-19 pandemic. Gastrointestinal endoscopy (epub ahead of print)
- WEO recommendations on digestive endoscopy and the COVID-19 pandemic. Disponível em http://www.worldendo.org/2020/03/24/weo-advice-on-digestive-endoscopy-and-the-covid-19-pandemic/
- Vavricka SR, Tutuian R, Imhof A, Wildi S, Gubler C, Fruehauf H, Ruef C, Schoepfer AM, Fried M. Air suctioning during colon biopsy forceps removal reduces bacterial air contaminatio in the endoscopy suite. Endoscopy. 2010 Sep;42(9):736-41
- Recommended Guidance for Extended Use and Limited Reuse of N95 Filtering Facepiece Respirators in Healthcare Settings. Disponível em: https://www.cdc.gov/niosh/topics/hcwcontrols/recommendedguidanceextuse.html