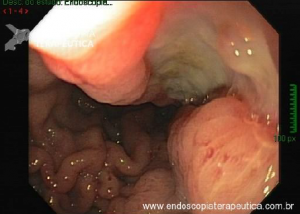
Pólipos colorretais menores que 20 mm: guia de sobrevivência para o endoscopista
Recentemente foi publicado na seção Masters of Endoscopy da revista
Endoscopy o artigo intitulado “Como nós ressecamos
pólipos colorretais menores que 20 mm”, dos autores
Douglas K. Rex, da Universidade de Indiana, e Evelien Dekker, da Universidade de Amsterdam. A seguir, faremos um
resumo dos principais pontos destacados.
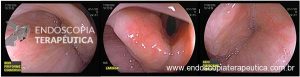
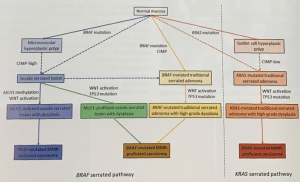
Primeiramente, uma avaliação minuciosa das lesões é necessária para diferenciar o tipo
de lesão (adenoma x pólipo serrilhado) e avaliar o risco de câncer, que está fortemente associado com o tamanho da
lesão.
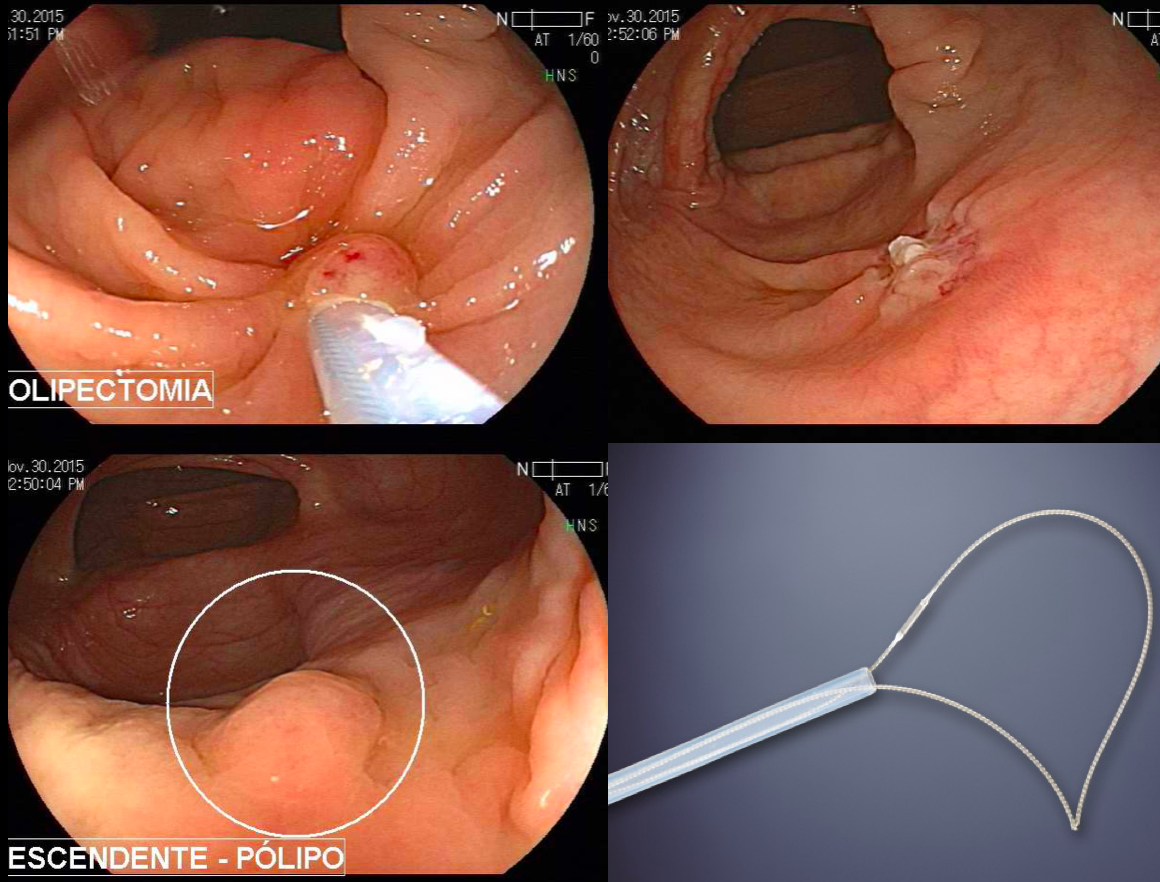
Os autores afirmam que a retirada de lesões com pinça a frio, às vezes, é apropriada se as lesões forem de 1 a 2 mm, já que podem ser totalmente
retiradas em uma “mordida”, porém eles usam alça a frio para quase
todas as lesões menores que 10 mm. Para adenomas convencionais de 10 a 19 mm, eles usam primariamente alça
diatérmica. Mucosectomia,
preferencialmente em bloco, é apropriada para adenomas convencionais volumosos não granulares e adenomas não
granulares com depressão nessa faixa de tamanho. Para pólipos serrilhados sésseis de 10 a 19 mm, a abordagem deles
difere até certo ponto: um usa primariamente mucosectomia a frio, e o
outro usa primariamente mucosectomia convencional com alça
diatérmica.
Os pólipos
e as lesões planas menores que 20 mm constituem 95% de todas as neoplasias colorretais e, portanto, compreendem a
maioria esmagadora das ressecções realizadas pelos colonoscopistas.
Para detectores de alto nível, cerca de 80% das lesões são menores que 5 mm e 90% são
menores que 10 mm. O risco de câncer é insignificante para lesões menores que 5 mm, muito abaixo de 1% para lesões
de 6 a 9 mm e cerca de 1 a 2% para lesões entre 10 e 19 mm.
Essencialmente, todas as lesões colorretais benignas menores 20 mm, com exceção de
lesões que se estendem para o apêndice ou íleo terminal, são endoscopicamente ressecáveis, com riscos e custos
menores que o tratamento cirúrgico. Os autores afirmam que referenciar lesões benignas menores que 20 mm para
tratamento cirúrgico aumenta o custo e expõe o paciente a um risco desnecessário. Assim, o colonoscopista atualizado deve ser apto a
realizar ressecções efetivas e seguras desses tipos de lesões.
Definições
| Lesões diminutas | 1-5 mm |
| Lesões pequenas | 6-9 mm |
| Lesões médias | 10-19 mm |
| Lesões grandes | > 20 mm |
| Lesões gigantes | > 30 mm |
Avaliação dos pólipos
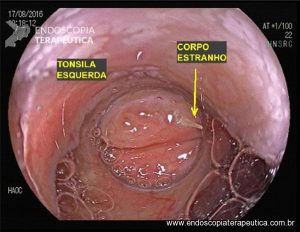
- Para uma tomada de decisão ótima na realização de uma
polipectomia, a superfície de todas as lesões deve ser avaliada com o intuito de predizer a invasão profunda
da submucosa antes da ressecção; - Além disso, a diferenciação endoscópica dos pólipos
serrilhados com os adenomas convencionais pode mudar a abordagem na ressecção; - Enfim, a lesão deve ser delineada com precisão;
- Por todos esses aspectos, para um diagnóstico ótimo,
endoscópios de alta definição e cromoscopia (com corantes ou virtual) têm provado seu mérito.
Base das técnicas
Os autores discorrem sobre a “revolução a frio” nas técnicas de polipectomia, isso é particularmente verdade para pólipos menores que 10
mm bem como para algumas lesões maiores. A ressecção a frio, isto é, sem aplicação de eletrocautério, é tão segura quanto a ressecção quente (com
eletrocautério) e tem um risco menor de sangramento tardio e perfuração.
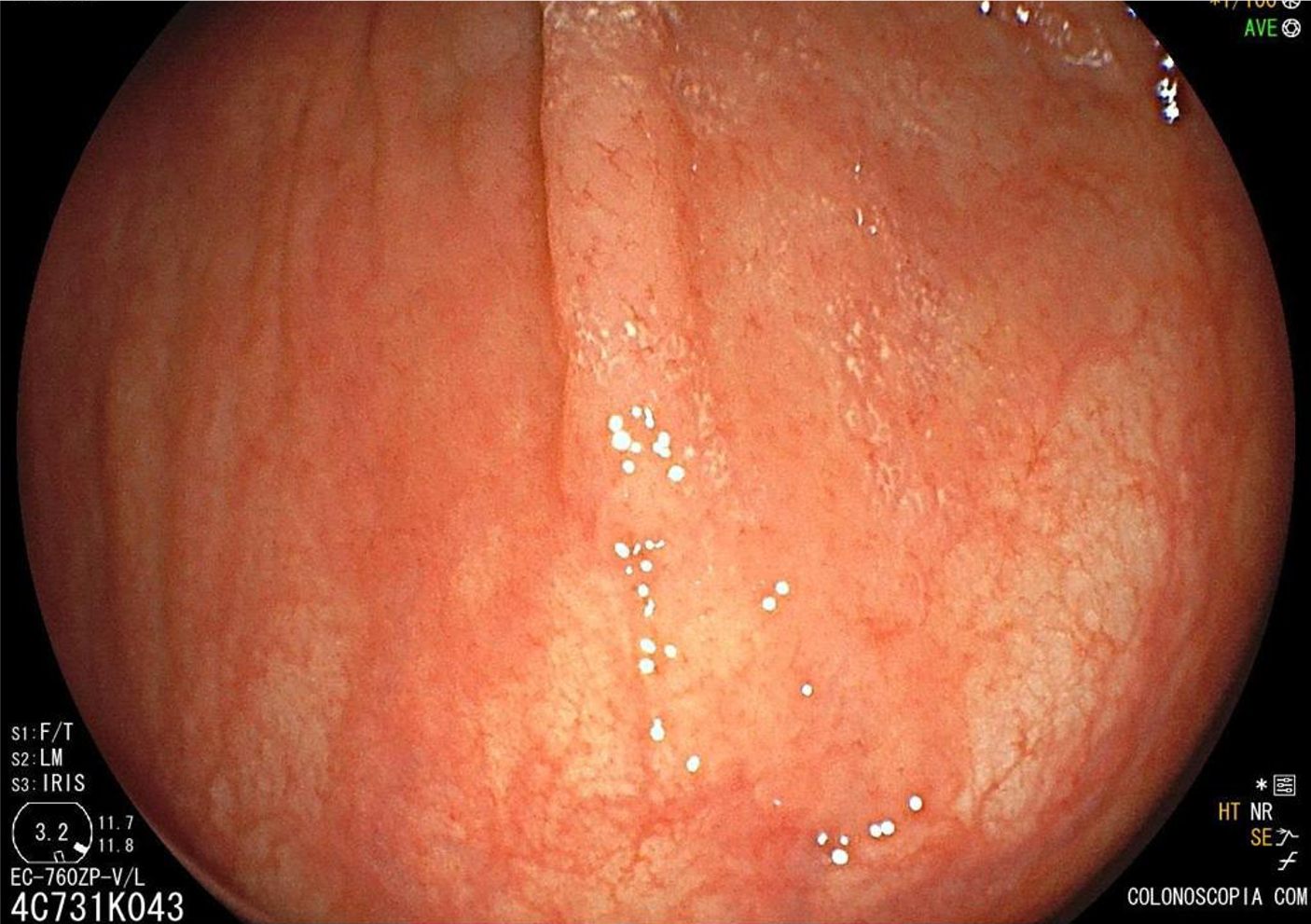
Lesões diminutas (menores que 5 mm)
-
- A ferramenta primária para ressecção de
pólipos diminutos é a alça a frio. Uma alça de tamanho
pequeno (aproximadamente 10 mm de diâmetro) e que seja rígida e fina facilitará sua colocação e pega
do tecido; - Incluir de 1 a vários milímetros de tecido
normal ao redor da lesão é crucial para garantir a ressecção completa; - Os autores usam alça a frio como abordagem
preferencial para todas as lesões de 1 a 5 mm, embora, segundo eles, a pinça a frio seja aceitável
para pólipos de 1 a 2 mm, particularmente se forem planos, muito difíceis de pegar ou se a lesão não
puder ser colocada na posição de 5 horas; - Como regra geral, nunca se usa pinça a frio
para ressecção em piece meal, pois ela é menos efetiva e menos eficiente que a ressecção com
alça; - Segundo os autores, a utilização de alça com
eletrocautério não tem papel nos pólipos diminutos, pois submete o paciente a um risco desnecessário
de sangramento e perfuração, e a hot biopsy,
frequentemente, é ineficaz para ressecção
completa; - Atualmente, a pinça de hot biopsy tem uma função nas ressecções de
pólipos: para retirar tecido residual plano ou fibrótico pós-mucosectomia.
- A ferramenta primária para ressecção de
Ressecção de pólipos pequenos (6 a 9 mm)
- Para esse grupo de lesões, nem pinça a frio nem
hot biopsy têm papel
algum; - A ferramenta primária novamente, segundo os autores, é
a alça a frio. Pela necessidade de se pegar um grande pedaço
de tecido, ocasionalmente, é necessário serrar o tecido através da submucosa com a alça a frio ou cortá-lo
puxando contra a ponta do colonoscópio. Isso, às vezes, leva a um “cordão” de submucosa, que consiste de
submucosa e, às vezes, de muscular da mucosa. Esse “cordão” não requer amostras de biópsias ou
tratamento; - O uso do eletrocautério também é apropriado para pólipos pequenos selecionados como os
sésseis volumosos ou pediculados, afirmam os autores. Entretanto, eles usam alça a frio para quase todo conjunto
de pólipos de 6 a 9 mm.
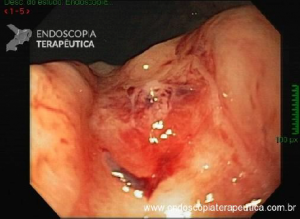
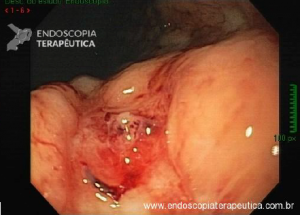
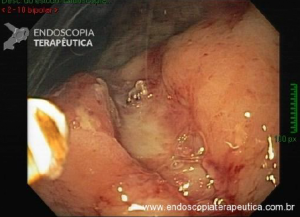
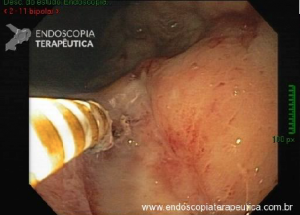
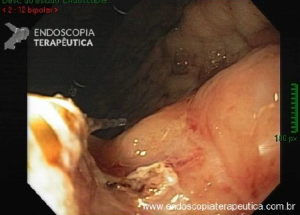
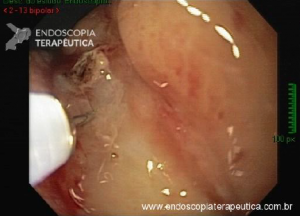
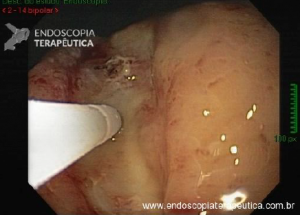
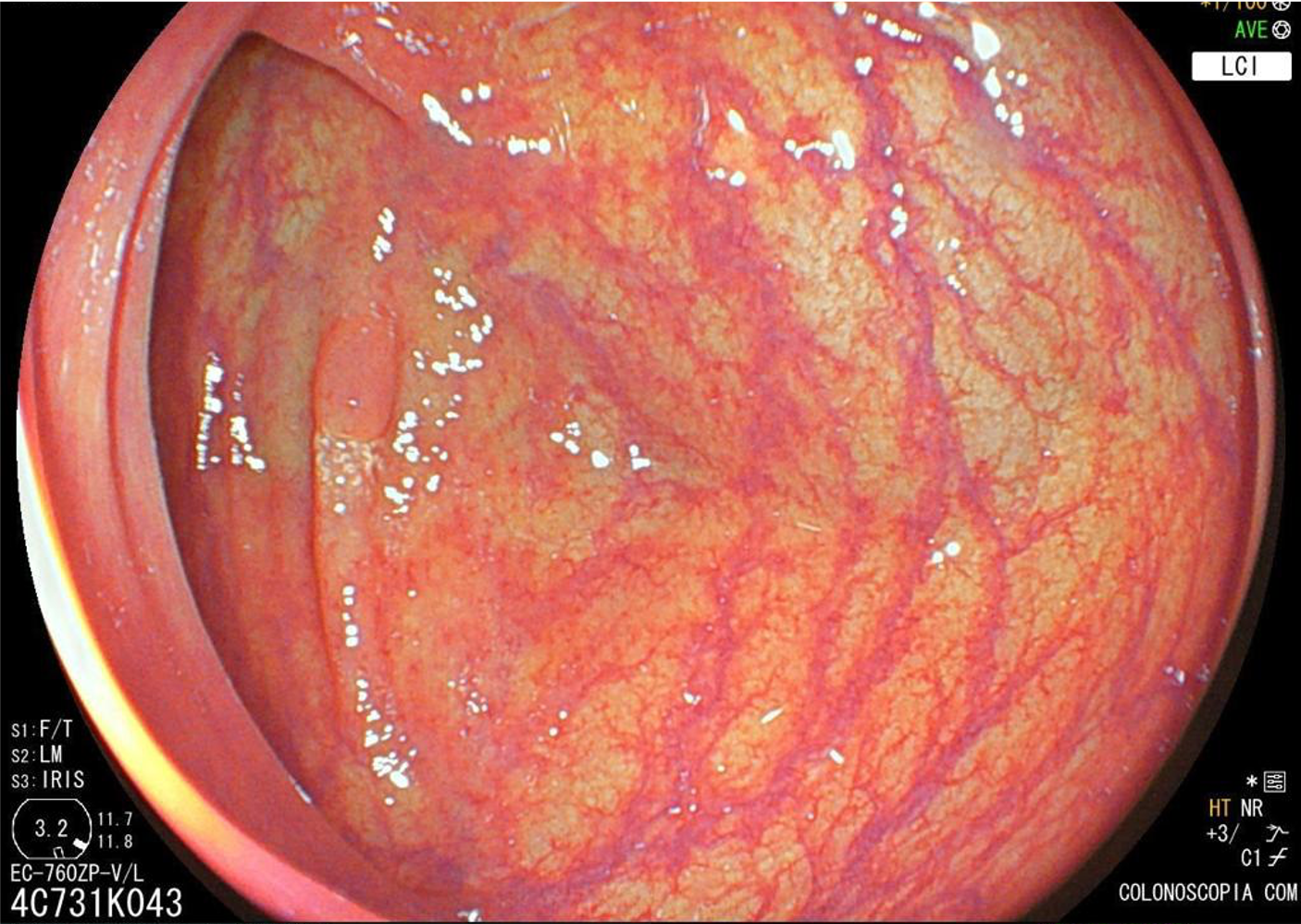
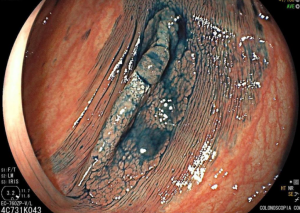
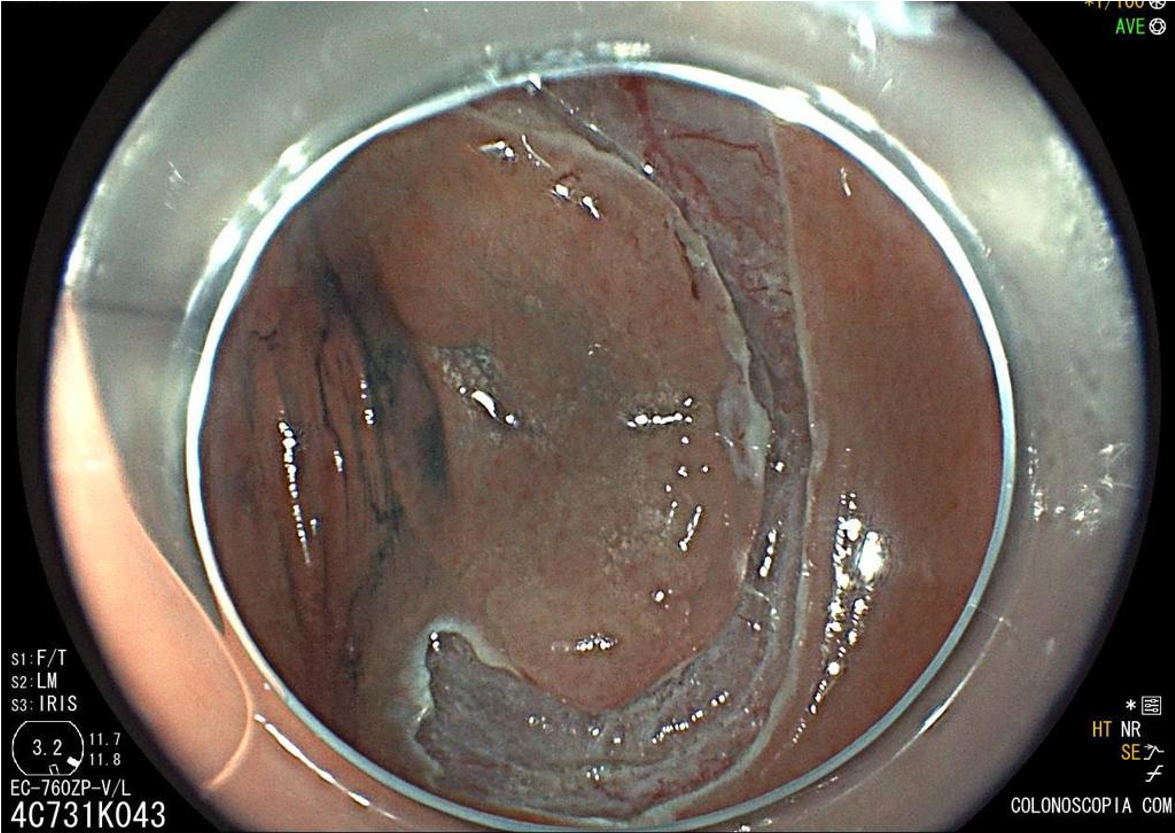
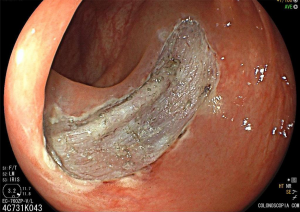
Ressecção de pólipos serrilhados médios (10–19 mm)
- A segurança da alça a frio pode ser percebida na
ressecção de lesões serrilhadas sésseis maiores que 10 mm de tamanho. Uma endoscopia de alta definição é
essencial para garantir a avaliação de todas as criptas serrilhadas e sua excisão com margem ampla. A
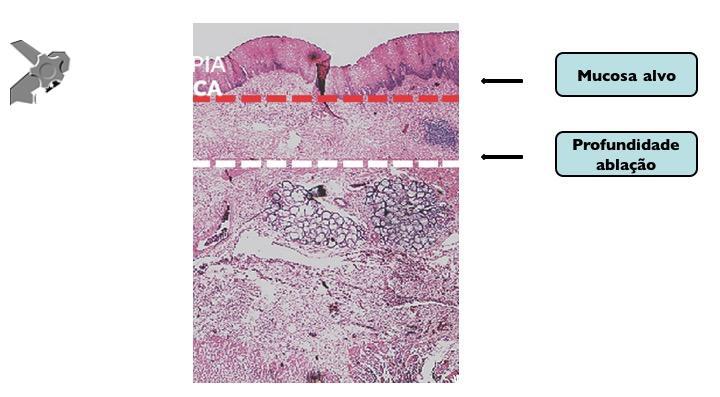
injeção submucosa com contraste antes da ressecção (mucosectomia) melhora sobremaneira a visualização das
criptas serrilhadas da lesão. Essa técnica, chamada “mucosectomia a frio” (cold
EMR) pode ser considerada para pólipos serrilhados de 10
a 19 mm de tamanho; - Um dos autores (D.K.R) usa mucosectomia a frio para
maioria dos pólipos serrilhados médios, enquanto o outro (E.D) prefere com eletrocautério. Essas diferenças
na prática são consistentes com a atual evidência limitada a respeito da melhor prática; - Outros autores usam ressecção a frio em piece meal
para pólipos serrilhados maiores que 10 mm sem injeção submucosa.
Estudos adicionais são necessários para esse tipo de prática.
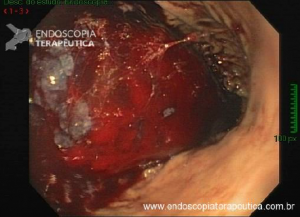
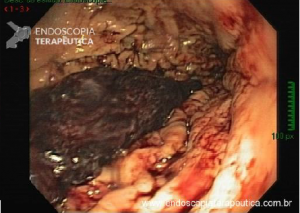
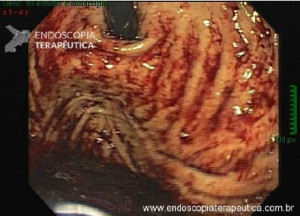
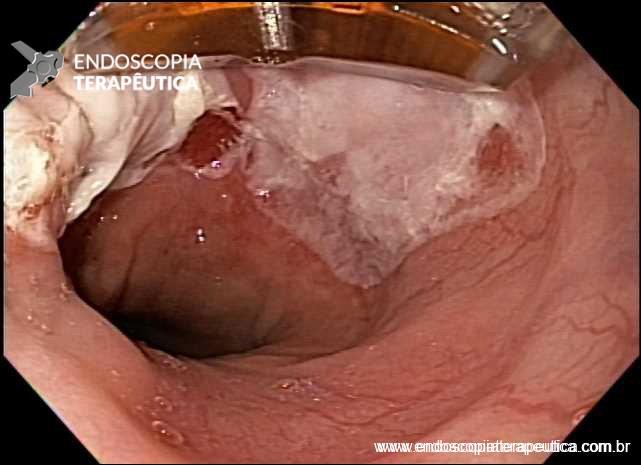
Vídeo: exemplo de mucosectomia a frio
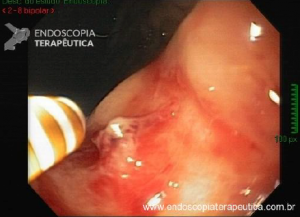
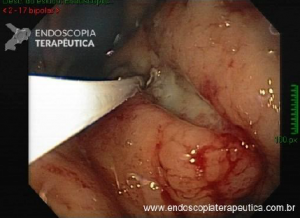
Ressecção de adenomas convencionais médios (10–19 mm)
- As técnicas para ressecção de adenomas convencionais
de 10 a 19 mm ainda estão evoluindo. Particularmente, as taxas de ressecção completa adequada para adenomas
convencionais maiores que 10 mm usando ressecção em piece meal
com alça a frio e mucosectomia a frio ainda não estão
estabelecidas; - Os autores revelam que usam uma mistura de abordagem
para adenomas dessa faixa de tamanho, dependendo do seu tamanho e morfologia; - Para lesões médias pediculadas, é preferível alça
diatérmica. Essas lesões devem sempre ser ressecadas em bloco, preferencialmente, com a alça posicionada
pelo menos abaixo da metade do pedículo, para aumentar a chance de ressecção com margens livres em caso de
câncer inesperado. Muitas dessas lesões estão localizadas no cólon sigmoide, e o posicionamento da alça pode
ser facilitado pela mudança de posição do paciente ou preenchendo a luz de água; - Para lesões pediculadas, eles preferem coagulação em
baixa potência usando corrente controlada. A terapêutica profilática com loops, injeção de adrenalina ou
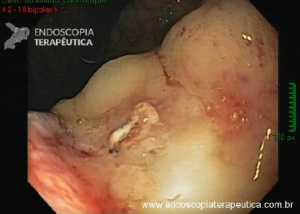
clipes é recomendada; - Lesões não pediculadas devem ser avaliadas para
achados endoscópicos de invasão profunda da submucosa, como ulceração, deformidade das criptas e do padrão
vascular; - As lesões com esses achados têm indicação de
tratamento cirúrgico. Na ausência desses achados, outros achados endoscópicos, como morfologia não granular
(particularmente se houver depressão ou se a lesão for séssil e volumosa), estão associados com maior risco
de invasão superficial da submucosa. Se ressecadas em bloco, os pacientes com essas lesões talvez possam ser
capazes de evitar cirurgia; - Portanto, adenomas não granulares entre 10 e 19 mm,
particularmente se eles são volumosos ou deprimidos, devem ser ressecados em bloco, usando eletrocautério
sempre que possível. A injeção submucosa reduz o risco e, frequentemente, facilita a ressecção em
bloco; - Para mucosectomia, os autores geralmente preferem
corrente de corte predominante. Existem outras abordagens como a realização de dissecção endoscópica da
submucosa (ESD).
Conclusão
- A tendência, em geral, na ressecção de lesões
colorretais menores que 20 mm é usar sempre que possível alça ao invés de pinça, e isto se aplica mesmo para
lesões de 1 a 5 mm; - Para lesões menores que 10 mm, a ressecção a frio, sem
eletrocautério, é tão ou muito próxima em termos de efetividade ao uso do eletrocautério e evitam-se os
riscos; - Estudos iniciais com técnicas a frio indicam que seu
resultado é efetivo na erradicação de pólipos serrilhados maiores que 10
mm; - A abordagem dos autores nesse tipo de lesão varia, o
que reflete a limitada evidência disponível. Estudos controlados de mucosectomia x mucosectomia a frio x
ressecção em piece meal a frio sem injeção são necessários; - As técnicas a frio não são estabelecidas como efetivas
para adenomas convencionais maiores que 10 mm. Na maioria dos adenomas convencionais de 10 a 19 mm, a
ressecção com alça usando o eletrocautério permanece o padrão ouro; - Para lesões de crescimento lateral (LST) não
granulares de 10 a 19 mm, a ressecção em bloco deve ser a meta, particularmente para lesões com achados
associados a alto risco de invasão profunda; - Lesões pediculadas do cólon são em sua maioria
adenomas. Quando maiores que 10 mm, elas devem ser removidas em bloco e utilizando alça com
eletrocautério.
E vocês, na prática clínica diária, utilizam alça mesmo para lesões menores que 5
mm? Sentem segurança em realizar “mucosectomia a frio” sem uso de corrente?
Como citar este artigo:
Arraes L. Pólipos colorretais menores que 20 mm. Guia de Sobrevivência para o
endoscopista. Endoscopia Terapêutica; 2021. Disponível em:
Pólipos colorretais menores que 20 mm: guia de sobrevivência para o endoscopista
Referência:
Rex DouglasK et al. How we resect colorectal polyps < 20 mm in size. Endoscopy.
2018
Acesse o Endoscopia Terapêutica para tomar contato
com mais artigos comentados, assuntos
gerais, casos
clínicos, quizzes, classificações e mais!