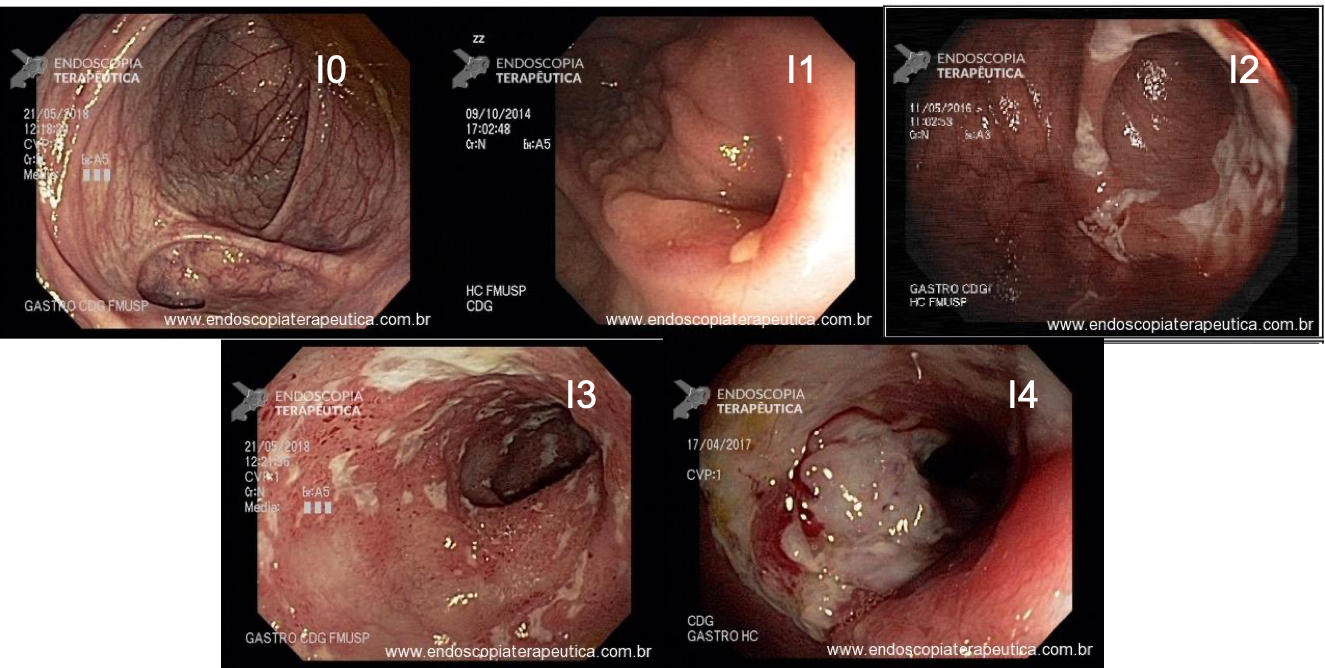
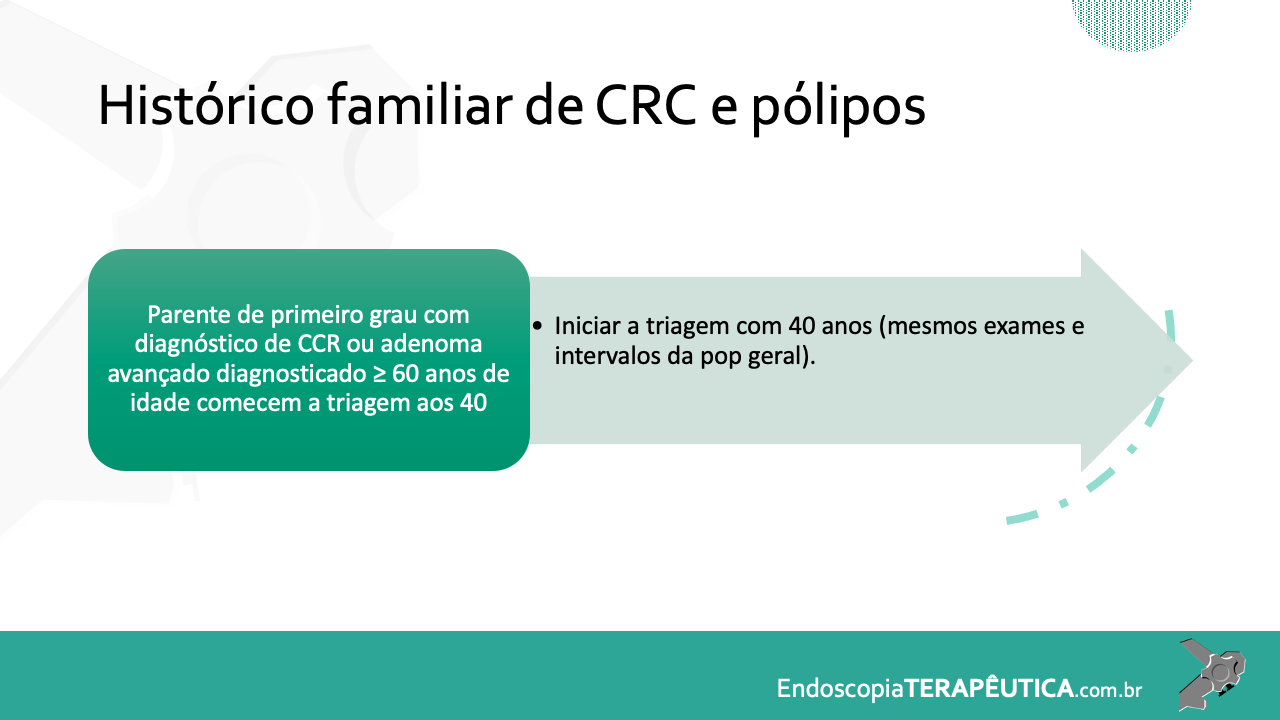
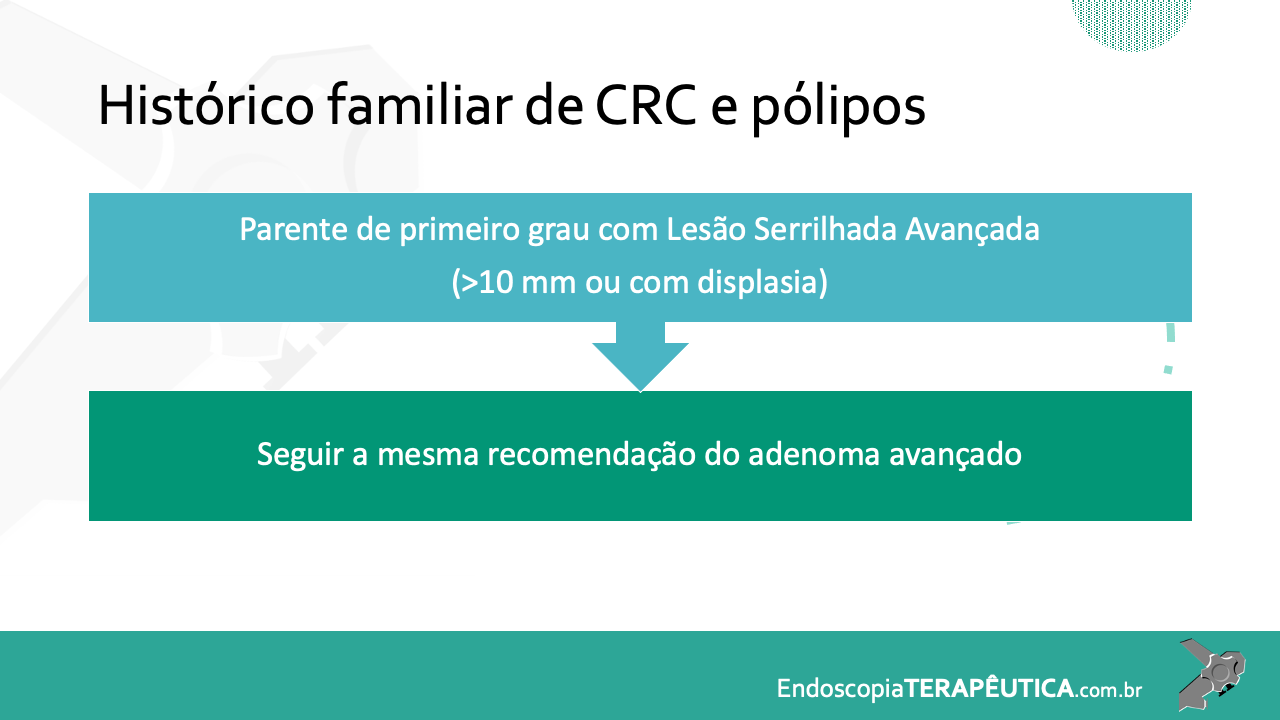
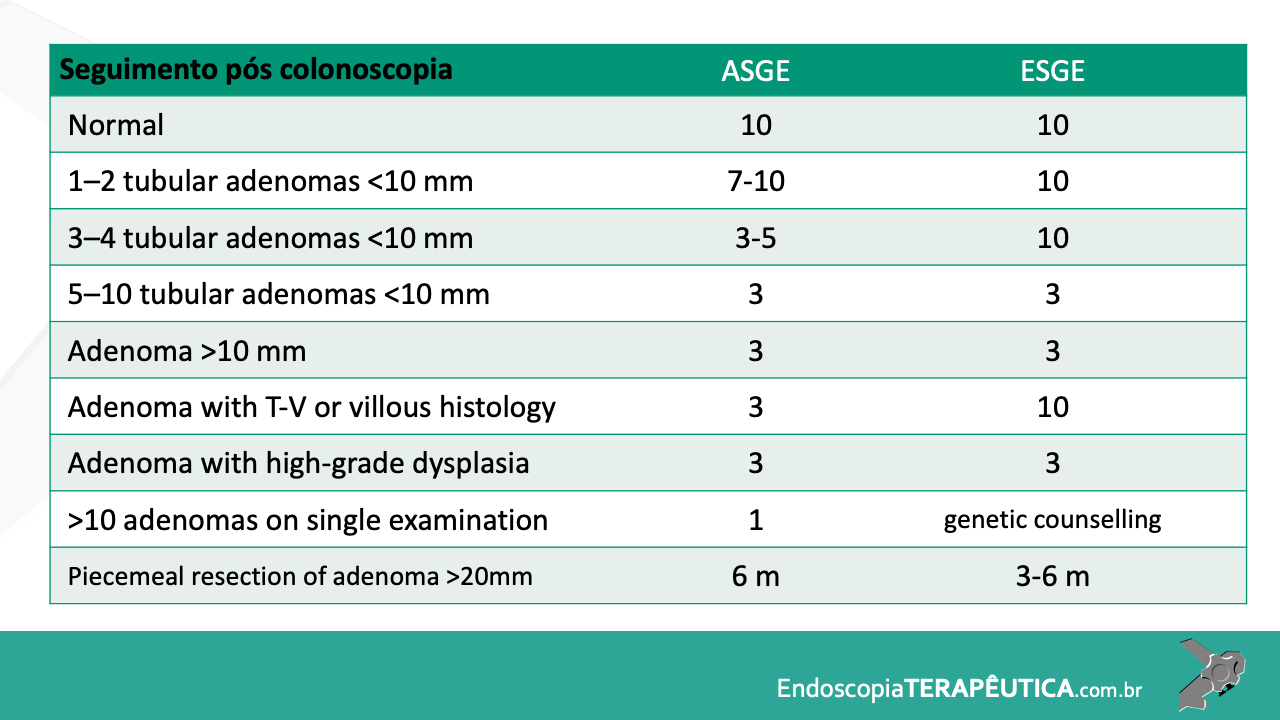
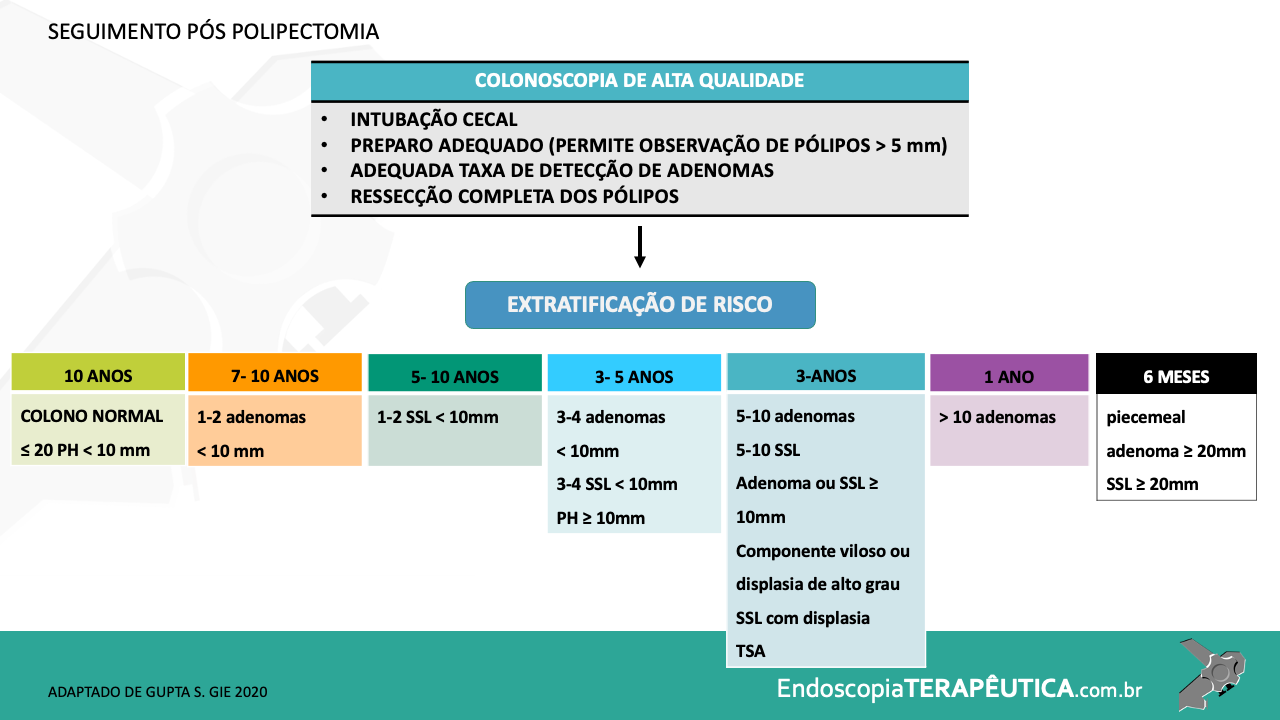
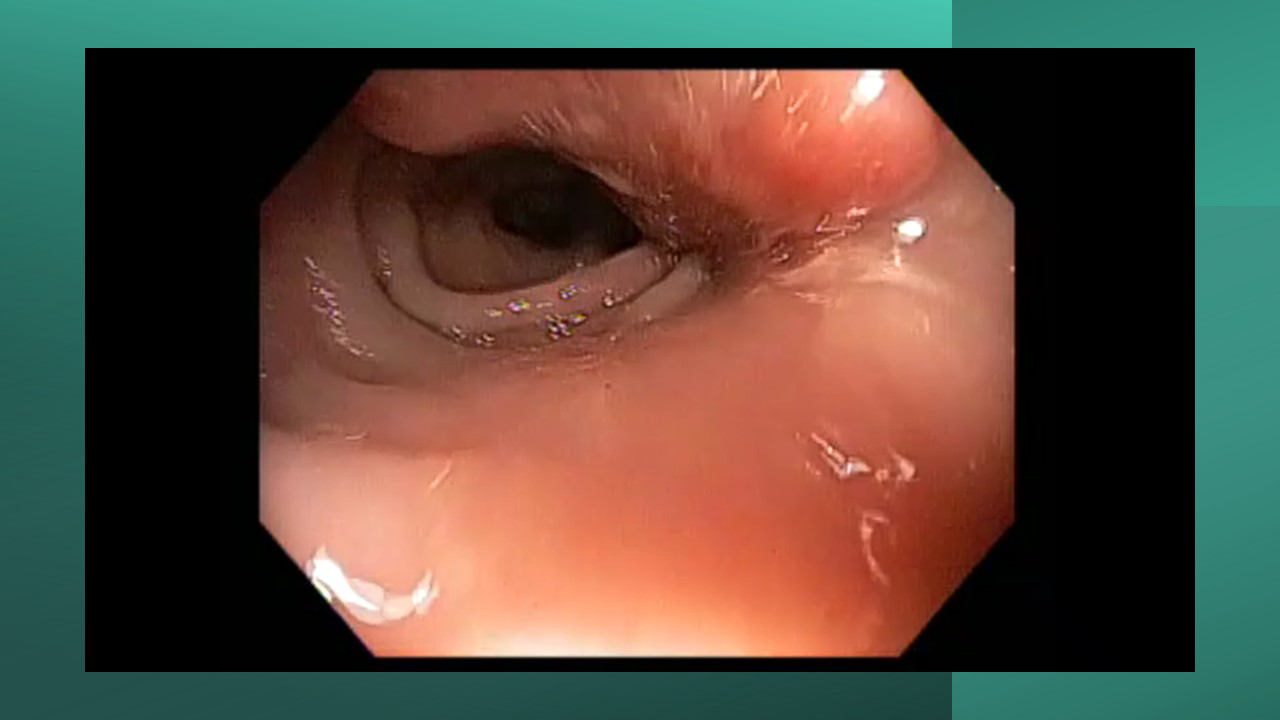
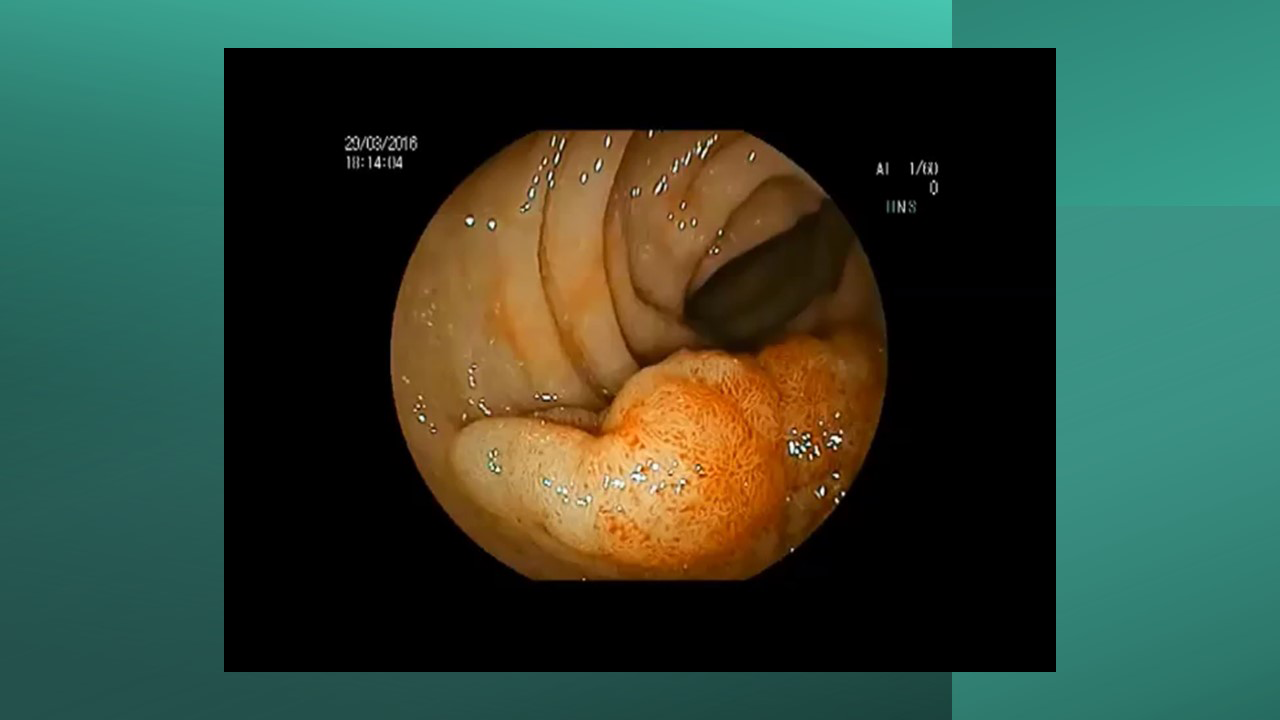
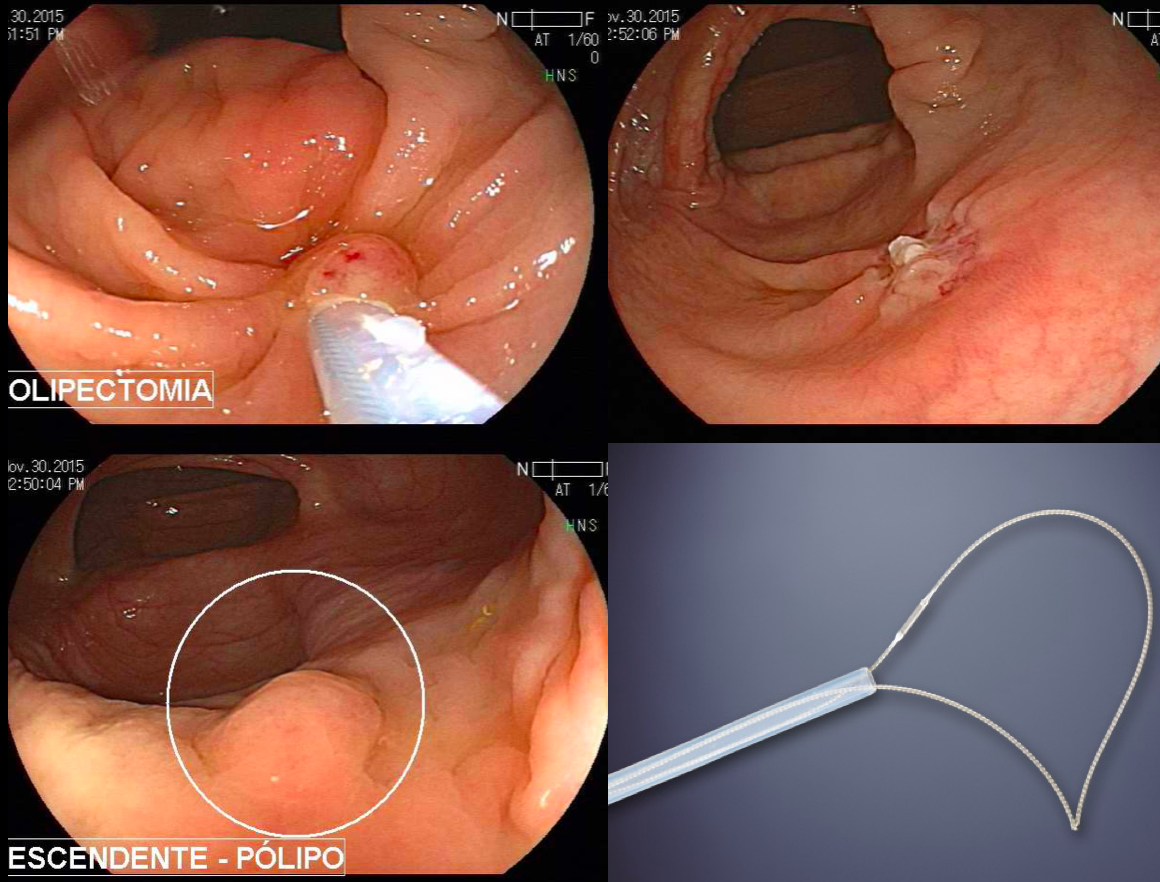
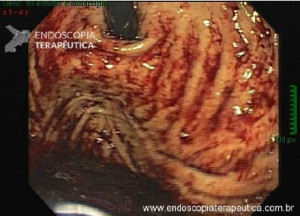
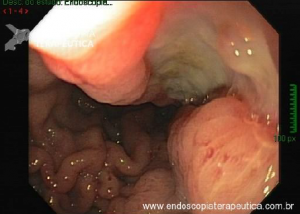
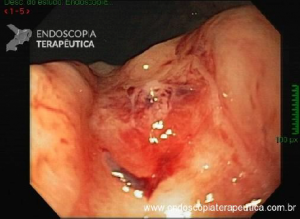
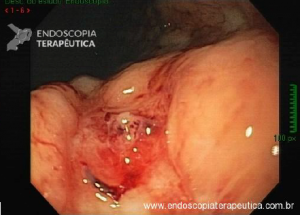
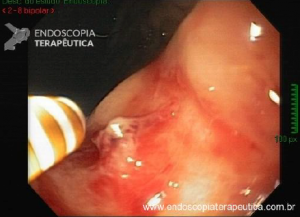
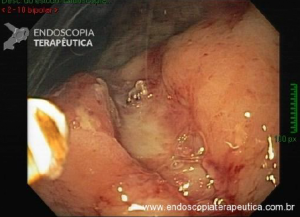
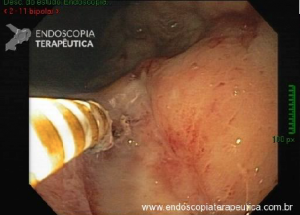
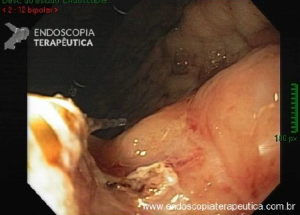
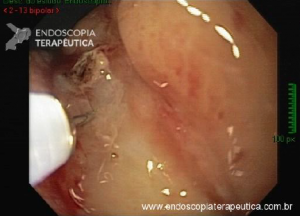
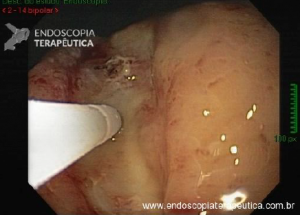
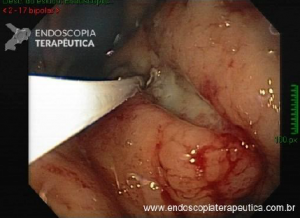
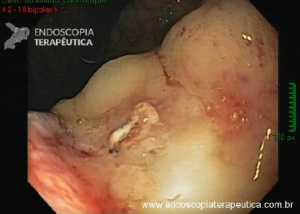
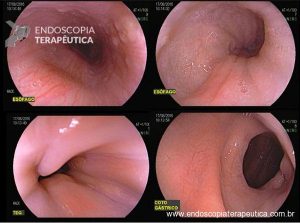
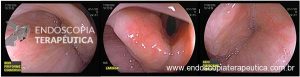
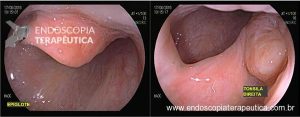
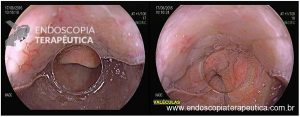
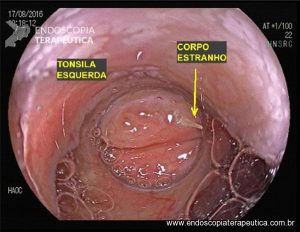
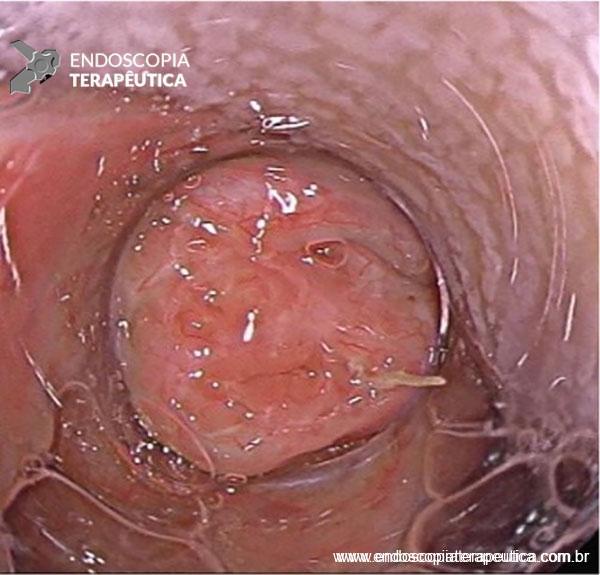
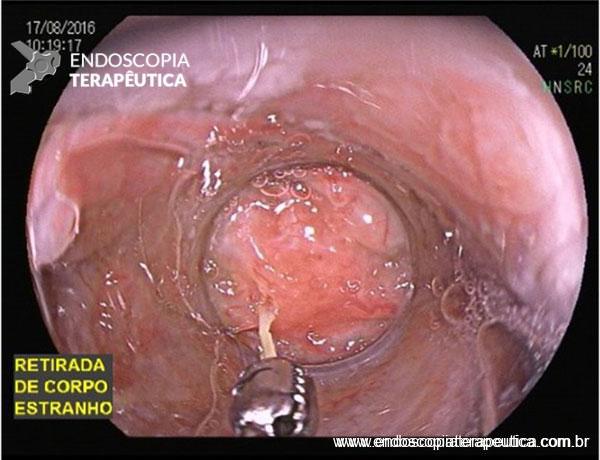
Os tumores localizados na papila duodenal maior (ou ampola de Vater) são um grupo de neoplasias pouco comum no trato gastrointestinal, no entanto, um estudo mostra um aumento da incidência anual nos últimos 30 anos nos Estados Unidos, situando-se, atualmente, em torno de 3.000 casos/anoi. Dentre os tipos histológicos, o adenocarcinoma e o adenoma representam mais de 95% dos casos. Embora o adenocarcinoma da papila duodenal maior seja usualmente a lesão de maior prevalência1, o surgimento de casos de adenomas incidentais nessa topografia (por ocasião de um exame endoscópico gastroduodenal de rotina, por exemplo) tende a mudar essa estatísticaii. Em uma série brasileira recente de pacientes submetidos à papilectomia endoscópica (PE), houve um aumento do número de procedimentos nos últimos 5 anos, com predomínio de adenomas com displasia de alto grauiii.
Os tumores dessa complexa região anatômica, onde confluem os ductos biliar e pancreático, podem ser classificados como benignos, pré-neoplásicos (por exemplo, adenomas) e malignos. O adenoma de papila duodenal maior é considerado uma lesão pré-neoplásica, pois tende a seguir a sequência adenoma-adenocarcinoma de maneira semelhante ao câncer colorretal, com taxas de transformação para adenocarcinoma variando entre 25-85%iv. Os adenomas podem ser esporádicos ou no contexto de síndromes genéticas, como o câncer colorretal hereditário não polipóide e a polipose adenomatosa familiar (PAF), em que até 80% dos pacientes desenvolverão tal condição durante a vidav. Os sintomas, quando presentes, são geralmente inespecíficos, como dor abdominal, mal-estar, náusea, vômito e perda ponderalvi; a icterícia está mais frequentemente associada a lesões invasoras.
Por serem, muitas vezes, diagnosticados incidentalmente e não apresentarem sintomas, os adenomas da papila duodenal maior representam hoje um dilema diagnóstico e terapêutico. A abordagem terapêutica desses tumores é tradicionalmente cirúrgica e, embora permita a remoção completa da lesão, está associada a taxas consideráveis de morbidade e mortalidade (9-14% e 1-9%, respectivamente)vii. A excisão local por via endoscópica (PE) ou por ampulectomia cirúrgica pode ser empregada para lesões precoces, isto é, adenoma com acometimento neoplásico superficial (displasia de alto grau) sem sinais de invasão da muscular própria (estadiamento oncológico clínico pré-operatório: T0/T1aN0M0). A duodenopancreatectomia (procedimento de Whipple) tem sido reservada para tumores de papila com suspeita para invasão para a muscular própria, tendo como sinais macroscópicos ulceração, infiltração, friabilidade e endurecimento à endoscopia.
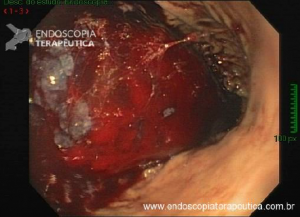
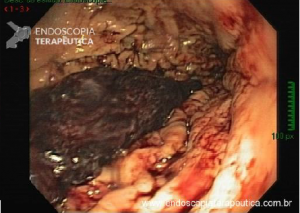
A PE, inicialmente proposta em 1993viii como uma alternativa de salvamento para pacientes sem condição de cirurgia, vem destacando-se mundialmente e na América Latina como uma opção terapêutica menos invasiva no tratamento de lesões precoces que acometem a papila duodenal maior3 ix. Embora não exista consenso sobre quais adenomas devem ser acompanhados ou ressecados por via cirúrgica ou endoscópica, recomenda-se a PE em adenomas tubulares, túbulo-vilosos ou vilosos na presença de displasia de alto grau (DAG) 7. Em duas revisões sistemáticas e meta-análise publicadas até o momento, avaliando-se o tratamento cirúrgico comparado ao endoscópico, a ressecção cirúrgica local está associada a maiores taxas de ressecção completa e menor recidivax xi. Quando incluído o procedimento de duodenopancreatectomia na avaliação, nota-se um maior número de complicações 11. Em ambos estudos, é notória ausência de estudos prospectivos randomizados e elevada heterogeneidade. Na meta-análise mais recente (2020)11, a taxa de ressecção endoscópica completa (ressecção oncológica R0) para PE foi 76.6% (IC 71.8–81.4%), a taxa de eventos adversos global 24.7% (IC 19.8–29.6%) e a taxa de recidiva 13.0% (IC 10.2–15.6%), esta para uma média de 44 meses de seguimento. As complicações que necessitam alguma intervenção associadas à PE, em ordem de frequência, são sangramento (intra ou pós-operatório), pancreatite e perfuração. Colangite e estenose de papila são outras complicações reportadas, de menor chance. A mortalidade é rara, sendo reportada como menos de 1%4. Na maior série comparativa (caso-controle) publicada até o momento, envolvendo 180 pacientes submetidos à técnica endoscópica (130 pacientes) versus cirurgia para excisão local de adenomas da papila de Vaterxii, os resultados clínicos foram semelhantes. A cirurgia apresentou maior número de eventos adversos (EA), e a PE maior chance de recidiva quando nesta houve necessidade de mais de uma sessão de tratamento endoscópico. As lesões desfavoráveis para tratamento endoscópico foram lesões maiores que 3.5 cm e com extensão para o ducto biliar. A PE, portanto, é recomendada como a principal opção de excisão local para adenomas menores que 4 cm, profundidade de invasão confinada à mucosa e submucosa e com extensão ductal menor que 1 cm 7.
A biópsia de papila duodenal maior permanece o padrão-ouro para decisão terapêutica, em que recomenda-se a obtenção de, ao menos, 6 espécimes e/ou coleta de fragmentos após 10 dias de uma esfincterotomia pós-drenagem biliar de tumor ampular obstrutivo7, bem como avaliação por patologista experiente em doenças biliopancreáticas. Entretanto, a biópsia, isoladamente, oferece baixa sensibilidade para diagnóstico de adenoma e de carcinoma, em que se pode subestimar a lesão em até 23% dos casosxiii, e que, na suspeita de neoplasia, recomenda-se a ressecção completa da lesão. Inversamente, as múltiplas variações morfológicas endoscópicas histopatológicas de uma papila duodenal maior normal podem ser erroneamente interpretadas como adenomas. Esses dilemas diagnósticos são evidenciados quando se estuda a população de pacientes submetidos à PE, em que, atualmente, apenas cerca de 13 a 36% deles apresentam correlação histopatológica com o espécime cirúrgico ressecadoxiv xv. Nesse contexto, pode haver tecido adenomatoso sem displasia (podendo ser interpretado como falso positivo para DAG ou eliminação do foco de displasia por ocasião da biópsia) e neoplasia invasora (falso negativo para adenocarcinoma) no espécime cirúrgico. Em uma série nacional recente, houve baixa correlação entre o diagnóstico pré e pós-PE para adenocarcinoma invasor e presença de DAG3. Com o aumento da experiência na abordagem dessas lesões, espera-se que essa correlação venha a ser equilibrada. Em complementação ao diagnóstico, houve um aprimoramento das técnicas endoscópicas de estadiamento, como o ultrassom endoscópico (USE), cromoscopia e magnificação endoscópica4. De fato, a utilização do USE parece ser um método útil no estadiamento de lesões precoces, com taxa de detecção de malignidade para lesões suspeitas de 82%xvi.
Com relação ao aspecto técnico, a PE propõe a ressecção da mucosa e submucosa duodenal na topografia dos anexos anatômicos da papila duodenal maior, incluindo o aparato esfincteriano e tecido ao redor do ducto biliar e os orifícios do ducto pancreático. A principal vantagem desse procedimento comparado à ampulectomia cirúrgica é evitar o acesso abdominal com duodenotomia e manipulação da região periampular, com ressecção de tecido pancreático e reinserção separada do ducto biliar comum e do ducto pancreático principal na parede duodenalxvii. Atualmente, tem sido descrito a ressecção endoscópica completa de tumores ampulares de até 4-5 cm de extensão lateral, desde que restritos à submucosa e com infiltração intraductal menor que 1 cm, mantendo taxas de sucesso elevadas e morbidade inferior às séries cirúrgicas.A técnica de PE tem como objetivo remover a lesão em bloco utilizando uma alça diatérmica, semelhante a um procedimento de mucosectomia endoscópica para adenomas colônicos. Com relação às técnicas utilizadas, as principais controvérsias são o uso de injeção submucosa antecedendo a ressecção com alça diatérmica e o uso de prótese pancreática profilática após a ressecção da lesão. Os argumentos para o uso de injeção submucosa são a redução no risco de sangramento quando associado à adrenalina e a criação de um coxim com separação das camadas superficial e profunda. Entretanto, essa etapa tem sido abolida por muitos centros por aumentar a dificuldade de apreensão da alça na lesão e o risco de pancreatitexviii. O benefício do uso de prótese pancreática como profilaxia para pancreatite, atualmente recomendado nesse contexto para pacientes de alto risco para pancreatite7 xix xx, vem sendo questionado em séries mais recentesxxixxii. O uso de próteses biliares não é incentivado de rotina7, podendo ser útil em caso de perfuração e sangramento com o intuito de compressão local e desvio da secreção biliar. Outras técnicas descritas, alternativamente, consistem na utilização de um fio guia transpapilarxxiii ou dissecção submucosa da margem lateralxxiv, empregados previamente à preensão e ressecção com alça diatérmica. Para casos de recidiva junto ao óstio, pode-se aplicar plasma de argônio e, quando biliar intraductal, pode-se recorrer à ablação endoscópica com radiofrequênciaxxv.
Conclusão
A papilectomia endoscópica é uma técnica endoscópica minimamente invasiva que permite a remoção tumoral completa de lesões ampulares precoces, na maioria dos casos, com taxas de eventos adversos aceitáveis.
Para saber mais sobre este tema, acesse o site Gastropedia clicando aqui!
Como citar este artigo
Bonin E.A. Papilectomia Endoscópica – Revisão da literatura. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/papilectomia-endoscopica–revisao-da-literatura
Referências
i Albores-Saavedra J, Schwartz AM, Batich K, Henson DE. Cancers of the ampulla of vater: demographics, morphology, and survival based on 5,625 cases from the SEER program. J Surg Oncol. 2009 Dec 1;100(7):598-605.
ii Chini P, Draganov PV. Diagnosis and management of ampullary adenoma: The expanding role of endoscopy World J Gastrointest Endosc. 2011 Dec 16; 3(12): 241–247.
iii Cathcart Jr NS, Souza RCA, Noda RW, Taglieri E, Ardengh JC, Bonin EA.endoscopic papillectomy for early ampullary neoplastic lesions – a case series analysis. Arq gastroenterol. 2020 jul-sep;57(3):300-305.
iv Ardengh JC, Kemp R, Lima-Filho ER, dos Santos JS. Endoscopic papillectomy: The limits of the indication, technique and results World J Gastrointest Endosc. 2015 Aug 10; 7(10): 987–994.
v Burke CA, Beck GJ, Church JM, van Stolk RU. The natural history of untreated duodenal and ampullary adenomas in patients with familial adenomatous polyposis followed in an endoscopic surveillance program. Gastrointest Endosc 1999; 49: 358-364
vi Cheng CL, Sherman S, Fogel EL, McHenry L, Watkins JL, Fukushima T,Howard TJ, Lazzell-Pannell L, Lehman GA. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc. 2004;60:757–64
vii ASGE Standards of Practice Committee, Chathadi KV, Khashab MA, Acosta RD, Chandrasekhara V, Eloubeidi MA, Faulx AL, Fonkalsrud L, Lightdale JR, Salztman JR, Shaukat A, Wang A, Cash BD, DeWitt JM. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc. 2015 Nov;82(5):773-81.
viii Binmoeller K.F., Boaventura S., Ramsperger K., Soehendra N. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest. Endosc. 1993;39:127–131.
ix Castaño Llano R, Ruiz Vélez MH, Sanín Fonnegra E, Erebrie Granados F, García Rendón LH, Núñez Cabarcas E. Experiencia local en la resección endoscópica de la papila. Rev Col Gastroenterol. 2007. Sep; 22( 3 ): 173-189.
x Mendonça EQ, Bernardo WM, Moura EG, Chaves DM, Kondo A, Pu LZ, Baracat FI. Endoscopic versus surgical treatment of ampullary adenomas: a systematic review and meta-analysis. Clinics (Sao Paulo). 2016 Jan;71(1):28-35.
xi Heise C, Ali EA , Hasenclever D, Auriemma F , Gulla A, Regner S, Gaujoux S, Hollenbach M Systematic Review with Meta-Analysis: Endoscopic and Surgical Resection for Ampullary Lesions. J Clin Med. 2020 Nov 10;9(11):3622. doi: 10.3390/jcm9113622.
xii Onkendi EO, Naik ND, Rosedahl JK, Harmsen SW, Gostout CJ, Baron TH Sr, Sarr MG, Que FG. Adenomas of the ampulla of Vater: a comparison of outcomes of operative and endoscopic resections. J Gastrointest Surg. 2014 Sep;18(9):1588-96.
xiii Elek G, Gyôri S, Tóth B, Pap A. Histological evaluation of preoperative biopsies from ampulla vateri.Pathol Oncol Res. 2003;9(1):32-41.
xiv Bellizzi AM, Kahaleh M, Stelow EB. The assessment of specimens procured by endoscopic ampullectomy.Am J Clin Pathol. 2009 Oct;132(4):506-13. doi: 10.1309/AJCPUZWJ8WA2IHBG.
xv Laleman W, Verreth A, Topal B, Aerts R, Komuta M, Roskams T, Van der Merwe S, Cassiman D, Nevens F, Verslype C, Van Steenbergen W. Endoscopic resection of ampullary lesions: a single-center 8-year retrospective cohort study of 91 patients with long-term follow-up. Surg Endosc. 2013 Oct;27(10):3865-76. doi: 10.1007/s00464-013-2996-2.
xvi Will U, Bosseckert H, Meyer F. Correlation of endoscopic ultrasonography (EUS) for differential diagnostics between inflammatory and neoplastic lesions of the papilla of Vater and the peripapillary region with results of histologic investigation. Ultraschall Med. 2008 Jun;29(3):275-80. doi: 10.1055/s-2008-1027327.
xvii Han J, Kim MH. Endoscopic papillectomy for adenomas of the major duodenal papilla. Gastrointest Endosc 2006; 63:292-301
xviii Chung KH, Lee SH, Choi JH, Kang J, Paik WH, Ahn DW, Ryu JK, Kim YT Effect of submucosal injection in endoscopic papillectomy of ampullary tumor: Propensity-score matching analysis United European Gastroenterol J. 2018 May; 6(4): 576–585.
xix Singh P, Das A, Isenberg G, Wong RC, Sivak MV, Agrawal D, Chak A. Does prophylactic pancreatic stent placement reduce the risk of post-ERCP acute pancreatitis? A meta-analysis of controlled trials. Gastrointest Endosc. 2004;60:544–550
xx Yining Wang Y, Qi M, Hao Y, Hong J. The efficacy of prophylactic pancreatic stents against complications of post-endoscopic papillectomy or endoscopic ampullectomy: a systematic review and meta-analysis Therap Adv Gastroenterol. 2019; 12: 1756284819855342. Published online 2019 Jun 26.
xxi Chang WI, Min YW, Yun HS, Lee KH, Lee JK, Lee KT, Rhee PL Prophylactic pancreatic stent placement for endoscopic duodenal ampullectomy: a single-center retrospective study. Gut Liver. 2014 May;8(3):306-12.
xxii Taglieri E, Micelli-Neto O, Bonin EA, Goldman SM, Kemp R, dos Santos JS, Ardengh JC, Analysis of risk factors associated with acute pancreatitis after endoscopic papillectomy. Sci Rep. 2020; 10: 4132.
xxiii Moon JH, Cha SW, Cho YD, Ryu CB, Cheon YK, Kwon KW, Kim YS, Kim YS, Lee JS, Lee MS, Shim CS, Kim BS. Wire-guided endoscopic snare papillectomy for tumors of the major duodenal papilla. Gastrointest Endosc. 2005 Mar;61(3):461-6.
xxiv Takahara N, Tsuji Y, Nakai Y, et al. A Novel Technique of Endoscopic Papillectomy with Hybrid Endoscopic Submucosal Dissection for Ampullary Tumors: A Proof-of-Concept Study (with Video). J Clin Med. 2020 Aug; 9(8): 2671.
xxv Camus M, Napoléon B, Vienne A, Le Rhun M, Leblanc S, Barret M, Chaussade S, Robin F, Kaddour N, Prat F. Efficacy and safety of endobiliary radiofrequency ablation for the eradication of residual neoplasia after endoscopic papillectomy: a multicenter prospective study. Gastrointest Endosc. 2018 Sep;88(3):511-518.
Autores
Eduardo Aimore Bonin
Nelson Silveira Cathcart Junior
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!