Seis perguntas que você sempre quis fazer sobre técnicas de ressecção a frio e as respostas inusitadas baseadas em evidências que só o endoscopia terapêutica traz!
O câncer colorretal é atualmente o segundo em incidência em homens e mulheres do Brasil e o terceiro em mortalidade geral. A detecção e remoção de pólipos é uma estratégia que reduz a mortalidade e a incidência dessa neoplasia. A colonoscopia é o exame de escolha para o diagnóstico e tratamento dos pólipos, tendo um papel determinante na prevenção do câncer colorretal.
A avaliação acurada das margens verticais das lesões é de extrema importância. A maior parte das lesões de risco, com histologia avançada, são lesões grandes, maiores que 10 mm. Vale a pena lembrar, no entanto, que cerca de 5,2% dos pólipos pequenos (até 5 mm) são associados à histologia avançada. Independente do tamanho, para lesões com histologia avançada, a ressecção incompleta está associada a um pior prognóstico. Discutir indicações, técnicas de ressecção e as evidências mais recentes tem uma grande importância para todos nós.
Pensando nisso, selecionamos algumas perguntas em relação às chamadas técnicas de ressecção a frio. Vamos lá!
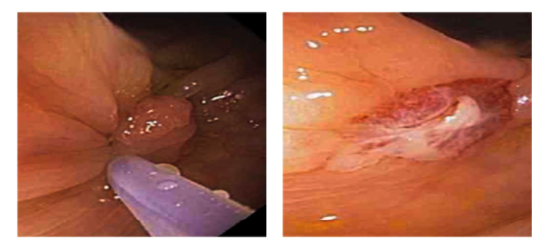
1. O que é melhor para pólipos pequenos (< 5 mm): polipectomia com alça ou com pinça?
A melhor técnica para ressecção de pólipos pequenos (< 5 mm) ainda é motivo de debate. Seriam essas lesões mais bem tratadas pela polipectomia com alça a frio? Será que a polipectomia com pinça é suficiente para tratá-las ?
Sabemos que a maior parte dos pólipos encontrados durante colonoscopias têm tamanho < 10 mm, e as técnicas usadas para a remoção dessas lesões são muito heterogêneas entre os endoscopistas.
Joon Sung Kim e cols conduziram um estudo clínico randomizado muito interessante em seu serviço (Hospital St Mary em Seul, Coreia do Sul) e que foi publicado no ano de 2015. Um total de 139 pacientes foi randomizado entre os grupos polipectomia com pinça e polipectomia com alça a frio. Depois do procedimento, todos os pacientes foram submetidos à mucosectomia para avaliar os leitos de ressecção em busca de lesões residuais.
Os resultados mostram que para as lesões diminutas, ou seja, com tamanho igual ou inferior a 4 mm, os resultados não diferem em relação às duas opções (uso de alça a frio ou polipectomia com pinça). No entanto, para as lesões com tamanho superior a 5 mm, a polipectomia com alça a frio está associada a uma maior taxa de ressecção completa e, por esse motivo, deve ser a preferência para essas lesões.
2. Fazer injeção submucosa melhora os resultados da polipectomia a frio?
Esse é um questionamento interessante. Será que há a necessidade de proceder injeção submucosa para melhorar os resultados da polipectomia a frio? Será que a injeção submucosa permite uma ressecção de mais tecido e garante as margens?
Yuichi Shimodate e cols conduziram um estudo prospectivo e randomizado em sua instituição em Okayama, no Japão, para responder a esses questionamentos. Os autores fizeram uma comparação entre a polipectomia com alça a frio auxiliada por injeção de salina na submucosa (salina + índigo carmine + adrenalina) e a polipectomia com alça a frio convencional.
Os desfechos estudados foram a taxa de ressecção completa da muscular da mucosa (definida como taxa de ressecção da muscular da mucosa > 80%), margens lateral e vertical, fragmentação das lesões e complicações, como sangramento e perfuração. Duzentos e quatorze pacientes foram randomizados entre os dois grupos. As taxas de ressecção completa de muscular da mucosa foram 43,9% no grupo com injeção submucosa e 53,3% no grupo de polipectomia convencional, e as taxas de margens vertical e lateral livres foram menores no grupo com uso de injeção submucosa (58% x 76% p=0,03 e 42,3% x 56,7% p=0,006, respectivamente). Os autores concluem que o uso de solução salina na submucosa, de maneira diferente ao que era esperado, não promoveu melhoria no manejo das lesões e, além disso, esteve associado a piores desfechos das ressecções em relação às margens.
O estudo de Shimodate mostra que vale a pena investir em uma boa técnica convencional de polipectomia a frio, sem a necessidade de injeção submucosa. Essa informação favorece, ainda, a polipectomia underwater como método de ressecção completa de lesões.
3. É possível remover lesões grandes com a técnica de polipectomia com alça a frio?
Ressecções de lesões maiores que 10 mm são usualmente realizadas com alça diatérmica e/ou mucosectomia. Esse tem sido o padrão de tratamento. O racional para o uso de corrente elétrica no manejo dessas lesões inclui facilidade na transecção dos tecidos, cauterização de eventuais tecidos displásicos remanescentes e prevenção do sangramento imediato, pela coagulação térmica dos vasos locais.
Nos últimos anos, no entanto, os impactos e riscos da injúria térmica aos tecidos têm sido demonstrados. Podemos citar a perfuração, sangramento tardio e a síndrome pós-polipectomia como exemplos de lesões causadas pelo uso do bisturi elétrico durante ressecções endoscópicas.
A ESGE (European Society of Gastrointestinal Endoscopy) recomenda o uso de polipectomia com uso de bisturi elétrico para lesões com tamanhos entre 10 e 19 mm e mucosectomia para as lesões ≥ 20 mm.
Nesse contexto, o uso da polipectomia a frio para lesões maiores que 10 mm vem sendo investigado, com as primeiras publicações datando de 2014.
Chandrasekar V e cols conduziram uma meta-análise para responder a esses questionamentos e mostraram resultados animadores em relação à segurança e eficácia da polipectomia a frio para lesões > 10 mm.
A meta-análise incluiu 8 estudos e 522 pólipos ressecados, com uma média de tamanho de 17,5 mm (10-60 mm). A taxa de efeitos adversos foi de 1,1%, com 0,7% de sangramento durante o procedimento (IC95%, 0%-1.4%), 0,5% de sangramento pós-procedimento (IC95% 1%-1,2%) e 0,6% de dor abdominal (IC95% 0,1%-1,3%). Não foi observada perfuração na análise. A taxa de complicações foi maior para pólipos ≥ 20 mm (1,3% de sangramento durante o procedimento e 1,2% de dor abdominal, sem sangramento tardio observado). A taxa de ressecção completa foi 99,3% (IC95% 98,6%-100%), e a taxa de lesão residual variou entre 1% e 11,1%, com um período de seguimento de 154 a 258 dias.
4. As taxas de sangramento são maiores com a técnica a frio?
O sangramento pode ocorrer durante o procedimento e após a ressecção. O sangramento durante o procedimento é definido como aquele com duração superior a 60s ou que requer abordagem e ocorre em cerca de 2,8% das polipectomias e 11,3% das mucosectomias. O sangramento pós-procedimento pode ocorrer a partir de 6h até 30 dias, associado à instabilidade hemodinâmica e que requer abordagem. Ocorre em cerca de 6-7% dos casos e está associado a lesões maiores que 20 mm, uso de antitrombóticos e lesões em cólon direito.
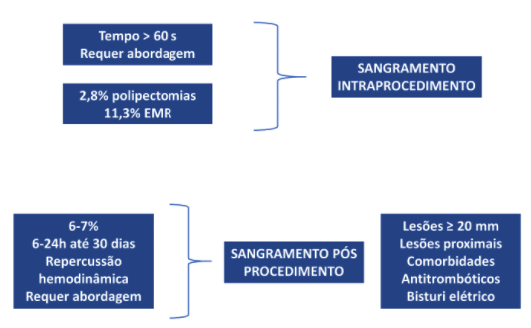 Na questão anterior, mostramos os resultados da meta-análise de Chadrasekar e cols, que mostraram taxas de sangramento intra e pós-procedimento por volta de 1%, mesmo para lesões maiores que 20 mm.
Na questão anterior, mostramos os resultados da meta-análise de Chadrasekar e cols, que mostraram taxas de sangramento intra e pós-procedimento por volta de 1%, mesmo para lesões maiores que 20 mm.
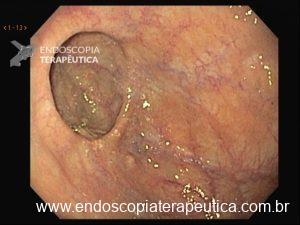
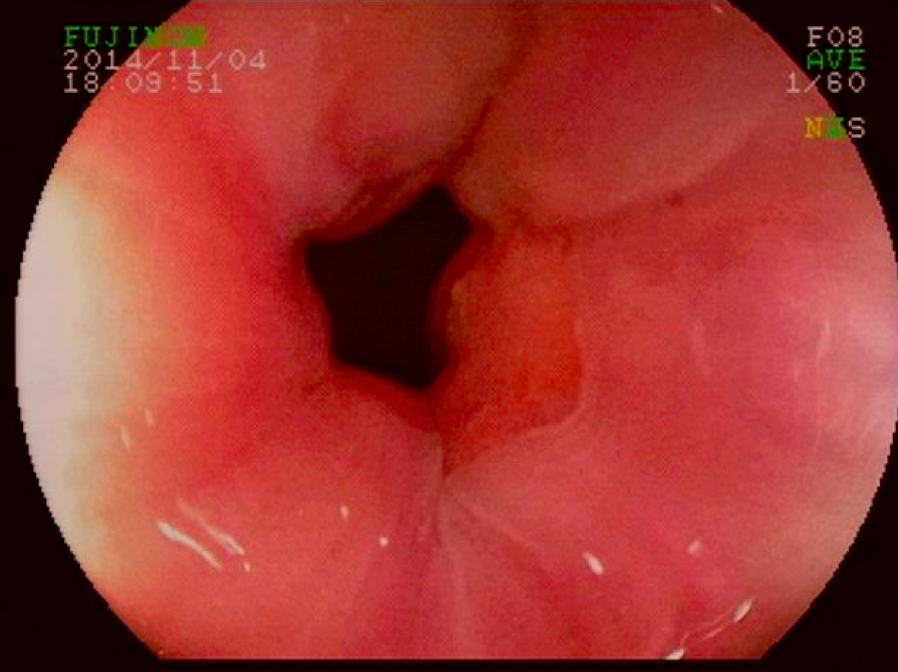
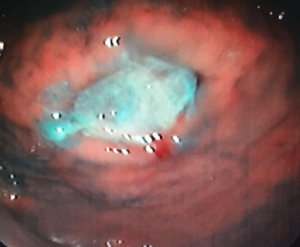
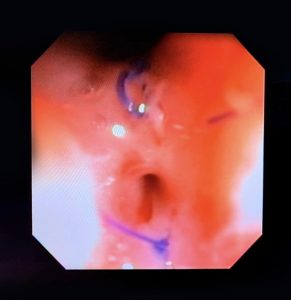
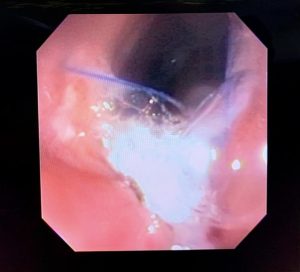
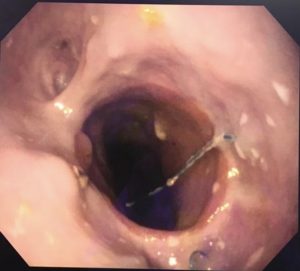
5. O que é aquela “coisinha branca protrusa e revirada” que fica no leito de ressecção? Devo me preocupar com aquilo?
A polipectomia com alça a frio é usualmente usada para remoção segura e efetiva de pólipos e é uma estratégia muito interessante para a prevenção do câncer colorretal. Como mencionado previamente neste texto, a polipectomia com alça a frio é mais usada para lesões pequenas, com tamanho entre 3 e 9 mm, no entanto, a técnica é também efetiva para lesões maiores.
Um dos riscos da polipectomia com alça a frio é a formação de protrusões de tecido no leito de ressecção após a realização da polipectomia.
A prevalência dessas protrusões é de cerca de 14 a 36% e, em sua maioria, correspondem a parte da muscular da mucosa ou da submucosa. Inicialmente, a maioria dos autores não considerou que essas protrusões tivessem algum significado clínico relevante. No entanto, alguns grupos têm valorizado esses achados durante o exame do leito de ressecção. Seriam essas protrusões associadas a problemas?
Tatsuya Ishii et al conduziram um interessante estudo retrospectivo, publicado no periódico GIE de Maio de 2021, estudando os leitos de ressecção e também as peças (pólipos) ressecadas. Os autores acessaram um total de 1.026 lesões, e, dessas, 116 (11,3%) exibiam protrusões de tecido no leito de ressecção. As protrusões estavam associadas à fragmentação das peças tanto em análise univariada (OR 3,74 IC95% 2,47-5,66 p<0.001) quanto em análise multivariada (OR 3,13 IC95% 2,04-4,82 p<0.001). Apesar disso, a proporção de taxas de ressecção completa não foi diferente nos pacientes, independente do fato de existirem as protrusões. A proporção de muscular da mucosa < 50% foi mais elevada no grupo que apresentava as protrusões (48,5 x 29,1% p<0.001).
As protrusões foram associadas com um maior tamanho dos pólipos e dos espécimes ressecados, tanto em análise univariada quanto em análise multivariada. Os autores argumentam que a presença dessas protrusões pode ser um alerta para um diagnóstico patológico fragilizado, pela associação com menor proporção de muscular da mucosa representada na peça e maior associação com fragmentação, que prejudica a análise das margens. Em pólipos malignizados isso torna-se um problema grave.
6. E a polipectomia/mucosectomia underwater? Tem alguma vantagem em relação à técnica convencional?
Nas chamadas técnicas underwater, o espaço luminal é preenchido por água, o que mantém a camada muscular própria sob tensão, fazendo com que as camadas submucosa e mucosa “flutuem”. Dessa maneira, os riscos de lesão térmica e de perfuração estão minimizados, e as técnicas underwater surgem como alternativas às técnicas ditas convencionais.
A injeção na submucosa é considerada um passo importante nos procedimentos de mucosectomia convencional e tem a função de elevar as lesões, tornando-as polipoides e, dessa maneira, facilitando a apreensão com alça de polipectomia. Além disso, afasta as lesões da camada muscular própria, minimizando os riscos de sangramento e perfuração, e, em teoria, aumentaria as taxas de ressecção completa e margens negativas.
O estudo prospectivo e randomizado de Shimodate e cols (mencionado previamente neste post) mostrou resultados que contrariam as premissas das técnicas de mucosectomia convencional e destacam as qualidades dos procedimentos underwater.
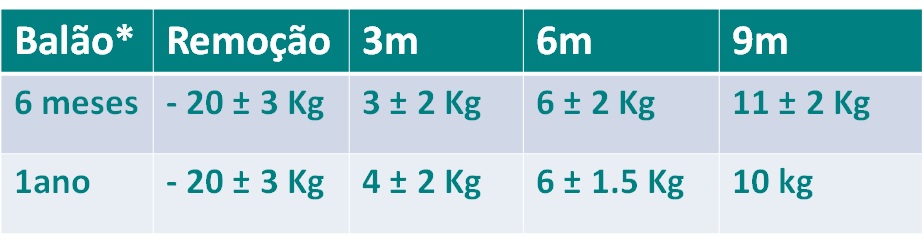
Recentemente, uma meta-análise de Choi e cols comparou a mucosectomia underwater (614 pacientes) e a mucosectomia convencional (623 pacientes), mostrando resultados inusitados. Os autores observaram que os procedimentos underwater estavam mais associados a ressecções “em bloc” e menores índices de recorrência em relação às técnicas convencionais, principalmente para lesões maiores que 20 mm. O quadro abaixo mostra os principais achados do estudo:
Sabemos que a recorrência das lesões está fortemente associada a ressecções incompletas ou ressecções piecemeal. As técnicas underwater têm se mostrado seguras, factíveis em diferentes contextos e associadas a maiores taxas de ressecção completa em estudos diversos, estudos head to head, publicados recentemente.
Como citar este artigo
Cardoso DMM. 6 perguntas que você sempre quis fazer sobre técnicas de ressecção a frio e as respostas inusitadas baseadas em evidências que só o endoscopia terapêutica traz. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/6-perguntas-que-voce-sempre-quis-fazer-sobre-tecnicas-de-resseccao-a-frio
Referências
- Kim JS, Lee Bo-In, Choi H et al. Cold snare polypectomy versus cold forceps polypectomy for diminutive and small colorectal polyps: a randomized controlled trial. (Gastrointest Endosc 2015;81:741-7.
- Shimodate Y, Itakura J, Takayama H et al. Impact of submucosal saline solution injection for cold snare polypectomy of small colorectal polyps: a randomized controlled study. Gastrointest Endosc 2020;92:715-22.
- Ferlitsch M, Moss A, Hassan C, et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2017;49:270-97.
- Chandrasekar VT, Spadaccini M, Aziz M et al. Cold snare endoscopic resection of nonpedunculated colorectal polyps larger than 10 mm: a systematic review and pooled-analysis. Gastrointest Endosc 2019;89:929-36.
- Ishii T, Harada T, Tanuma T et al. Histopathologic features and fragmentation of polyps with cold snare defect protrusions. Gastrointest Endosc 2021;93:952-9.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!