Sobre a marcação colônica por tatuagem, qual a alternativa correta?
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Desde março de 2020, quando a OMS definiu que estávamos diante de uma pandemia de consequências desconhecidas, uma grande mobilização da comunidade científica mundial buscou acúmulo de conhecimento sobre o novo vírus, porém, por meses à frente, ainda agiríamos no escuro em muitas situações, contando com muito menos informação de qualidade do que gostaríamos.
No quesito transmissibilidade, por exemplo, muito se assumiu como verdade a partir do comportamento de outros coronavírus, dada a semelhança estrutural do SARS-CoV-2 com seus predecessores.
Ainda em março, aqui no site, alguns artigos trouxeram uma parte importante do que já era conhecido e relevante (links abaixo).
Infelizmente, quase nada tratava especificamente do comportamento viral no ambiente da endoscopia. Na verdade, até recentemente a endoscopia digestiva estava fora da lista de procedimentos geradores de aerossóis, havendo apenas a evidência de disseminação bacteriana demonstrada por culturas de amostras de face shields usadas por endoscopistas. Apesar disso, medidas para a redução da transmissão por aerossóis foram e seguem recomendadas. E muitas perguntas seguiram sem respostas. Endoscopia de fato produz aerossol? O vírus em suspensão é capaz de infectar alguém durante ou após o exame?
Recentemente, uma revisão buscou tratar do assunto com olhar voltado à prática endoscópica. Nessa revisão, intitulada “Extent of infectious SARS-CoV-2 aerosolisation as a result of oesophagogastroduodenoscopy or colonoscopy”, os autores selecionaram 26 artigos dentre 3745 inicialmente localizados.
Foram incluídos estudos que relatassem riscos por aerossol em pacientes com COVID-19, tendo sido excluídos os não relacionados à COVID-19, com metodologia considerada fraca, não escritos em inglês, e aqueles não indexados à PubMed.
Figura 1 – Flow chart com elegibilidade, inclusão e exclusão de artigos.
Os autores relatam que os estudos selecionados na revisão sugerem alta infectividade por contato e por gotículas, no entanto, afirmam não haver em sua amostra nenhum estudo clínico que demonstre carga viral presente no aerossol, não sendo possível a definição de uma “dose” infectante, mas afirma que isso pode corresponder a algumas centenas de partículas virais. Entenda-se por “dose” a menor quantidade de partículas virais necessárias para iniciar uma infecção.
Abaixo, estão listadas algumas afirmações colocadas pelos autores em sua discussão:
Figura 2 – Agregado das amostras e dias de início dos sintomas.
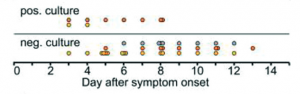
Figura 3 – Resultados agregados de sucesso de isolamento viral em diferentes dias desde o início dos sintomas.
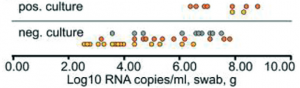
Figura 4 – Sucesso de isolamento viral e carga viral da amostra.
A revisão apresenta dificuldades para trazer, de fato, luz ao assunto, seja por limitações em seu desenho, seja pela escassez de informações na literatura.
Em resumo, as evidências que sustentam o papel da aerossolização como via de transmissão de COVID-19 na prática endoscópica são limitadas até o momento e o assunto ainda carece de melhor entendimento.
Rodrigues R. Aerossóis e transmissibilidade na prática endoscópica: a dúvida que paira no ar. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/aerossois-e-transmissibilidade-na-pratica-endoscopica-a-duvida-que-paira-no-ar/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quiz, classificações e mais!
A pandemia do coronavírus impôs maciças restrições à prática da endoscopia, especialmente à sua maior parcela, a dos procedimentos eletivos, assim como fez em todos os setores, de maneira jamais vista.
Ao redor do mundo, múltiplas sociedades produziram e divulgaram uma série de recomendações para adequação da prática médica, visando a continuidade dos atendimentos necessários com a máxima segurança possível, ainda que, com restrições.
Essas restrições são ainda mais rígidas nos procedimentos considerados geradores de aerossóis, como é o caso da endoscopia digestiva. Em casos confirmados ou suspeitos de COVID-19, recomenda-se a realização do procedimento em sala com pressão negativa, medida de difícil cumprimento, dada a escassez desse recurso em nosso meio (1,2).
Seu princípio de funcionamento é relativamente simples. Trata-se de um ambiente selado, no qual uma pressão negativa é gerada a partir da exaustão de ar em volume maior do que aquele que é permitido entrar nesse ambiente. Mas na verdade, o manejo da pressão é apenas um dos seus fundamentos. O controle do ar ambiente para se evitar transmissão por partículas suspensas está baseado em três pilares:
Nestas salas, o sistema controla a troca gasosa com o exterior, retirando do ambiente entre 30 e 40% a mais em volume de ar do que permite entrar, gerando assim, uma espécie de vácuo permanente com fluxo unidirecional. A diferença entre a exaustão e o suprimento de ar deve ser de cerca de 2.5 Pascal, induzindo o fluxo do ar de espaços adjacentes para a sala isolada.
O fluxo da massa de ar é promovido por ventilação mecânica e a capacidade do sistema de eliminar diferentes quantidades de material infectante depende do número de trocas de ar por hora (air changes per hour – ACH – Figura 1) oferecido pelo sistema, bem como do posicionamento das entradas e saídas de ar, além da configuração física da sala.
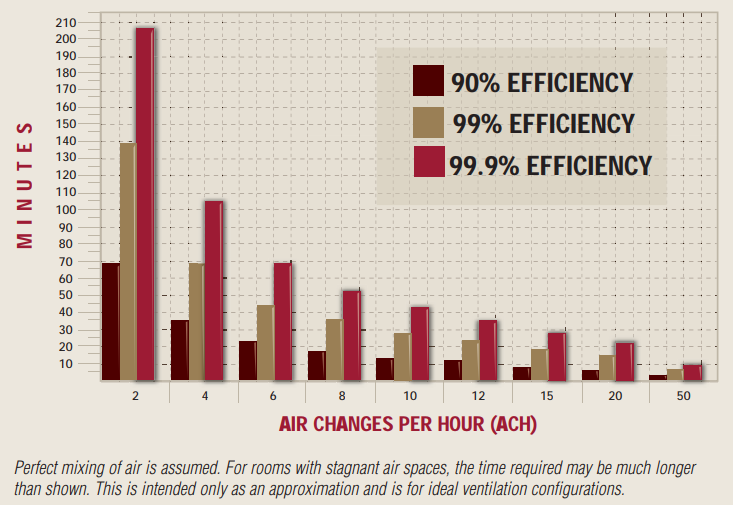
Figura 1 – Tempo requerido para remoção de 90%, 99% e 99,9% de contaminantes transmitidos pelo ar. Excerto de Airborne Infectious Disease Management: Methods for Temporary Negative Pressure Isolation (ref. 3)
Embora o princípio das salas de pressão negativa seja simples, a sua disponibilidade é pequena, mesmo em grandes centros em países desenvolvidos. Atualmente, nos EUA, apenas 2 a 4 % das salas hospitalares contam com pressão negativa. Nada de errado nisso até recentemente, por serem pouco demandadas proporcionalmente e representarem custo adicional.
A medida tem sido adotada tanto em ambiente hospitalar (3), aumentando a capacidade de acomodação em condições de isolamento, quanto fora do hospital, em pontos alternativos de cuidados (4 e 5). Para isso o recurso é a adaptação por Isolamento Temporário por Pressão Negativa (TNPI). TNPIs devem ser considerados quando há necessidade de salas de isolamento para infecção com transmissibilidade pelo ar (Airborne Infeccion Isolation Rooms – AIIRs) e esses ambientes encontram-se ausentes ou são insuficientes. Existem várias configurações de TNPIs. Em todas elas um equipamento de filtragem tipo HEPA (high performance particulate arrestance) e de ventilação mecânica é colocado no ambiente. Esse sistema estará ligado uma saída de ar, que pode ser uma janela, com eliminação do ar filtrado para o exterior do prédio, ou ainda para o próprio sistema de ventilação (Figuras 2 e 3). Uma terceira versão, menos eficiente, pode utilizar cortinas plásticas para delimitar o espaço de isolamento. O sistema de filtragem e ventilação cria uma pressão negativa relativa, no entorno do paciente, e drena o ar para fora dos limites do isolamento (Figura 4).
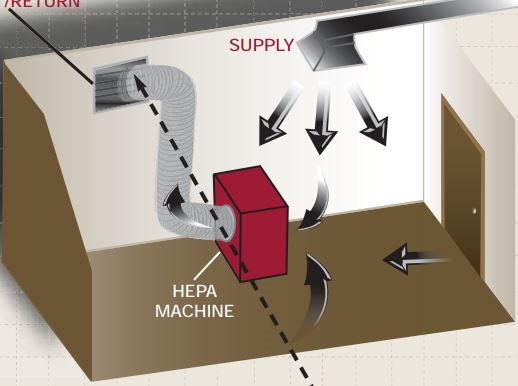
Figura 3 – Isolamento temporário por pressão negativa com saída para sistema de ventilação. Excerto da ref (3).

Figura 4 – Isolamento temporário por pressão negativa com delimitação por cortinas plásticas. Excerto da ref (3).
Ainda não sabemos quais das novas recomendações de segurança perdurarão na prática endoscópica após a fase crítica da pandemia, mas é possível que haja necessidade de ampliação da oferta de ambientes que contem com essa tecnologia.
A ADR (taxa de detecção de adenoma) é um dos principais indicadores de qualidade em colonoscopia pois está inversamente correlacionada ao risco de desenvolvimento de câncer colorretal de intervalo. Muitos artigos e esforços têm tentado encontrar caminhos para aumentar a frequência com que encontramos essas lesões. De fato, é difícil imaginar que fatores não ligados diretamente à execução do exame, não interfiram de alguma forma no yield do procedimento.
Já são conhecidos fatores ligados ao paciente (qualidade do preparo, gênero), ao examinador (experiência, conhecimento, técnica e tempo de retirada, fadiga) e ao equipamento (alta resolução, campo de visão), como interferentes na ADR. Alguns autores estão ampliando o olhar para outros elementos que possam interferir no indicador.
Pensando assim, pesquisadores do Massachusetts General Hospital e da Columbia University avaliaram o efeito das dimensões do monitor na visibilização da mucosa e, como consequência, na ADR, com a hipótese de que monitores maiores poderiam melhorar o indicador.
O estudo foi feito em um único centro, com inclusão de todos os pacientes atendidos ambulatorialmente durante o período do estudo, num total de 1795 pacientes. Caso o paciente tivesse mais de um exame, apenas o primeiro foi levado em conta. A maior parte dos pacientes faziam exame de screening (57%), e tinham boas/excelentes condições de preparo (93%, escala de Aronchick modificada) Todos os dias, os médicos eram aleatoriamente encaminhados a duas salas de exame. Em uma das salas era usado um monitor padrão de 19 polegadas (1280×1024) e na outra um monitor de 32 polegadas (1920×1080). Além das dimensões dos monitores, não houve qualquer mudança na rotina dos procedimentos e a distância entre a tela e o examinador era de 1,20 m. A tabela 1 traz mais detalhes sobre os monitores.
Foi definida como desfecho primário a comparação entre as ADRs obtidas nos dois grupos. Como desfechos secundários, foram observadas as ADRs específicas de cada médico, bem como as taxa de detecção de pólipos global e individuais (PDR).
Tabela 1 – Especificações dos monitores usados no estudo.
| Size | Model | Technology | Resolution | Pixel pitch | Viewing angle | Contrast ratio |
| 19-inch | SC-SX19- A1A11 | active matrix with in-plane switching | 1280x 1024 | .294 mm | 178- degree | 600:1 |
| 32-inch | SC-WU32-A1A11 | active matrix thin-film-transistor screen with lightemitting diode backlight | 1920×1080 | .364 mm | 178-degree | 3000:1 |
Como vemos, embora fosse, até certo ponto, intuitivo imaginar que uma maior amplitude da imagem pudesse favorecer a detecção de lesões, isso não foi demonstrado no estudo. A única exceção parece ser que o uso de um monitor maior foi associado estatisticamente ao aumento na detecção de pólipos por endoscopistas com menor PDR basal (PDR < 35%, P=.04).
A tabela 2 sumariza os achados do estudo.
Tabela 2 – Achados e estatística dos resultados.
| 19”
(n-905) |
32”
(n=890) |
P | |
| Qualquer lesão polipoide | 297 (32.8) | 306 (34.4) | .50 |
| Adenoma | 248 (27.4) | 248 (27.9) | .80 |
| Polipos hiperplásicos | 80 (8.8) | 83 (9.3) | .60 |
| Outras benignas | 52 (5.8) | 39 (4.4) | .26 |
| Câncer colorretal | 8 (.9) | 8 (.9) | .98 |
Os autores comentam que não foram consideradas outras variáveis como tempo de retirada e ponderam que as maiores dimensões do monitor possam trazer outros benefícios que não o aumento da ADR.
Ok, parece que trocar de monitor não vai ajudar muito. E se a gente caprichasse na sedação e deixasse o paciente sempre quietinho, sem interferir na paz do exame?
Existem evidências de que o exame com sedação moderada não é superior em ADR e PDR quando comparado a exames sem sedação. Será que o mesmo ocorre ao se comparar sedação com benzodiazepínicos e opióides versus sedação profunda com propofol?
Com essa pergunta e de olho no uso crescente de propofol em exames de screening, um grupo da Universidade do Missouri comparou retrospectivamente estes indicadores em colonoscopias índice conduzidas com os dois modelos de sedação, em períodos não coincidentes. No total, foram 338 pacientes no grupo de sedação moderada e 247 receberam sedação profunda. Nenhuma diferença estatística foi observada entre os grupos, quanto à ADR ou PDR, independente do gênero ou em avaliações de subgrupos. No passado, outros estudos falharam em demonstrar benefícios da sedação profunda na detecção de lesões, mas incluíam pacientes de perfil heterogêneo, o que poderia ter comprometido os resultados. Este estudo do Missouri seria o primeiro a considerar apenas colonoscopias índice e em pacientes ASA 1 e 2.
Ambos os trabalhos que eu trouxe aqui têm limitações de desenho, mas apontam para conclusões que reforçam a importância de um exame cuidadoso e atento, independente dos recursos tecnológicos que estejam ao dispor.
Referências
Impact of moderate versus deep sedation on adenoma detection rate in index average-risk screening colonoscopies.
Gastrointest Endosc. 2019 Sep;90(3):502-505. doi: 10.1016/j.gie.2019.05.011. Epub 2019 May 15.
PMID: 31102644 DOI: 10.1016/j.gie.2019.05.011
Effect of video monitor size on polyp detection: a prospective, randomized, controlled trial.
Gastrointest Endosc. 2019 Aug;90(2):254-258.e2. doi: 10.1016/j.gie.2019.03.1172. Epub 2019 Apr 12.
PMID: 30986402 DOI: 10.1016/j.gie.2019.03.1172
Selecionamos 3 artigos das principais revistas endoscópicas para discussão:
Konstantinos Triantafyllou, Paraskevas Gkolfakis, Georgios Tziatzios, Ioannis S Papanikolaou, Lorenzo Fuccio, and Cesare Hassan
CENÁRIO
Endocuff – um dispositivo plástico com projeções flexíveis montado na ponta do colonoscópio, promete melhorar a inspeção mucosa no cólon.
OBJETIVO
Estudar o efeito do Endocuff na taxa de detecção de adenomas (ADR), detecção de adenomas avançados (AADR) e no número médio de adenomas por colonoscopia (MAC).
MÉTODO
Buscas na literatura identificaram trials randomizados controlados avaliando colonoscopias com Endocuff (Endocuff assisted colonoscopy – EAC) vs colonoscopia convencional (CC) quanto a ADR, AADR e MAC. O tamanho de efeito no desfecho do estudo foi calculado a partir de modelo de efeito fixo ou aleatório e foi demonstrado como risco relativo (RR) [intervalo de confiança (CI) de 95%] e diferença média (MD) (95% CI). A taxa de necessidade de remoção do Endocuff também foi calculada.
RESULTADOS
Identificamos nove estudos incluindo 6038 pacientes. Todos incluíram população mista (rastreamento, seguimento e exames diagnósticos). Sete estudos avaliaram a primeira, e dois avaliaram a segunda geração do dispositivo. EAC foi associada a aumento da ADR quando comparada à CC [RR (95%CI):1.18 (1.05-1.32);Ι2 = 71%]; EAC beneficiou mais endoscopista com ADR ≤ 35% comparados aqueles com ADR > 35% [RR (95%CI): 1.37 (1.08-1.74); Ι2 = 49% vs 1.10 (0.99-1.24); Ι2 = 71%]. Quanto a AADR e MAC, não foi observada diferença entre EAC e CC [RR (95%CI): 1.03 (0.85-1.25); Ι2 = 15% e MD (95%CI): 0.30 (-0.17-0.78); Ι2 = 99%]. A análise de subgrupos não mostrou qualquer diferença entre as duas gerações do dispositivo. Nos braços EAC do estudo, o dispositivo precisou ser removido em 3% (95%CI: 2%-5%) dos casos, principalmente devido a tortuosidade do sigmoide ou presença de divertículo no seu trajeto.
CONCLUSÃO
EAC aumentou a ADR comparada com CC, especialmente para endoscopistas com baixa ADR. Não foi observado efeito significante quanto a AADR e MAC.
Comentários:
Diversos trabalhos têm se ocupado de buscar maneiras de incrementar a ADR, uma vez que a taxa é o principal indicador de qualidade de serviços de colonoscopia e em última análise a real entrega da proteção oferecida pela colonoscopia na prevenção de CCR passa por uma ADR satisfatória. Nessa busca surgem desde recomendações técnicas, como revisão de segmentos do cólon, retrovisão em cólon direito e outros, além de dispositivos capazes de aumentar a detecção de lesões.
Este estudo compila achados de outros trabalhos comparando EAC com CC e aponta para melhor desempenho de EAC, supostamente pelo acessório auxiliar a visibilização da face proximal das haustrações do cólon. No entanto, essas conclusões deve ser observadas com reserva. Vale mencionar que, as variáveis extraídas dos estudos selecionados, não incluem tempo de retirada nos exames, seja em EAC ou CC. Embora ainda haja discussão sobre o assunto, acredita-se que um maior tempo de retirada do aparelho favoreça uma maior detecção de pólipos e, consequentemente, de adenomas. Não é possível afirmar, portanto, que a maior detecção associada ao uso do acessório não seja fruto de um exame com tempo de retirada mais longo imposto pela própria presença do Endocuff.
Yoriaki Komeda, Tomohiro Watanabe, Toshiharu Sakurai, Masashi Kono, Kazuki Okamoto, Tomoyuki Nagai, Mamoru Takenaka, Satoru Hagiwara, Shigenaga Matsui, Naoshi Nishida, Naoko Tsuji, Hiroshi Kashida, and Masatoshi Kudo
CENÁRIO
Fatores de risco para recorrência local após polipectomia, mucosectomia (EMR), e dissecção endoscópica da submucosa (ESD) não estão definidos. Além disso, o intervalo apropriado para seguimento endoscópico de tumores colorretais com alto risco de recorrência local não estão estabelecidos.
OBJETIVO
Identificar as características clinico-patológicas de lesões recorrentes após ressecção endoscópica de tumor colorretal e determinar o intervalo apropriado.
MÉTODO
Trezentos e sessenta pacientes (1412 tumores colorretais) submetidos a polipectomias, EMR, ou ESD e foram seguidas por mais de 1 ano para identificação de recorrência local, foram incluídos no estudo. Os achados clinicopatológicos associados com recorrência local foram determinados via análises uni e multivariada.
RESULTADOS
Recorrência local foi observada em 31 dos 360 pacientes (8,6%) [31 das 1412 lesões (2.2%)] após ressecção de tumor colorretal. Ressecção em piecemeal, tamanho do tumor maior que 2 cm, e presença de componente viloso foram associados com recorrência local. Destes, ressecção em piecemeal foi identificada como fator de risco independente para a recorrência. Lesões ressecadas em mais de 5 fragmentos foram associadas a maior risco de recorrência com tempo médio de 3 meses entre a ressecção e a recorrência, nestes casos. O período de recorrência em casos ressecados em mais de 5 fragmentos foi mais curto que o daquelas ressecadas em menos de 4 fragmentos (3.8 ± 1.9 meses vs 7.9 ± 5.0 meses, P < 0.05).
CONCLUSÕES
Recorrência local de tumores colorretais tratados endoscopicamente depende de desfechos do primeiro procedimento. Ressecção em piecemeal foi o único fator de risco significante associado com recorrência local após ressecção endoscópica.
Comentários
Embora o estudo não tenha ineditismo sobre os fatores associados à recorrência local, seus achados, obtidos a partir de uma ampla casuística, estão alinhados com a literatura prévia e ajudam a cristalizar a importância do entendimento da lesão, no momento de definir a terapêutica endoscópica.
Já havia sido demonstrada a associação entre ressecção em piecemeal e o risco aumentado de recorrência local (PMID 25848926). Componente viloso da lesão e tamanho > 2 cm também foram apontados como fatores de risco para recorrência local na análise univariada, Adicionalmente, neste estudo, os autores observaram recorrência mais precoce na lesões ressecadas com > 5 fragmentos e embora reconheçam não ter havido critério único para o agendamento da colonoscopia de seguimento, trazem uma recomendação para esse follow-up.
Recommendation of interval before repeat colonoscopy.
| Interval before a repeat colonoscopy |
| 1-3 mo after piecemeal resection ≥ 5 pieces (high risk for recurrence) |
| 4-6 mo after piecemeal resection ≤ 4 pieces (moderate risk for recurrence) |
| 6 mo after en blocresection for cancer (low risk for recurrence) |
| ≥ 12 mo after en bloc resection for adenoma (very low risk for recurrence) |
Excerto de PMID 25848926
Viveksandeep Thoguluva Chandrasekar, MD, Marco Spadaccini, MD, Muhammad Aziz, MBBS1,2, Roberta Maselli, MD, PhD3, Seemeen Hassan, MD4, Lorenzo Fuccio, MD5, Abhiram Duvvuri, MD1,2, Leonardo Frazzoni, MD5, Madhav Desai, MD1,2, Alessandro Fugazza, MD3, Ramprasad Jegadeesan, MD1,2, Matteo Colombo, MD3, Chandra Skekhar Dasari, MD2, Cesare Hassan, MD, PhD6, Prateek Sharma, MD1,2, Alessandro Repici, MD3
CENÁRIO E OBJETIVOS
Polipectomia com alça diatérmica (hot snare polypectomy – HSP) e mucosectomia (EMR) são padrão na ressecção de pólipos colorretais ≥10 mm. Para evitar o risco de dano induzido por eletrocautério, surgem evidências recentes sobre o uso de polipectomia com alça e EMR a frio para essas lesões. O objetivo desta análise é relatar os desfechos de ressecções por alça a frio para pólipos > 10 mm.
MÉTODO
Os bancos de dados da PubMed/Medline, Embase, Google Scholar, e Cochrane foram consultados para identificar estudos, publicados até julho de 2018, que realizaram ressecções por alça a frio para pólipos colorretais ≥10 mm. Os desfechos primários foram eventos adversos (sangramento, perfuração e dor abdominal pós-polipectomia) e os secundários foram taxa de ressecção completa, taxas de pólipo residual, e taxas de adenomas versus pólipos sésseis serrilhados (SSPs). Análise de subgrupos foi realizada considerando tamanho, localização da lesão e técnica de ressecção
RESULTADOS
Oito estudos foram incluídos na análise final, com 522 pólipos colorretais com tamanho médio de 17,5 mm (10-60). A taxa global de eventos adversos foi de 1,1% (95% CI. 0,2%-2,0%; I2 = 0%). As taxas de sangramento intra e pós-procedimento foram de 0,7% (95% CI, 0%-1.4%) e 0,5% (95% CI, 0,1%-1,2%), respectivamente, com taxa de dor abdominal de 0,6% (95% CI, 0,1%-1,3%).
Pólipos ≥20 mm tiveram taxa de sangramento intra-procedimento maior, de 1,3% (95% CI, 0,7%-3,3%) e taxa de dor abdominal de 1,2% (95% CI, 0, 7%-3,0%), mas sem sangramentos tardios. Não foram relatadas perfurações. A taxa de ressecção completa foi de 99,3% (95% CI, 98,6%-100%). Taxas agrupadas de pólipos residuais de qualquer histologia, adenomas, e SSPs foram 4,1% (95% CI, 0,2%-8,4%), 11,1% (95% CI, 4,1%-18,1%), e 1,0% (95% CI, 0,4%-2,4%), respectivamente, durante período de seguimento que variou de 154 a 258 dias.
CONCLUSÕES
Os resultados desta revisão sistemática e análise agrupada foram excelentes com ressecção com alça a frio de pólipos colorretais > 10 mm considerando as taxas de sangramento pós-polipectomia, ressecção completa e de pólipos residuais. Estudos controlados aleatorizados comparando ressecção a frio com alça diatérmica em pólipos > 10 mm são necessários para investigação adicional.
Comentários:
O estudo chama a atenção por demonstrar segurança e bons resultados na abordagem de lesão > 10 mm, ou até mesmo > 20 mm, sem a “proteção” da coagulação vascular instantânea ou mesmo da desvitalização de lesões residuais, oferecida pelo eletrocautério, algo a ser visto com reservas por muitos até algum tempo atrás.