Artigos comentados – Agosto 2018
Neste post estão listados alguns artigos interessantes publicados nas últimas edições das revistas Gastrointestinal Endoscopy (GIE) e Endoscopy.
GIE – Eficácia da drenagem biliar guiada por CPRE vs guiada por EUS para obstrução biliar maligna: estudo prospectivo randomizado controlado
A drenagem biliar realizada por colangiografia retrógrada endoscópica (CPRE) é o tratamento padrão para obstrução biliar maligna quando a cirurgia curativa não é mais uma opção. Métodos alternativos, como a drenagem biliar percutânea trans-hepática reduzem significativamente a qualidade de vida. Portanto, os objetivos deste estudo foram avaliar a eficácia e segurança da drenagem realizada por ultrassom endoscópico (EUS) em comparação com CPRE na obstrução biliar maligna.
Métodos
O estudo prospectivo randomizado e controlado foi realizado com 30 pacientes.15 para EUS e 15 para CPRE.
O sucesso técnico, o tempo de procedimento, o sucesso clínico e os eventos adversos foram avaliados.
Resultados
30 pacientes tiveram obstrução maligna extra-hepática do trato biliar (19 homens, 11 mulheres).
27 pacientes apresentavam adenocarcinomas ductais pancreáticos não ressecáveis
1 paciente tinha câncer do hepatocolédoco distal
2 pacientes tinham linfadenopatia maligna metastática.
Não houve diferenças significativas, tanto em termos de taxa de sucesso técnico e taxa de sucesso clínico (100% vs 93% e 93% vs 100% na CPRE vs EUS, respectivamente; P = 1,00, P = 1,00).
4 pacientes (31%) tiveram disfunção do stent no crescimento de tumores no grupo da CPRE, enquanto 2 pacientes tiveram impactação alimentar e 2 pacientes tiveram migração do stent no grupo EUS. Nenhum evento adverso significativo relacionado ao procedimento ocorreu em nenhum dos grupos.
Conclusões
Este estudo prospectivo, randomizado e controlado sugere que o EUS tem segurança semelhante à CPRE.
EUS não foi superior à CPRE em termos de alívio da obstrução biliar maligna.
As drenagens realizadas por EUS podem ter menos casos de crescimento tumoral através da prótese (tumor ingrowth), mas também pode ter mais casos de impactação alimentar ou migração do stent.
GIE – Stent metálico auto-expansível coberto e descoberto para tratamento paliativo de estenoses biliares extra-hepáticas primárias malignas: um estudo multicêntrico randomizado
Massimo Conio, Benedetto Mangiavillano, Angelo Caruso, Rosa Angela Filiberti, Todd H. Baron, Luca De Luca, Sergio Signorelli, Mattia Crespi, Mario Marini, Paolo Ravelli, Rita Conigliaro, Antonella De Ceglie
Os stents metálicos auto-expansíveis (SEMSs) são usados para aliviar obstruções biliares malignas. Nosso objetivo foi comparar a permeabilidade do stent, a taxa de eventos adversos e a sobrevida global dos stents metálicos cobertos versus descobertos em pacientes com estenoses biliares primárias extra-hepáticas malignas, não candidatos para a cirurgia.
Métodos
Trata-se de um estudo multicêntrico randomizado que analisou 158 pacientes com obstrução biliar maligna distal inoperável realizada em 5 centros de referência italianos entre dezembro de 2014 e outubro de 2016. 78 pacientes foram randomizados para receber um SEMS totalmente coberto e 80 pacientes receberam SEMSs descobertos. Dados de 148 (72 cobertos e 76 descobertos) de 158 pacientes foram analisados.
Resultados
O tempo médio de perviedade do stent foi menor para os descobertos (240 dias vs 541 dias para USEMS; P =, 031). Eventos adversos ocorreram com 19 dos pacientes com stents cobertos (26,4%) e 10 descobertos (13,2%); P = 0,061
As principais causas da disfunção dos cobertos foram migração (7% vs 0% no grupo descobertos ) e oclusão precoce, principalmente por causa do “sujidade” (necrose tumoral associada à barro biliar) ou supercrescimento.
A oclusão tardia do stent por causa do crescimento do tumor ocorreu em 13,2% dos pacientes no grupo com stents descobertos. Não houve diferenças significativas nos níveis de melhoria da bilirrubina conjugada ou na sobrevida global entre os grupos. Sobrevida mediana foi de 134 dias no grupo cobertos e 112 dias no grupo descobertos (P = .23).
Conclusão
O número de eventos adversos relacionados ao stent foi maior, embora não significativamente, entre os pacientes do grupo coberto. Os stents cobertos tiveram uma taxa de migração significativamente maior do que descobertos. Os descobertos tambem apresentaram oclusão mais cedo. Uma diferença significativa na taxa de permeabilidade foi observada em favor do grupo dos stents descobertos.
ENDOSCOPY – Fatores associados ao sangramento tardio após a ressecção de grandes pólipos colorretais não pediculados
Elliott, Timothy R.; Tsiamoulos, Zacharias P.; Thomas-Gibson, Siwan; Suzuki, Noriko; Bourikas, Leonidas A.; Hart, Ailsa; Bassett, Paul; Saunders, Brian P.
A hemorragia tardia é a complicação significativa mais comum após a ressecção endoscópica em piecemeal dos grandes pólipos colorretais não pediculados. Fatores de risco para o sangramento tardio não estão completamente definidos. Nosso objetivo foi determinar os fatores de risco para o sangramento tardio após o a ressecção.
Métodos
Os dados foram analisados prospectivamente em um centro terciário com pacientes que apresentam lesões maiores que 20 mm as quais foram ressecadas por piecemeal entre 2010 e 2012. Dados do paciente, do pólipo e relacionados ao procedimento foram coletados. Quatro fatores no leito lesional pós ressecção foram avaliados para concordância interobservadores e incluídos na análise. A gravidade do sangramento tardio foi relatada de acordo com as diretrizes. Preditores de sangramento foram identificados.
Resultados
A hemorragia tardia que necessitou de hospitalização ocorreu após 22 de 330 procedimentos (6,7%).
Um total de 11 pacientes precisou de transfusão sanguínea; destes, 4 foram submetidos a colonoscopia de urgência, 1 sofreu embolização radiológica e 1 necessitou de cirurgia. A concordância interobservador para identificação dos quatro fatores avaliados no leito lesional pós ressecção em piecemeal foi moderada (faixa de kappa de 0,52 a 0,57). Os fatores associados ao sangramento tardio foram fibras musculares visíveis (P = 0,03) e a presença de “mancha vermelho cereja” (P = 0,05). Fatores não associados com o sangramento tardio foram classe de American Association of Anesthesiologists, uso de aspirina, tamanho de pólipo, local e uso de coagulação de plasma de argônio.
Conclusões
Fibras musculares visíveis e a presença de “mancha vermelha de cereja” no leito da ressecção foram associadas com sangramento tardio. Esses achados sugerem que a avaliação e a documentação fotográfica do leito lesional após a ressecção em piecemeal são importantes e, quando consideradas juntamente com outros fatores do paciente e do procedimento, podem ajudar a reduzir a incidência e a gravidade do sangramento tardio.
QUIZ !!! Acerta esse ?
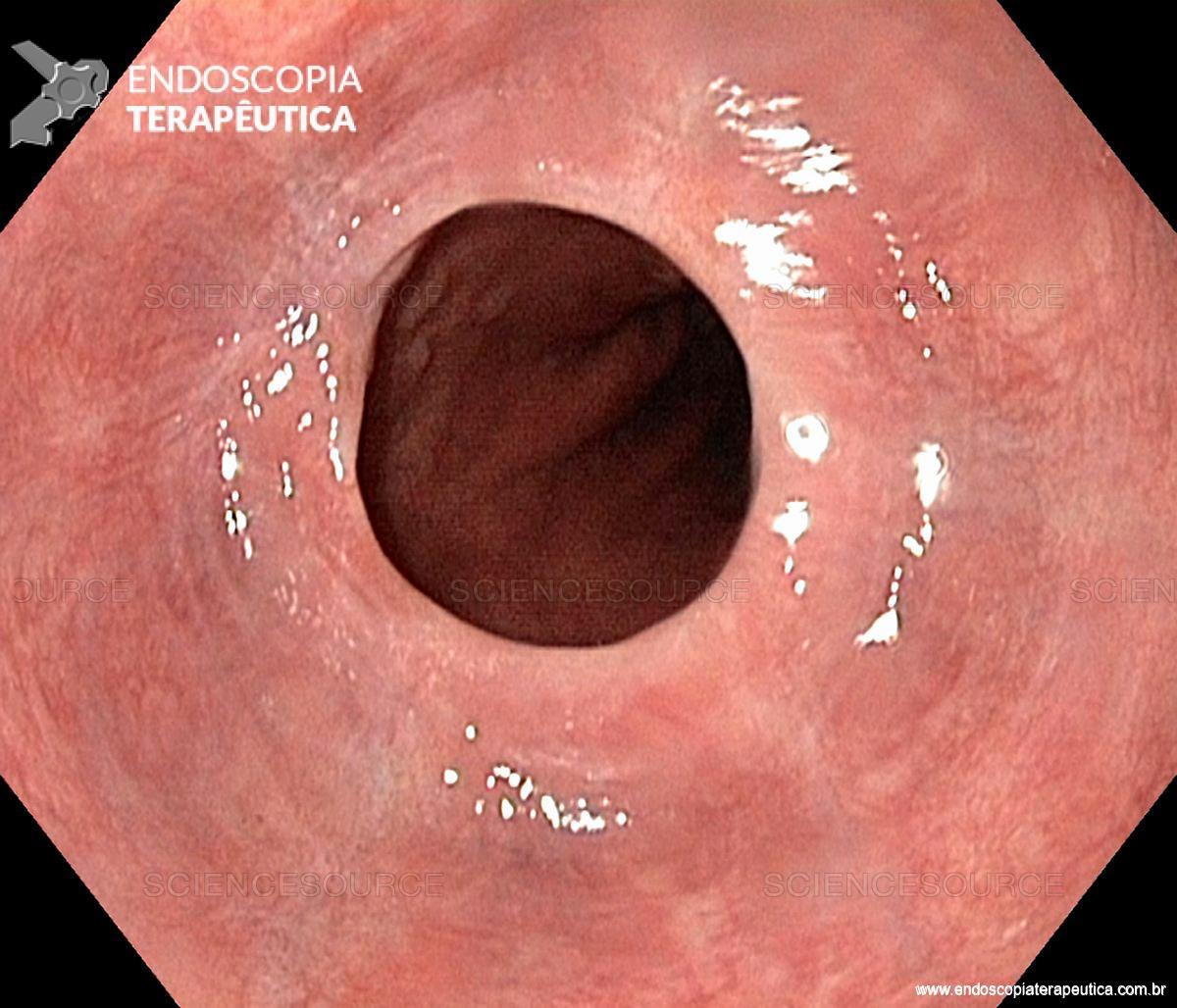
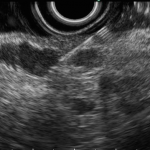
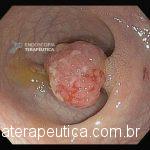
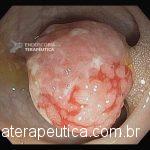
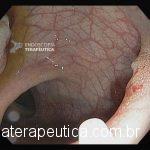
Paciente, feminina, 64 anos, realiza endoscopia digestiva alta de rotina, a qual evidenciou, lesão gástrica subepitelial, medindo cerca de 25 mm, endurecida ao toque da pinça e recoberta por mucosa íntegra. Foi submetida à ecoendoscopia que mostrou uma lesão hipoecoica, homogênea, medindo cerca de 25 mm e inserida na quarta camada.
Clique nas imagens para ampliá-las !
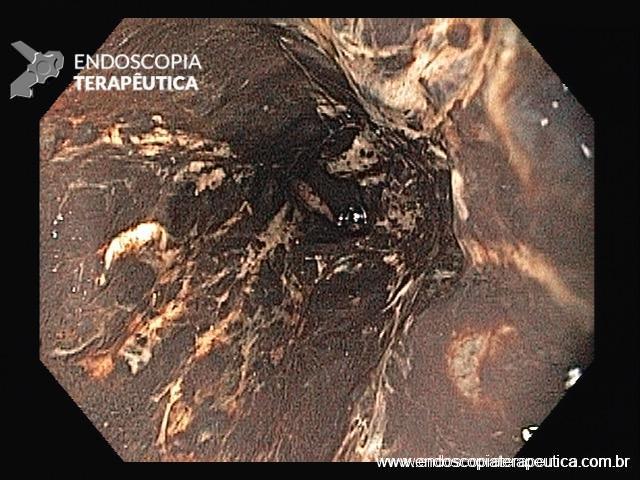
Esôfago negro
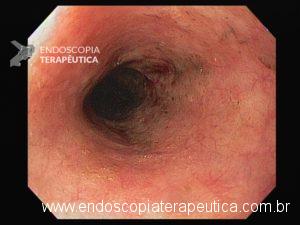
Esôfago proximal
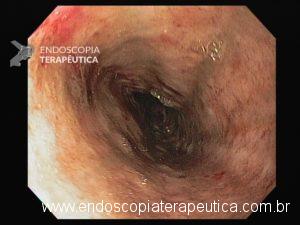
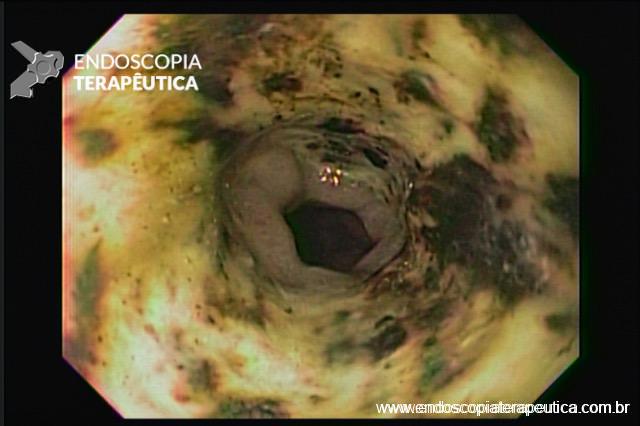
Esôfago proximal/médio
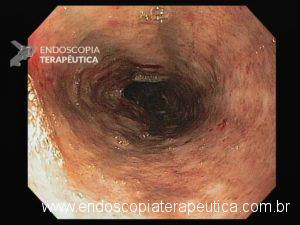
Esôfago médio
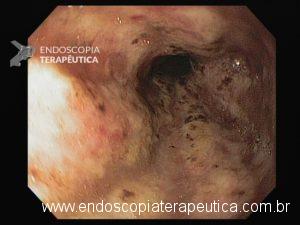
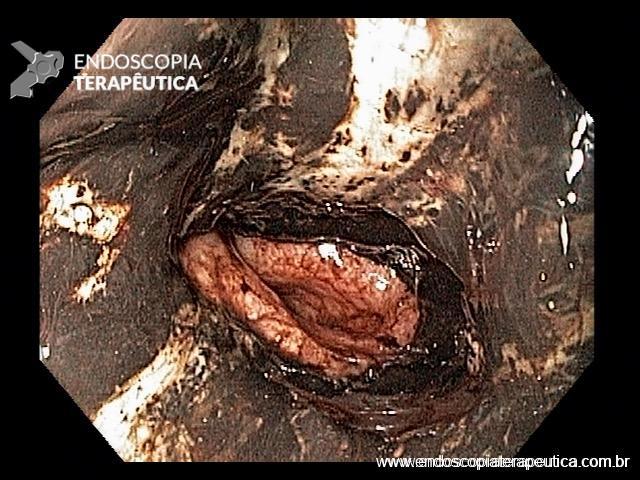
Esôfago distal
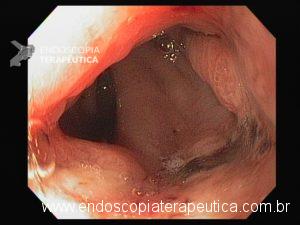
Esôfago distal
INTRODUÇÃO
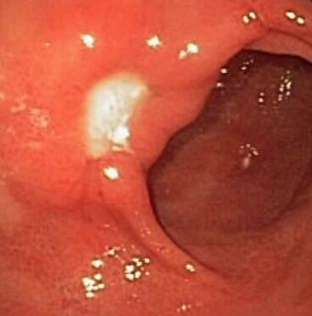
A necrose esofágica aguda (NEA), também conhecida como esôfago negro ou esofagite necrotizante, é uma síndrome rara caracterizada por uma aparência escurecida da mucosa, com comprometimento circunferencial difuso, que afeta principalmente os dois terços distais interrompendo-se abruptamente na junção gastroesofágica (a mucosa gástrica mantém-se normal).
EPIDEMIOLOGIA
A necrose esofágica aguda é uma condição rara com uma prevalência estimada de até 0,2 % em séries de autópsia. Em algumas séries de endoscopia, a prevalência da NEA variou de 0,001 a 0,2% dos casos. A incidência parece ser mais do que quatro vezes maior nos homens em comparação com as mulheres e os pacientes têm uma idade média de 68 anos no diagnóstico.
ETIOLOGIA E PATOGÊNESE
A etiologia da necrose esofágica aguda não é clara, mas a isquemia e a obstrução da saída gástrica podem ser eventos desencadeantes. Em alguns relatos tem sido associada ao uso de antibióticos de amplo espectro, infecções (por exemplo, candida albicans, citomegalovírus, vírus do herpes e klebsiella pneumoniae), volvo gástrico, hérnia paraesofágica, hiperglicemia, cetoacidose diabética, síndrome de Stevens-Johnson, vômitos intensos e prolongados, hepatite alcoólica, acidose lática e até dissecção aórtica. Ou seja, em geral são pacientes com quadro clínico bastante debilitado e com risco de comprometimento circulatório.
Outra hipótese para sua etiologia seria a presença de dois eventos associados, onde o inicial, um estado vascular de baixo fluxo, predisporia a mucosa à uma lesão intensa e o segundo causaria uma obstrução da saída gástrica levando à um acúmulo de líquido no estômago, o que promoveria um refluxo gastresofágico, resultando em lesão direta, e por fim, necrose. O que fortalece tal hipótese é que a redução temporária do fluxo sanguíneo esofágico pode resultar em necrose esofágica extensa que se resolve rapidamente quando o fluxo é reestabelecido. Além disso, a necrose esofágica aguda tende a ocorrer no terço distal do esôfago, que é relativamente hipovascularizado em comparação com outros segmentos esofágicos. A necrose da mucosa esofágica e submucosa, com trombose microscópica e recuperação rápida após o reestabelecimento do fluxo são eventos semelhantes aos ocorridos na colite isquêmica.
MANIFESTAÇÕES CLÍNICAS
Aproximadamente 70% dos pacientes com necrose esofágica aguda apresentam hemorragia digestiva alta com hematêmese e melena. Os sintomas podem aparecer rapidamente após um evento desencadeante. Outros sintomas gastrointestinais incluem: disfagia, dor epigástrica e dor torácica. Os pacientes também podem ter sintomas relacionados à patologia subjacente a qual predispôs ao evento desencadeante inicial e apresentarem-se com sinais de sepse, incluindo taquicardia e hipotensão.
ACHADOS LABORATORIAIS
Os achados laboratoriais não são específicos e frequentemente são devidos à doença subjacente. Eles incluem: acidose lática, hipoalbuminemia, anemia, insuficiência renal e hiperglicemia.
DIAGNÓTICO
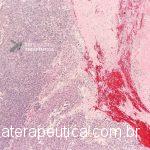
A necrose esofágica aguda é habitualmente diagnosticada incidentalmente em pacientes submetidos à endoscopia digestiva alta para avaliação de sangramento gastrointestinal. Embora a aparência endoscópica seja sugestiva, são necessárias biópsias esofágicas para excluir outras etiologias e estabelecer o diagnóstico.
Endoscopia e biópsia – Na endoscopia, é caracterizada por descoloração periférica circunferencial com tecido hemorrágico friável subjacente associado a diminutos pontos enegrecidos, e também por uma delimitação precisa entre a mucosa esofágica e a gástrica, a qual tem aparência normal distalmente à junção gastroesofágica.
Geralmente envolve o terço distal do esôfago, embora o envolvimento proximal tenha sido descrito. À medida que a doença progride, o esôfago pode ficar parcialmente coberto com exsudatos brancos espessos que são descolados facilmente revelando um tecido de granulação rosa. Esses exsudatos provavelmente representam células mucosas espalhadas.
As biópsias servem para diferenciar a necrose de outras condições nas quais a mucosa também pode estar escurecida e também para descartar causas infecciosas, como por exemplo, candida albicans, citomegalovírus, vírus herpes simples e klebsiella pneumoniae.
Na histologia, há necrose extensa comprometendo a mucosa e a submucosa. Inflamação e destruição parcial de fibras musculares adjacentes podem ocasionalmente ser observadas, e os vasos sanguíneos às vezes são trombosados e/ou ocluídos.
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial inclui outras condições em que a mucosa esofágica também pode estar escurecida. A necrose esofágica aguda pode ser diferenciada destas condições pela história clínica e pela biópsia.
- Melanose – melanose esofágica tem sido descrita em pacientes com esofagite crônica subjacente. É mais comumente observada no esôfago distal. Em contraste com a necrose esofágica aguda, a descoloração é frequentemente focal. As biópsias revelam melanócitos com características de coloração de pigmento semelhantes à melanina.
- Pseudomelanose – A pseudomelanose é devida à deposição de tecido de pseudomelanina, um pigmento derivado da degradação lisossômica. Na histologia, um pigmento marrom composto por lipofuscina e melanina pode ser visualizado dentro dos macrófagos.
- Melanoma – O melanoma primário do esôfago é raro. Geralmente se origina no esôfago médio e distal e tem uma aparência polipoide. O diagnóstico é feito pela presença de atividade melanocítica juncional na avaliação histológica da mucosa esofágica.
- Acantose nigricans – é caracterizada por placas de aspecto aveludado, verrucoso e hiperpigmentado. Embora possa ser benigno, também pode ser um fenômeno paraneoplásico comumente associado a neoplasias malignas intra-abdominais.
- Resíduo de carvão – O pó de carvão ou o carbono é o pigmento exógeno mais comum a ser depositado nos tecidos do corpo humano. O mecanismo pelo qual o pó de carvão é depositado no esôfago não está claro.
- Ingestão cáustica – O dano esofágico grave causado pela ingestão de agentes corrosivos pode provocar desprendimento da mucosa e uma pigmentação preta da parede esofágica. Tais pacientes podem apresentar um histórico de ingestão cáustica e podem ter queimaduras orofaríngeas associadas.
- Esofagite Pseudomembranosa – geralmente é relatada em associação com graves doenças sistêmicas. Uma membrana concêntrica, fina, amarela ou preta, recobre os terços distais e, menos comumente, o esôfago inteiro. Pode ser desalojada da parede, revelando uma mucosa subjacente friável. Na histologia, a pseudomembrana não tem membrana basal e é composta por exsudato fibrinoso e células inflamatórias misturadas.
TRATAMENTO
Existem dados limitados para orientar o manejo da necrose esofágica aguda, e o gerenciamento de tal condição é amplamente baseado na experiência clínica.
A terapêutica inicial consiste em expansão de volume com fluidos intravenosos e tratamento da doença de base. A supressão do acidez gástrica com inibidores de bomba de prótons deve ser adotada para reduzir a lesão péptica adicional. A ingestão oral deve ser evitada por pelo menos 24 horas. O uso da suspensão de sucralfato deve ser considerado pelo seu papel na prevenção de lesão esofágica péptica associada.
As sondas nasogástricas ou nasoenterais devem ser evitadas, a menos que sejam usadas afim de descomprimir uma obstrução da saída gástrica ou se houver vômito persistente. Uma decisão sobre o uso de antimicrobiano e/ou antifúngico deve ser feita individualmente, especialmente na configuração de pacientes que estão criticamente doentes ou parecem estar sépticos.
HISTÓRIA NATURAL
Com cuidados de suporte, a resolução dos achados endoscópicos ocorre na maioria dos pacientes. No entanto, as taxas de mortalidade em pacientes com necrose esofágica aguda variam de 13 a 35%. A mortalidade é em grande parte devido à doença de base, sendo que apenas 6% das mortes são diretamente atribuíveis à complicações da NEA.
COMPLICAÇÕES
- Perfuração esofágica – A perfuração esofágica é uma complicação aguda da necrose esofágica que ocorre em menos de 7% dos pacientes, mas requer intervenção urgente dada a alta mortalidade associada. A presença de dor retroesternal ou lombar severa persistente pode indicar seu aparecimento. Pacientes com perfuração esofágica podem ter crepitação à palpação da parede torácica devido à presença de enfisema subcutâneo.
- Estenose esofágica – As estenoses esofágicas são complicações à longo prazo da necrose esofágica aguda e ocorrem em 25 a 40 % dos pacientes. Os pacientes com estenoses geralmente apresentam disfagia gradualmente progressiva e habitualmente requerem dilatação endoscópica.
VEJA MAIS IMAGENS ABAIXO
(clique para ampliá-las)
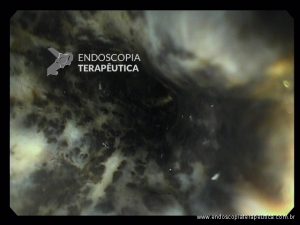
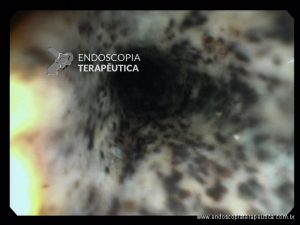

Confira também: Esofagite por cândida – Kodsi
Bibliografia
QUIZ !!! Vamos ver se você acerta mais uma ?
Criança de 5 anos foi encaminhada ao serviço de endoscopia devido à queixa de hematoquezia há cerca de 6 meses. Negava qualquer outro sinal ou sintoma.
Foi submetida à colonoscopia que evidenciou um pólipo subpediculado à aproximadamente 4 cm da borda anal, medindo cerca de 1,5 cm, com porção cefálica apresentando algumas erosões, e coloração avermelhada. Realizada polipectomia sem intercorrências.
Curso de Endoscopia Digestiva Terapêutica do Hospital Israelita Albert Einstein
Síndrome de Mirizzi
Em 1948, o cirurgião argentino Pablo L. Mirizzi descreveu um paciente com obstrução parcial do hepatocolédoco secundário a cálculo biliar impactado no infundíbulo da vesícula biliar associado à resposta inflamatória envolvendo o ducto cístico e o ducto hepático comum. Essa apresentação tornou-se conhecida como Síndrome de Mirizzi (SM).

Pablo Luis Mirizzi (1893-1964)
Inicialmente, Mirizzi caracterizou a síndrome por associação dos seguintes fatores: ducto cístico com trajeto paralelo ao ducto hepático comum, cálculos impactados no ducto cístico ou no infundíbulo da vesícula biliar, obstrução mecânica do ducto hepático comum por cálculos ou secundário à inflamação, icterícia contínua ou intermitente e colangite recorrente.
Atualmente, ela compreende um espectro de apresentações que variam desde a compressão extrínseca do hepatocolédoco até a presença de fístula colecistobiliar.
É uma complicação relativamente rara, ocorrendo em 0,05% – 3,95% dos pacientes com colelitíase.
Possui maior prevalência em mulheres com idade entre 21 e 90 anos, provavelmente um reflexo da preponderância de litíase biliar nesse grupo.
Quadro clínico e laboratorial
O quadro clínico-laboratorial da SM não é específico. Na anamnese, normalmente o paciente relata colelitíase de longa data, episódios de icterícia obstrutiva e passado de colecistite aguda e/ou colangite.
Os sinais e sintomas referidos geralmente incluem:
- dor abdominal em hipocôndrio direito e/ou epigástrio;
- icterícia;
- náuseas e vômitos;
- colúria;
- febre.
Quanto aos exames laboratoriais, as transaminases costumam estar elevadas, bem como a bilirrubina direta, a fosfatase alcalina e a gama- GT.
Cerca de 80% dos pacientes com SM apresentam icterícia, dor abdominal e alterações das provas de função hepática.
Exames de imagem
A ultrassonografia e a tomografia computadorizada de abdome podem sugerir o diagnóstico de SM ao revelar cálculo(s) fixo(s) na área do infundíbulo, próximo à junção do ducto cístico com o hepático comum, e dilatação das vias biliares acima do local da compressão.
A colangiopancreatografia retrógrada endoscópica (CPRE) também pode revelar compressão ou estreitamento do hepatocolédoco.
A ecoendoscopia no diagnóstico da coledocolitíase, independentemente do tamanho do cálculo ou do diâmetro coledociano, é um teste diagnóstico mais acurado do que a CPRE para a detecção de cálculo na via biliar principal.
Para o diagnóstico da SM, a ecoendoscopia apresenta uma sensibilidade de 97% e especificidade de 100%.
A colangioressonância pode demonstrar com precisão a presença de dilatação biliar, o grau de obstrução, a localização intra ou extraluminal dos cálculos, podendo revelar ainda alterações anatômicas, como fístulas e malformações.
Classificação
A síndrome de Mirizzi, que antes era classificada em apenas quatro tipos, atualmente, inclui mais um, o tipo V, que compreende a fístula colecistoentérica.
Os tipos são:
I) compressão extrínseca do ducto hepacolédoco por cálculo no infundíbulo da vesícula ou no ducto cístico;
II) presença de fístula colecistobiliar com erosão de diâmetro inferior a 1/3 da circunferência do ducto hepacolédoco;
III) presença de fístula colecistobiliar com diâmetro superior a 2/3 da circunferência do ducto hepacolédoco;
IV) presença de fístula colecistobiliar que envolve toda a circunferência do ducto hepacolédoco;
V) qualquer tipo, mais fístula colecistoentérica (Va: sem íleo biliar e Vb: com íleo biliar).
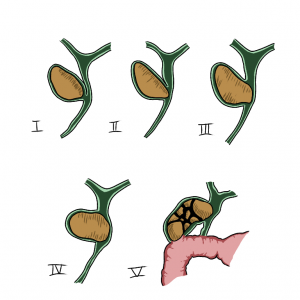
Classificação de Csendes para a síndrome de Mirizzi. Modificado de Lacerda PS, et al. Mirizzi syndrome: a surgical challenge. Arq Bras Cir Dig. 2014.
Tratamento
Os casos de Mirizzi tipo I, ou seja, sem fístula colecistobiliar, podem ser tratados pela colecistectomia clássica. Porém, em casos de extenso processo inflamatório, a colecistectomia subtotal com remoção dos cálculos pode ser mais adequada.
Mirizzi II/III (fístula colecistobiliar): abordagem dos pacientes com fístula colecistobiliar envolve colecistectomia subtotal fundo-cística. A vesícula biliar deve ser removida deixando um remanescente de parede medindo cerca de 5-10 mm ao redor da fístula colecistobiliar, a fim de permitir a coledocoplastia do ducto biliar destruído. A exploração do colédoco deve ser sempre realizada usando uma incisão distal à fístula e protegida por um tubo Kehr.
No tipo IV, devido à extensa destruição da via biliar, o tratamento consiste em anastomose bilioenterica.
No tipo V, deve ser realizada a sutura da víscera acometida.
A CPRE e a colangioscopia podem ser realizadas também como técnicas alternativas de tratamento em pacientes sem condições cirúrgicas.
Como citar este artigo
Ruiz RF, Martins B. Síndrome de Mirizzi. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/mirizzi/
Referências
- Safioleas M, et al. Mirizzi Syndrome: an unexpected problem of cholelithiasis. Our experience with 27 cases International Seminars in Surgical Oncology 2008;5:12.
- Waisberg J, et al. Benign Obstruction of the common hepatic duct (Mirizzi Syndrome): diagnosis and operative management. Arq Gastroenterol 2005;42(1).
- Beltran MA, Csendes A, Cruces Ks. The Relationship of Mirizzi Syndrome and Cholecystoenteric Fistula: Validation of a Modified Classification. World J Surg 2008; 32:2237-2243.
- Fonseca Neto OCL, Pedrosa MGL, Miranda Al. Surgical management of Mirizzi syndrome. ABCD Arq Bras Cir Dig. 2008;21(2):51-4.
- Machado MAC, et al. Colecistectomia Videolaparoscópica em paciente com Síndrome de Mirizzi. Rev Hosp Clin Fac Med S Paulo 1997;52(6):324-327.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Técnica modificada para realização da gastro-jejunostomia endoscópica percutânea
Modified technique for percutaneous endoscopic gastrojejunostomy placement
Rev. Col. Bras. Cir. 2017; 44(4): 413-415
INTRODUÇÃO
A realização da gastrostomia endoscópica percutânea (PEG) proporciona nutrição enteral segura e a longo prazo em pacientes com disfagia ou ingestão oral insuficiente(1).
No entanto, as complicações relacionadas à nutrição gástrica, como pneumonia por aspiração e vazamento periostomal grave, podem impedir o uso da PEG. A nutrição jejunal pode superar essas complicações com o fornecimento de dieta após o piloro(2) .
A alimentação jejunal é comumente obtida colocando-se uma extensão jejunal através de um tubo de PEG existente. Este procedimento é referido como gastrojejunostomia endoscópica percutânea (PEG-J). A PEG-J tem algumas indicações frequentes como (3):
- gastroparesia grave
- obstrução pilórica
- pacientes com gastrostomia, mas com refluxo gastroesofágico grave, e aspirações pulmonares de repetição
Diversas técnicas para realização da PEG-J já foram relatadas na literatura, com significativas variações técnicas entre elas e diferentes impactos na taxa de sucesso do procedimento. Neste artigo sugerimos modificações à técnica inicialmente descrita por Sibille et al. 4 , para minimizar o risco de uma de suas principais complicações: a migração da extensão jejunal de volta para o estômago.
RELATO TÉCNICO
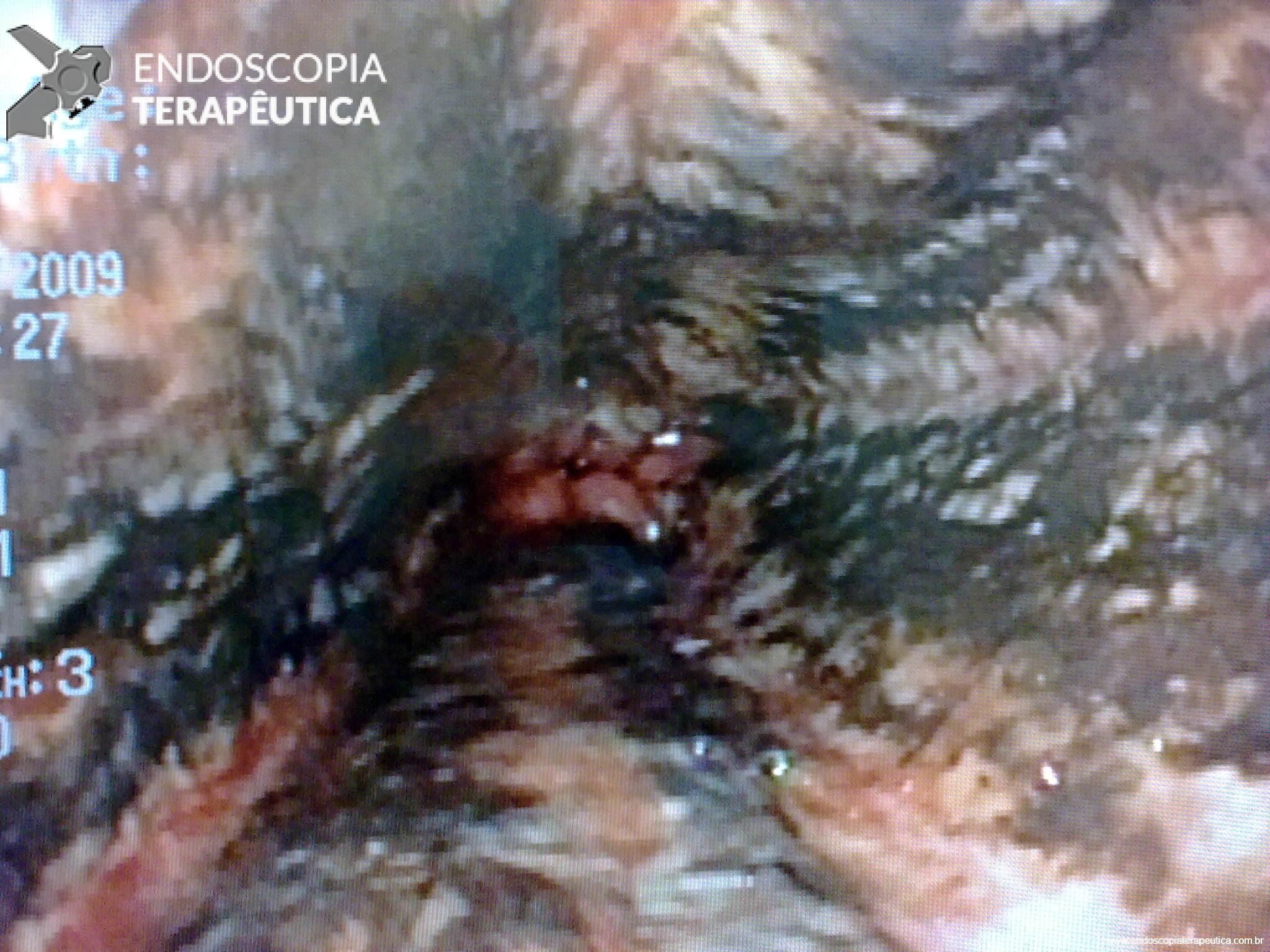
A técnica modificada que estamos sugerindo deve ser realizada por um endoscopista juntamente com outro médico ou um auxiliar. Após a realização da gastrostomia endoscópica percutânea (PEG) como descrito por Gauderer, Ponsky e Izant com uma sonda de 24 Fr, o gastroscópio deve ser reintroduzido no estômago e posicionado logo abaixo da junção gastroesofágica (Figura 1). O estômago deve ser mantido insuflado enquanto o auxiliar avança o anteparo interno da sonda de gastrostomia em direção ao piloro. Eventualmente pode ser necessário usar a ponta do endoscópio para guiar a direção correta do anteparo e, se esta manobra falhar, um pinça de corpo estranho pode ser usada para carregar o anteparo interno da sonda em direção ao piloro, conforme descrito por Sibille et al. 4. Uma vez que o anteparo interno estiver posicionado na região pré-pilórica, a sonda de gastrostomia deve ter seu lúmen bem lubrificado com gel. Em seguida, o auxiliar avança suavemente a extensão jejunal através do lúmen da sonda de gastrostomia para passar o piloro em direção ao intestino delgado (a extensão jejunal atravessará diretamente o piloro sem o uso de um fio-guia). Neste ponto, o auxiliar puxa ligeiramente de volta a sonda de gastrostomia apenas para permitir que o endoscopista possa apreender a extensão jejunal com uma pinça de corpo estranho. Esta manobra irá assegurar a posição da extensão jejunal até o final do procedimento. Sob controle da visão endoscópica, o auxiliar novamente puxa a sonda de gastrostomia de volta em direção à parede gástrica até sentir resistência, o que indica que o anteparo interno está em contato novamente com a parede gástrica. Finalmente, a extremidade proximal da extensão jejunal deve ser conectada à sonda de gastrostomia e tanto a pinça como o gastroscópio são então removidos.
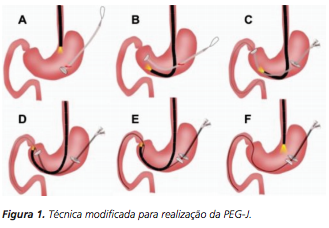
DISCUSSÃO
Os pacientes em condições críticas e geriátricos frequentemente necessitam de nutrição enteral, que é preferível à parenteral. No entanto, o esvaziamento gástrico é comumente prejudicado por gastroparesia, particularmente em pacientes com diabetes ou com comorbidades graves(4,6). Para permitir um fluxo adequado da dieta enteral para o intestino delgado e diminuir a regurgitação ou aspiração, a dieta deve ser fornecida após o ângulo de Treitz. Assim, a PEG-J ainda é a melhor opção para esses pacientes. Além disso, a PEG-J possibilita a sucção gástrica para reduzir a regurgitação.
O procedimento de colocação de uma PEG-J, entretanto, é muitas vezes um desafio técnico. Neste artigo demonstramos uma técnica modificada para a colocação da PEG-J com objetivo de evitar a principal dificuldade do procedimento: formação de alça na extensão jejunal dentro do estômago.
Fluoroscopia e fio-guia não são necessários com o uso desta técnica. Na verdade, o fio-guia em si não impede a possibilidade de formação de alça enquanto se avança a extensão jejunal. E a visão endoscópica após o posicionamento da extensão jejunal no intestino delgado torna a fluoroscopia desnecessária.
Além disso, não foi adotada a técnica de passagem inicial de um fio-guia, conforme descrito por DeLegge et al. (7), pois em alguns casos esta abordagem tornou a extensão jejunal mais rígida, e impediu a passagem da extensão do bulbo para o segunda porção duodenal.
CONCLUSÕES
O passo chave na nossa técnica modificada é o posicionamento da sonda de gastrostomia junto ao piloro enquanto a extensão jejunal é avançada através do duodeno. Esta simples manobra, realizada sob controle visual, evitou a formação de alça dentro do estômago na extensão jejunal, que muitas vezes pode complicar o procedimento e torná-lo mais demorado.
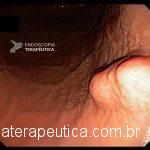
Após a realização de diversos casos, tive dificuldade em posicionar alguns anteparos na região pré-pilórica devido à desvios do piloro, fato que por vezes impediu o sucesso do procedimento. Portanto, comecei “intubar” o piloro com anteparo interno posicioná-lo no bulbo duodenal (sempre com auxílio de uma pinça; de corpo estranho se possível). Veja foto abaixo. Com essa manobra observei que a taxa de sucesso aumentou consideravelmente.
E você ? Também já sofreu para passar uma sonda dessas ? Relate sua experiência para nós. Assim todos poderemos aprender juntos !
REFERÊNCIAS
1. Toh Yoon EW, Yoneda K, Nakamura S, Nishihara K. Percutaneous endoscopic transgastric jejunostomy (PEG- -J): a retrospective analysis on its utility in maintaining enteral nutrition after unsuccessful gastric feeding. BMJ open Gastroenterol. 2016;3(1):e000098. Erratum in: BMJ Open Gastroenterol. 2016;3(1):e000098corr1.
2. Zhang Z, Xu X, Ding J, Ni H. Comparison of postpyloric tube feeding and gastric tube feeding in intensive care unit patients: a meta-analysis. Nutr Clin Pract. 2013;28(3):371-80.
3. DiSario JA. Endoscopic approaches to enteral nutritional support. Best Pract Res Clin Gastroenterol. 2006;20(3):605-30.
4. Sibille A, Glorieux D, Fauville JP, Warzée P. An easier method for percutaneous endoscopic gastrojejunostomy tube placement. Gastrointest Endosc. 1998;48(5):514-7.
5. Gauderer MW, Ponsky JL, Izant RJ Jr. Gastrostomy without laparotomy: a percutaneous endoscopic technique. J Pediatr Surg. 1980;15(6):872-5. 6. Heyland D, Cook DJ, Winder B, Brylowski L, Van deMark H, Guyatt G. Enteral nutrition in the critically ill patient: a prospective survey. Crit Care Med. 1995;23(6):1055-60. 7. DeLegge MH, Patrick P, Gibbs R. Percutaneous endoscopic gastrojejunostomy with a tapered tip, nonweighted jejunal feeding tube: improved placement success. Am J Gastroenterol. 1996;91(6):1130-4