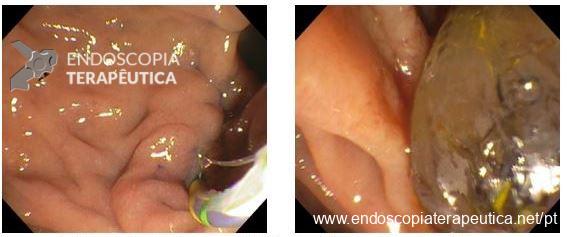
Ecoendoscopia na avaliação das neoplasias da vesícula biliar
Introdução
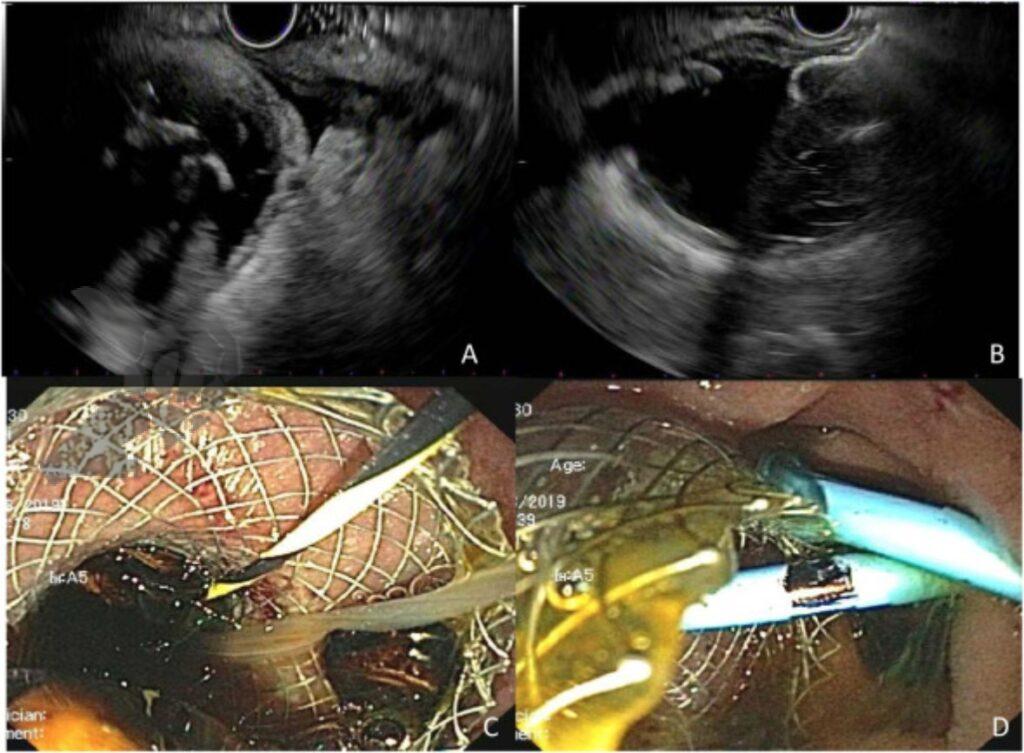
A neoplasia da vesícula biliar é geralmente diagnosticada tardiamente devido à ausência de sintomas específicos. A ecoendoscopia tem papel central na caracterização morfológica, avaliação da invasão parietal e hepática, pesquisa de linfonodos regionais e possibilidade de diagnóstico anatomopatológico por punção ecoguiada.
A proximidade anatômica, traz vantagem à ecoendoscopia em relação a ultrassonografia transabdominal e a tomografia na avaliação local detalhada.
Formas de Apresentação
As neoplasias vesiculares podem se manifestar sob duas principais formas morfológicas:
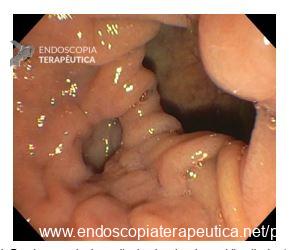
Forma Polipoide
- Lesão focal intraluminal, geralmente sólida, séssil ou com base ampla.
- Pode surgir sobre pólipo adenomatoso ou displásico (adenocarcinoma in situ).
- No EUS, os padrões suspeitos de malignidade incluem:
- Tamanho >10 mm.
- Margens irregulares e heterogeneidade interna.
- Aumento da vascularização ao Doppler.
- Perda do padrão de camadas da parede adjacente.
Obs: Pólipos <6 mm, múltiplos e hiperecogênicos costumam representar pólipos de comportamento benigno
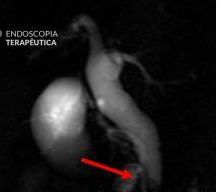
Forma Infiltrativa (Espessamento da Parede)
- O tumor se apresenta como espessamento focal assimétrico, irregular e heterogêneo da parede da vesícula.
- Pode ser diagnóstico diferencial com patologias benignas como colecistite xantogranulomatosa ou adenomiomatose, mas o EUS ajuda pela visualização das camadas da parede:
- Preservação das camadas → processo inflamatório benigno.
- Desorganização ou perda das camadas → invasão neoplásica.
- A invasão hepática é sugerida por apagamento da interface hiperecogênica entre a vesícula e o fígado.
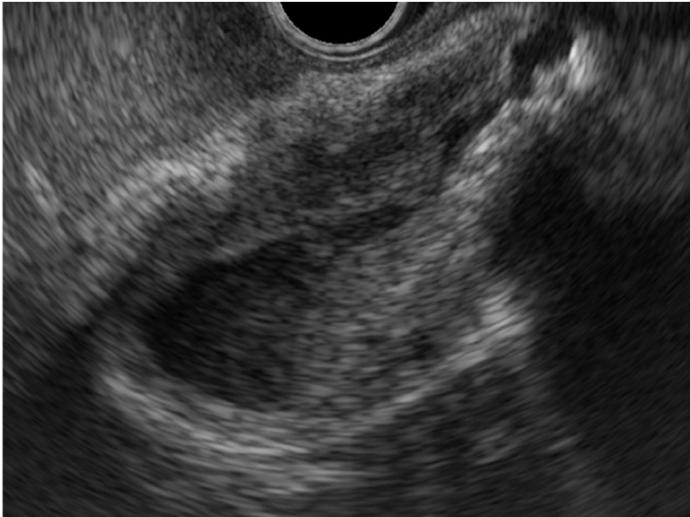
Estadiamento por EUS
| Características | Correlação Estadio | Acurácia | |
| Tipo A | Pediculado; camada adjacente preservada | Tis | 100% |
| Tipo B | Séssil / base larga; hiperecoica externa preservada | T1 | 76% |
| Tipo C | Séssil; hiperecoica estreitada | T2 | 85% |
| Tipo D | Séssil; hiperecoica desorganizada | T3-4 | 93% |
Sadamoto e colaboradores propuseram uma classificação que correlaciona os achados na ecoendoscopia com o estadio oncológico, apresentando boa acurácia nas lesões precoces e avançadas, representadas pelos tipos A e D.
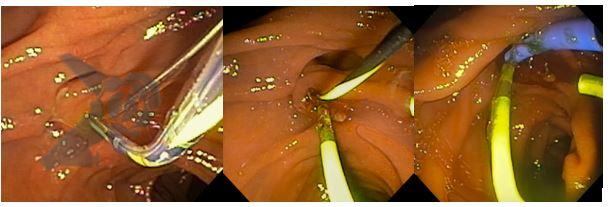
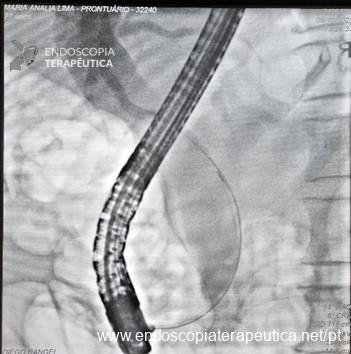
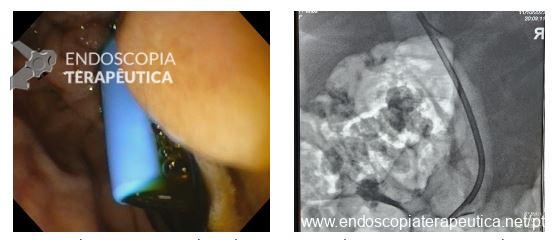
Punção Ecoguiada
- Permite diagnóstico diferencial entre neoplasia de vesícula e patologias benignas
- Direcionamento de terapia guiada por marcadores genômicos
- Avaliação de linfonodos acometidos / metastases hepáticas
- Puncionar primeiramente estas lesões e na sequência o tumor primário
- Contraindicações relativas: tumores claramente ressecáveis, devido ao risco (ainda que baixo) de disseminação peritoneal.
- Evitar transfixar a luz da vesícula pelo risco de colecistite
Contraste Harmônico
- Carcinomas: realce heterogêneo e irregular, com washout precoce.
- Pólipos benignos: realce homogêneo e sustentado.
- Aumenta a acurácia na distinção entre adenoma e carcinoma precoce, e na definição dos limites tumorais para planejamento cirúrgico.
Inteligência artificial
O uso de inteligência artificial e deep learning aplicados às imagens de EUS tem mostrado desempenho promissor para:
- Diferenciar pólipos benignos e malignos
- Detectar invasão da parede,
- Estimar o estadiamento T com acurácia superior a 90% em estudos recentes
Conclusão
A ecoendoscopia representa ferramenta precisa para avaliação detalhada das neoplasias de vesícula biliar, permitindo a caracterização morfológica, vascular, estadiamento loco-regional e amostragem tecidual guiada, desempenhando papel essencial na definição da conduta.
Referências
- Szpakowski JL, Tucker LY. Outcomes of Gallbladder Polyps and Their Association With Gallbladder Cancer in a 20-Year Cohort. JAMA Netw Open. 2020 May 1;3(5):e205143
- Sadamoto et. al. Preoperative diagnosis and staging of gallbladder carcinoma by EUS. Gastrointest Endosc. 2003 Oct;58(4):536-41.
- Takahashi et. al. Recent Advances in Endoscopic Ultrasound for Gallbladder Disease Diagnosis.
Diagnostics (Basel). 2024 Feb 8;14(4):374 - Obaid et al. Detection of Gallbladder Disease Types Using Deep Learning: An Informative Medical Method. Diagnostics (Basel). 2023 May 15;13(10):1744.
Como citar este artigo
Logiudice FP. Ecoendoscopia na avaliação das neoplasias da vesícula biliar Endoscopia Terapeutica 2025, Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/ecoendoscopia-na-avaliacao-das-neoplasias-da-vesicula-biliar/