Endoscopia no Futuro: Inteligência Artificial até que ponto?
O desenvolvimento de carros e transportes inteligentes sem condutor, assistentes virtuais da Alexa e Google Nest gerenciando a rotina domiciliar são uma realidade que permeia a atualidade e respalda um estudo de Oxford o qual estima que 47% das profissões atuais estão em risco de automação.
Na era pós-pandemia do Covid, vimos a aceleração digital alcançar a educação com vídeo-aulas, reuniões virtuais e congressos por conferência remota. Neste sentido, uma das pautas atuais é a inteligência artificial (IA) como tecnologia na Medicina nesta última década. Ela já atua em vários campos da radiologia, oftalmologia, dermatologia e neurologia, desde diagnóstico de imagens em mamografias, lesões malignas cutâneas e na retinopatia diabética.
Para compreender a IA, é essencial saber as terminologias básicas:
- Inteligência Artificial (IA): ciência multidisciplinar que envolve aprendizado automatizado;
- Machine Learning (ML): meio da IA de aprendizado automatizado por computação através de diversos métodos algorítimicos;
- Deep Learning (DL): um dos meios de ML mais atual por envolver diversas camadas de correlações algorítimicas, podendo ter pesos diferentes em cada conexão, simulando a arquitetura de rede neural.
Na gastroenterologia, a IA entremeia a Endoscopia em dois meios que podem ser vistos no Vídeo:
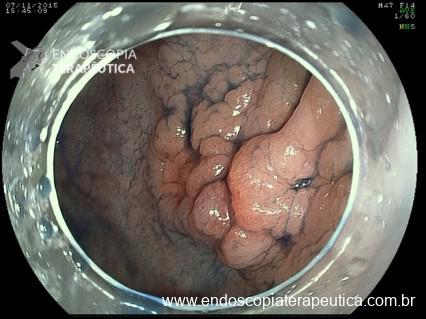
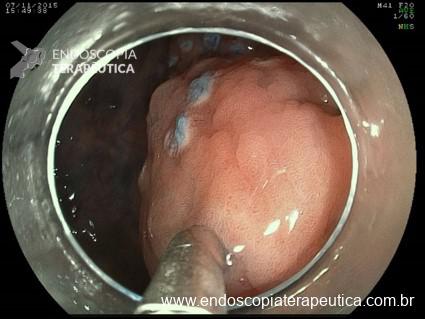
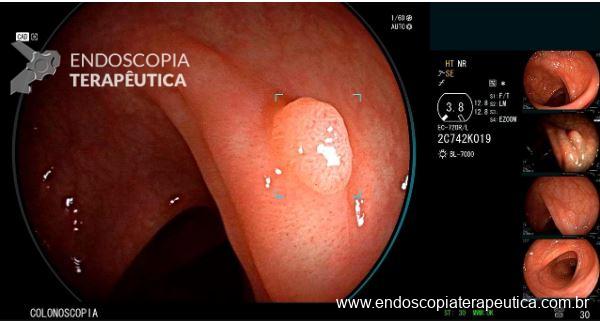
- Computer-Aided Detection (CADe): envolve o uso de ML e DL para detecção e localização de lesão. Por exemplo, a indicação de pólipos na colonoscopia, como na Figura 1, denotado por sinal azul claro em forma de retrato envolvendo o pólipo
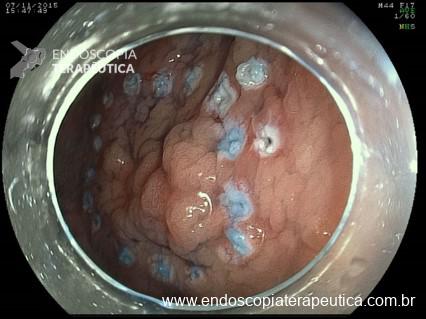
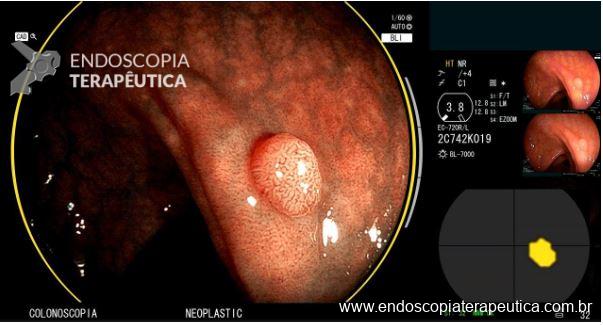
- Computer-Aided Diagnosis (CADx): envolve o uso de ML e DL para auxiliar no diagnóstico de lesões. É possível que a IA consiga diferenciar lesões neoplásicas de hiperplásicas na colonoscopia, como visto na Figura 2, com um círculo amarelo envolvendo a na visão endoscópica e demarcação da lesão no campo inferior direito.
Atualmente, o uso de IA encontra-se em diversos estudos e em fases distintas, desde validação, eficácia até a vigilância pós-comercialização com aprovação do FDA (agência reguladora de saúde e serviços nos EUA). Seu uso na endoscopia digestiva alta, cápsula endoscópica e colonoscopia podem ser separados por segmentos:
Esôfago
- Esôfago de Barrett (EB): Groof et al. obteve uma sensibilidade e especificidade maiores com IA na detecção de EB, respectivamente de 90% e 88%, quando comparado aos especialistas sem CADe de 88% e 72%, respectivamente. Ebigbo et al. desenvolveu um CADx capaz de diagnosticar cancer em EB, bem como diferenciar invasão de submucosa, de T1a de T1b, com 77% de sensibilidade e 64% de especificidade.
- Carcinoma Espinocelular (CEC): O CADe de Guo et al. conseguiu uma sensibilidade de 98% e especificidade de 95% com o auxílio de cromoscopia NBI.
Estômago
- Helicobacter pylori: Nakashima e colegas desenvolveram um CADx com sensibilidade à luz branca de 66.7%, à cromoscopia BLI de 96.7% e à cromoscopia com LCI de 96.7%.
- Câncer precoce: Kanesaka et al. conseguiram delinear por CADx as lesões suspeitas com sensibilidade e especificidade de 65.5% e 80.8%, respectivamente. Zhu e colegas desenvolveram um modelo capaz de diferenciar a profundidade da lesão, de SM1 versus SM2, com sensibilidade de 76.5% e especificidade de 95.6%, auxiliando na avaliação de ressecção endoscópica.
Intestino Delgado
- Sangramento de intestino delgado: o diagnóstico por cápsula endoscópica de Jia e colegas chegou a 99% de sensibilidade e especificidade. Aoki et al. desenvolveu um CADe para detecção de erosões e ulcerações com acurácia de 90.8%.
Intestino Grosso
- Taxa de detecção de pólipo (ADR): Um estudo randomizado de Wang et al. reportou um aumento de ADR no grupo com CADe comparado ao convencional (34% versus 28%).
- Cancer colorretal: Ito e colegas aplicaram um CADx capaz de diagnosticar a profundidade de invasão de cancer T1b, chegando a acurácia de 81,2%.
- Doença inflamatória intestinal: Campo ainda com estudos prospectivos em andamento. Maeda et al. desenvolveram um CADx predizendo inflamação histológica em retocolite ulcerativa com acurácia de 91%.
A tecnologia avança exponencialmente e o estudo de Oxford mostra que o profissional do futuro deve estar aberto a inovar e aprender. Isso não difere na Medicina, tanto que em universidades renomadas, como a Harvard Medical School nos EUA, já possuem grades curriculares que antecipam a participação dos alunos no hands-on e contato com paciente e especialidades, bem como a desenvolver soft skills de pensamento crítico, coordenação e tomada de decisão, habilidades ainda além do escopo da IA.
De tantas aplicabilidades que estão em andamento e outras a virem, a IA deverá se apresentar multimodal no campo da endoscopia. Ela envolverá não apenas a detecção e diagnóstico, mas também na decisão clínica através de previsão histológica e de risco metastático em lesões neoplásicas, auxiliando nas condutas e decisões a curto e longo prazo, podendo delinear o prazo ideal de seguimento.
Referências Bibliográficas
- Boyle, Kathleen. “TECHNOLOGY AT WORK v6. 0: The Coming of the Post-Production Society.” (2021).
- Brown, Jeremy R. Glissen, and Tyler M. Berzin. “Adoption of New Technologies: Artificial Intelligence.” Gastrointestinal Endoscopy Clinics 31.4 (2021): 743-758.
- Okagawa, Yutaka, et al. “Artificial intelligence in endoscopy.” Digestive Diseases and Sciences 67.5 (2022): 1553-1572.
Como citar este artigo
Kum, AST e Miyajima, NT. Endoscopia no Futuro: Inteligência Artificial até que ponto? Endoscopia Terapeutica 2023, vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/endoscopia-no-futuro-inteligencia-artificial-ate-que-ponto/