Você sabe quais são os critérios de indicação de ressecção endoscópica do câncer gástrico precoce e os critérios de cura (eCura)?
A Sociedade Japonesa de Endoscopia (JGES) publicou em 2021(1) um guideline atualizado de Mucosectomia e Dissecção Endoscópica da Submucosa (ESD) para câncer gástrico precoce.
Em relação às recomendações de 2016(2), os critérios expandidos foram considerados absolutos na atual edição. Persistem como critérios expandidos somente as lesões recidivadas. Algumas lesões que antes eram contraindicadas à ressecção endoscópica foram alocadas nas indicações relativas.
Avaliação pré-operatória
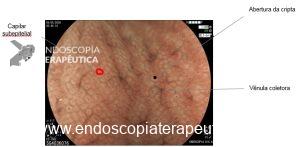
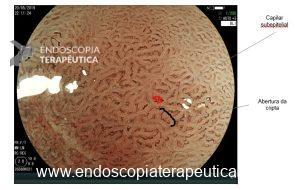
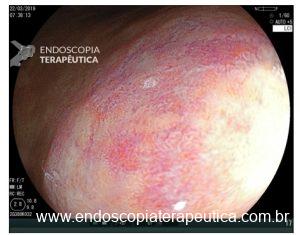
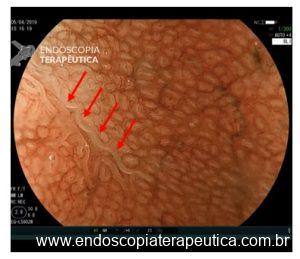
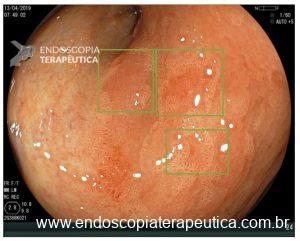
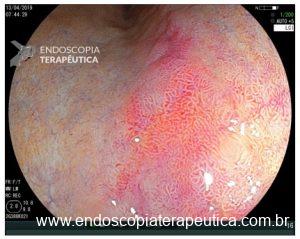
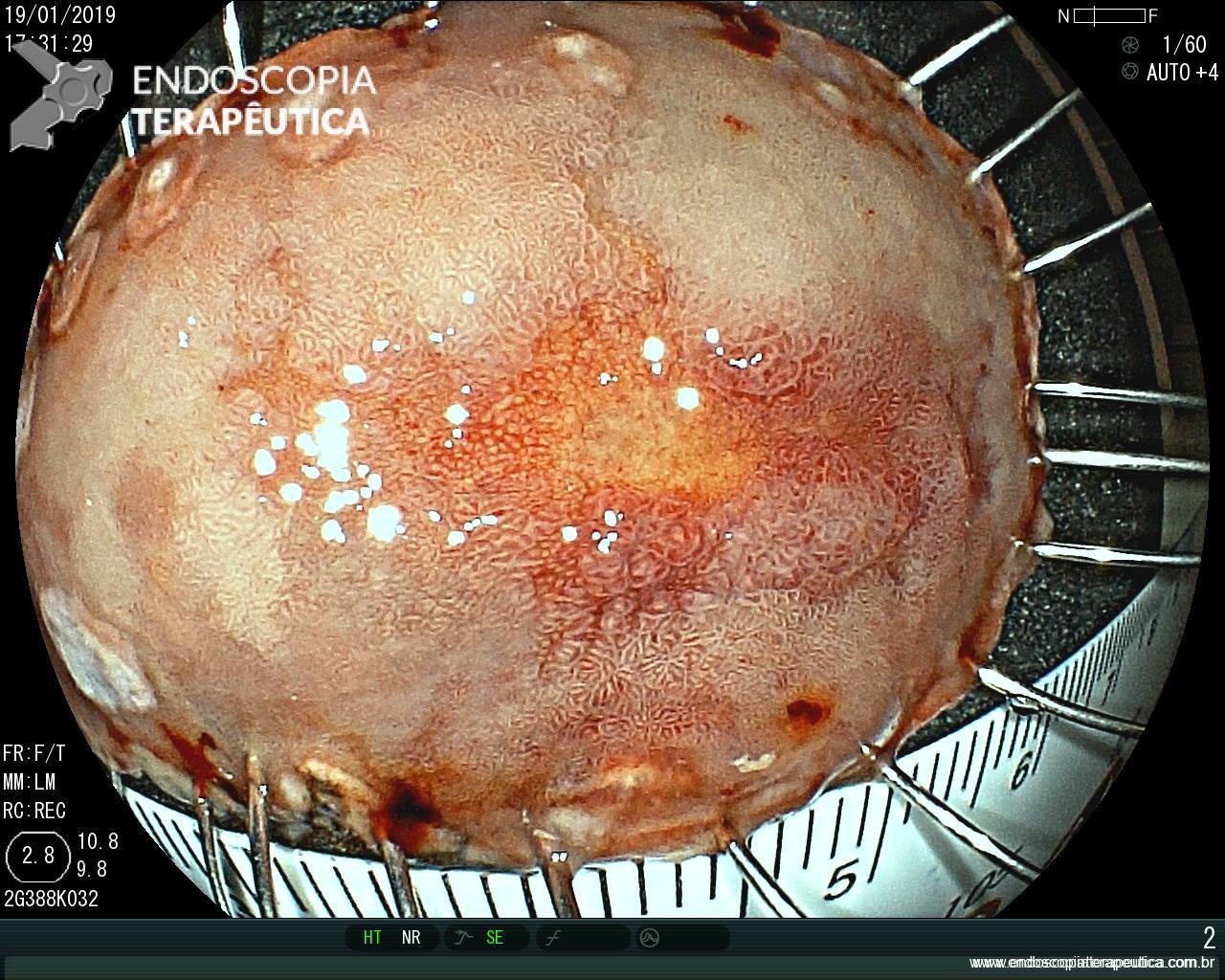
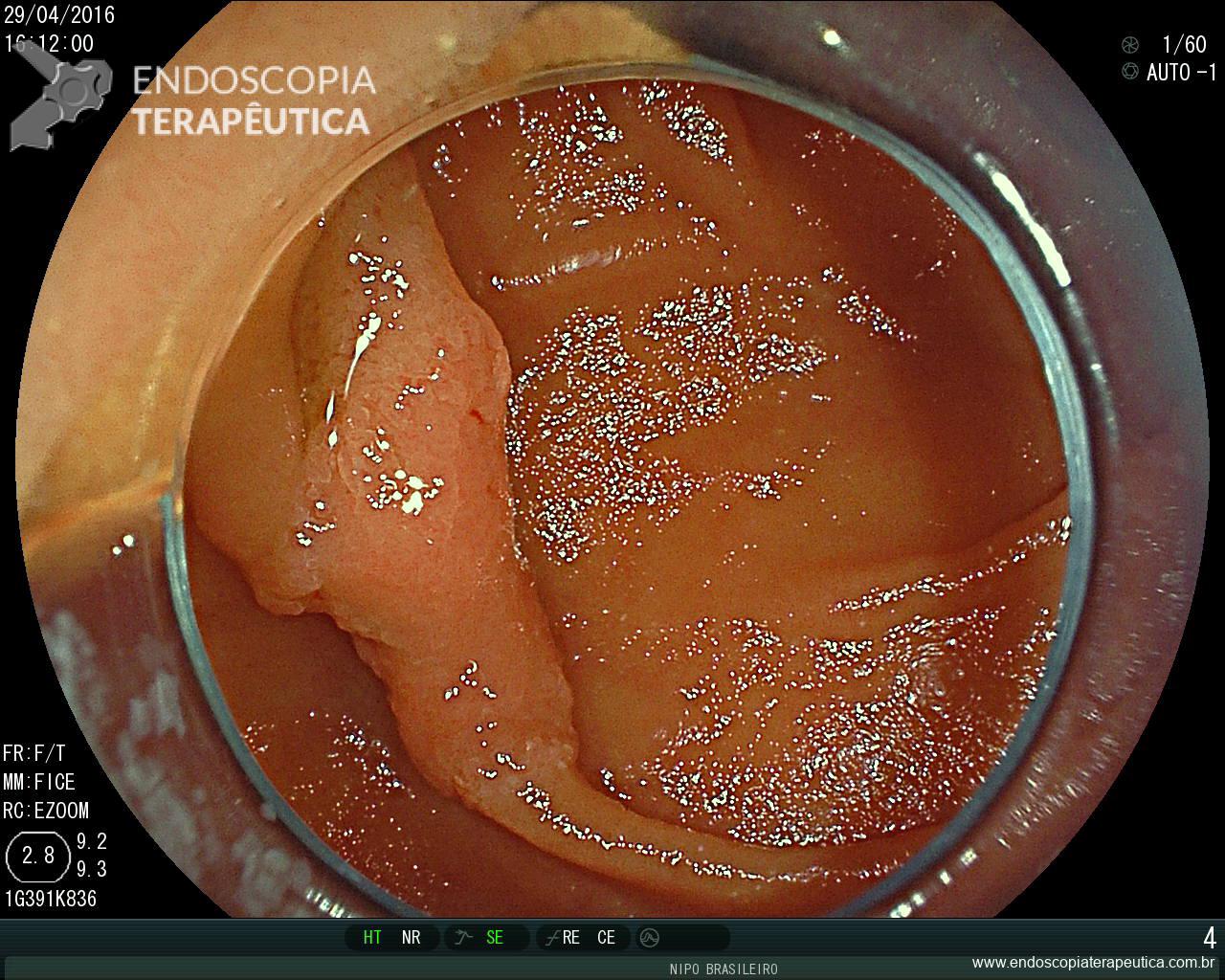
Importante ressaltar que, no estômago, a avaliação endoscópica pré-operatória nem sempre consegue predizer com acurácia a profundidade de invasão (diferente do cólon e esôfago, onde temos classificações que guiam a conduta). Achados endoscópicos que sugerem invasão da submucosa:
- hipertrofia ou convergência de pregas,
- tamanho do tumor >3cm,
- lesões muito avermelhadas,
- superfície irregular,
- elevação das margens,
- sinal da não extensão (quando a mucosa gástrica é expandida pela insuflação, as lesões com invasão maciça da submucosa não se estendem e formam uma elevação trapezoide, além disso, as pregas convergem e se tornam elevadas).
Em alguns casos, quando há dificuldade nesta informação, a Ecoendoscopia pode ser ferramenta útil.
| Em geral, a ressecção endoscópica deve ser realizada quando o risco de metástase linfonodal é extremamente baixo e os resultados a longo prazo são semelhantes aos da cirurgia. Além disso, o tamanho e a localização devem permitir a ressecção em bloco. |
Para determinar se uma lesão gástrica é passível de ressecção endoscópica curativa, devemos avaliar:
- tipo histológico
- tamanho
- profundidade de invasão
- presença ou não de ulceração.
Indicações
Segundo o Guideline de 2021 da JGES, podemos dividir as indicações de ressecção endoscópica do câncer gástrico precoce em:
- Absolutas: quando o risco de metástase linfonodal é <1% e os resultados da ressecção endoscópica se mostraram semelhantes aos da cirurgia.
- Relativas: quando a lesão não preenche os critérios absolutos, mas nos casos em que a cirurgia é arriscada ou para obter uma avaliação histopatológica acurada.
- Expandidas: lesões intramucosas recidivadas após ressecção endoscópica eCura C1
O quadro abaixo resume os critérios de indicação (tabela 1):
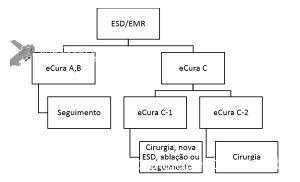
Critérios de cura:
Já os critérios de cura são divididos em:
eCuraA (ressecção curativa):
- A ressecção endoscópica é igual ou superior à cirúrgica em desfechos a longo termo. É indicado seguimento a cada 6-12 meses.
eCuraB:
- Apesar de estudos com resultados de longo prazo ainda não terem sido publicados, a cura é esperada. Estão incluídas nesses grupos lesões diferenciadas, ≤ 3 cm, SM1 (invasão até 500 micras). É indicado seguimento a cada 6-12 meses com EDA + CT.
eCuraC:
- quando a lesão não preenche os critérios acima. Pode ser dividida em:
- C-1: quando a lesão é diferenciada mas não foi ressecada em bloco ou teve margens horizontais positivas. Nesse caso, o risco de metástase é baixo. Pode-se observar, repetir a ESD, fazer ablação ou operar.
- C-2: todas as outras lesões que não preencheram os critérios. Na maioria destes casos, é indicada cirurgia devido ao potencial risco de recorrência e metástases.
DESCOMPLICANDO….
Indicações absolutas = tumores intramucosos (T1a)
- Diferenciados sem ulceração: qualquer tamanho
- Diferenciados com ulceração: <3cm
- Indiferenciados sem ulceração: <2cm
Critérios de cura:
- eCuraA = critérios absolutos + margens negativas, ausência de invasão angiolinfática à seguimento
- eCuraB = T1b (SM1), diferenciado, <3cm, margens negativas, ausência de invasão angiolinfática à seguimento
- eCuraC-1 = piecemeal ou margens horizontais positivas à seguimento
- eCura C-2 = quando não preenchem os critérios acima à cirurgia
A tabela 2 e o algorítimo 1 sedimentam os critérios de eCura e seguimento pós ESD:
Para saber mais sobre este tema, acesse o site Gastropedia clicando aqui!
Como citar esse artigo:
Moura RN. Você sabe quais os critérios de indicação e cura do ESD gástrico (eCura)? Endoscopia Terapêutica; 2022. Disponível em: endoscopiaterapeutica.net/pt/assuntosgerais/criterios-esd-gastrico-ecura
REFERÊNCIAS BIBLIOGRÁFICAS
- Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition). Dig Endosc. 2021 Jan;33(1):4-20.
- Ono H, Yao K, Fujishiro M et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer. Dig Endosc 2016; 28: 3–15.
Saiba mais sobre ESD:
Dissecção Endoscópica Submucosa (ESD): dicas para iniciar e aprimorar a técnica
Saiba mais sobre a detecção do câncer gástrico precoce clicando aqui: