CPRE: usar fio-guia curto ou longo?
Artigo publicado na Am J Gastroenterology em dezembro 2016 por Buxbaum J e col
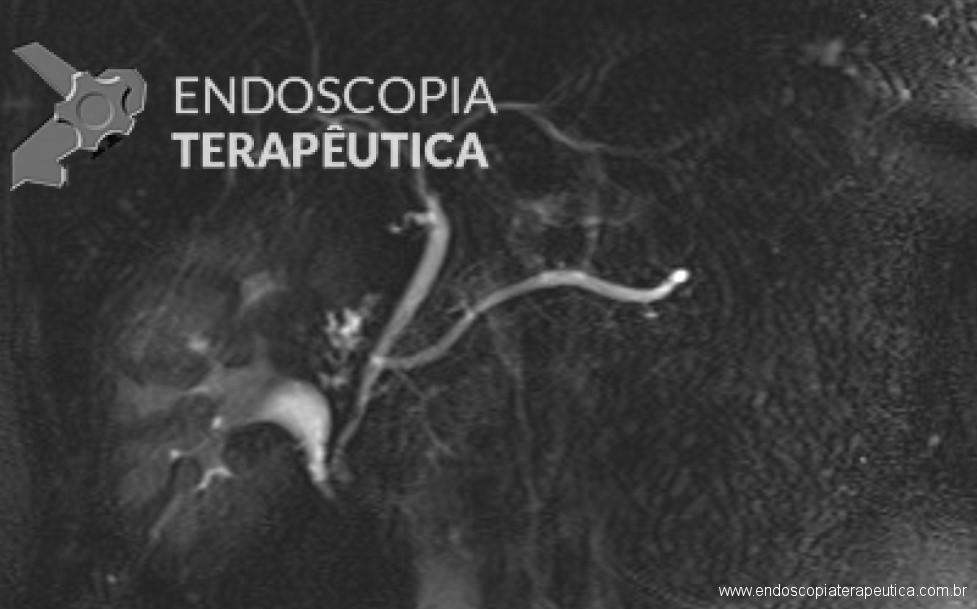
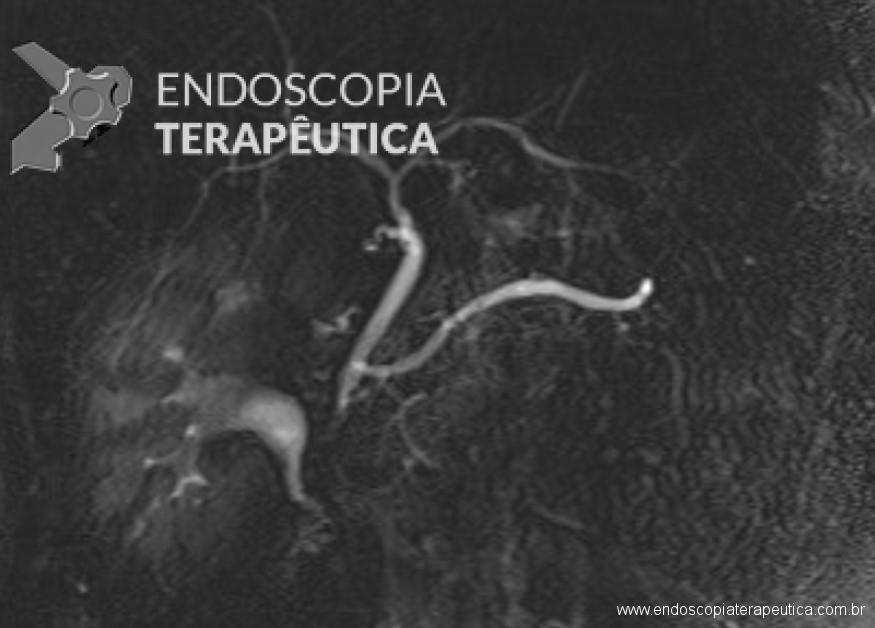
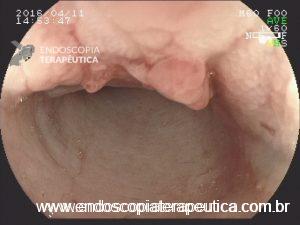
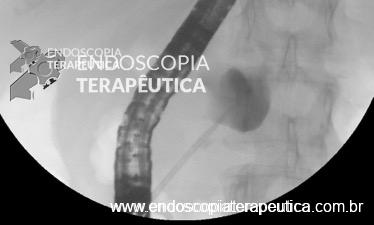
Na maioria dos casos, a canulação do ducto biliar é a parte mais desafiadora da CPRE. A dificuldade na canulação está associada à pancreatite pós-CPRE.
Os fios-guias longos clássicos, que atravessam todo o comprimento do duodenoscópio e dos acessórios, são controlados pelo assistente para auxilar a canulação. Recentemente, sistemas com fios-guias curtos foram desenvolvidos, em que todo o fio-guia, exceto sua parte mais distal (5-50 cm distais), pode ser “descascado” do papilótomo, permitindo que o endoscopista controle diretamente o fio-guia durante a canulação.
Uma pesquisa recente nos EUA revelou que 43% dos endoscopistas preferem o sistema de fio-guia curto que é controlado pelo próprio endoscopista, em comparação com 33% que preferiam o sistema de fio-guia longo controlado pelo assistente.
Uma abordagem adicional freqüentemente usada para facilitar a canulação é o uso de papilótomo com tamanho menor. Teoricamente, os papilótomos de pequeno diâmetro podem permitir o acesso a vias biliares mais diminutas.
Objetivos:
O objetivo do estudo foi avaliar a segurança e a eficácia da canulação controlada pelo endoscopista versus canulação controlada pelo assistente, e avaliar também a eficácia e segurança da canulação com uso papilótomos de menor diâmetro versus papilótomos de diâmetro padrão.
Métodos:
Ensaio-clínico randomizado e controlado realizado na Los Angeles County + University of Southern California Medical Center.
Os pacientes foram randomizados usando um design fatorial 2 × 2 para a canulação com fio-guia controlado pelo endoscopista e controlado pelo assistente numa proporção 1:1, e uso do papilótomo de menor diâmetro (ponta de 3,9 Fr) versus papilótomo padrão (ponta de 4,4 Fr) numa proporção também de 1:1.
A canulação guiada por fio-guia foi utilizada em todos os casos. Injeção de contraste foi usada apenas como uma manobra de salvamento se o avanço do fio não fosse possível.
O fio-guia de 450 cm com ponta reta foi utilizado (Jagtome Rx Biliary System; Boston Scientific; Natick, MA, EUA). Fio-guia de 0,025 polegadas foi utilizado naqueles randomizados para o papilótomo de 3,9Fr, e fio-guia de 0,035 polegadas naqueles randomizados para o papilótomo de 4.3Fr.
Foram incluídos pacientes submetidos a primeira CPRE com indicação de canulação biliar padrão, incluindo coledocolitíase, fístula e obstrução biliar.
Análise estatística:
A hipótese inicial era que haveria uma diferença de 10% na taxa de canulação bem-sucedida (85-95%). Um tamanho de amostra com 498 pacientes foi calculado para demonstrar uma diferença significativa entre os grupos. Como este foi o primeiro ensaio-clínico controlado e randomizado sobre esse tema, foi planejada uma análise intermediária quando 200 pacientes estivem incluídos no estudo.
Resultados:
O estudo foi interrompido após a análise intermediária, com 216 pacientes randomizados, devido a uma taxa significativamente menor de eventos adversos no grupo canulação controlada pelo endoscopista comparada com o grupo canulação controlada pelo assistente: 3/109 (2,8%) vs. 12/107 (11,2 %), p = 0,016; principalmente devido a uma menor taxa de pancreatite pós-CPRE: 3/109 (2,8%) vs. 10/107 (9,3%), p = 0,049 (Figura abaixo).
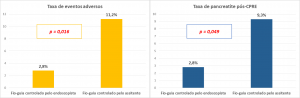
Houve uma tendência (estatisticamente não significativa: p = 0.106) de menor taxa de complicações, em especial pancreatite pós-CPRE, com o uso do papilótomo de menor diâmetro quando comparado com o uso do papilótomo padrão.
A diferença na taxa da canulação biliar bem-sucedida entre os grupos canulação controlada pelo endoscopista versus controlada pelo assistente foi não significativa: -0,5% (IC 95%: 12,0 a 11,1%); sendo também não significativa na comparação com papilótomo de menor diâmetro versus diâmetro padrão: -0,9% (IC 95%: 12,5 a 10,6%).
Comentários:
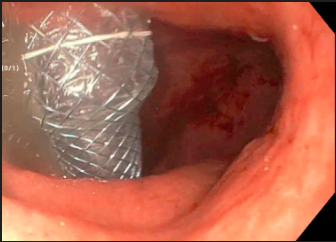
Inicialmente, a canulação biliar era obtida com uso das cânulas de CPRE seguida de injeção de contraste. Um grande impacto na abordagem da canulação foi o advento dos papilótomos no lugar das cânulas, com base em ensaios clínicos que demonstram uma eficácia superior com os papilótomos. O fio-guia na ponta distal do papilótomo permite uma flexibilização variável na direção do ducto biliar, com melhora no acesso biliar. Mais recentemente, a passagem por fio-guia em detrimento a injeção de contraste foi adotada para confirmar o acesso biliar e melhorar a segurança do procedimento. A abordagem guiada pelo fio reduziu consistentemente as taxas de pancreatite pós-CPRE em 8-15% em comparação com a injeção de contraste.
Embora seja amplamente aceito que a injeção de contraste no ducto pancreático é o principal fator responsável da pancreatite pós-CPRE, estudos recentes revelaram que a passagem do fio-guia no ducto pancreático é também um fator causal importante.
Uma das conseqüências potencialmente mais graves da passagem do fio no ducto pancreático é a perfuração traumática do ducto, que é especialmente propensa a acontecer com a passagem às cegas do fio-guia em pacientes com ductos tortuosos. Tal perfuração pode levar a fístulas e pancreatite grave.
Se a passagem do fio-guia para o ducto biliar é o objetivo, e evitar a passagem do fio-guia no ducto pancreático é um componente importante para a segurança do procedimento, isso implica em uma pergunta, quem seria o melhor para controlar o fio-guia: o endoscopista ou o assistente?
Esse estudo publicado em dezembro de 2016 na American Journal of Gastroenterology por Buxbaum e colaboradores demonstrou que a canulação controlada pelo endoscopista reduziu a taxa de eventos adversos, em especial de pancreatite pós-CPRE.
Os resultados desse estudo parecem intuitivos, pois é um fato estabelecido que o trauma mecânico repetitivo da papila, e do ducto pancreático em particular, está associado à pancreatite pós-CPRE. Com o endoscopista controlando o fio-guia, a quantidade de força usada para avançar o fio-guia pode ser substancialmente reduzida, pois há um uso mais apropriado da força, direção e profundidade na manipulação do fio-guia na abordagem controlada por endoscopista.
Dados também já disponíveis na literatura sugerem tempo de uso da fluoroscopia e tempo de procedimento mais curtos com o uso do fio-guia controlado pelo endoscopista (Fazel A, et al. Gastrointest Endosc. 2006).
Artigo deste post: