Máscaras N95 – conceitos e recomendações
Uma máscara N95 ou um respirador N95 é um respirador de partículas que filtra pelo menos 95% das partículas transportadas pelo ar (0,3 mícrons). Se instalados adequadamente, os recursos de filtragem dos respiradores N95 excedem os das máscaras faciais. No entanto, mesmo um respirador N95 devidamente ajustado não elimina completamente o risco de doença.
- A N95 é um tipo de filtering facepiece respirator (FFR ou FFP)
- Esse tipo de respirador protege contra partículas, mas não gases ou vapores.
- A letra N indica que a máscara não é resistente a óleo.
| Oil resistance | Rating | Description |
| Not oil resistant | N95 | Filters at least 95% of airborne particles |
| N99 | Filters at least 99% of airborne particles | |
| N100 | Filters at least 99.97% of airborne particles | |
| Oil resistant | R95 | Filters at least 95% of airborne particles |
| R99 | Filters at least 99% of airborne particles | |
| R100 | Filters at least 99.97% of airborne particles | |
| Oil proof | P95 | Filters at least 95% of airborne particles |
| P99 | Filters at least 99% of airborne particles | |
| P100 | Filters at least 99.97% of airborne particles |
O padrão europeu classifica em 3 classes: FFP1, FFP2, and FFP3 que correspondem a filtração mínima de 80%, 94%, and 99%. Portanto, respiradores FFP2 são equivalentes a N95, sendo a recomendação de proteção contra doenças transmitidas pelo ar em diversos países.
Como colocar, ajustar e retirar uma máscara N95
https://www.cdc.gov/niosh/docs/2010-133/pdfs/2010-133.pdf
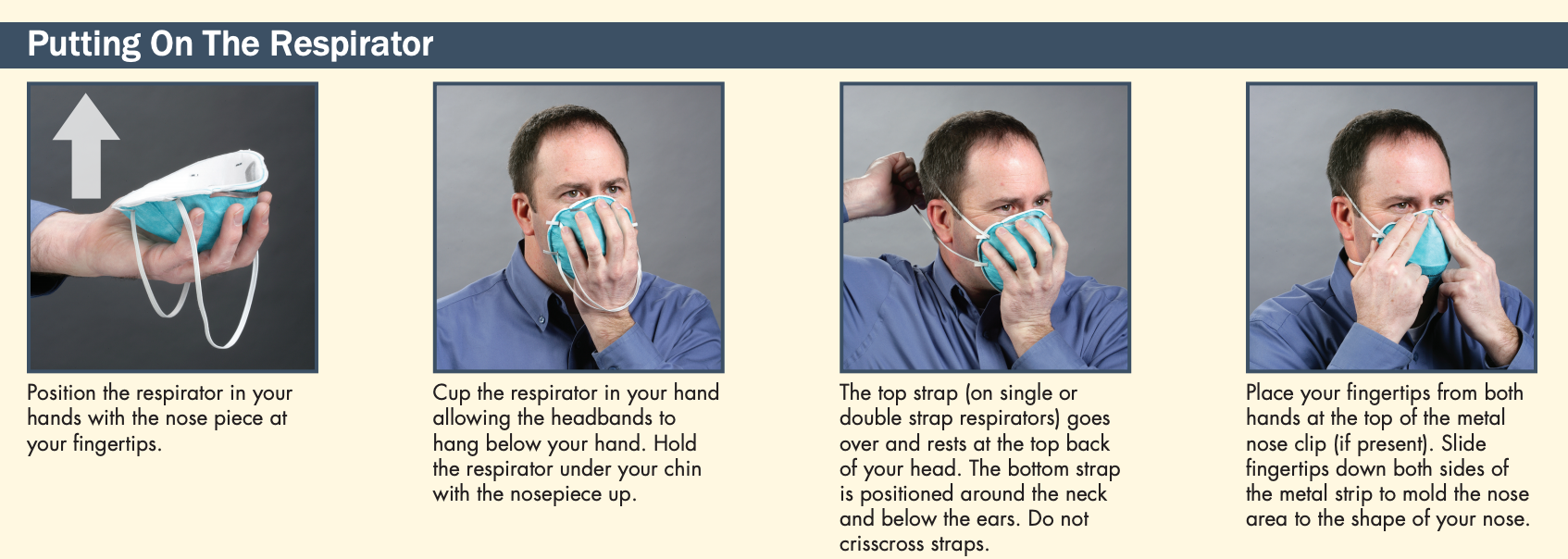


How to Perform a User Seal Check with an N95 Respirator – vá direto para 2’00”
Comparação entre máscaras N95 vs máscara cirúrgica
Os respiradores N95 podem filtrar pequenas partículas, sendo a proteção recomendada nas doenças transmitidas pelo ar (tuberculosa, sarampo, etc). No entanto, o uso ideal dos respiradores N95 requer treinamento e testes de ajuste. Além disso, não está claro que os respiradores N95 sejam mais eficazes do que as máscaras faciais na prevenção da gripe, uma vez que estes últimos são capazes de filtrar as gotículas grandes, o principal meio de transmissão.
Para que a proteção respiratória seja eficaz, é crucial obter um ajuste adequado. Em um estudo que utilizou manequins para tosse e respiração, uma máscara facial hermeticamente fechada bloqueou a entrada de 94,8% do vírus da gripe na boca e um respirador N95 hermeticamente fechado bloqueou 99,6% do vírus infeccioso. Por outro lado, uma máscara facial mal ajustada bloqueou a entrada de 56,6% dos vírus e um respirador N95 mal ajustado bloqueou apenas 66,5% dos vírus.[5]
A maioria, mas não todos os estudos, não demonstraram diferença na eficácia entre máscaras faciais e respiradores N95 na prevenção de infecções por influenza ou outras infecções por vírus respiratórios entre os profissionais de saúde.
Uma meta-análise de 2017 de estudos randomizados mostrou os seguintes resultados [3]:
- Houve um efeito protetor das máscaras (cirúrgicas ou respiradores) contra doenças respiratórias e infecções de influenza (RR 0,34, 95 % IC 0,14-0,82).
- Mascaras tipo respiradores N95 conferiram maior proteção contra doenças respiratórias clínicas e infecções bacterianas em comparação com as máscaras cirúrgicas.
- Mascaras tipo respiradores N95 não conferiram maior proteção quanto a infecções virais ou influenza em comparação com as máscaras cirúrgicas.
Um estudo randomizado que incluiu 2371 profissionais de saúde de 137 centros ambulatoriais em sete centros médicos dos Estados Unidos [4]:
- Locais ambulatoriais em cada centro foram randomizados para que seus profissionais de saúde usem respiradores N95 ou máscaras faciais ao interagir com pacientes com doença respiratória
- Período de 12 semanas de pico da doença respiratória viral ao longo de quatro temporadas de influenza.
- Houve um número semelhante de eventos de infecção por influenza confirmados em laboratório nos grupos respirador e máscara facial N95 (207 versus 193 eventos; OR 1,18, IC 95% 0,95-1,45).
- Também não houve diferenças significativas entre os grupos na incidência de eventos respiratórios agudos, infecções respiratórias detectadas em laboratório, eventos respiratórios confirmados em laboratório ou eventos semelhantes a influenza.
Vídeo mostrando a formação de microgotas suspensas no ar:
Dicas de como reutilizar a máscara N95
No dia 20 de março o JAMA pediu que especialistas dessem sugestões de como otimizar o uso de equipamentos durante a crise. Entre as sugestões a Sociedade Americana de Cirurgiões Gastrointestinais e Endoscópicos (SAGES) deu destaque à sugestão de como reutilizar essa máscara que é tão importante para quem está na linha de frente.
Segue a tradução do texto:
“27 de março de 2020, por Aurora Pryor
Eu contactei o Dr. Peter Tsai, o inventor das máscaras de tecido N95. As máscaras N95 são feitas de polipropileno e são desenhadas para firmemente cobrir sua face com mínimo escape de ar ao seu redor. Eu perguntei ao Dr. Tsai sobre como reutilizar a N95 e quais materiais poderiam ser adicionados às máscaras feitas em casa para que fossem mais efetivas. Ele respondeu o seguinte:
MÉTODO DE REUTILIZAÇÃO DAS MÁSCARAS N95 #1
Quando reutilizar máscaras N95, deixe a máscara em ar atmosférico seco por 3 a 4 dias para secar completamente. O polipropileno nas máscaras N95 é hidrofóbico e não contém humidade. COVID-19 precisa de um hospedeiro para sobreviver. Ele pode sobreviver em uma superfície de metal por até 48 horas, em plástico por 72 horas e em papelão por 24 horas. Quando sua máscara esta seca por 3—4 dias, o vírus não terá sobrevivido.
- Pegue 4 máscaras N95, marque com números de 1 a 4
- No dia 1, use a máscara número 1, em seguida deixe-a secando por 3-4 dias
- No dia 2, use a máscara número 2, em seguida deixe-a secando por 3-4 dias
- O mesmo para o dia 3 e 4…
MÉTODO DE REUTILIZAÇÃO DAS MÁSCARAS N95 #2
Você também pode esterilizar a máscara N95 pendurando-as no forno (sem contato com metal) a 70 oC por 30 minutos. Esta reportado que o COVID-19 não pode sobreviver a 65 oC por 30 minutos.
Use um clipe (pregador) de madeira para pendurar a máscara no forno da cozinha para fazer a esterilização.
Quando esterilizar as N95, mantenha as máscaras longe de luz ultravioleta (UV) / luz do sol. As máscaras N95 são degradadas cela luz UV porque ela danifica as cargas eletromagnéticas do polipropileno. Não esta claro quanto tempo as máscaras podem ser expostas a luz UV antes de ficarem ineficazes.
Dicas para os métodos de reuso das máscaras N95
- NÃO coloque a máscara na superficial de metal (do forno), ou muito perto, porque a temperatura do na superfície de metal é mais quente que a do ar em temperatura. (pode danificar o material)
- Mantenha a N95 longe de luz UV / luz do sol.
- Quando for remover a máscara, segure pela ponta dos elásticos para retirar a N95. Suas mãos podem ser contaminadas neste momento – não toque a parte de dentro da máscara. Lave suas mãos com sabão por 20 segundos depois de retirar a máscara.“
Estratégias para uso estendido ou reuso das máscaras N95 em tempos de falta de EPIs
Definições:
- O uso estendido refere-se à prática de usar a mesma máscara N95 para encontros repetidos com vários pacientes, sem remover a máscara entre os encontros. O uso prolongado pode ser implementado quando vários pacientes são infectados e os pacientes são colocados juntos em salas de espera, clínicas ou unidades hospitalares dedicadas. A proteção para os olhos pode ser mantida com a máscara N95 para uso estendido.
- A reutilização refere-se à prática de usar a mesma máscara N95 para vários encontros com pacientes, mas removê-la entre os encontros. A máscara é armazenada entre os encontros e reutilizada.
Recomendações do CDC para uso estendido:
- A orientação é para reutilização da máscara N95 por uma única pessoa (sem compartilhamento).
- Descarte da máscara N95 após o uso durante os procedimentos com geração de aerossóis.
- Descarte da máscara N95 contaminados com sangue, secreções respiratórias, nasais ou outros fluidos corporais dos pacientes.
- Considerar o uso de protetor facial (face shield) sobre a máscara N95 e/ou máscara cirúrgica para reduzir a contaminação da superfície.
- Realizar higiene das mãos com água e sabão ou um desinfetante para as mãos à base de álcool ants e depois de tocar ou ajustar o respirador.
Recomendações do CDC para reuso:
Não há como determinar o número máximo possível de reutilizações seguras para uma máscara N95 como um número genérico a ser aplicado em todos os casos.
Deve-se minimizar o contato desnecessário com a superfície da máscara, com adesão às práticas de higiene das mãos e a técnica adequada de colocação e retirada de EPIs, incluindo inspeção física e realização da verificação do selagem da máscara pelo usuário.
Descarte da máscara N95 após o uso durante os procedimentos de geração de aerossóis.
- Descarte da máscara N95 contaminados com sangue, secreções respiratórias, nasais ou outros fluidos corporais.
- Considerar o uso de protetor facial (face shield) sobre a máscara N95 e/ou máscara cirúrgica para reduzir a contaminação da superfície.
- Manter a máscara N95 em recipiente limpo e respirável. Os recipientes de armazenamento devem ser descartados ou limpos regularmente.
- Realizar higiene das mãos com água e sabão ou um desinfetante para as mãos à base de álcool ants e depois de tocar ou ajustar o respirador.
- Evite tocar no interior da máscara N95.
- Usar um par de luvas limpas (não esterilizadas) ao vestir a máscara N95 usada e realizar a verificação do selagem de ar pelo usuário.
Dica de como retirar e armazenar uma máscara N95 para reuso
Vídeo: dica de como retirar e armazenar uma máscara N95 para reuso
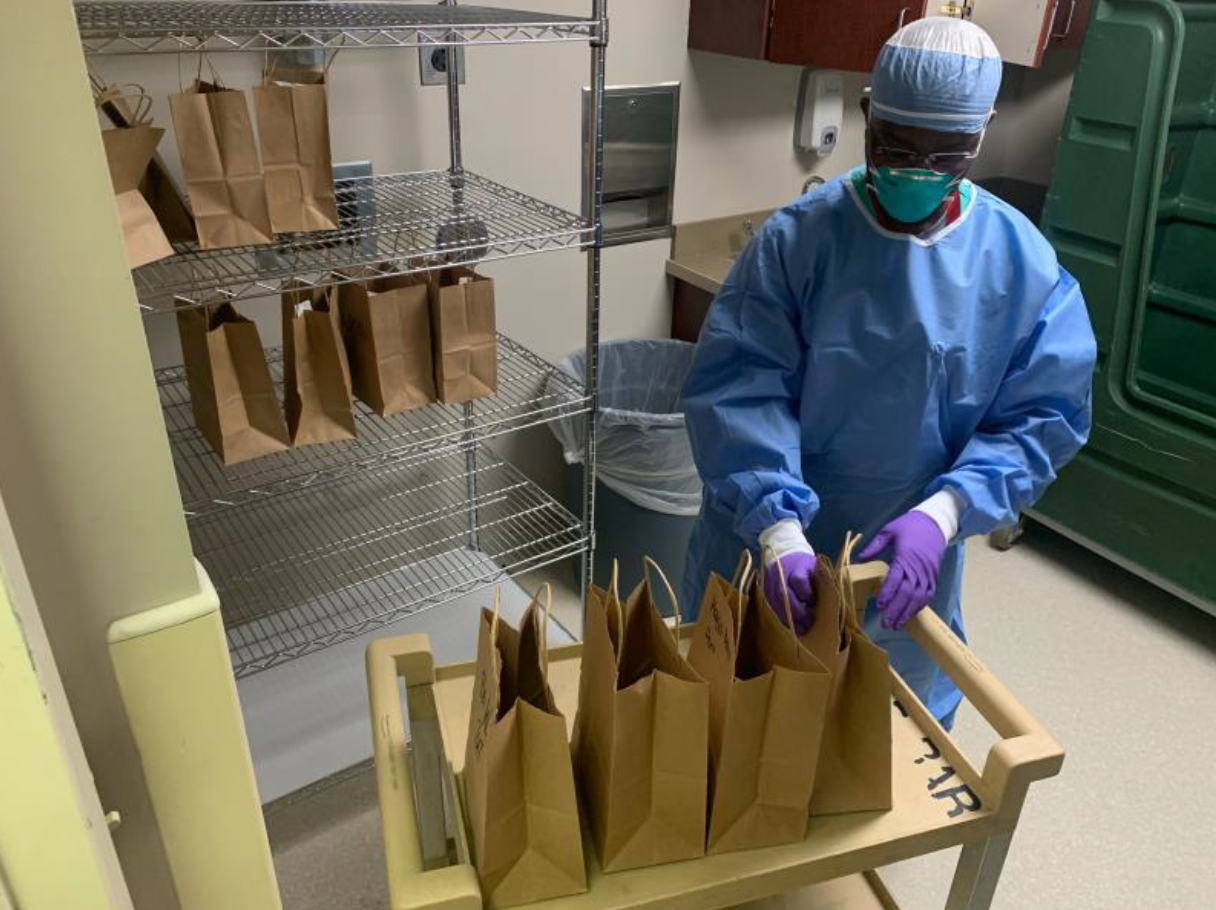
Idealmente, as máscaras N95 devem ser armazenadas em locais secos e ventilados. O tuperware perfurado para permitir ventilação e sacolas de papel são uma boa opção.
Segue o link para as paginas do JAMA e SAGES com os textos originais:
https://jamanetwork.com/journals/jama/fullarticle/2763590
https://www.sages.org/n-95-re-use-instructions/
ESSE POST FOI ESCRITO EM COAUTORIA COM DR. BRUNO DA COSTA MARTINS
REFERÊNCIAS
- Centers for Disease Control and Prevention (CDC).Recommended Guidance for Extended Use and Limited Reuse of N95 Filtering Facepiece Respirators in Healthcare Settings. March 27, 2020.
- Nebraska Medicine COVID-19 PPE Guidance. Extended Use and Limited Reuse of Disposable Facemasks, Respirators and Protective Eyewear. March 19, 2020.
- Offeddu V, Yung CF, Low MSF, Tam CC . Effectiveness of Masks and Respirators Against Respiratory Infections in Healthcare Workers: A Systematic Review and Meta-Analysis. Clin Infect Dis. 2017;65(11):1934.
- Radonovich LJ Jr, Simberkoff MS, Bessesen MT, Brown AC, Cummings DAT, Gaydos CA, Los JG, Krosche AE, Gibert CL, Gorse GJ, Nyquist AC, Reich NG, Rodriguez-Barradas MC, Price CS, Perl TM, ResPECT investigators. N95 Respirators vs Medical Masks for Preventing Influenza Among Health Care Personnel: A Randomized Clinical Trial. JAMA. 2019;322(9):824.
- Noti JD, Lindsley WG, Blachere FM, Cao G, Kashon ML, Thewlis RE, McMillen CM, King WP, Szalajda JV, Beezhold DH. Detection of infectious influenza virus in cough aerosols generated in a simulated patient examination room. Clin Infect Dis. 2012 Jun;54(11):1569-77. Epub 2012 Mar 29
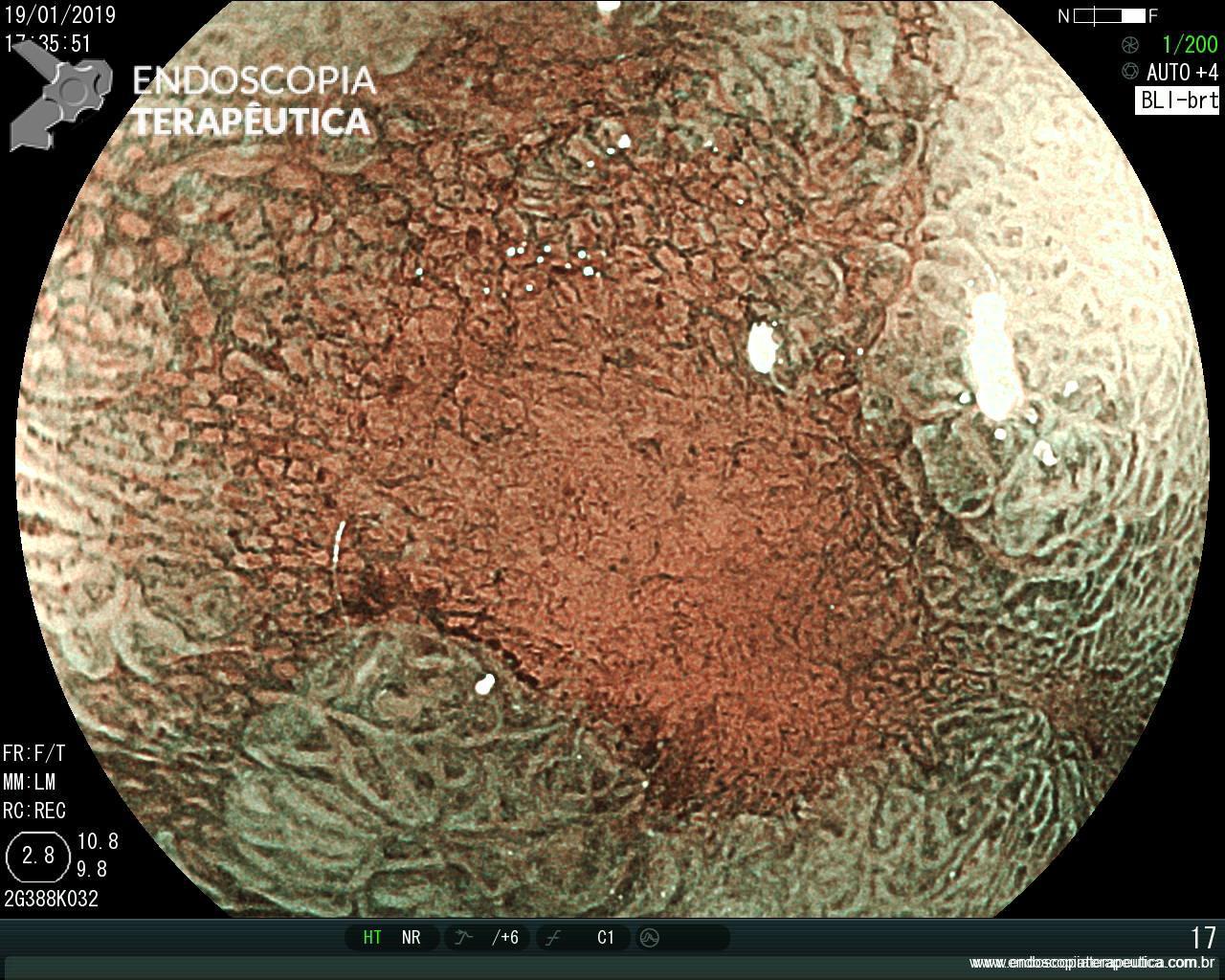
Caso clínico: Importância do exame cuidadoso da câmara gástrica!
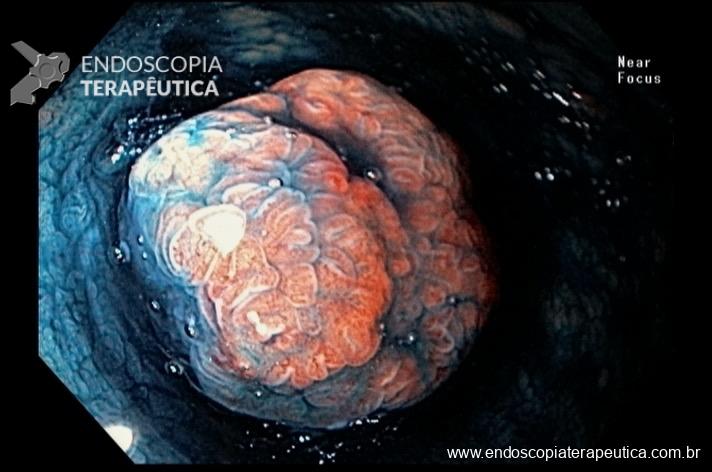
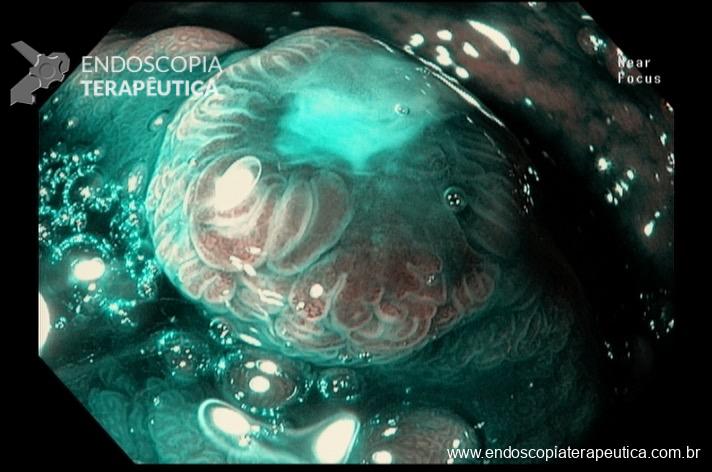
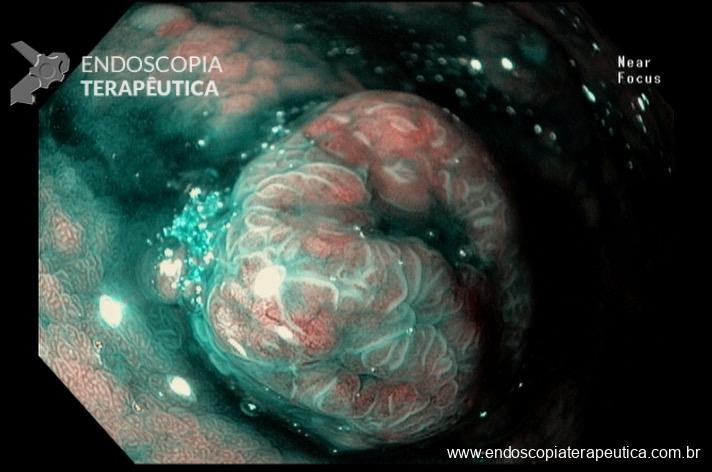
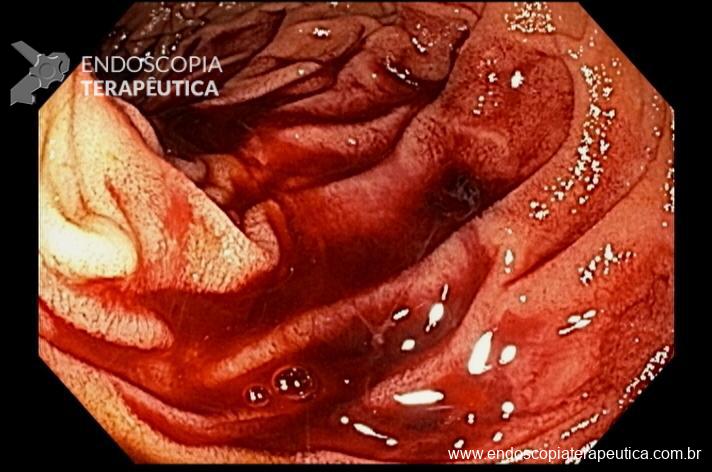
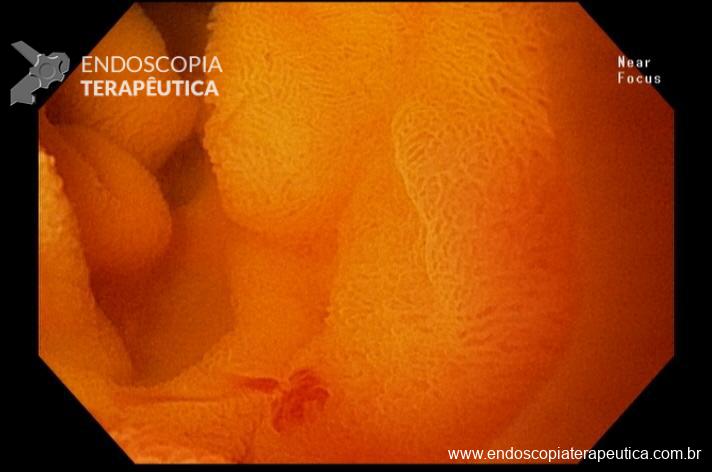
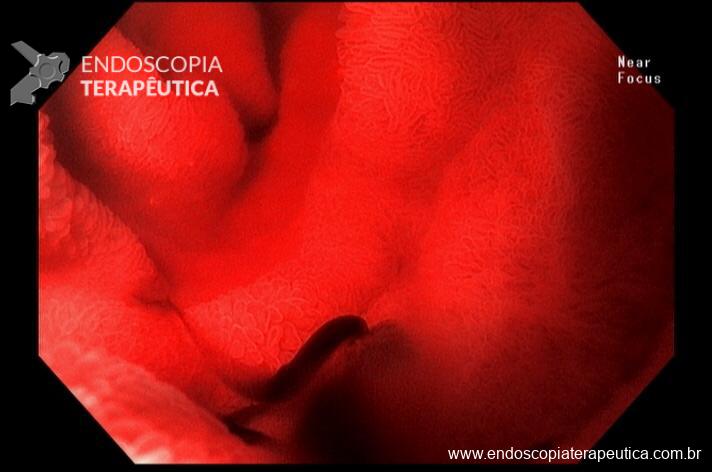
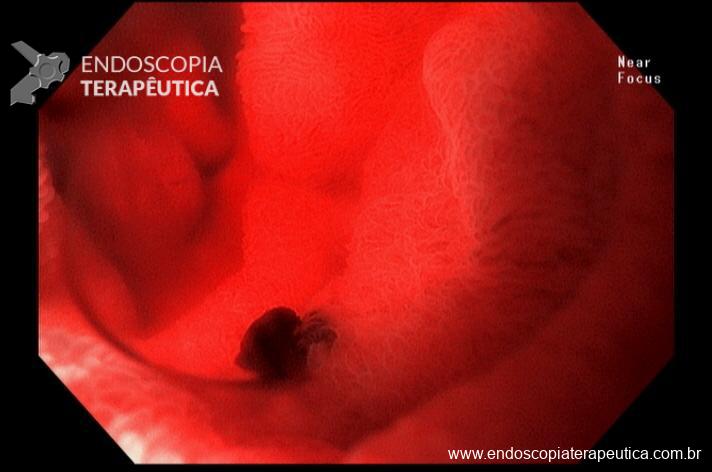
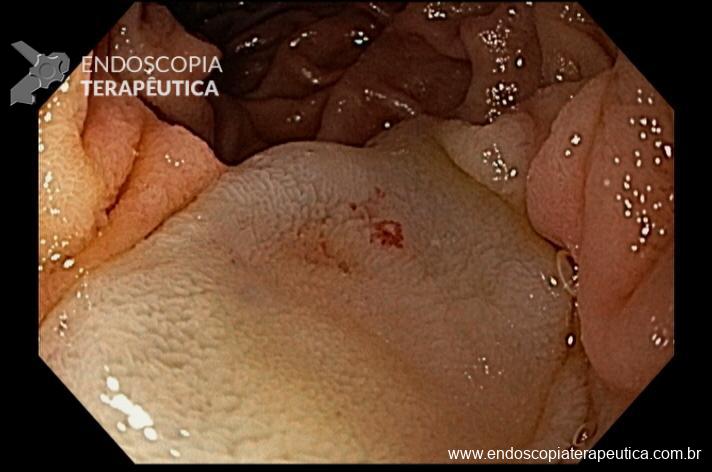
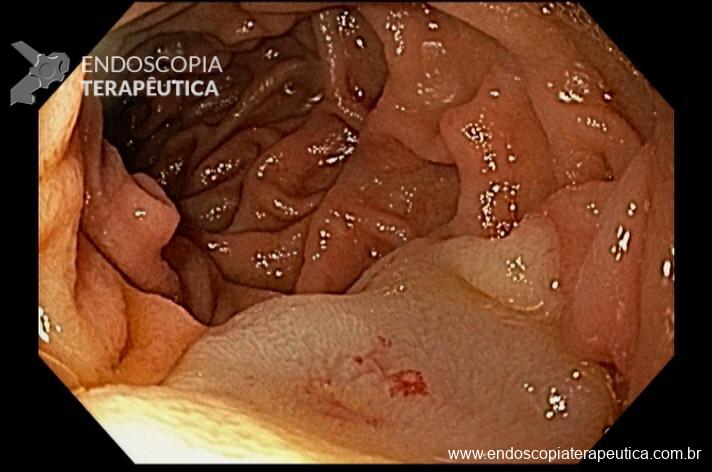
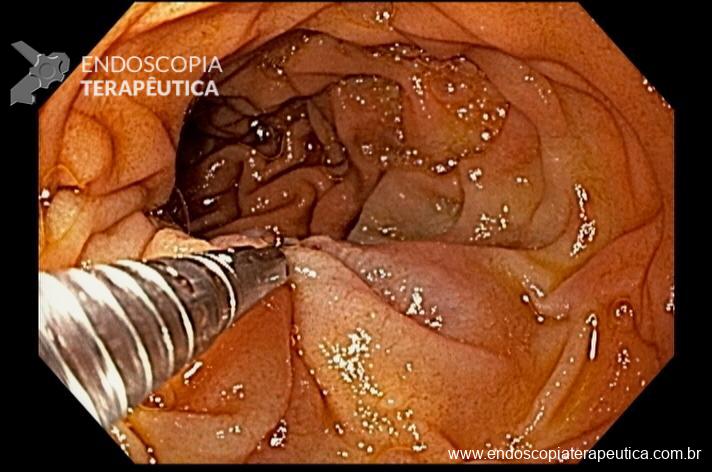
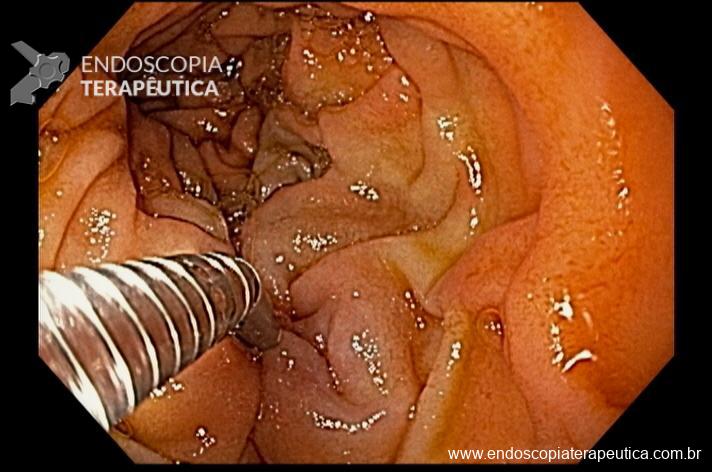
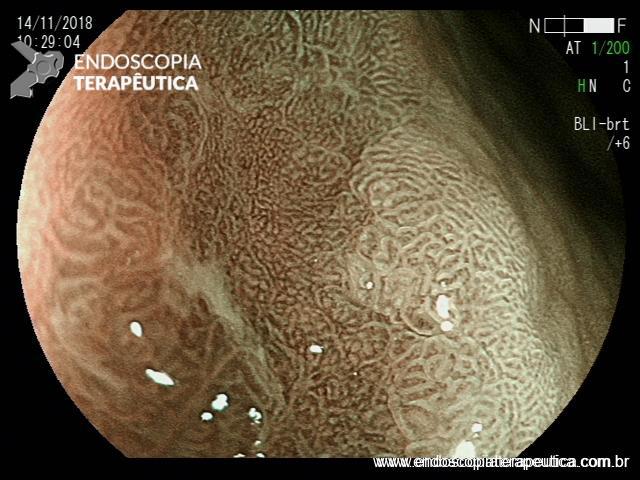
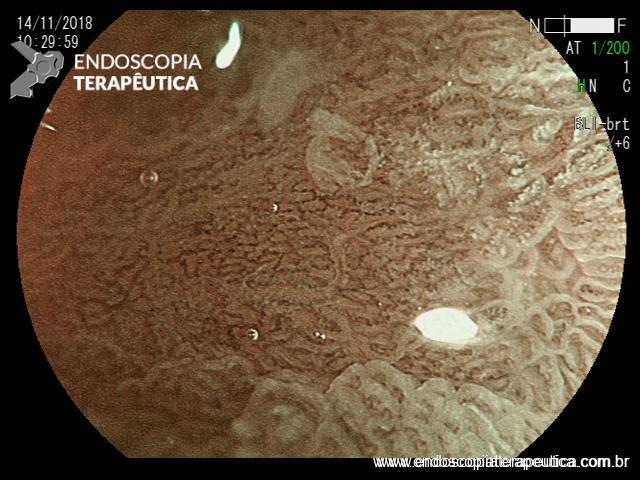
Paciente feminina, 63 anos, veio para realização de endoscopia digestiva alta por epigastralgia esporádica. Sem outros sinais de alarme.
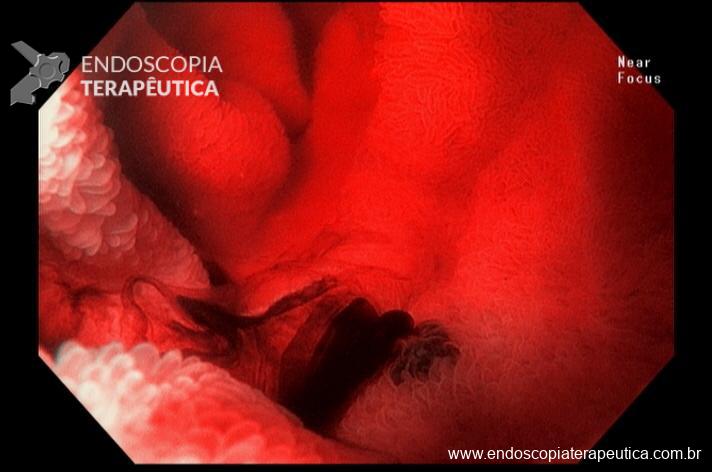
Abaixo vídeo do exame:
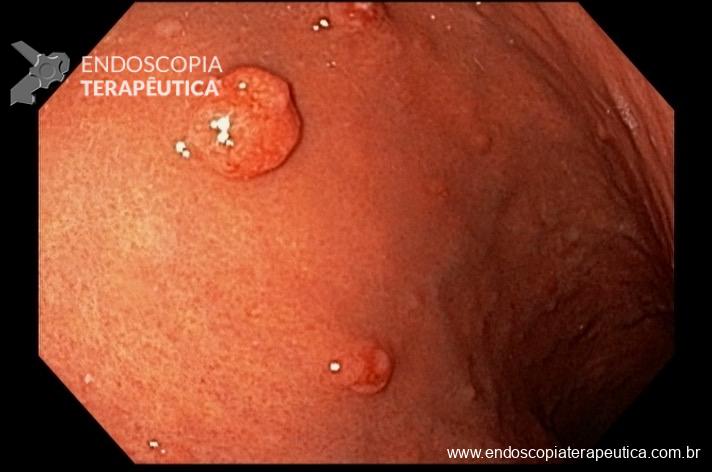
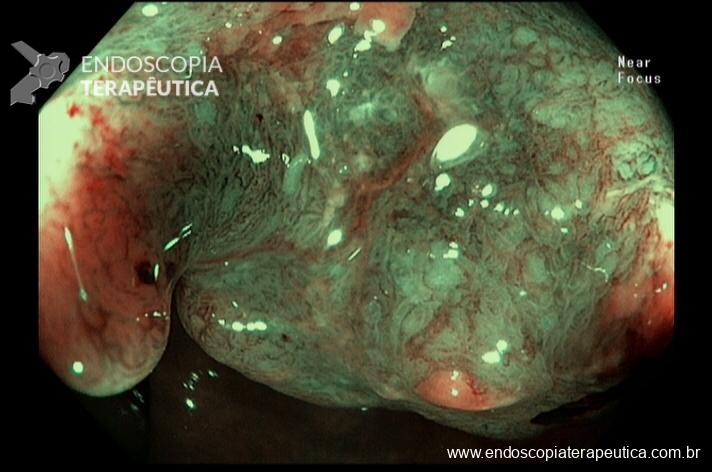
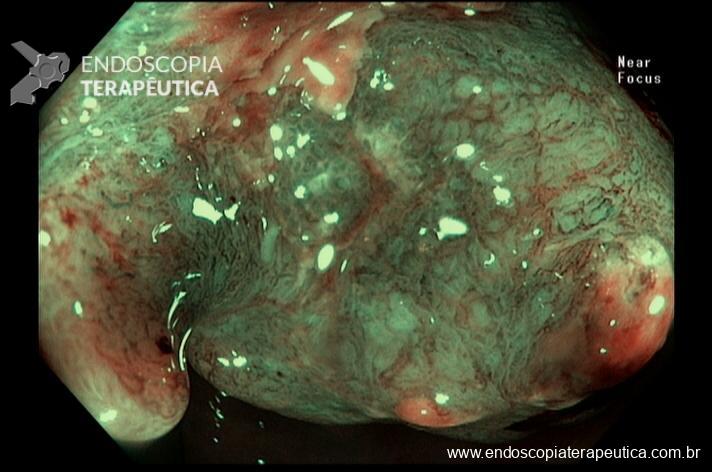
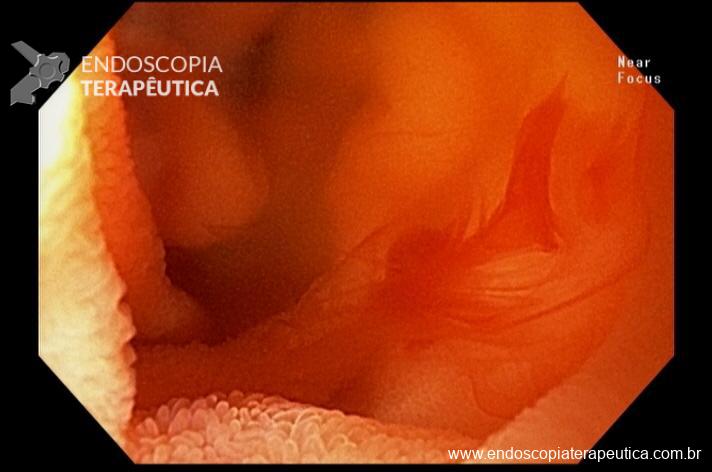
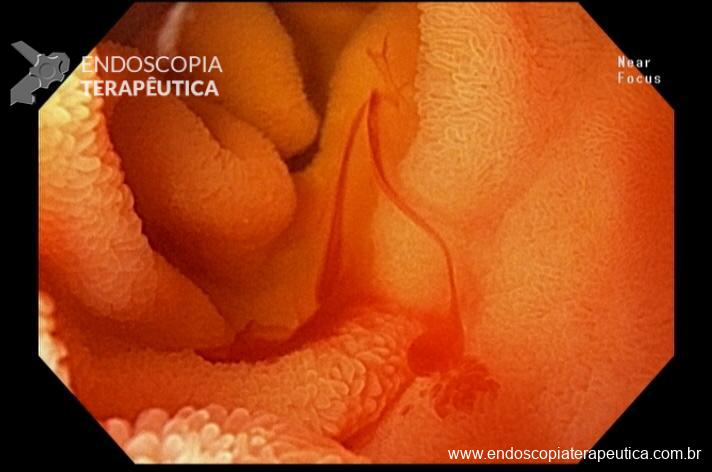
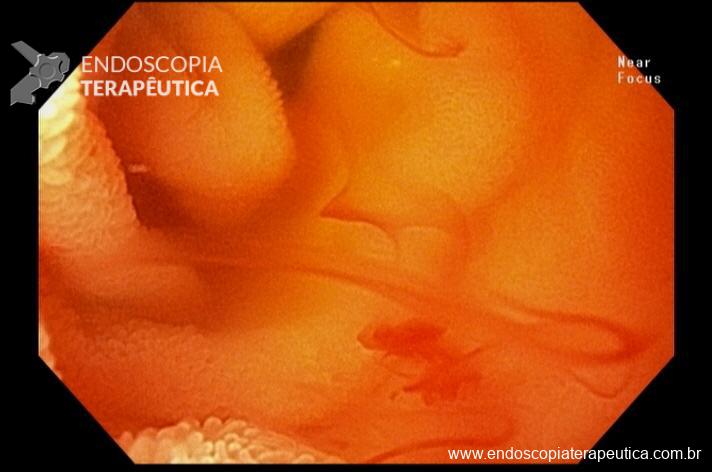
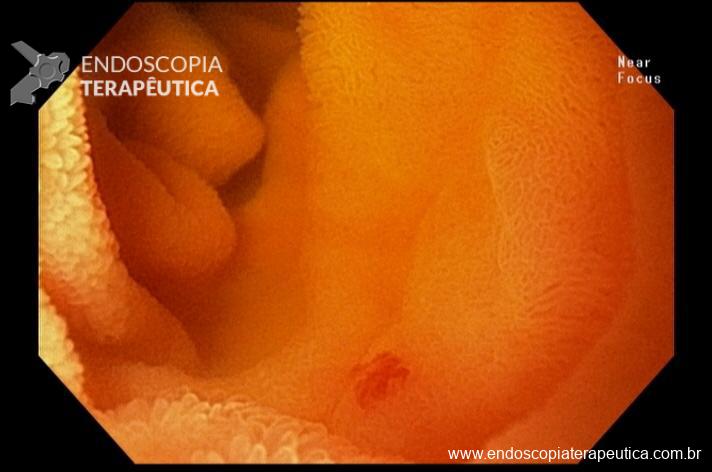
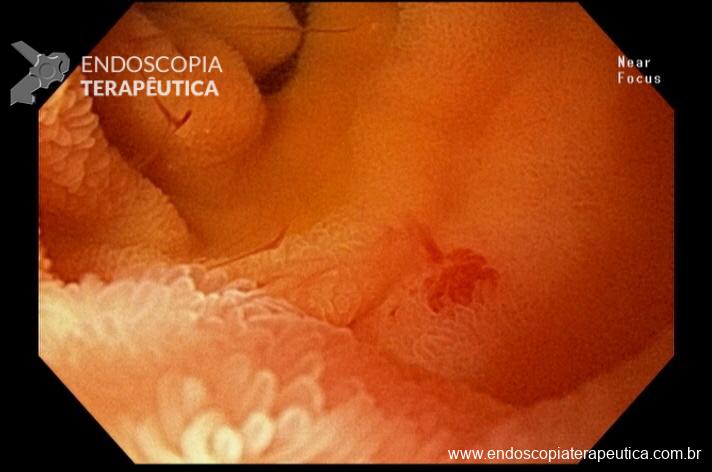
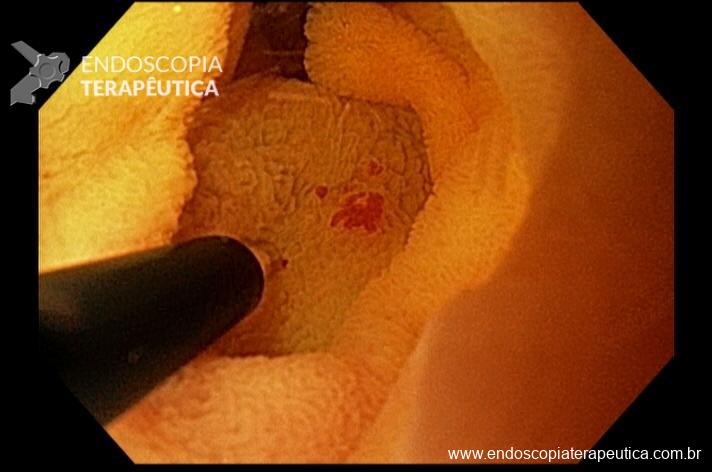
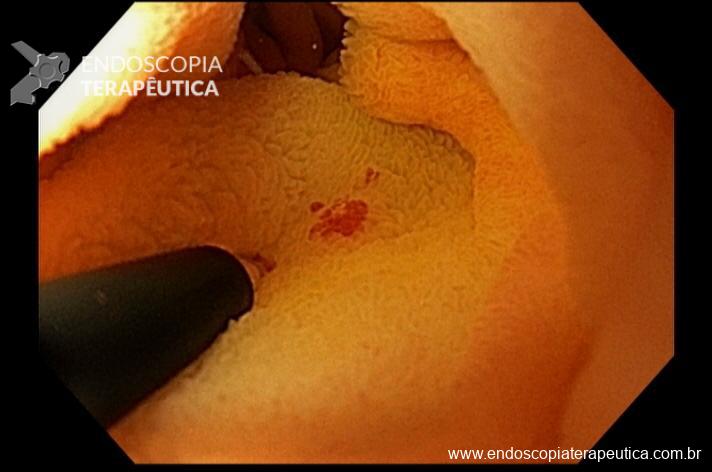
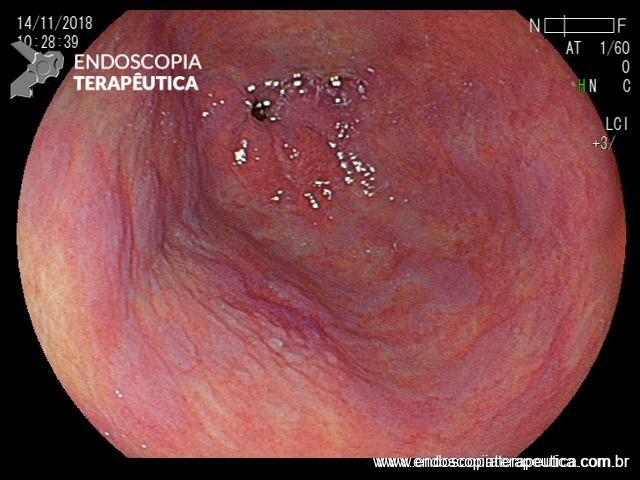
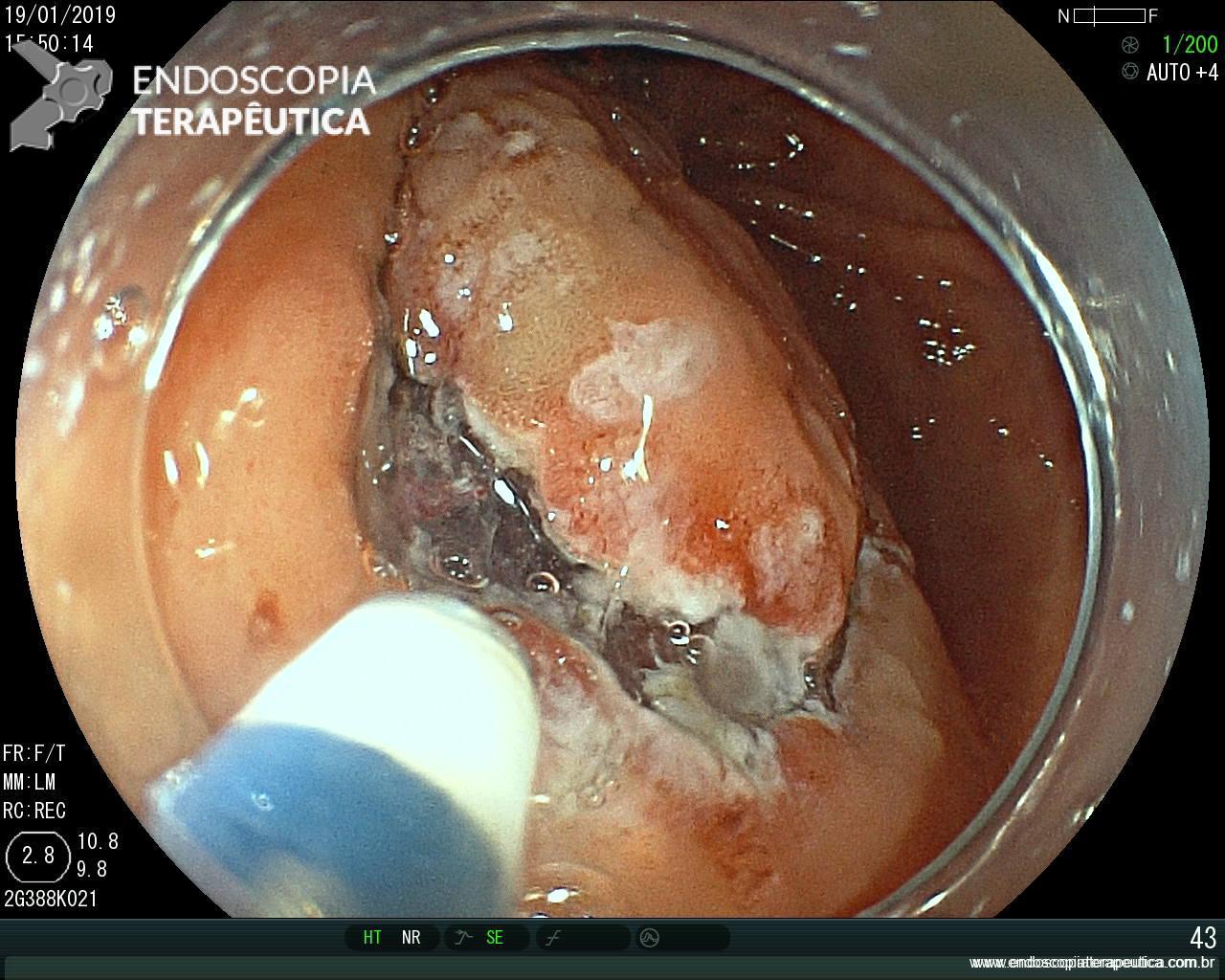
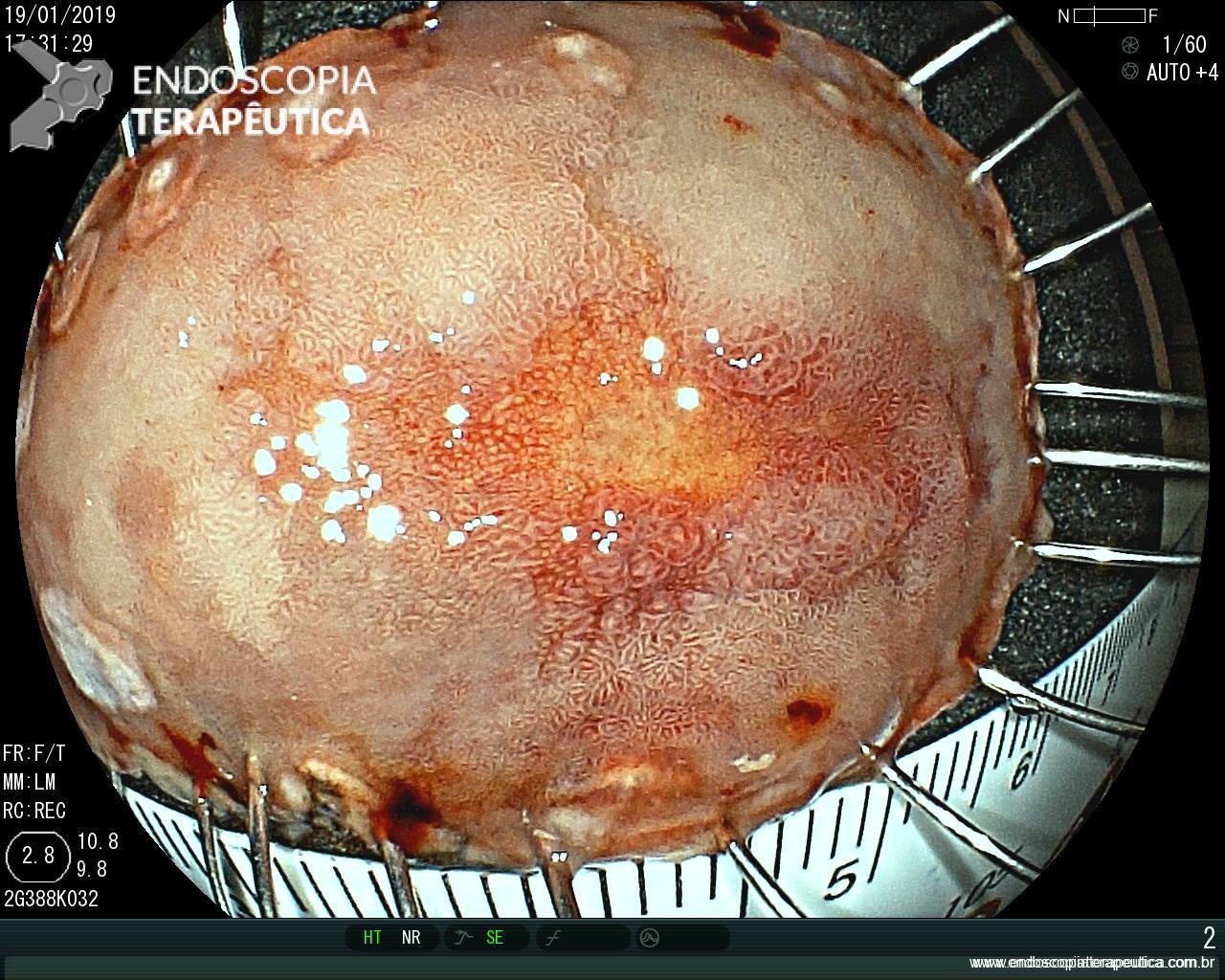
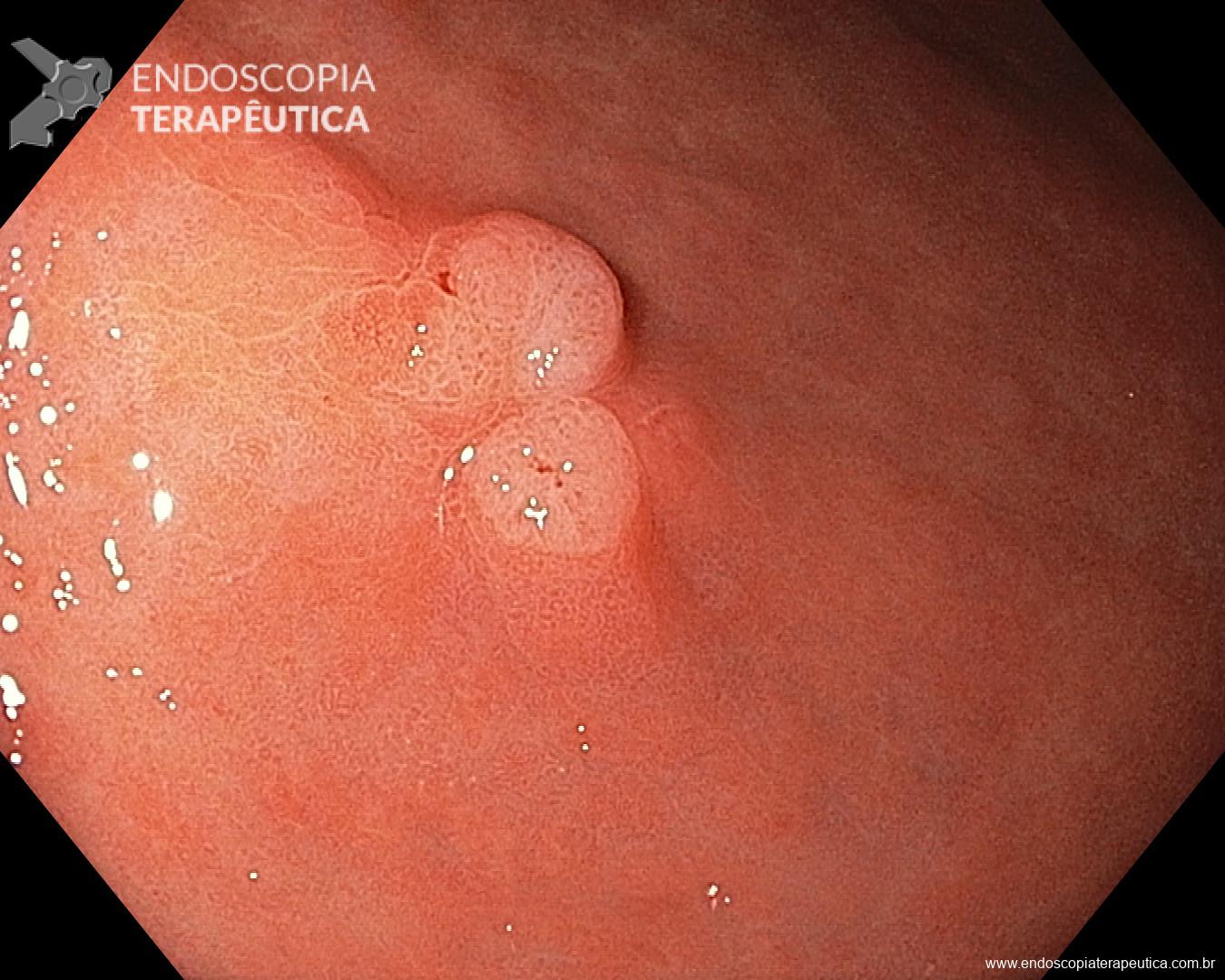
Percebam a importância em lavar adequadamente a câmara gástrica, com objetivo de visualizar toda a mucosa do estômago. Adicionalmente, realizada insuflação adequada do órgão e uso de escopolamina endovenosa. Nesse caso foi observada uma lesão elevada (0-IIa), na grande curvatura para parede anterior da transição corpo-antro, medindo cerca de 1,5 cm. Fotos abaixo:
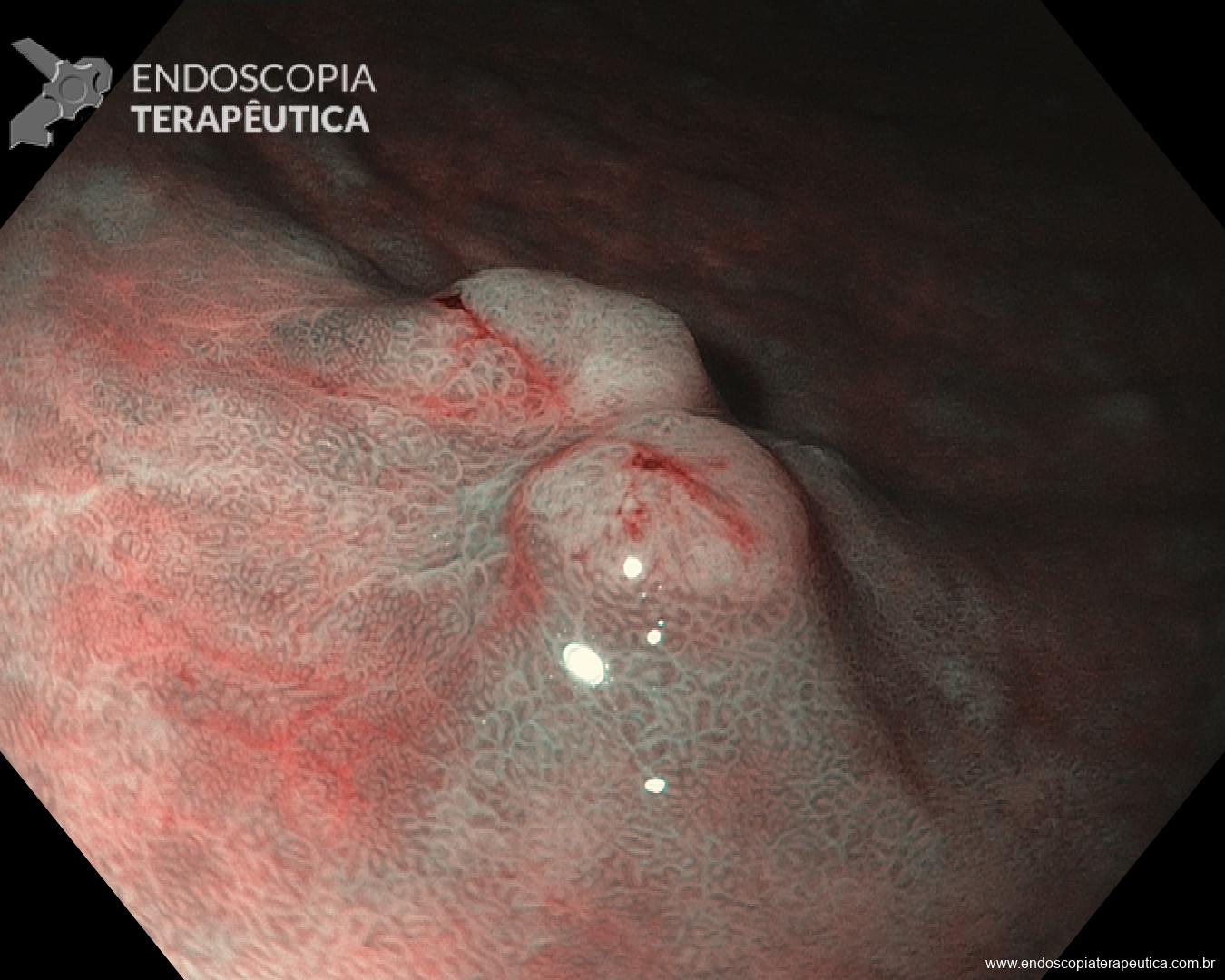
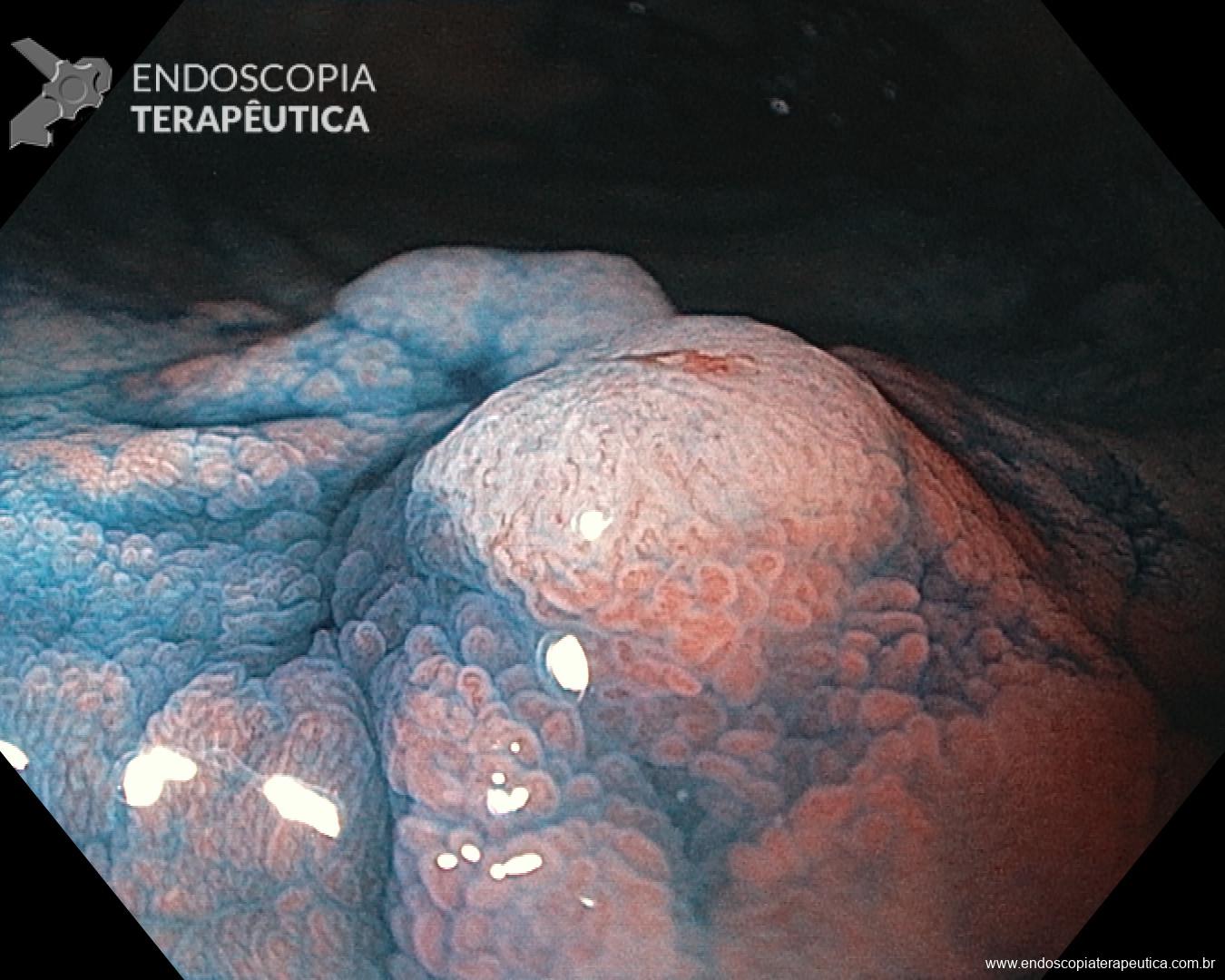
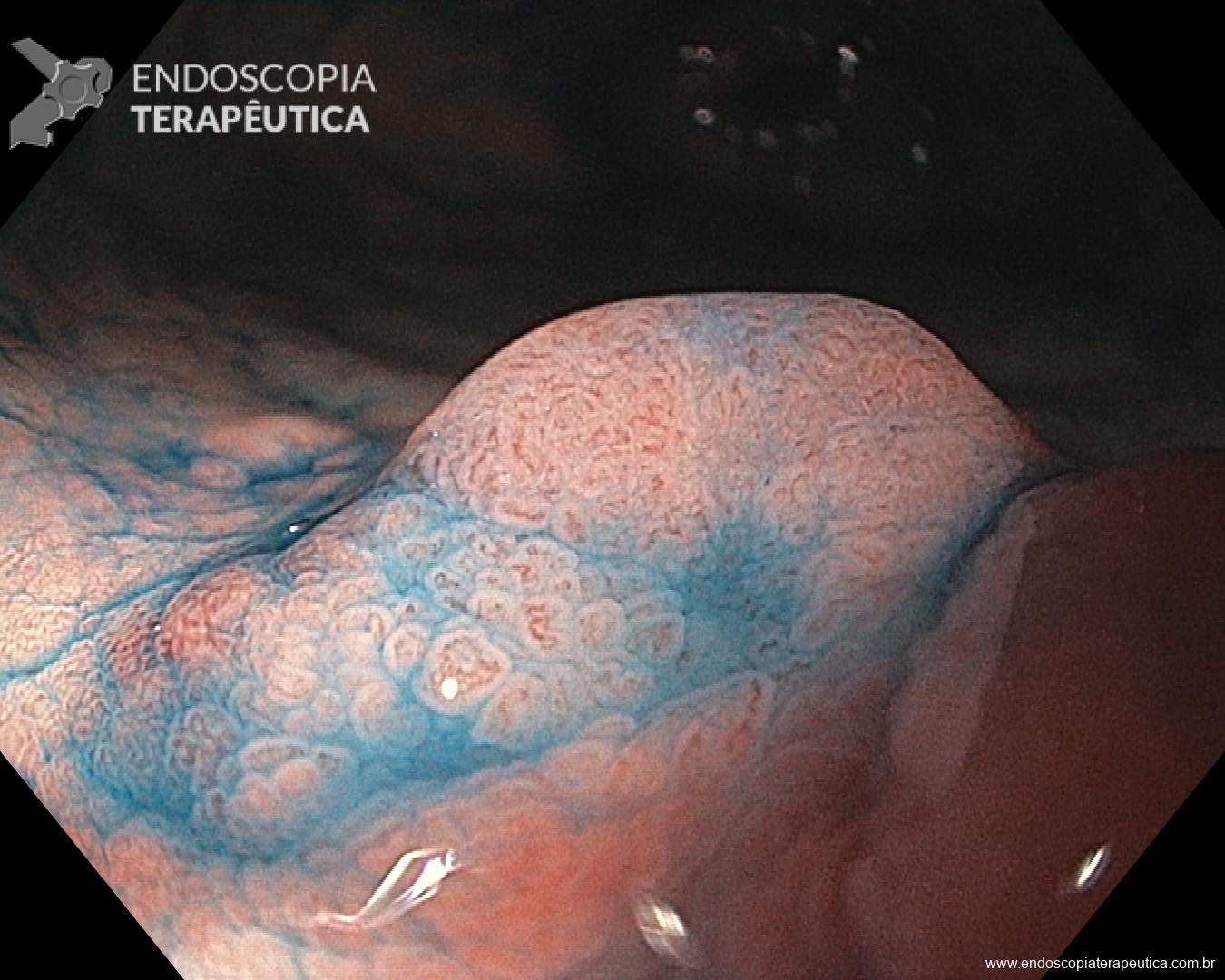
A biópsia mostrou adenocarcinoma bem diferenciado com foco de invasão da submucosa. Imagem abaixo gentilmente cedida pelo Dr Heinrich Seidler:
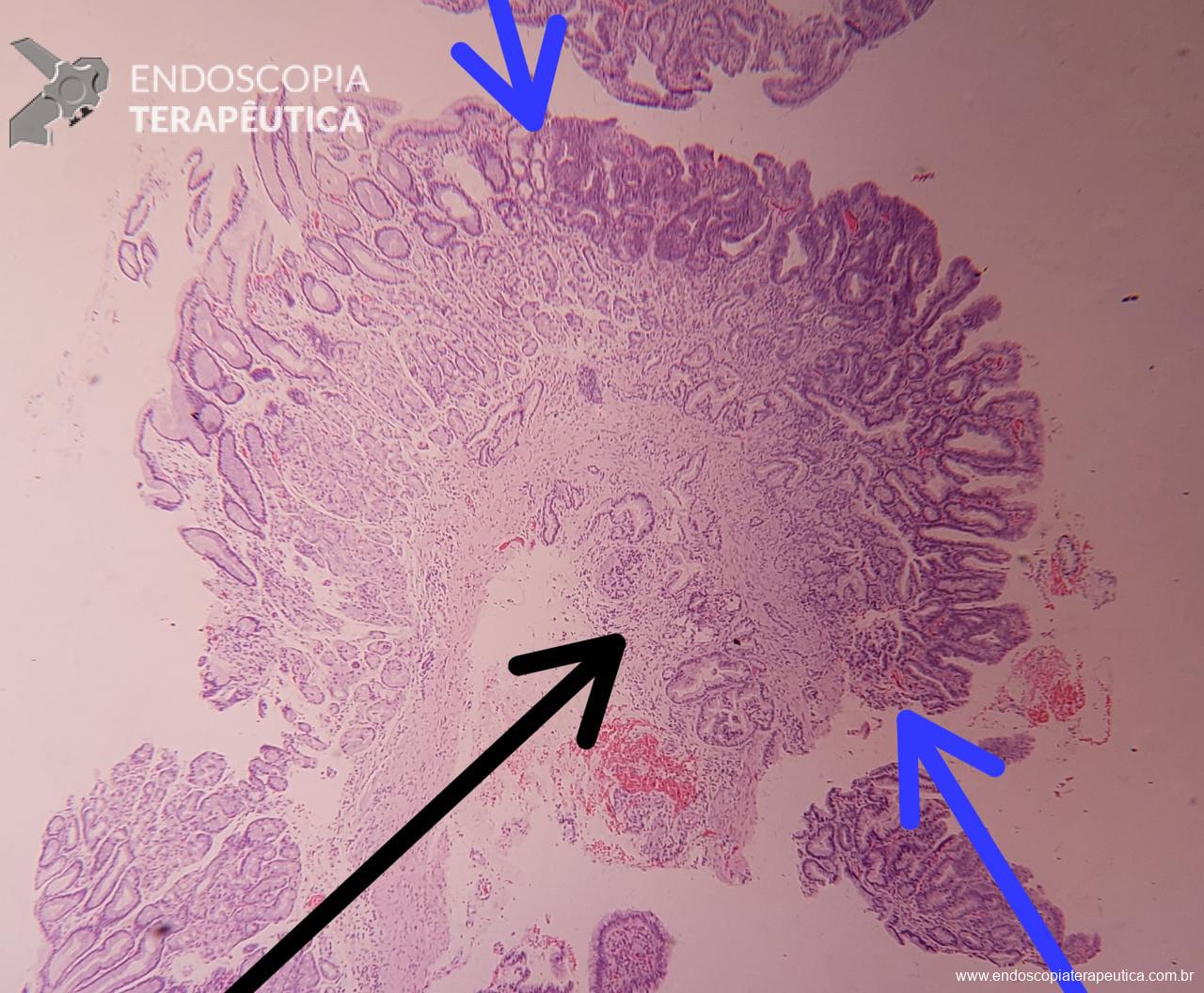
As setas em azul mostram o componente intramucoso da lesão, e a seta preta o foco de invasão na submucosa.
Paciente foi submetido a gastrectomia subtotal com linfadenectomia. O exame da peça operatória mostrou adenocarcinoma tubular bem diferenciado com invasão da submucosa, e acometimento de 01 linfonodo de 33 (1/33). Estadiamento: pT1bN1
Para acessar mais um post de neoplasia gástrica precoce, clique AQUI!
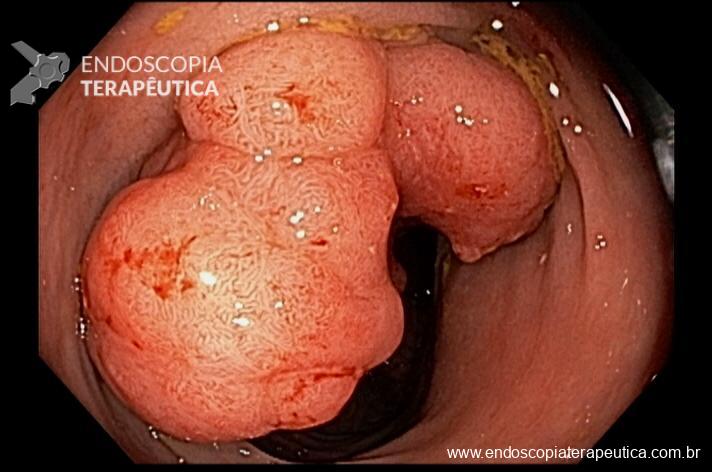
QUIZ!! Como você classificaria essa lesão?
Hemorragia Digestiva Alta: Exame e Terapêutica Endoscópica Underwater
Paciente masculino, 82 anos, com IRC dialítica, AVC prévio em uso de clopidogrel 75mg/dia, com quadro de melena há 3 dias, acompanhado de adinamia intensa. Investigação laboratorial mostrou hemoglobina de 5.3 mg/dL, necessitando de hemotransfusão.
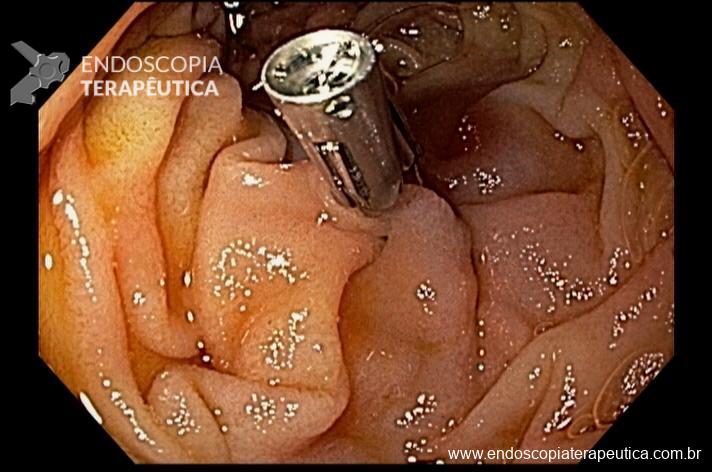
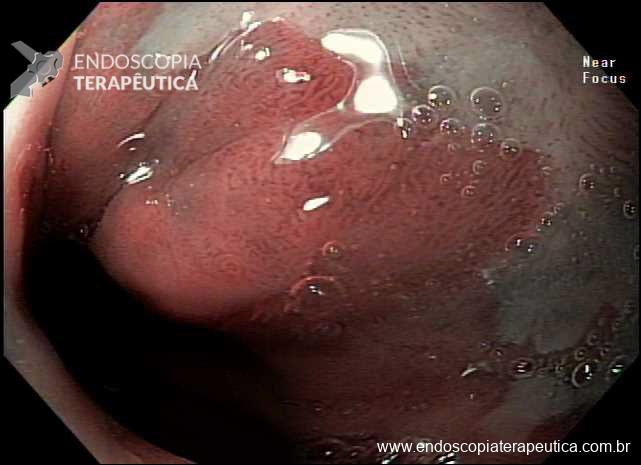
Realizada endoscopia digestiva alta que evidenciou sangramento ativo em duodeno distal. Foto abaixo:
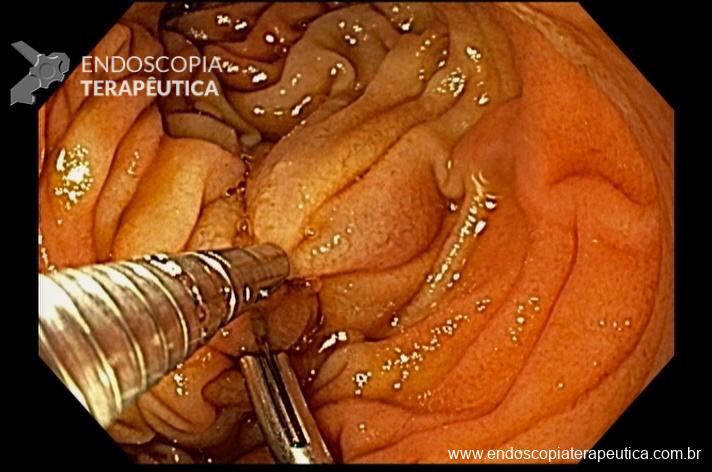
Pela intensidade do sangramento ativo houve dificuldade de identificar o foco exato do sangramento. Dessa forma, optado por realizar o exame com preenchimento do órgão com água. Fotos abaixo:
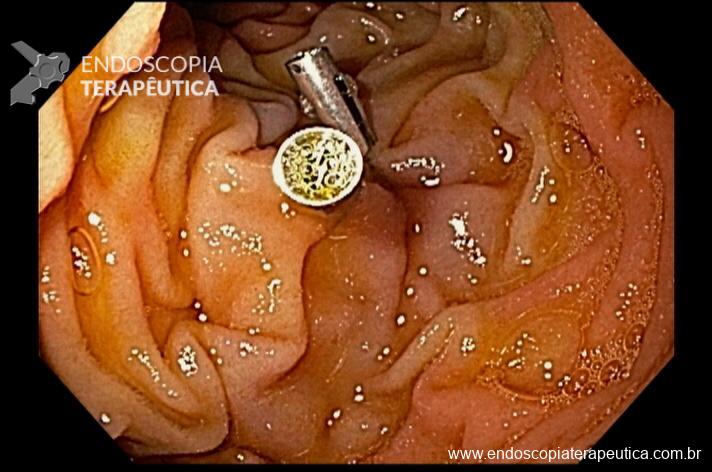
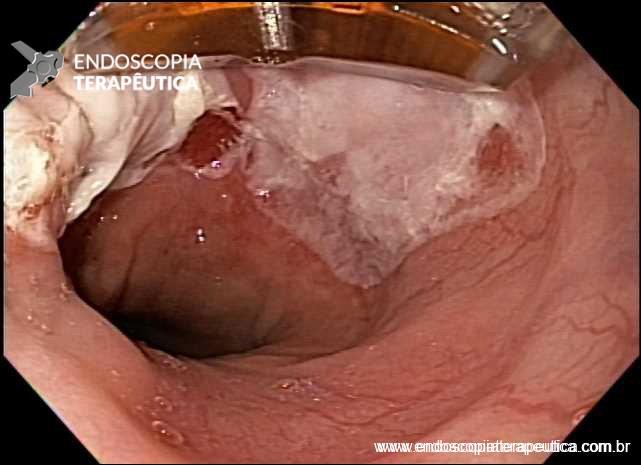
Sendo então observado uma malformação vascular com sangramento ativo. Optado pela realização de injeção underwater de solução de adrenalina (1:10.000UI), com parada do sangramento. Fotos abaixo:
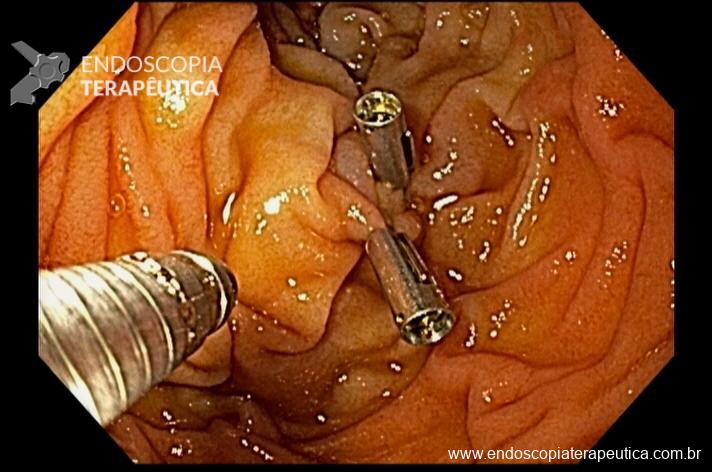
E em seguida realizada a colocação de 2 clipes hemostáticos:
Paciente evoluiu bem, recebendo alta após 2 dias, sem novos episódios de sangramento em acompanhamento ambulatorial de 1 mês.
Artigos Comentados!! Classificações do esôfago de Barrett
Introdução:
Recentemente houve a disponibilização e comercialização no Brasil da terapia de ablação com radiofrequência para o esôfago de Barrett. Nesse novo cenário é interessante nos familiarizarmos com as principais classificações endoscópicas propostas na literatura para avaliação diagnóstica do Barrett.
Três sistemas de classificação foram propostas com uso do NBI (narrow band imaging) em conjunto com magnificação: classificação de Kansas, Amsterdã e Nottingham. Elas sugerem que o padrão irregular da mucosa e dos vasos são preditivos de displasia, e o padrão “sulcado / viloso” é preditivo de metaplasia intestinal especializada (MI). Em um estudo que comparou os três sistemas, a acurácia para a MI sem displasia variou entre 57% e 63%, e a acurácia para a MI com displasia foi de 75%. A concordância interobservador foi razoável (classificação de Nottingham) a moderada (classificações de Kansas e Amsterdã).
Barrett’s International NBI Group (BING):
Mais recentemente, um sistema de classificação mais simples para discriminar esôfago de Barrett neoplásico (com displasia de alto grau e adenocarcinoma) do Barrett não-neoplásico usando o NBI foi desenvolvido e validado. O Barrett’s International NBI Group (BING) usou o NBI e o near focus (GIF-HQ190; EXERA III; Olympus Inc., Tokyo, Japan) para classificar diferenciar o padrão mucoso e de vascularização em regular e irregular, conforme tabela abaixo:
Os padrões regulares da mucosa e da vascularização são preditivos do Barrett sem displasia, enquanto padrões irregulares de mucosa e/ou vascularização são preditivos de Barrett com displasia de alto grau / adenocarcinoma.
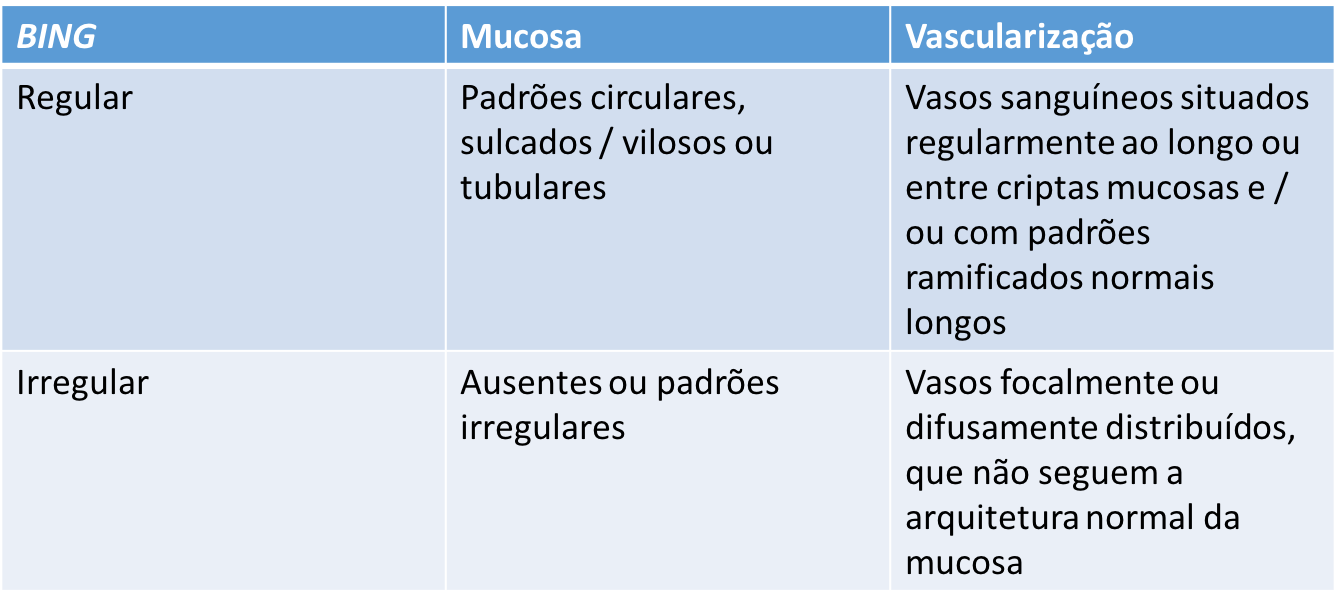
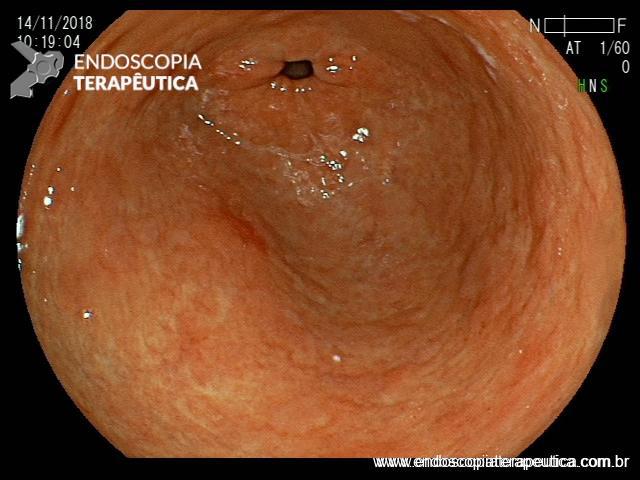
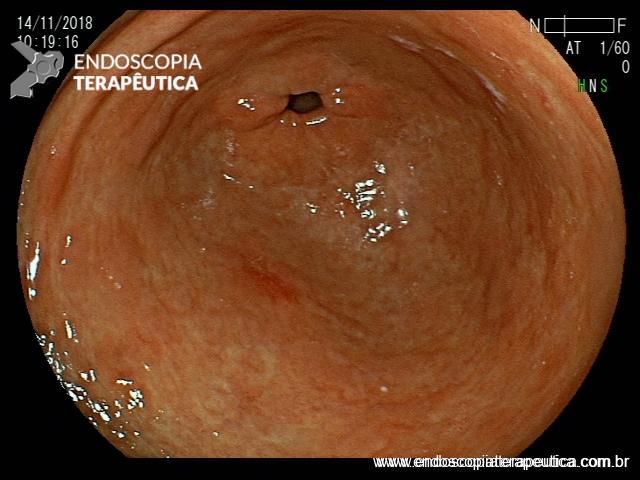
Abaixo alguns exemplos:
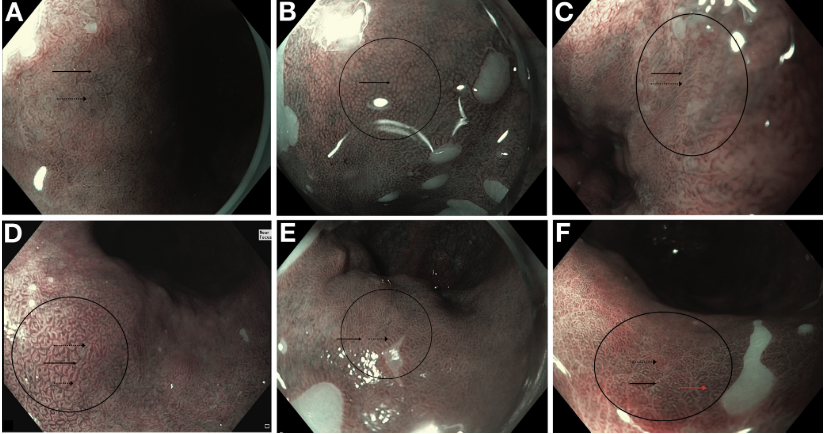
(A) Barrett sem displasia. Observe a presença de padrões de mucosa circular (seta sólida) dispostos de maneira ordenada e vasos sanguíneos que seguem claramente a arquitetura da mucosa (setas tracejadas). (B) Barrett sem displasia. Observe a presença de padrões de mucosa circular dispostos de maneira ordenada e vasos sanguíneos que seguem claramente a arquitetura normal da mucosa (seta sólida). (C) Barrett sem displasia. Observe a presença de padrões de mucosa circular (seta sólida) dispostos de maneira ordenada e vasos sanguíneos que seguem claramente a arquitetura das cristas mucosas (setas tracejadas). (D) Barrett sem displasia. Observe a presença de padrões de mucosa da cripta / vilosidade (seta sólida) dispostos de maneira ordenada e vasos sanguíneos dispostos de maneira regular entre as criptas mucosas (setas tracejadas). (E) Barrett sem displasia. Observe a presença de padrões de mucosa circular (seta sólida) dispostos de maneira ordenada e vasos sanguíneos que seguem a arquitetura da mucosa (setas tracejadas). (F) Barrett sem displasia. Observe a presença de padrões de mucosa circular (seta preta sólida) e criptas / vilosidades (seta vermelha) organizados de forma ordenada e vasos sanguíneos que seguem a arquitetura da cripta mucosa (setas tracejadas).
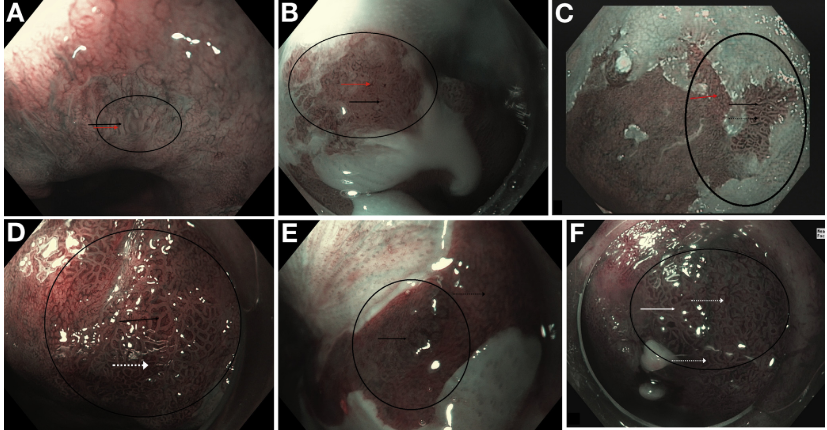
A) Barrett com displasia. Observe a mucosa irregular (seta preta) e padrões vasculares (seta vermelha). (B) Barrett com displasia. Observe a mucosa irregular (seta preta) e padrões vasculares (seta vermelha). Os vasos não seguem a arquitetura normal da mucosa. (C) Barrett com displasia. Observe a mucosa irregular (seta preta sólida) e os padrões vasculares (setas tracejadas). Em contraste, a seta vermelha mostra área na mucosa onde os vasos são dispostos de maneira regular, seguindo a arquitetura normal da mucosa. (D) Barrett com displasia. Observe os padrões da mucosa e vasculares irregulares (setas tracejadas). Os vasos focalmente ou difusamente distribuídos não seguem a arquitetura normal da mucosa. (E) Barrett com displasia. Observe que os padrões irregulares de mucosa e vascular (seta sólida) e nas setas tracejadas contrastam com padrão de mucosa e vascular regularmente organizado. (F) Barrett com displasia. Observe os padrões de mucosa irregular (seta sólida) e vascular (setas tracejadas).
Estudos de validação mostraram que a classificação BING pode predizer a presença ou ausência de displasia com alto nível de precisão (> 90%) e com alta concordância interobservador.
Referência (clique no link abaixo para acessar o artigo):
Câncer gástrico precoce – Diagnóstico com cromoscopia e magnificação
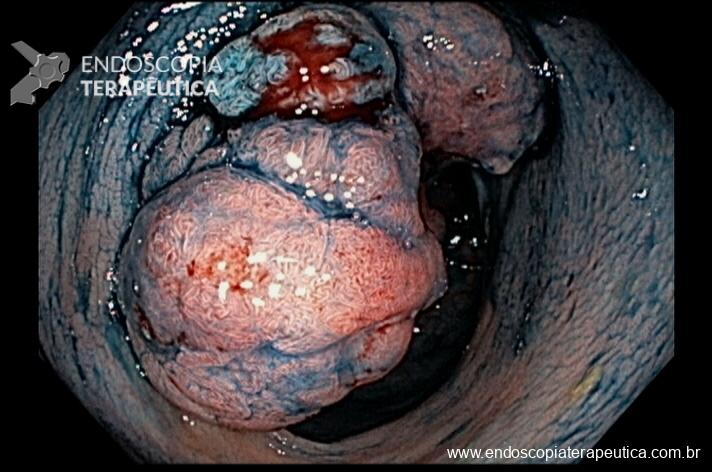
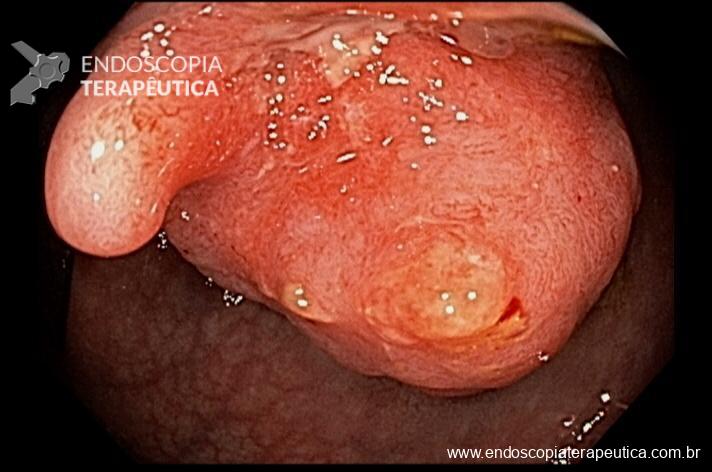
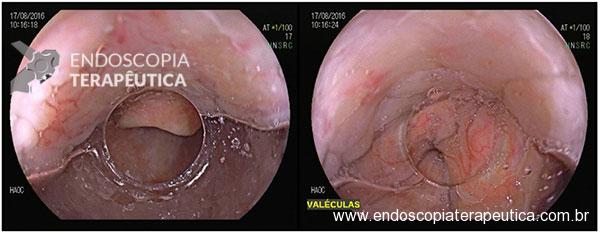
Paciente 66 anos, sexo feminino, sem queixas, veio para exame de endoscopia digestiva alta (EDA) para avaliação pré-operatória (gastroplastia redutora).
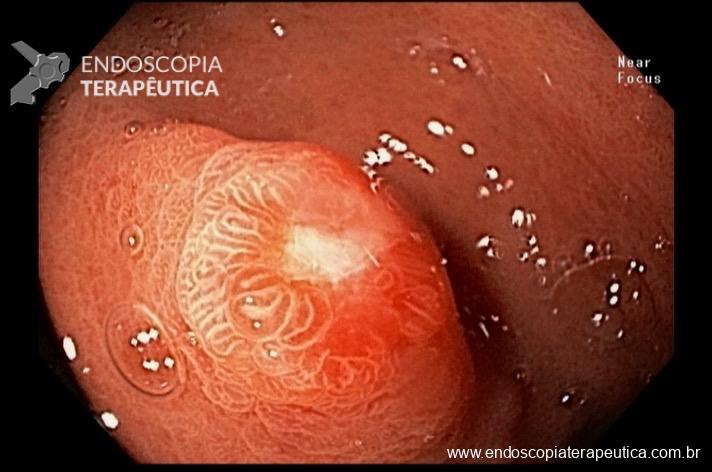
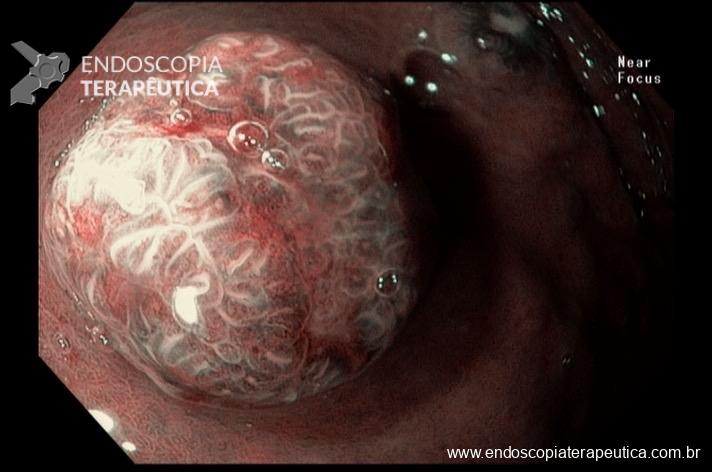
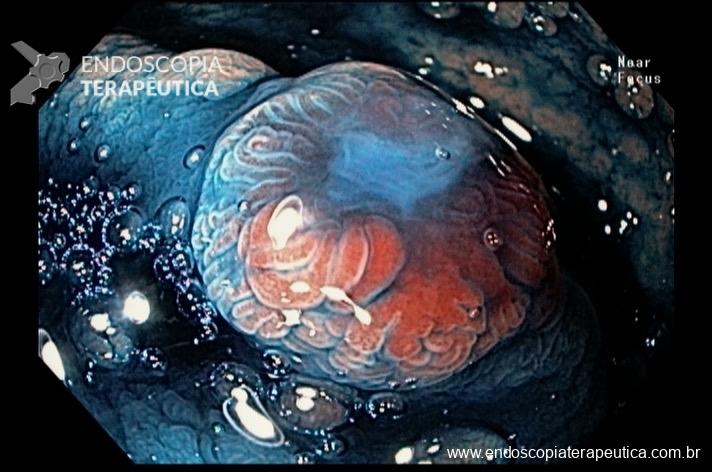
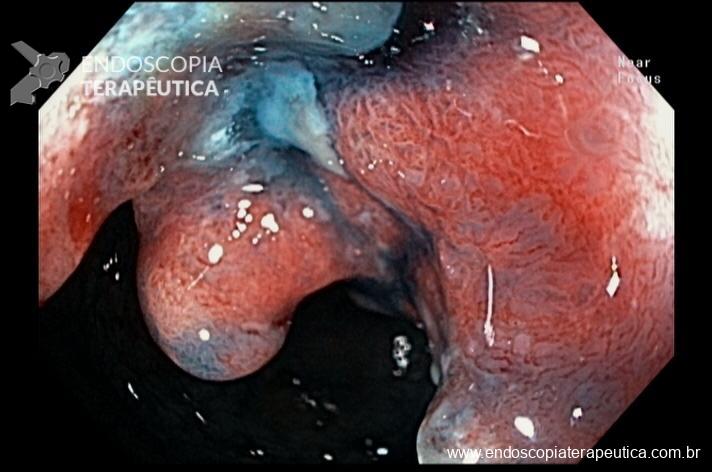
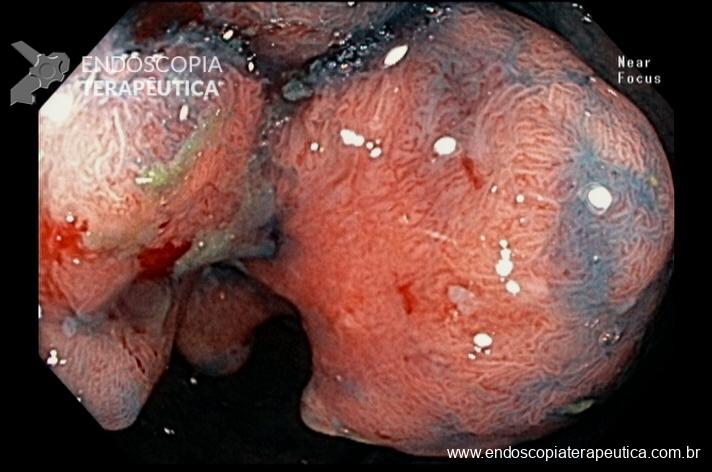
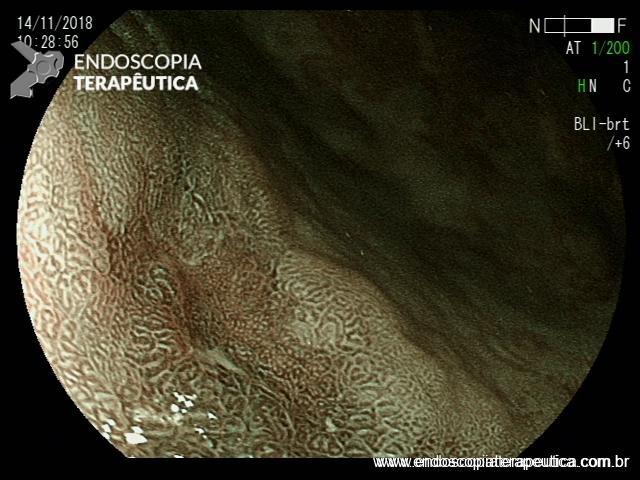
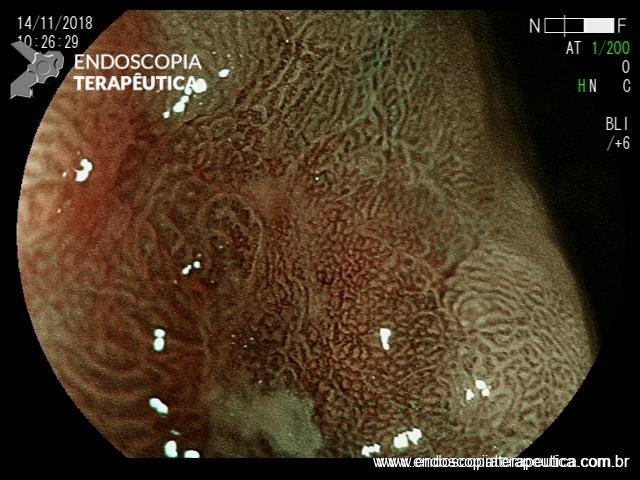
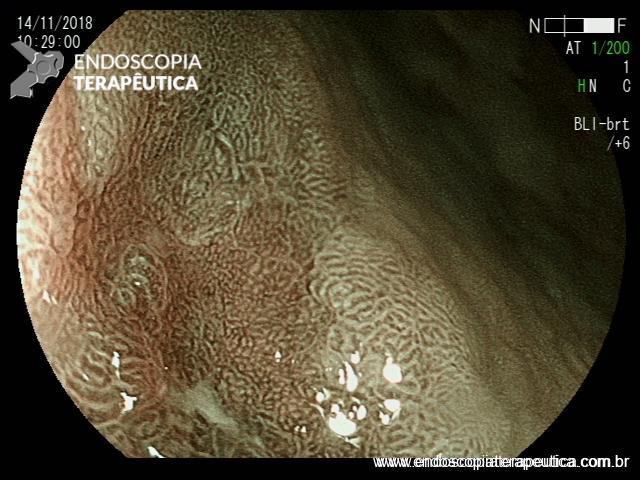
Após lavagem abundante da câmara gástrica com água e simeticona, identificada gastrite atrófica com metaplasias intestinais em antro, e lesão deprimida suspeita (0-IIc / Classificação de Paris), medindo cerca de 1,5 cm, localizada na grande curvatura para parede anterior de antro distal, fotos a seguir:
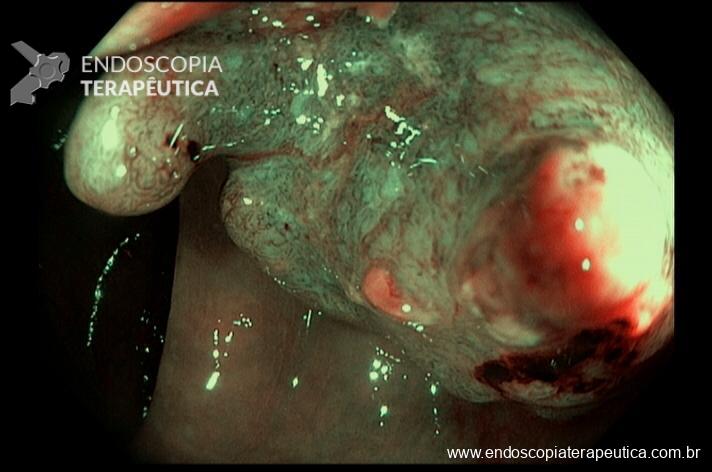
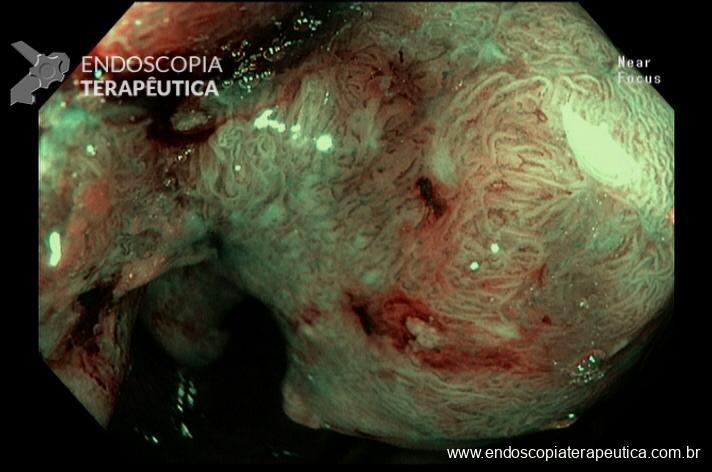
Após identificação da lesão com luz branca e com uso da cromoscopia óptica, realizada avaliação com uso da magnificação, sendo possível observar com mais detalhes a linha demarcatória, e a irregularidade das criptas e da vascularização no leito da lesão:
A biópsia demonstrou adenocarcinoma bem diferenciado, intramucoso. A paciente foi então encaminhada para realização de estadiamento com ecoendoscopia, que evidenciou que lesão não apresentava sinais de invasão da submucosa, e não se observaram linfonodomegalias (eusT1aN0Mx).
Paciente foi então encaminhada para realização de ressecção da lesão gástrica pela técnica de dissecção endoscópica da submucosa (ESD) com o Dr Nelson Miyajima (H. Nipo-Brasileiro).
Procedimento ocorreu sem intercorrências. E o AP evidenciou adenocarcinoma bem diferenciado, restrito a mucosa, ausência de invasão linfovascular, e margens livres (estadiamento pTis).
Veja mais sobre: processo de limpeza e desinfecção de endoscópios
QUIZ!! Tratamento endoscópico do Esôfago de Barrett.
Paciente de 55 anos, sexo masculino, tabagista, obeso (IMC 38 kg/m2), com doença do refluxo gastrointestinal (DRGE) de longa data. Vem em acompanhamento de devido ao achado anterior de esôfago de Barrett (C3M5), cuja a biópsia tinha revelando displasia de baixo grau. Foi submetido à duas terapias ablativas com radiofrequência. Abaixo as fotos do terceiro exame, que demonstrou redução significativa da epitelização colunar em esôfago distal, restando apenas uma pequena área de cerca de 1 cm pela parede anterior junto à TEG. Realizada a terceira sessão de ablação com radiofrequência com um cateter de ablação focal.
Pâncreas Divisum – Diagnóstico e Terapêutica
Pâncreas divisum é a anomalia pancreática congênita mais comum, ocorrendo em aproximadamente 10% dos indivíduos. A anatomia clássica do pâncreas divisum consiste em um pequeno ducto ventral, que drena através da maior papila maior e o ducto dorsal maior, que drena através da pequena papila menor (Fig A e C)
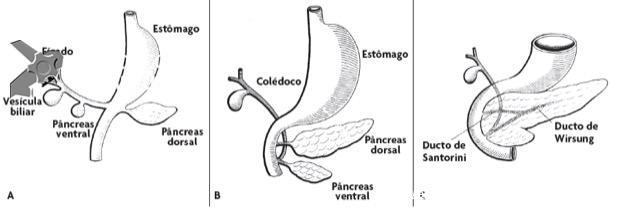
Aspecto embriológico do pâncreas. (A) O broto dorsal dá origem ao pâncreas dorsal, enquanto o pâncreas ventral se origina do broto comum hepatovesicular-pancreático. (B) Rotação do broto ventral que se colocará por trás do broto dorsal. (C) Aspecto final da fusão dos brotos ventral e dorsal. Imagem adaptada de Sakai, P et al. Tratado de Endoscopia Digestiva – Diagnóstica e Terapêutica – Vias Biliares e Pâncreas – Volume 3 – 2a edição – Revista e Atualizada
Quando não ocorre a fusão dos ductos dorsal e ventral na fase de coalescência de seus primórdios, não se desenvolve qualquer via de comunicação entre eles. O ducto pancreático ventral permanece curto com algumas ramificações, já que seu desenvolvimento fica prejudicado, e é considerado um ducto rudimentar, drenando na papila maior em conjunto com o ducto biliar principal.
O ducto pancreático dorsal permanece como o principal ducto, iniciando-se na cauda pancreática e drenando na papila menor.
Quando ocorre a fusão dos ductos dorsal e ventral, porém, através de um ducto muito afilado sem a fusão completa, denomina-se pâncreas divisum incompleto.
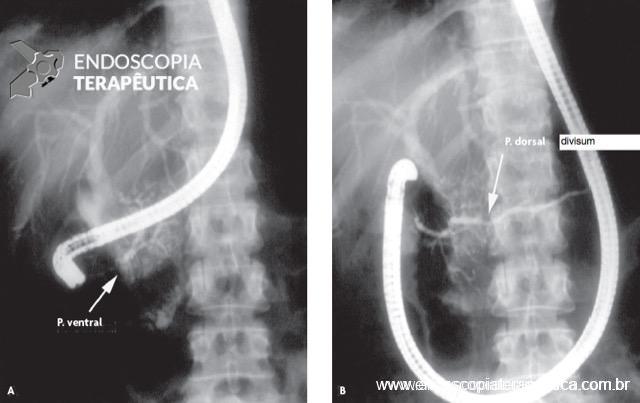
Pancreatite crônica em paciente com pâncreas divisum, observando-se a predominância da calcificação no pâncreas ventral (A) em relação ao pâncreas dorsal (B). Imagem adaptada de Sakai, P et al. Tratado de Endoscopia Digestiva – Diagnóstica e Terapêutica – Vias Biliares e Pâncreas – Volume 3 – 2a edição – Revista e Atualizada
Pâncreas divisum incompleto com opacificação inicial do pâncreas ventral na cateterização da papila maior (A) e enchimento gradativo do pâncreas dorsal através de uma comunicação ductal fina (B). Imagem adaptada de Sakai, P et al. Tratado de Endoscopia Digestiva – Diagnóstica e Terapêutica – Vias Biliares e Pâncreas – Volume 3 – 2a edição – Revista e Atualizada
Pacientes com pâncreas divisum e dor recorrente do tipo pancreatobiliar, pancreatite aguda ou pancreatite crônica clinicamente significativa necessitam de imagem pancreática (por exemplo, colangiopancreatografia por ressonância magnética) e uma avaliação da etiologia subjacente. Contudo, recomenda-se terapia com esfincterotomia da papila menor para pacientes com crises de pancreatite aguda se nenhuma outra etiologia for encontrada, e se houver evidência de dilatação do ducto dorsal na imagem pancreática.
Abaixo vídeo de ecoendoscopia de caso de pâncreas divisum:
A terapia endoscópica com esfincterotomia tem a vantagem de ser menos invasiva do que a cirurgia. Reserva-se a cirurgia para pacientes com falha a terapia endoscópica ou em que a endoscopia não é possível devido a anatomia cirúrgica alterada, e em pacientes com estenose de papila menor.
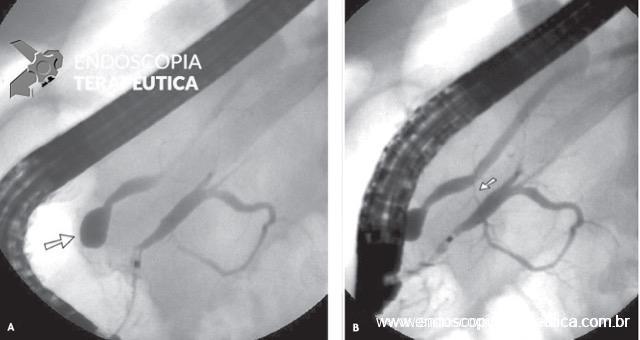
A terapia endoscópica para o pâncreas divisum consiste em esfinterotomia endoscópica da papila menor (Fig. D). A dilatação endoscópica com balão isoladamente ou stent pancreático prolongado não são recomendados devido ao risco de complicações. A terapia endoscópica tem taxas de sucesso relativamente altas em pacientes com pancreatite aguda recorrente, cerca de 75% de taxa de sucesso.
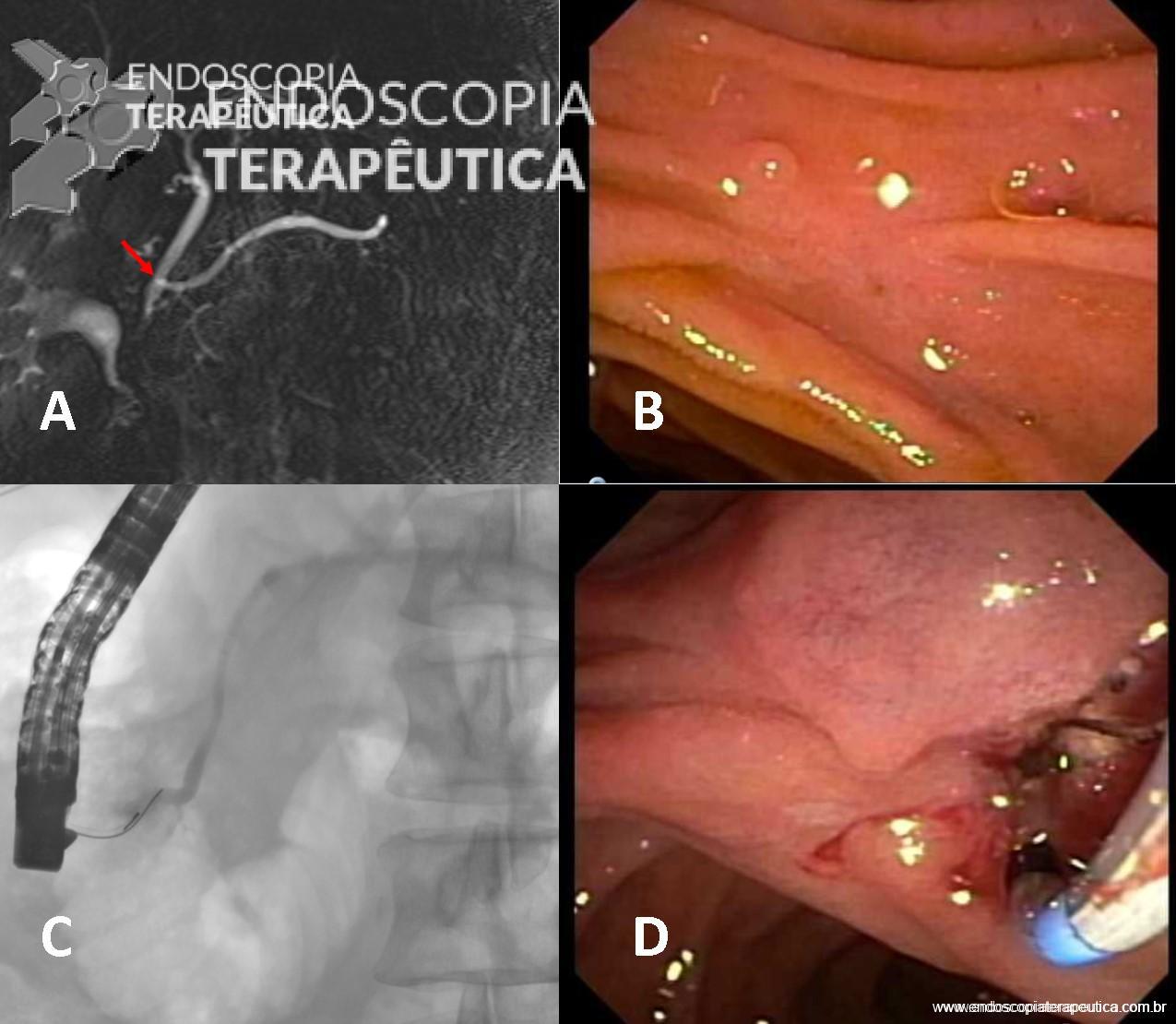
A: Ducto pancreático principal com drenagem pela papila menor (seta). B: Visão endoscópica da papila menor. C: CPRE: canulação e injecao de contrate pela papila menor. D: Esfincterotomia da papila menor.
Referências:
- Sakai, P et al. Tratado de Endoscopia Digestiva – Diagnóstica e Terapêutica – Vias Biliares e Pâncreas – Volume 3 – 2a edição – Revista e Atualizada.
- Kanth R et al. Endotherapy in symptomatic pancreas divisum: a systematic review. Pancreatology. 2014 Jul-Aug;14(4):244-50.
Como citar esse artigo:
Franco MC. Pâncreas divisum – Diagnóstico e Terapêutica. Endoscopia Terapêutica; 2018. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/pancreas-divisum/
Artigos Comentados – Fevereiro 2018
Apresentamos uma seleção de três artigos que foram publicados recentemente, sobre o uso do etomidato para sedação em endoscopia, preparo de cólon com simeticona, e tempo para realização de CPRE em pacientes com colangite aguda. Seguem abaixo:
1. Etomidate versus propofol sedation for complex upper endoscopic procedures: a prospective double-blinded randomized controlled trial.
Introdução:
O propofol é um dos agentes sedativos mais comumente utilizado para realização de procedimentos endoscópicos devido ao rápido início de ação e menor tempo de recuperação, quando comparado com os benzodiazepínicos e opióides. Entretanto, o propofol está associado com graves eventos adversos cardiopulmonares.
O etomidato é um agente hipnótico com rápido início de ação (5-15 seg) e recuperação (5-15 min), que provoca menores efeitos adversos nos parâmetros cardiopulmonares, protege o SNC e não estimula a liberação de histamina.
O exame de ecoendoscopia costuma ser mais prolongado e complexo que a realização da endoscopia alta diagnóstica, além de que a passagem do ecoendoscópio ser mais desconfortável para o paciente.
Objetivos:
Comparar a segurança e efetividade do propofol e etomidato na realização de exames endoscópicos mais complexos e prolongados (no estudo: ecoendoscopia).
Métodos:
Ensaio-clínico, duplo-cego, randomizado, com 128 pacientes que realizaram ecoendoscopia (Hallym University Dongtan Sacred Heart Hospital, Korea). No grupo de propofol a indução de sedação começou com um bolus inicial de 0,5 mg/kg, seguida de titulação com bolus de 0,25 mg/kg. No grupo etomidato a indução começou com um bolus inicial de 0,1 mg/kg, seguida de titulação com bolus de 0,05 mg/kg. A sedação foi administrada por uma enfermeira treinada sob supervisão do médico endoscopista, com objetivo de alcançar sedação profunda (escore 1 de MOAA/S).
Resultados:
Eventos adversos cardiopulmonares em geral foram identificados em 22 pacientes (34,38%) do grupo etomidato e em 33 pacientes (51,56%) do grupo propofol, sem diferença significativa (p = 0,074). No entanto, a incidência de dessaturação (6,25% vs 31,25%; p = 0,001) e depressão respiratória (7,81% vs 32,81%, P = 0,001) foi significativamente menor no grupo etomidato. A freqüência de mioclonia foi significativamente maior no grupo etomidato (34,37% vs 12,5%; p = 0,012). Análise de variância mostrou efeitos significativos do tempo de sedação e uso do etomidato na elevação da pressão arterial sistólica. A satisfação do médico com a sedação foi maior no grupo etomidato.
Conclusões:
A administração de Etomidato resultou em menos eventos de depressão respiratória e teve uma eficácia sedativa melhor do que o propofol; no entanto, foi mais freqüentemente associado ao mioclônia e ao aumento da pressão arterial durante os procedimentos endoscópicos.
link do artigo: AQUI
2. Impact of preprocedure simethicone on adenoma detection rate during colonoscopy: a multicenter, endoscopist-blinded randomized controlled trial.
Yu Bai, Jun Fang, Sheng-Bing Zhao, et al. Endoscopy 2018 Feb;50(2):128-136.
Introdução:
O preparo do cólon para colonoscopia requer remoção completa dos resíduos, fluídos e espuma. O polietilenoglicol (PEG) é amplamente utilizado para o preparo do cólon, com agentes antiespumantes (como a simetilicona) comumente usados em combinação com o PEG. Atualmente existem poucos dados na literatura sobre o efeito da simeticona na taxa de detecção de adenoma (TDA).
Objetivos:
Investigar se o uso da simeticona no preparo do cólon pode aumentar a TDA.
Métodos:
Ensaio-clínico, multicêntrico, randomizado, com endoscopista “cegos” com relação ao uso ou não da simeticona, e pacientes consecutivos que realizaram colonoscopia em 6 centros na China. Os pacientes foram distribuídos aleatoriamente para um dos dois grupos: PEG com simeticona ou PEG sozinho. O preparo foi realizado com 2L de PEG, com de 30 ml de simeticona no grupo intervenção, 6-8 horas antes da colonoscopia, sendo a mistura administrada em doses de 250 mL a cada 10-15 minutos.
Resultados:
Foram incluídos 583 pacientes. A TDA foi maior no grupo PEG com simeticona (21,0% vs 14,3%, p = 0,04). O número médio de adenomas detectados foi significativamente maior: 2,20 ± 1,36 vs. 1,63 ± 0,89 (p = 0,02). Pacientes no grupo PEG com simeticona apresentaram melhor eficácia no prepraro do cólon: Boston bowel preparation scale (BBPS) ≥6 em 88,3% vs 75,2% (p < 0,001); e escore de bolhas de 1,00 ± 1,26 vs. 3,98 ± 2,50 (p < 0,001). A distensão abdominal foi relatada com menor freqüência no grupo PEG com simeticona (7,8% vs. 19,7%, p < 0,001).
Conclusões:
O uso combinado de PEG e simeticona está associado a uma TDA significativamente aumentada em uma população chinesa.
Link do artigo: AQUI
3. Association between early ERCP and mortality in patients with acute cholangitis.
Michael Dougherty, Thomas M. Runge, MSCR, Swathi Eluri, et al. Gastrointestinal Endoscopy 2018 Jan;87(1):185-192.
Introdução:
A colangite aguda (CA) é uma condição grave que está associada a alta mortalidade de até 10% apesar do tratamento adequado, e acima de 50% se não tratada. A associação entre o tempo para realização da CPRE e mortalidade em pacientes com colangite aguda não está clara na literatura.
Objetivos:
Investigar se a CPRE precoce dentro de 24 horas está associada a uma menor mortalidade em 30 dias.
Métodos:
Estudo retrospectivo a partir de banco de dados coletado prospectivamente, com pacientes consecutivos com colangite aguda, de acordo com os critérios das Diretrizes Internacionais de Tóquio de 2013, que foram submetidos à CPRE (Odense University Hospital, Dinamarca).
Resultados:
Na análise, 166 pacientes preencheram os critérios de inclusão. Sendo que 48 pacientes (29%) foram submetidos à ERCP dentro de 24 horas, e 118 pacientes (71%) à CPRE tardia. Os pacientes submetidos à ERCP em 24 horas eram mais jovens (65 vs 73 anos; p = 0,01) e apresentavam maior freqüência cardíaca (95 vs 90 bpm; p = 0,02). A mortalidade global foi de 8% entre pacientes submetidos à CPRE precoce, e de 19% entre os pacientes submetidos à CPRE tardia. Após ajuste por fatores de confusão, o desempenho da CPRE dentro de 24 horas foi significativamente associado a menor mortalidade em 30 dias (OR, 0,23; IC 95% 0,05-0,95; p = 0,04).
Conclusões:
Os resultados indicam que a CPRE precoce dentro de 24 horas está associada a menor mortalidade em 30 dias em pacientes com colangite aguda.
Link do artigo: AQUI