1. Introdução
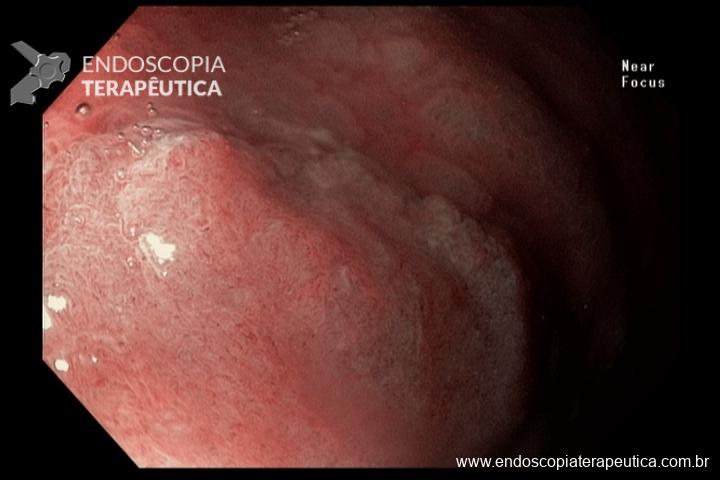
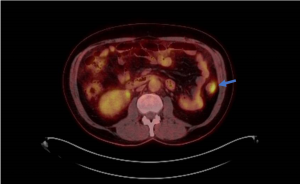
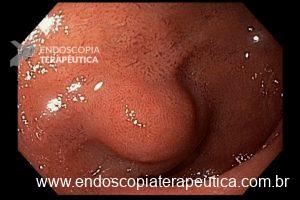
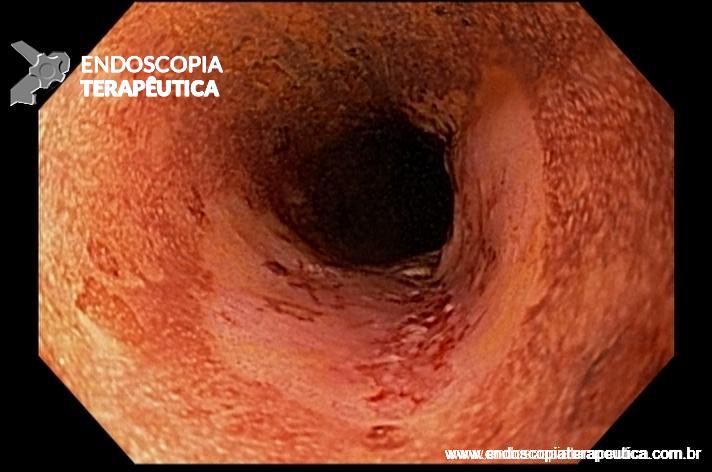
O esôfago de Barrett é a única lesão pré-maligna identificável do adenocarcinoma esofágico. Dados epidemiológicos dos EUA revelaram uma incidência de 18.174 casos de câncer de esôfago em 2014, sendo 60% por adenocarcinoma, com uma sobrevida em 5 anos de apenas 15–20%. [1,2]
A terapêutica endoscópica mudou o manejo dos pacientes com Barrett, possibilitando tratamento eficaz e minimamente invasivo.
2. Indicações de tratamento endoscópico
De uma forma geral, está indicado no paciente com Barrett com displasia ou com adenocarcinoma intramucoso.
Abaixo, a tabela expõe as últimas recomendações das principais sociedades americanas e europeias sobre as estratégias de vigilância e manejo dos pacientes com Barrett:
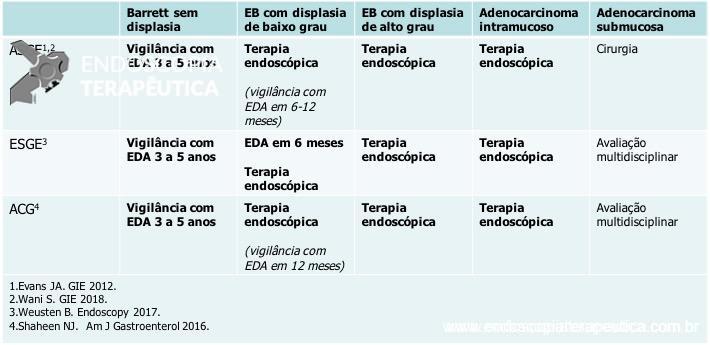
Antes de indicar o tratamento endoscópico nos pacientes com Barrett com displasia, recomenda-se confirmação do diagnóstico histológico por pelo menos 1 patologista especialista ou por um grupo de patologistas. Uma vez observado que a revisão histológica por 1 especialista acarretou mudança no resultado do AP em 55% (maior parte das vezes em downgrading). [3]
Estratégias de tratamento
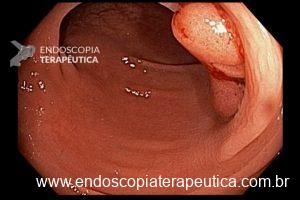
As estratégias se dividem em 2, a depender da presença ou não de lesão endoscopicamente visível:
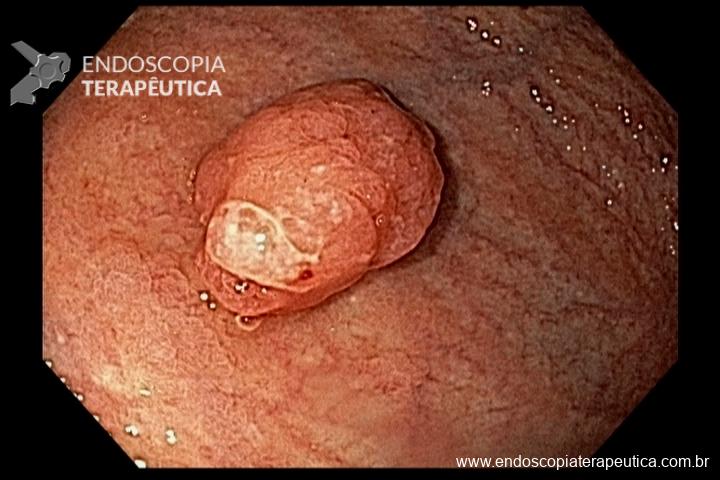
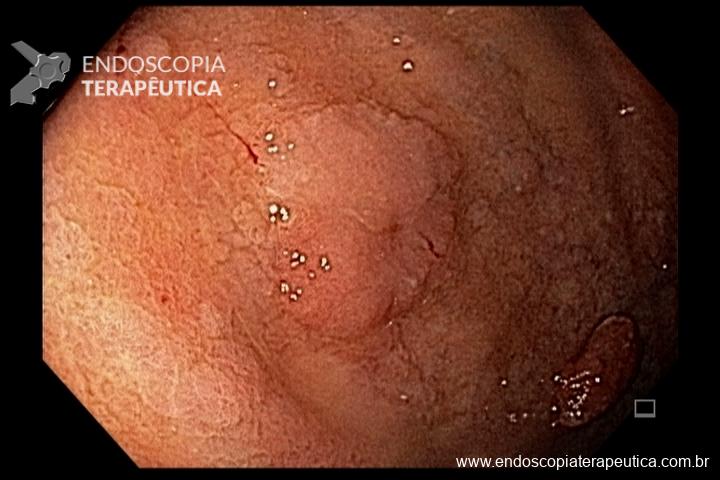
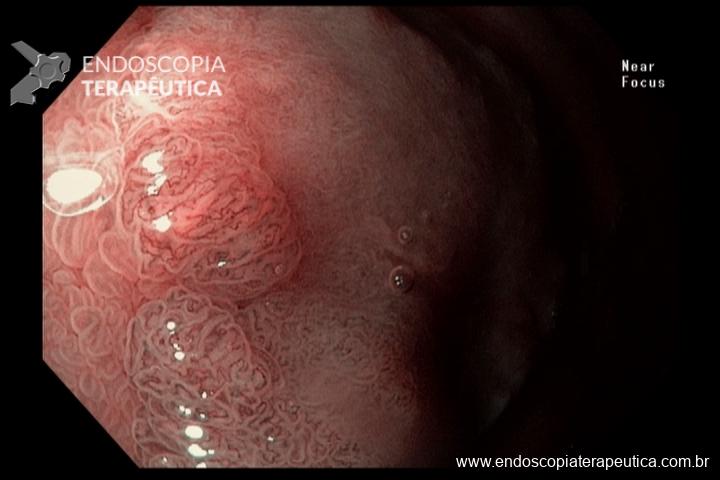
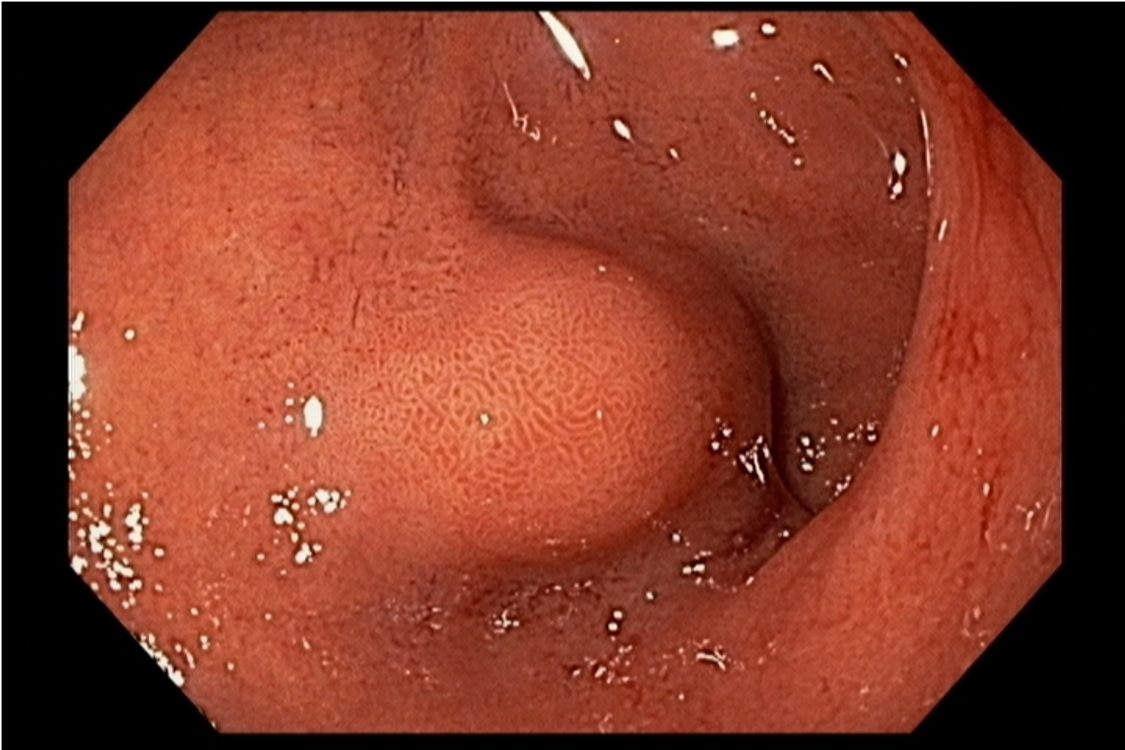
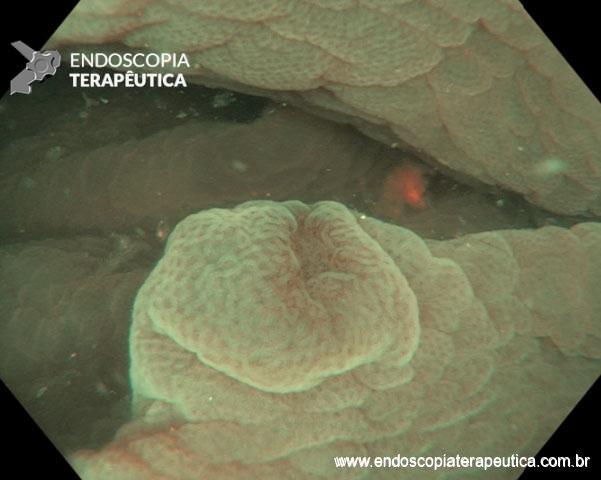
- Barrett com displasia sem lesão visível: terapia ablativa;
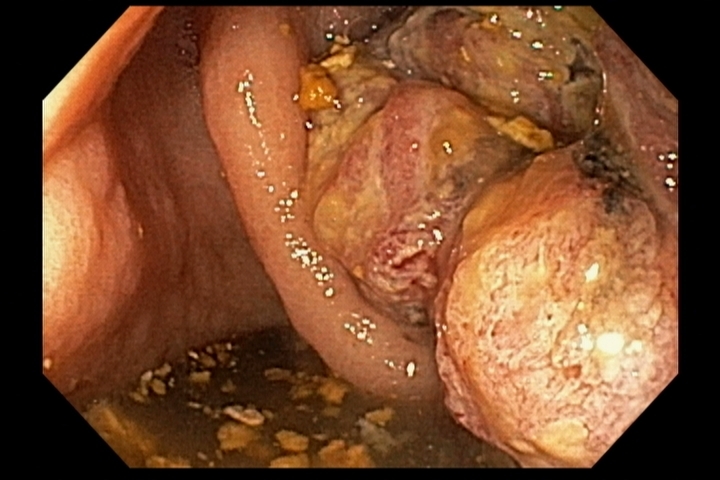
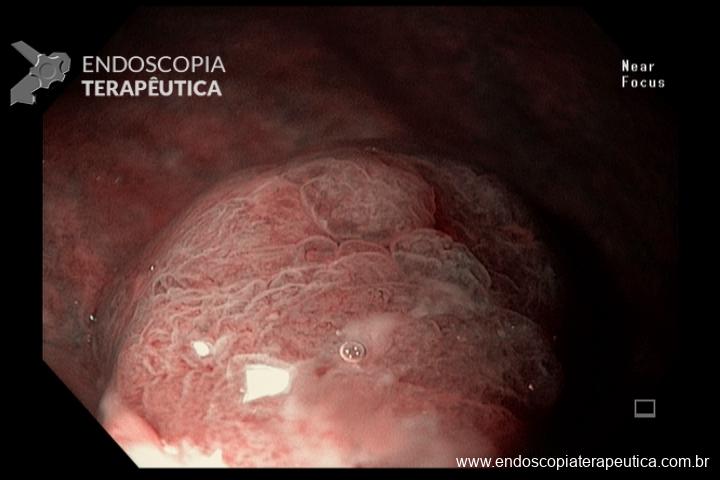
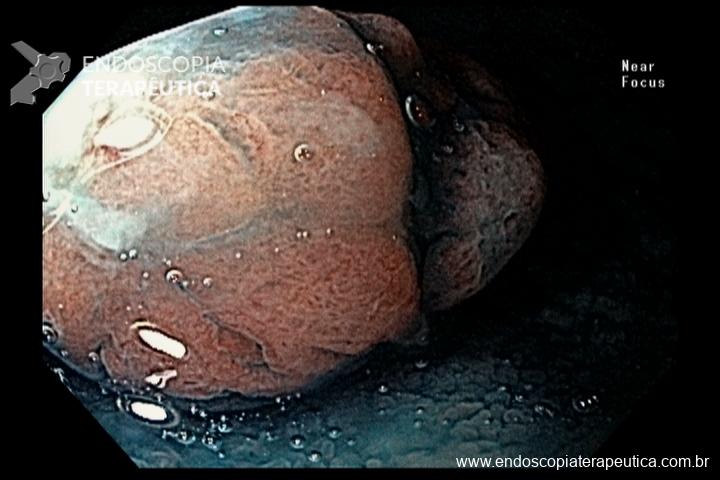
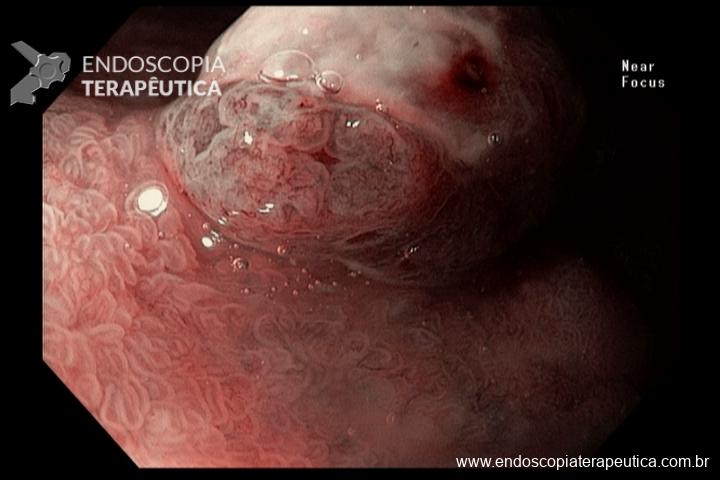
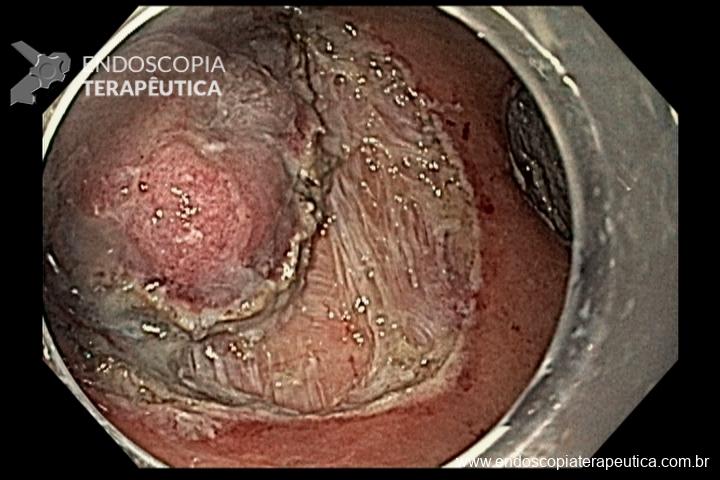
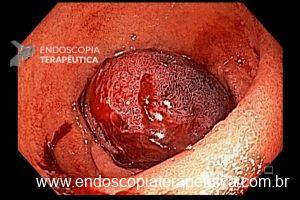
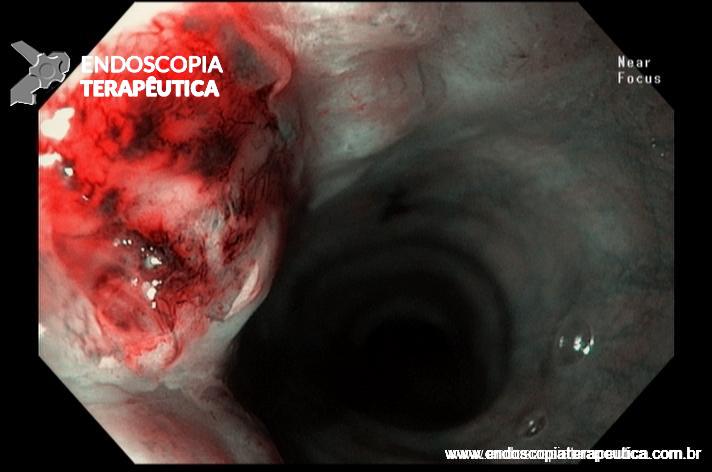
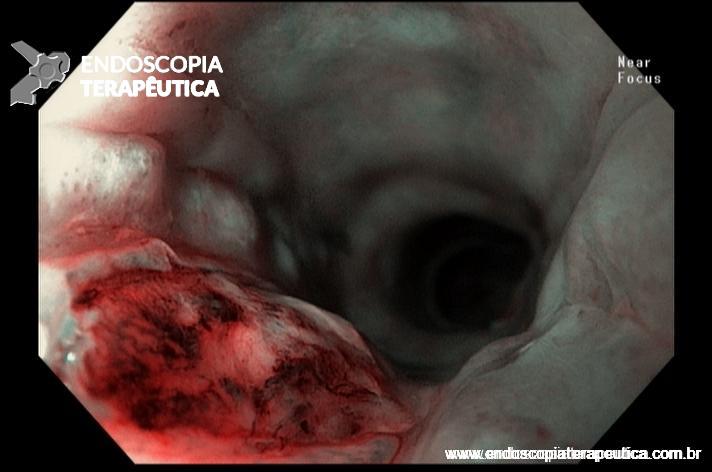
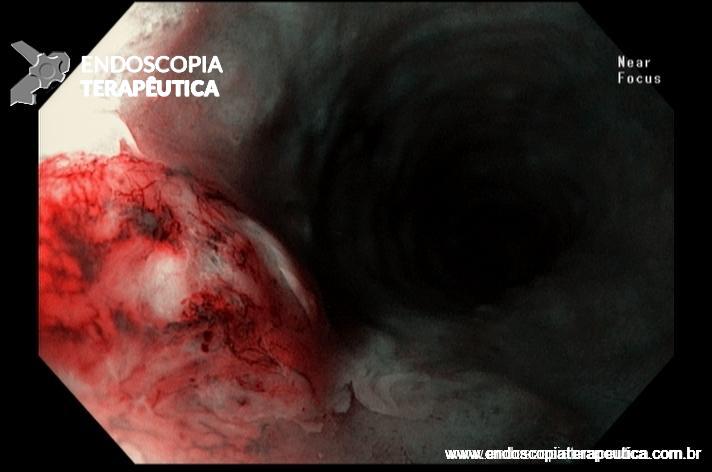
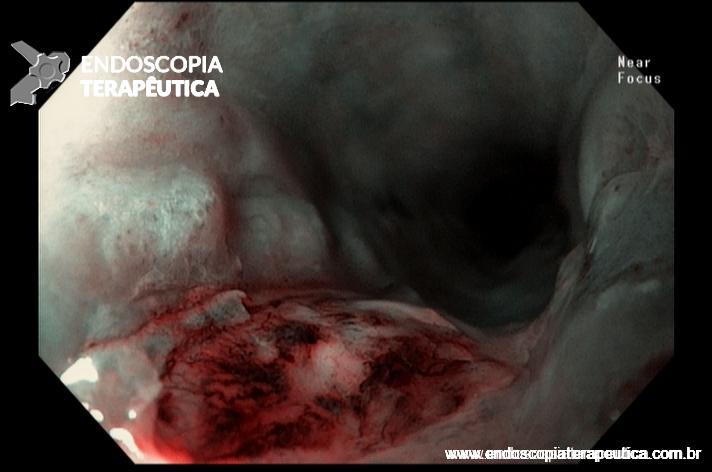
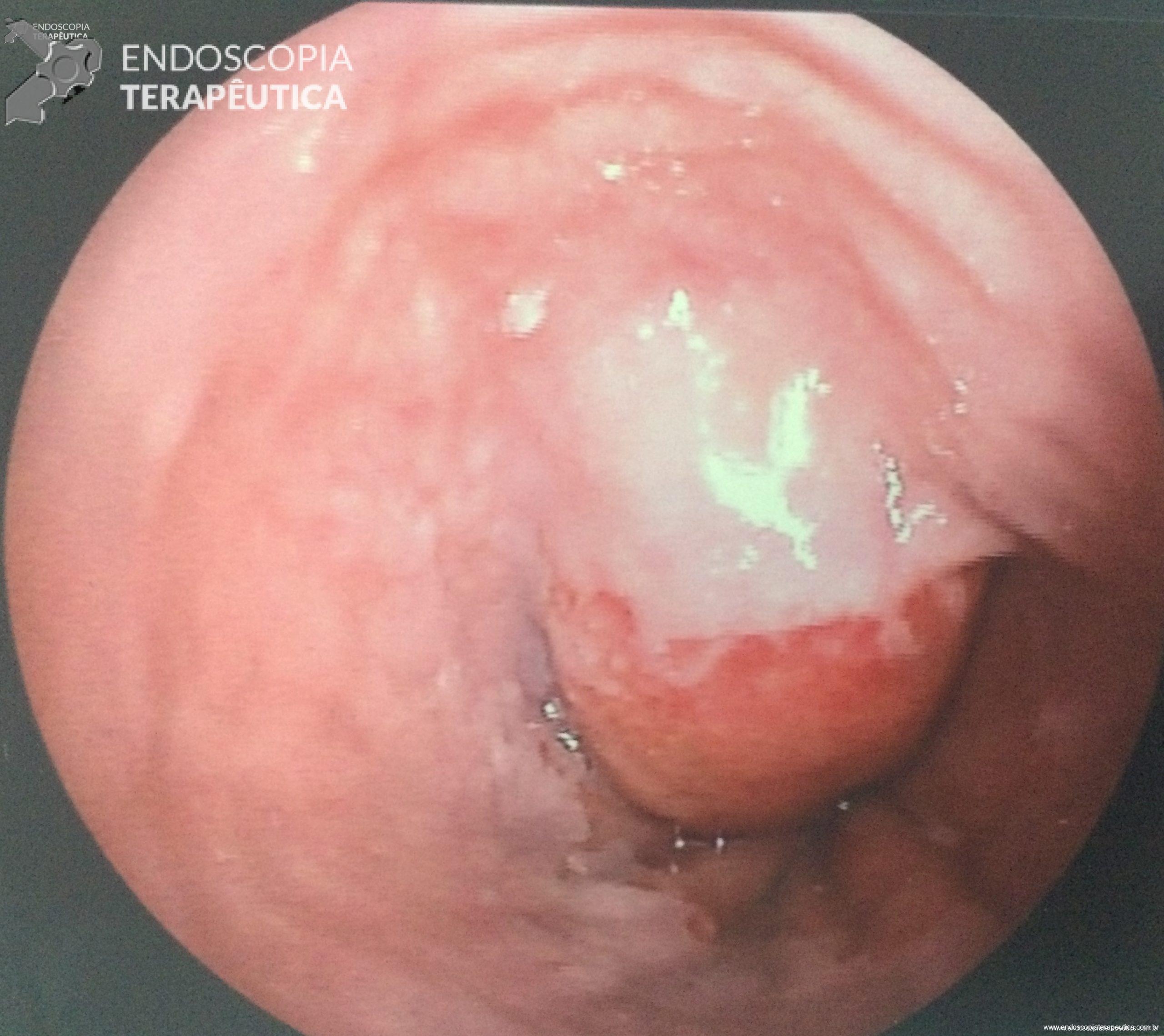
- Barrett com displasia e com lesão visível: ressecção endoscópica da lesão visível, seguida da terapia ablativa do Barrett remanescente.
A ressecção das lesões visíveis fornece um correto estadiamento histológico e, consequentemente, direciona o correto intervalo de vigilância, com mudança no AP inicial em 39% (maior parte das vezes em upgrading na displasia/neoplasia). [3]
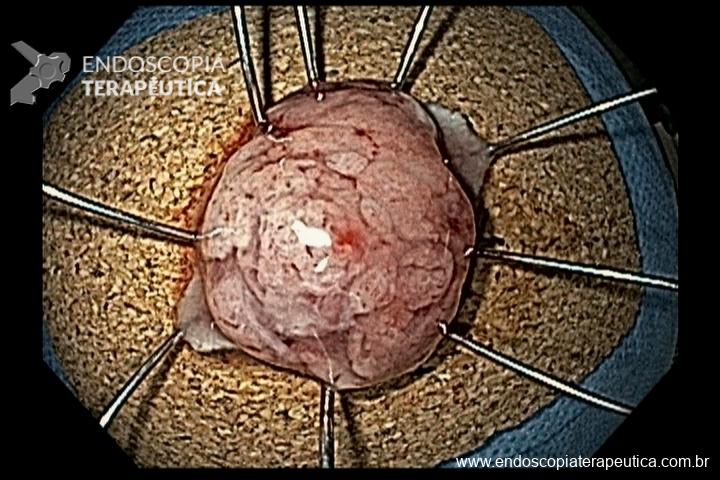
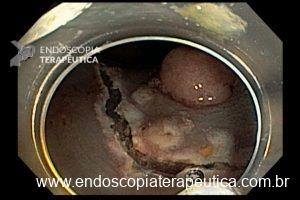
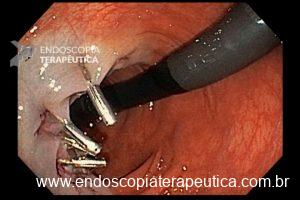
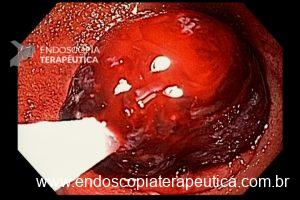
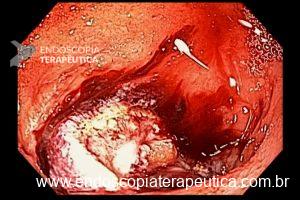
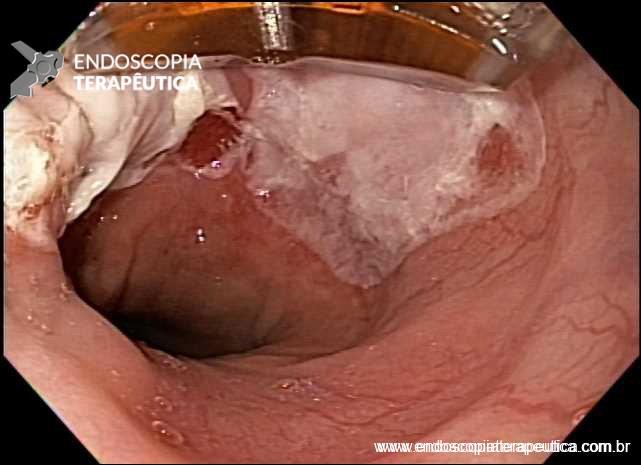
Técnicas de ressecção endoscópica
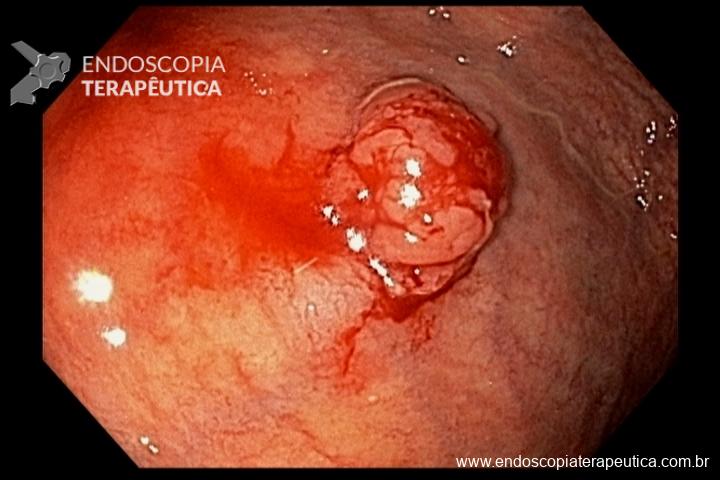
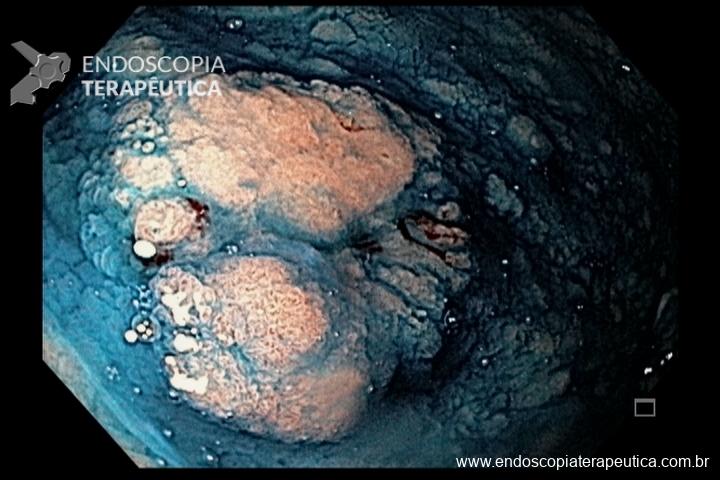
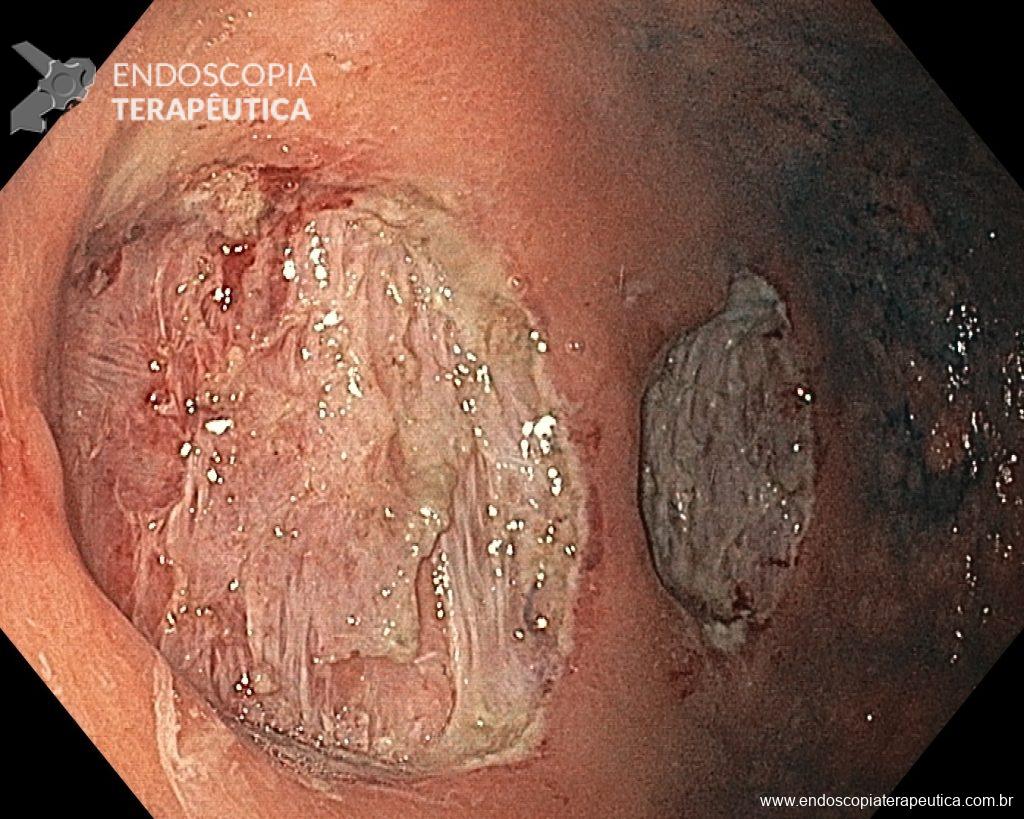
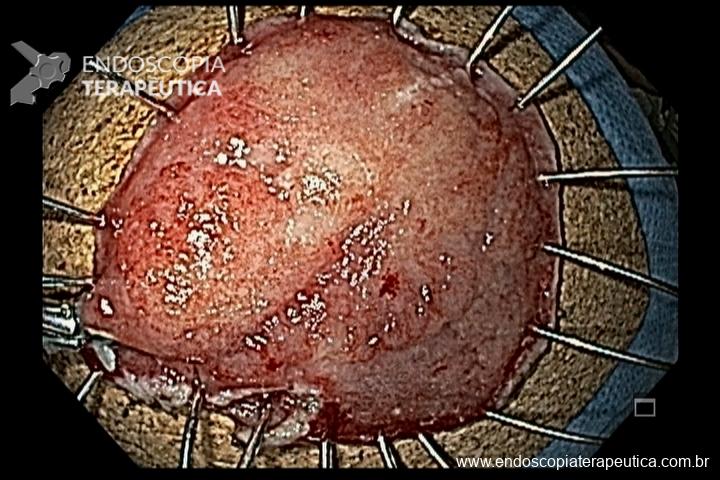
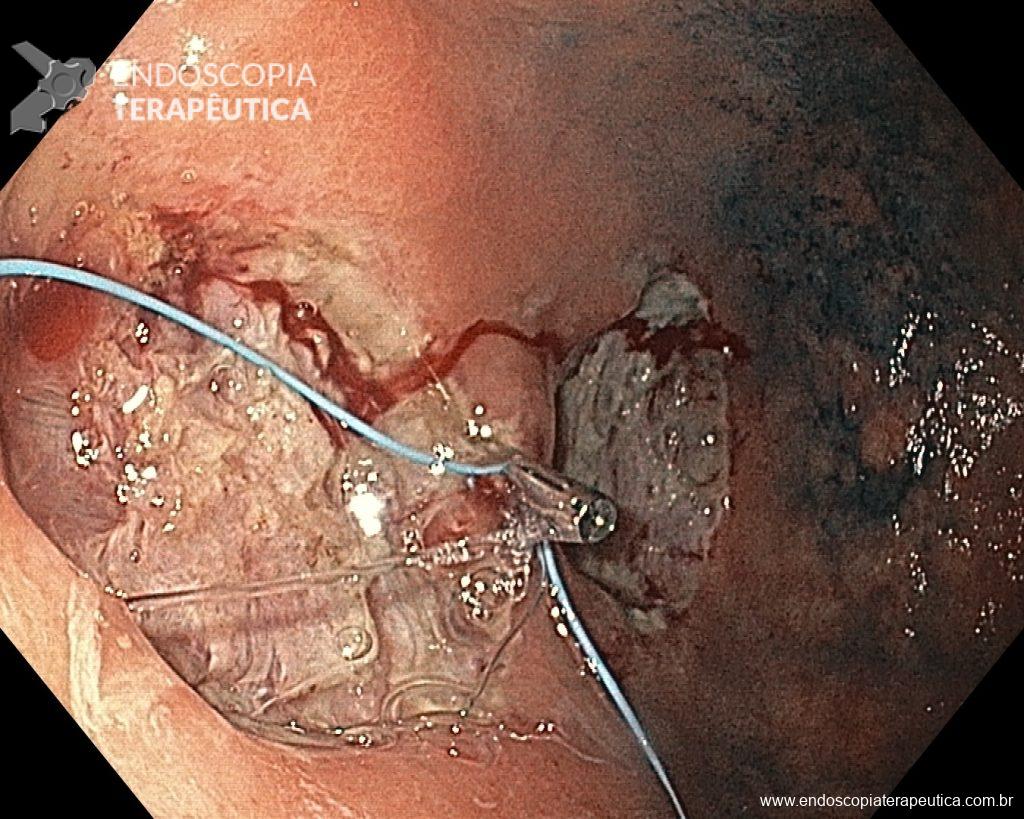
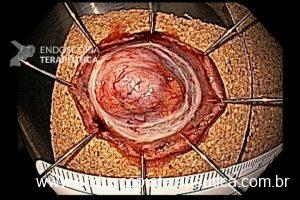
As principais técnicas são a mucosectomia com multibandas (multiband mucosectomy) e a mucosectomia com auxílio do Cap (Cap technique). Ambas apresentam eficácia e segurança semelhantes. Estudo com 2.513 mucosectomias em pacientes com Barrett demonstrou taxa de sangramento de 1,2%, estenose 1%, e nenhuma perfuração. [4]
A seguir link com vídeo da técnica de ressecção com multibandas: CLIQUE AQUI
Papel da dissecção endoscópica da submucosa (ESD)
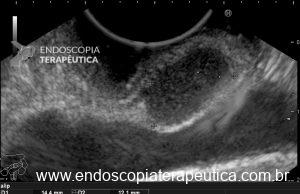
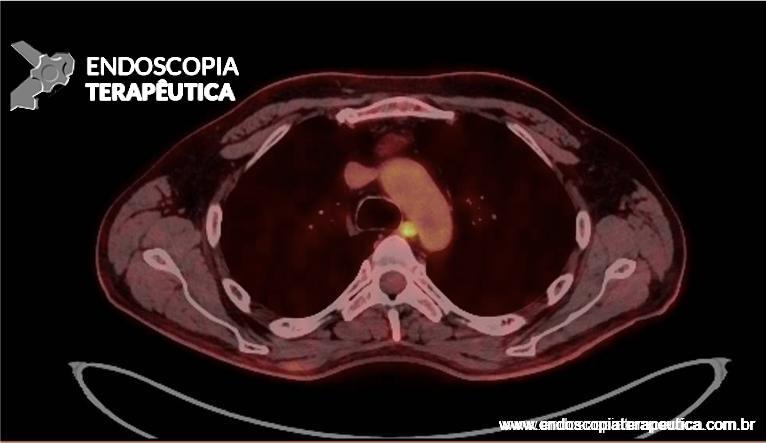
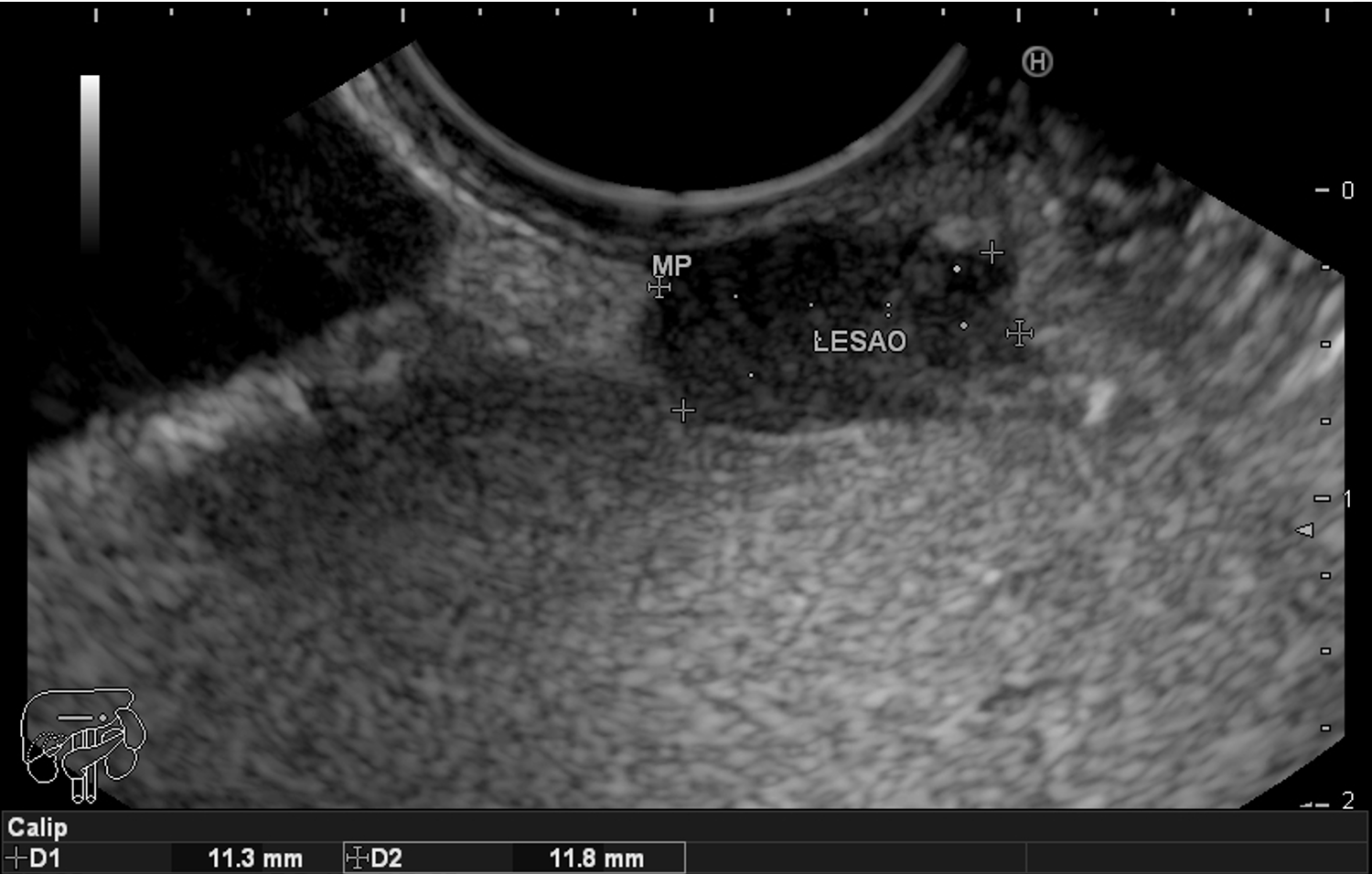
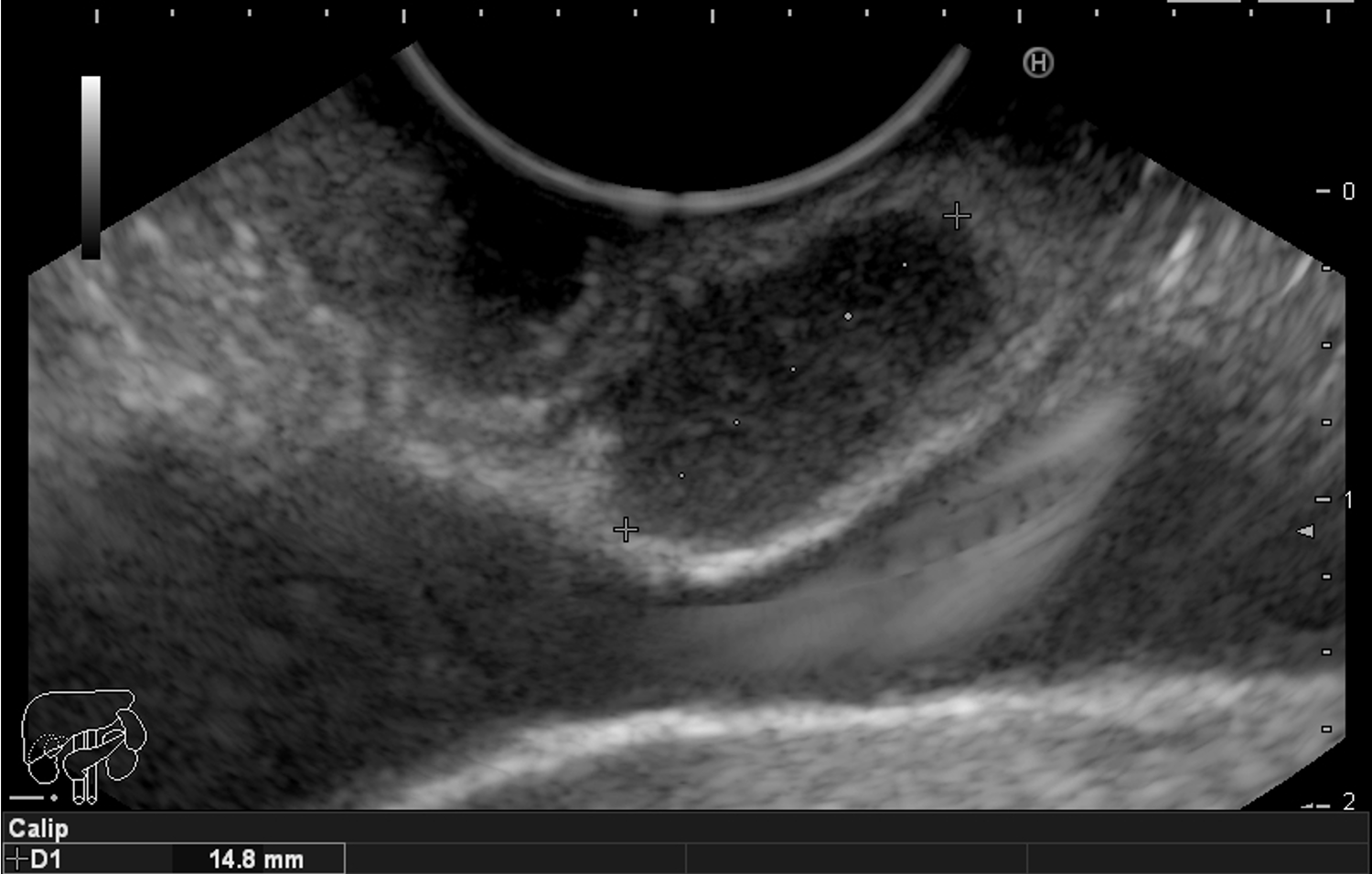
Para os casos específicos de Barrett, o estadiamento histológico e de profundidade parecem ser os parâmetros mais importantes para guiar o manejo dos pacientes. Diferentemente de outras condições neoplásicas, não há necessidade absoluta de obtenção de margens laterais livres no Barrett. Alguns estudos demonstraram a eficácia da técnica de mucosectomia no Barrett comparado à ESD [5]:
- ESD vs EMR;
- > taxas de R0 (ressecção com margens laterais livres);
- Tempo de procedimento mais prolongado;
- Maior taxa de eventos adversos;
- Mesma taxa de remissão de neoplasia.
A ESD tem sido reservada para os casos de lesões com componente luminal significativo, o que dificulta a apreensão pelo sistema de bandas e pelo Cap, e para as lesões com suspeita de invasão da submucosa, uma vez que se tem observado uma boa evolução dos pacientes com Barrett com adenocarcinoma com invasão da submucosa até 500 µm, tumor bem ou moderadamente diferenciado, após ESD com margens livres e ausência de invasão angiolinfática. [5]
Terapia endoscópica ablativa
A ablação por radiofrequência é o método de eleição, por sua alta segurança, eficácia e por já ter sido extensivamente validado na literatura e prática médica. Outras opções são: terapia fotodinâmica, crioterapia e ablação com plasma de argônio.
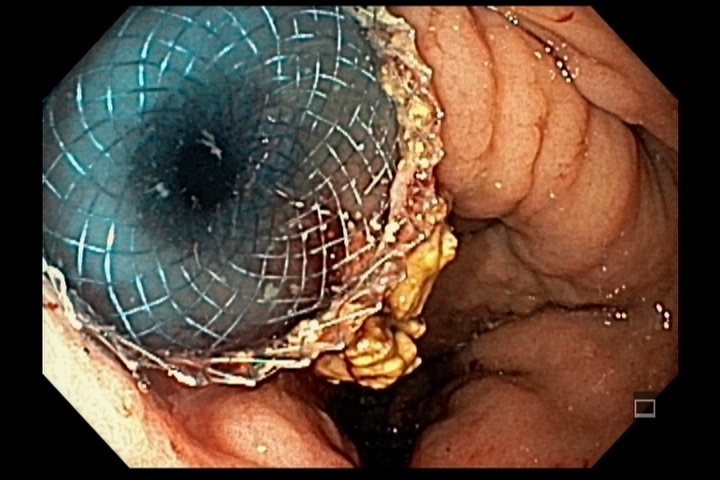
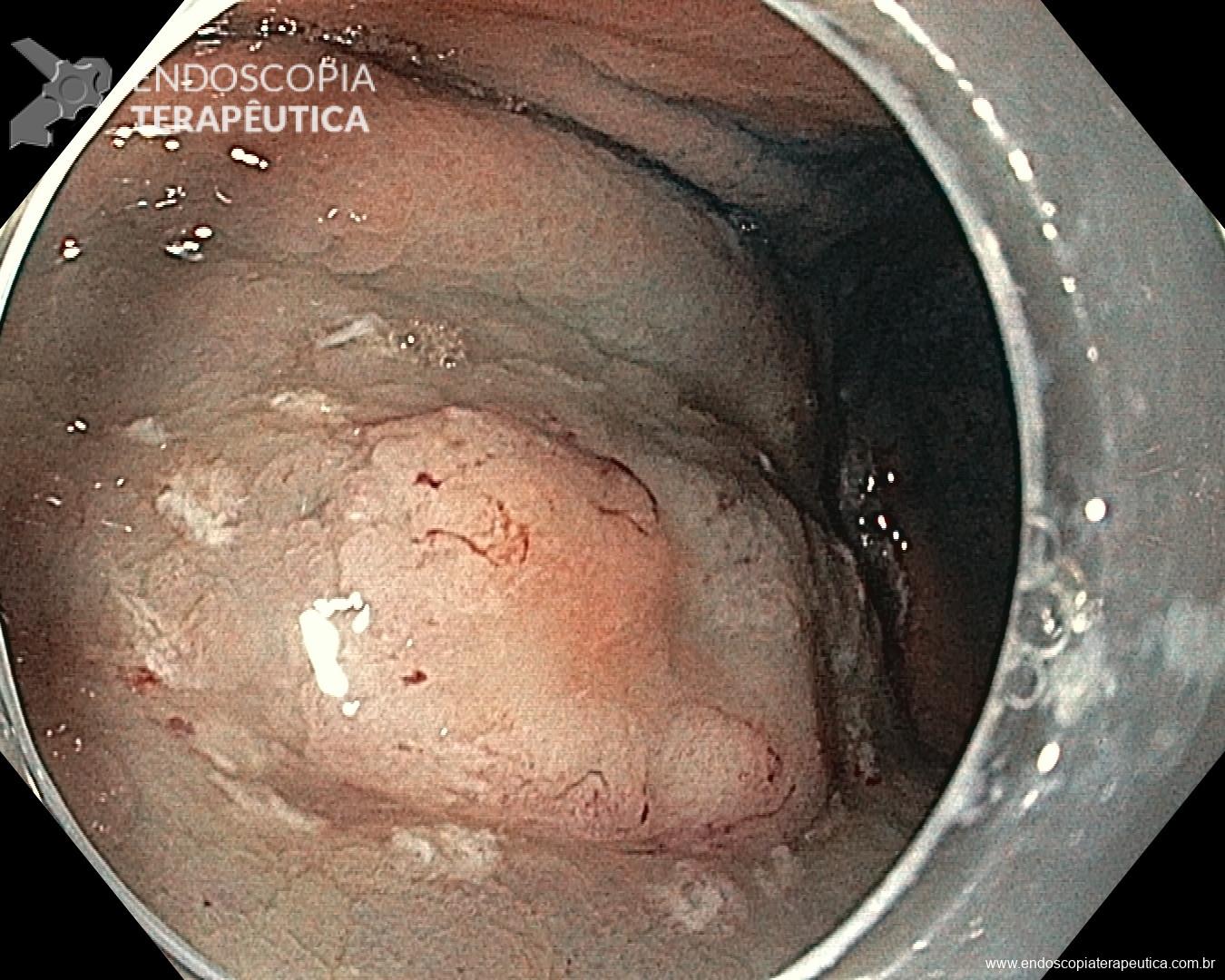
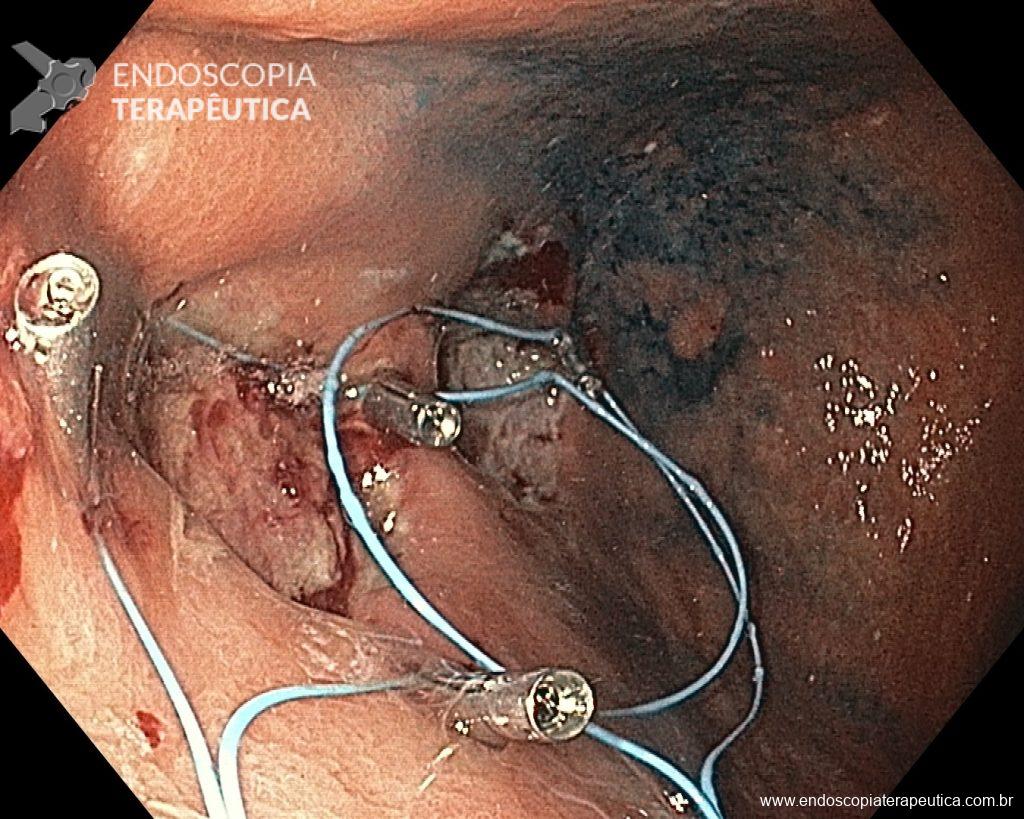
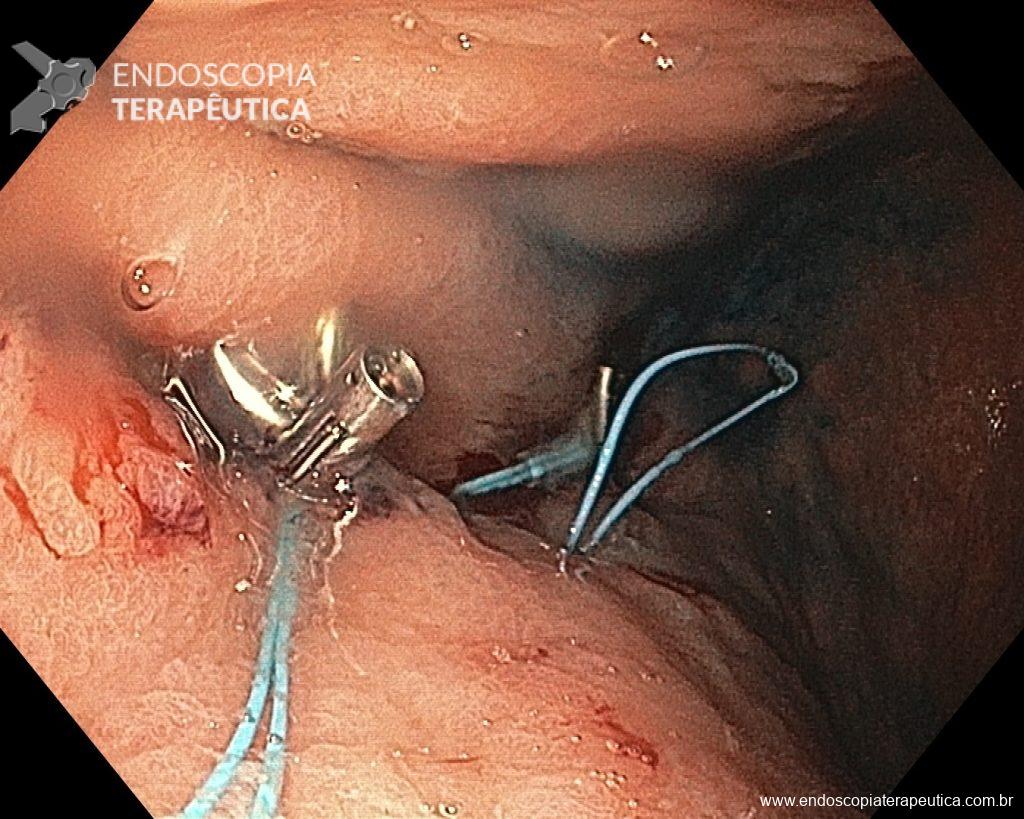
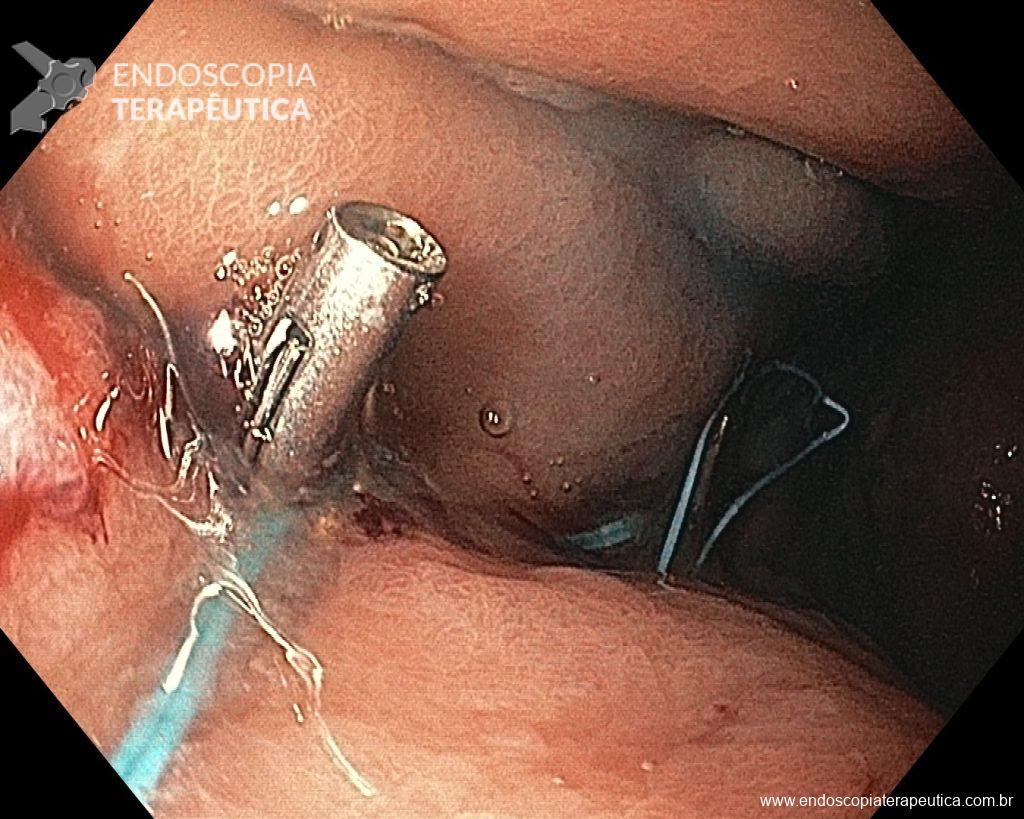
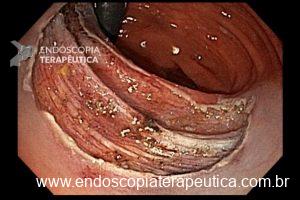
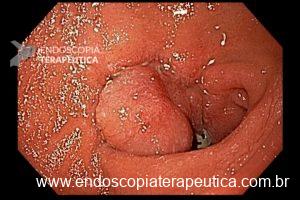
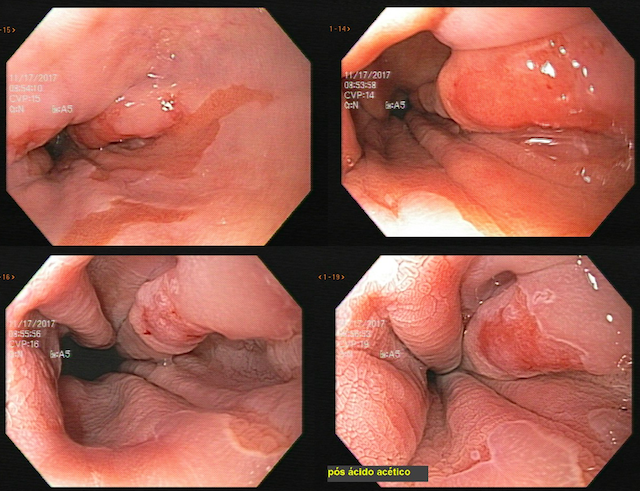
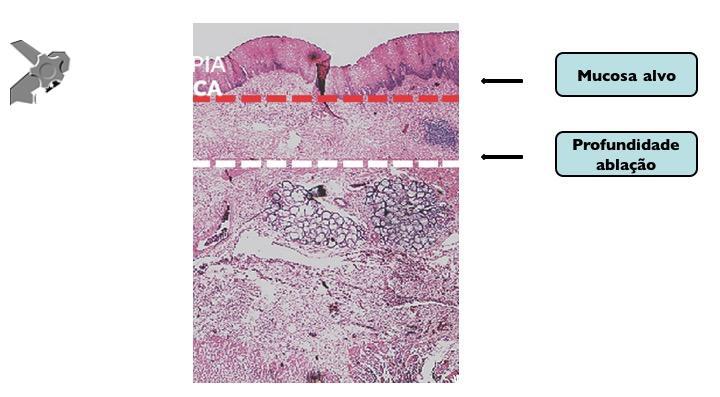
A ablação com radiofrequência (Sistema Barrx® RFA; Medtronic) promove destruição do tecido-alvo pelo calor por meio de cateteres endoscópicos com uso de gerador elétrico conectado a matrizes de eletrodos bipolares (faixa de RF: 450-500 kHz). A ablação acomete profundamente até a muscularis mucosae (500–1000 µm), a submucosa não é atingida (↓risco de hemorragia, fibrose e estenose).
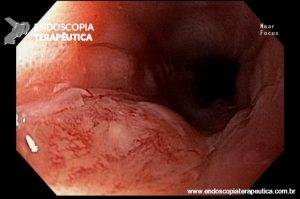
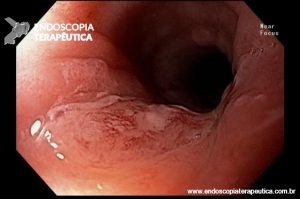
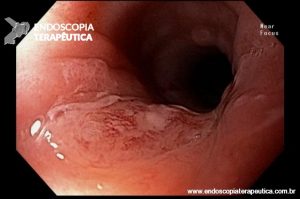
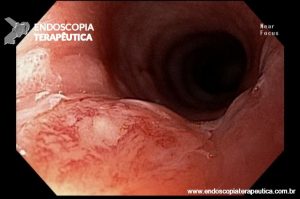
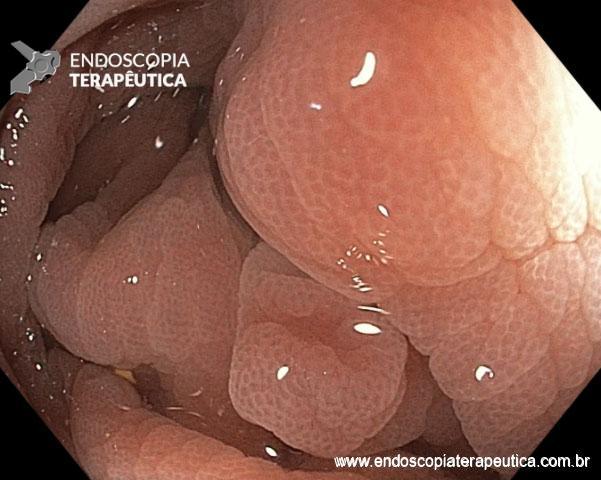
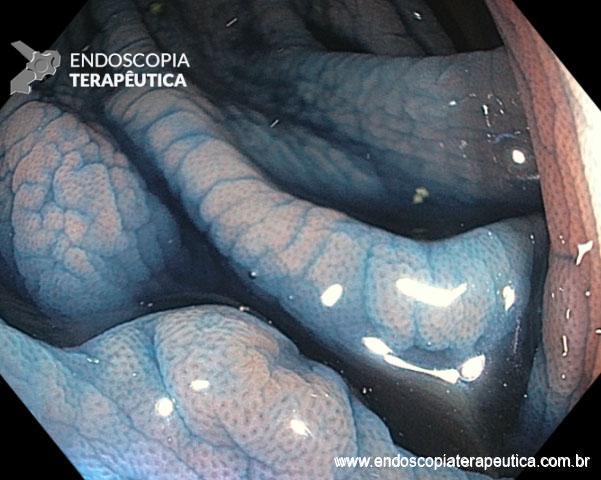
Ablação com radiofrequência do esôfago de Barrett.
O sucesso da terapia ablativa é definido pela erradicação completa da displasia, bem como da metaplasia intestinal, no esôfago tubular. Com estudos demonstrando taxas de sucesso de 98% após 1 ano do tratamento de pacientes com Barrett com displasia e/ou adenocarcinoma intramucoso. [6]
Eventos adversos foram observados na literatura em 8,8% dos casos, sendo o principal estenose 5,6%, seguido por sangramento 1% e perfuração 0,6%. [7]
A ablação por radiofrequência (ARF) permite a destruição do tecido-alvo desejado pelo calor. É um tratamento amplamente utilizado para a arritmia cardíaca, câncer, varizes e sangramento uterino. Quando disponível, a ARF tornou-se o tratamento padrão para o esôfago de Barrett displásico.
3. Vigilância
A vigilância deve ser empregada pois observa-se taxa de recorrência de cerca de 20% em 2 a 3 anos após sucesso. Na recorrência, observou-se que 25% apresentaram displasia e que em > 95% dos casos o tratamento endoscópico pode ainda ser estabelecido.
O intervalo de vigilância depende do grau de displasia observado antes do tratamento.
- Displasia de alto grau/adenocarcinoma: endoscopia com biópsias (nos 4 quadrantes a cada 1 cm) de 3 em 3 meses no primeiro ano, de 6 em 6 meses no segundo ano e, depois, anualmente. [8]
- Displasia de baixo grau: endoscopia com biópsias (nos 4 quadrantes a cada 1 cm) de 6 em 6 meses no primeiro ano e anualmente após [8]; ou endoscopia com biópsias (nos 4 quadrantes a cada 1 cm) 1 vez no ano por 2 anos e, depois, a cada 3 anos. [9]
Referências
- Rubenstein JH. Gastroenterology 2015.
- Hur C. Cancer. 2013
- Wani S. GIE 2018.
- Tomizawa Y. Am J Gastroenterol 2013.
- Weusten B. Endoscopy 2017.
- Gondrie JJ. Endoscopy 2008.
- Qmseya BJ. Clin Gastroenterol Hepatol 2016.
- Shaheen NJ. Am J Gastroenterol 2016.
- Wani S. Gastroenterol 2016.
Como citar este artigo:
Franco M. Barrett, Endoscopia e as inúmeras possibilidades de abordagem/manejo. Endoscopia Terapêutica; 2021. Disponível em: endoscopiaterapeutica.net/pt/assuntosgerais/barrett-endoscopia-inumeras-possibilidades-de-abordagem-manejo
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!