Assuntos gerais : Endometriose Intestinal
Introdução
A endometriose é uma doença ginecológica benigna definida pela presença de glândulas endometriais fora da cavidade uterina. É frequentemente diagnosticada na terceira década de vida, afetando 10 a 12% das mulheres em idade reprodutiva.
A sua etiologia ainda hoje é discutida, e a teoria mais popular é a da menstruação retrógrada. Durante a menstruação células endometriais migram através das trompas de Falópio para o peritônio e ali crescem sob a influência de fatores hormonais. Outras teorias consistem na transformação de células de outras topografias em células endometriais através de diferentes meios (metaplasia, células tronco).
A endometriose profunda é definida como a invasão subperitoneal com profundidade maior que 5 mm, sendo o intestino o órgão extragenital mais acometido, apresentando de 5 a 12% de prevalência nas mulheres com endometriose. A topografia é em 90% dos casos em cólon sigmoide e reto. Embora o envolvimento intestinal isolado possa ser observado, cerca de 50 % dos pacientes com doença no reto apresenta acometimento em outros locais. Curiosamente, em aproximadamente 30% dos casos com envolvimento de retossigmoide, o cólon direito também é acometido.
Sintomas
Os sintomas da endometriose intestinal podem ser inespecíficos como dismenorreia, dispareunia e dor pélvica crônica. Sintomas intestinais mais específicos, como diarreia, constipação, sangue nas fezes, distensão abdominal, disquezia e raramente obstrução intestinal, também podem ocorrer. No entanto, quaisquer sintomas pélvicos, especificamente de natureza cíclica, devem levantar a suspeita de endometriose.
Além disso, pacientes com endometriose frequentemente apresentam comorbidades psicopatológicas significativas, como ansiedade e depressão, que muitas vezes podem potencializar a gravidade da dor experimentada.
Diagnóstico
- Exame físico : através do toque pélvico bimanual é frequentemente útil no diagnóstico, especialmente se realizado no momento da menstruação, período em que as lesões podem estar mais inflamadas, sensíveis e palpáveis.
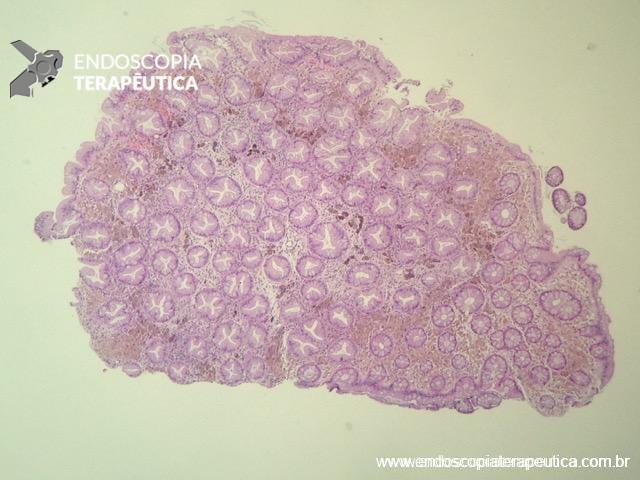
- Ultrassom transvaginal: exame de escolha como avaliação inicial, permite descrever tamanho, localização, distância da borda anal, profundidade e número de nódulos. Endometriomas se demonstram como imagens hipoecoicas que envolvem a parede intestinal a partir da serosa, podendo se estender para a muscular própria e a submucosa e raramente a mucosa (5% dos casos de endometriose intestinal). No entanto a limitação dessa técnica consiste em lesões no sigmoide, pois geralmente estão fora do campo de visão.
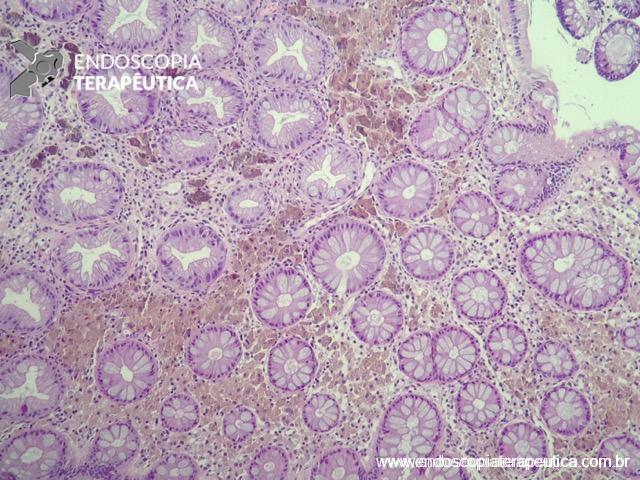
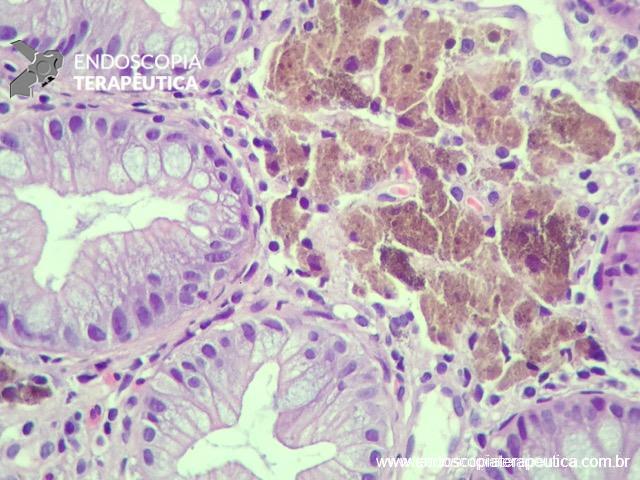
- Ultrassom retal: é considerado o teste de escolha para avaliar lesões que infiltram a parede intestinal com alta acurácia na determinação de profundidade, além da possibilidade de confirmação histológica através da punção. Outra importante função deste método é no diagnóstico diferencial de lesões subepiteliais. A endometriose quase sempre acomete mais de uma camada, especialmente a serosa e raramente acomete a camada mucosa. Demais lesões subepiteliais primárias da parede intestinal costumam ser restritas a apenas uma camada.
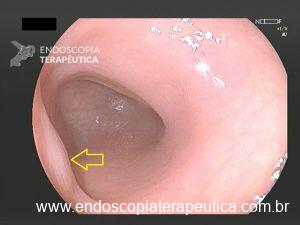
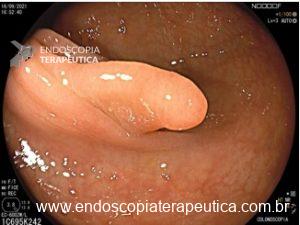
Figura 1: Paciente com endometriose e abaulamento submumoso em cólon sigmoide
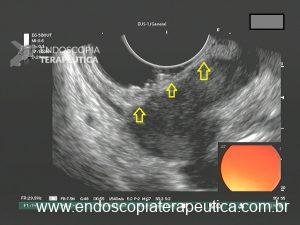
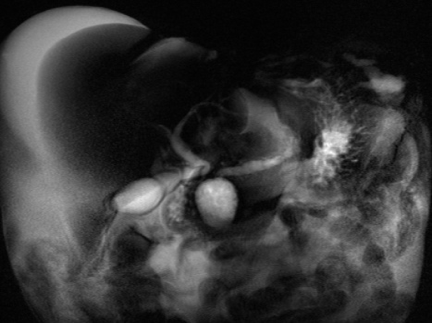
Figura 2: Ecoendoscopia demonstrando invasão maciça de imagem hipoecoica em submucosa de cólon
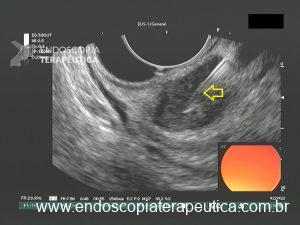
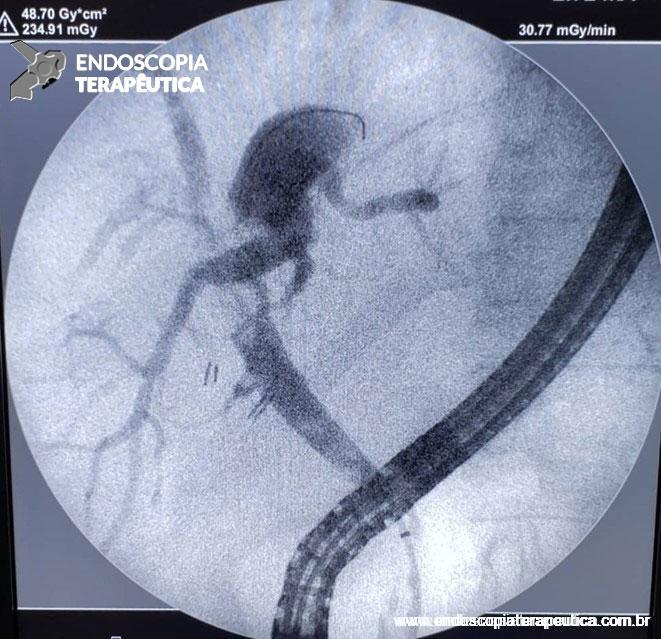
Figura 3: Punção ecoguiada de imagem hipoecoica
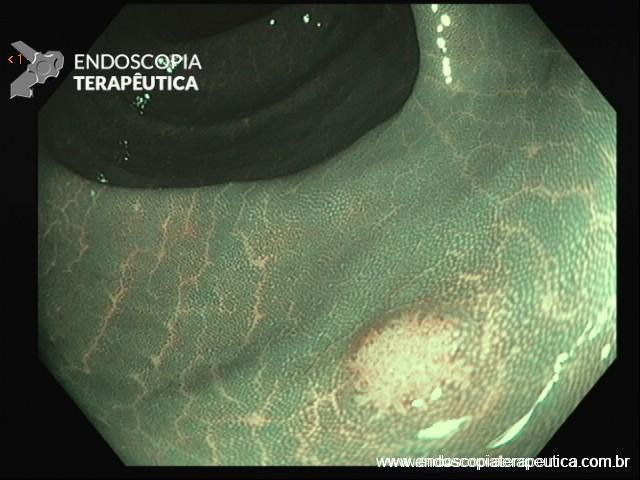
- Colonoscopia: fornece sinais específicos em apenas 4% dos casos de endometriose profunda, se demonstra como lesões subepiteliais e eventualmente com mucosa apresentando edema, enantema, friabilidade, irregularidade de superfície ou mesmos quadros de estenoses. Apesar baixa sensibilidade (7%) desse exame para o diagnóstico de endometriose, a colonoscopia possibilita investigação de outras doenças que podem levar a sintomas atribuídos a endometriose.
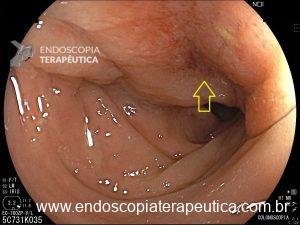
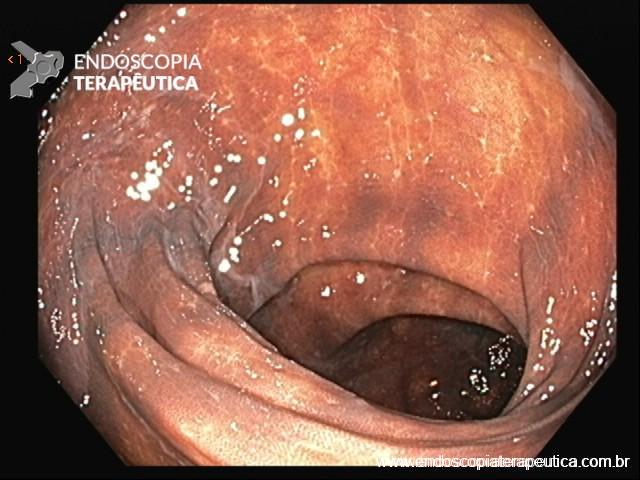
Figura 4: Endometriose profunda causando redução da luz em cólon sigmoide. Imagem cedida pela Dra Renata Nobre Moura.
- Ressonância: altamente eficiente e acurada, apresenta melhor resolução entre as estruturas e maior campo de visão. Esta técnica é cada vez mais utilizada nos casos em que o ultrassom apresenta dúvidas, na suspeita acometimento profundo da pelve ou quando há programação cirúrgica.
Tratamento
Como tratamento medicamentoso de primeira linha estão as combinações estroprogestogênicas, progestogênios isolados e análogos do hormônio liberador de gonadotrofina, sendo muito úteis também na prevenção de recorrência pós-operatória da doença. Em um estudo de pacientes utilizando o tratamento medicamentoso, foi observada uma diminuição de 53% dos sintomas gastrointestinais. Entretanto após 12 meses, 33% optaram pelo tratamento cirúrgico devido aos sintomas persistentes.
O exame padrão ouro no diagnóstico da endometriose é a laparoscopia, sendo também o método de escolha para o tratamento cirúrgico da endometriose pélvica sintomática. Dessa forma uma avaliação pré-operatória com os exames citados acima, é crucial para o manejo da doença, sendo que na presença de lesões intestinais ou no sistema urinário, um cirurgião especialista é altamente recomendado.
O tratamento cirúrgico é indicado nos pacientes que não respondem ao tratamento medicamentoso, e deve-se ser realizado preferencialmente de forma conservadora, com exceção dos casos estenose intestinal, uretral ou massas de características duvidosas, onde a remoção radical deve ser indicada.
Pontos chave Endometriose Intestinal
– 10 a 12% das mulheres (faixa etária 30 anos)
– patogênese: teoria da menstruação
– 5 a 12% acometimento intestinal
– 90% cólon e reto
– assintomática, inespecífico ou sintomas cíclicos
– exame físico: toque bimanual
– ultrassom transvaginal: exame inicial, limitação para cólon sigmoide
– ultrassom retal: confirmação de acometimento intestinal e diagnóstico diferencial de lesões subepiteliais
– ressonância: avaliação geral de endometriose profunda
– colonoscopia: lesões subepitelais e investigação sintomas paralelos
– tratamento medicamentoso: primeira escolha
– tratamento cirúrgico: laparoscopia, conservador quando possível
Referências
Nezhat C, Li A, Falik R, Copeland D, Razavi G, Shakib A, Mihailide C, Bamford H, DiFrancesco L, Tazuke S, Ghanouni P, Rivas H, Nezhat A, Nezhat C, Nezhat F. Bowel endometriosis: diagnosis and management. Am J Obstet Gynecol. 2018 Jun;218(6):549-562. doi: 10.1016/j.ajog.2017.09.023. Epub 2017 Oct 13. PMID: 29032051.
Habib N, Centini G, Lazzeri L, Amoruso N, El Khoury L, Zupi E, Afors K. Bowel Endometriosis: Current Perspectives on Diagnosis and Treatment. Int J Womens Health. 2020 Jan 29;12:35-47. doi: 10.2147/IJWH.S190326. PMID: 32099483; PMCID: PMC6996110.
Rossini LG, Ribeiro PA, Rodrigues FC, Filippi SS, Zago Rde R, Schneider NC, Okawa L, Klug WA. Transrectal ultrasound – Techniques and outcomes in the management of intestinal endometriosis. Endosc Ultrasound. 2012 Apr;1(1):23-35. doi: 10.7178/eus.01.005. PMID: 24949332; PMCID: PMC4062201.
Bourgioti C, Preza O, Panourgias E, Chatoupis K, Antoniou A, Nikolaidou ME, Moulopoulos LA. MR imaging of endometriosis: Spectrum of disease. Diagn Interv Imaging. 2017 Nov;98(11):751-767. doi: 10.1016/j.diii.2017.05.009. Epub 2017 Jun 23. PMID: 28652096.
Colaiacovo R, Carbonari A, Ganc R, de Paulo G, Ferrari A. Bowel endometriosis mimicking gastrointestinal stromal tumor and diagnosed by endoscopic ultrasound. Endoscopy. 2014;46 Suppl 1 UCTN:E433-4. doi: 10.1055/s-0034-1377429. Epub 2014 Oct 14. PMID: 25314180.
Nácul, Andrea Prestes e Spritzer, Poli MaraAspectos atuais do diagnóstico e tratamento da endometriose. Revista Brasileira de Ginecologia e Obstetrícia [online]. 2010, v. 32, n. 6 [Acessado 3 Abril 2022] , pp. 298-307. Disponível em: <https://doi.org/10.1590/S0100-72032010000600008>. Epub 28 Set 2010. ISSN 1806-9339. https://doi.org/10.1590/S0100-72032010000600008.
Milone, M., Mollo, A., Musella, M., Maietta, P., Sosa Fernandez, L. M., Shatalova, O., Conforti, A., Barone, G., De Placido, G., & Milone, F. (2015). Role of colonoscopy in the diagnostic work-up of bowel endometriosis. World journal of gastroenterology, 21(16), 4997–5001. https://doi.org/10.3748/wjg.v21.i16.4997
Você sabe o que é fiducial?
O câncer de pâncreas é a quarta principal neoplasia causadora de mortes nos Estados Unidos. Dos pacientes diagnosticados com essa condição, apenas 10% são candidatos à cirurgia, sendo que 30 a 40% são limítrofes entre ressecável e localmente avançado, e os outros 50 a 60% já apresentam doença metastática.
Dentre as opções terapêuticas para os pacientes não candidatos cirúrgicos, a radioterapia tem um papel importante, sendo a modalidade estereotáxica a preferida pois consegue entregar uma alta dose de radiação em uma área bem-definida, aumentando sua efetividade e diminuindo os efeitos colaterais.
Um dos maiores desafios da radioterapia nos tumores de pâncreas é que, durante o ciclo respiratório, estima-se uma movimentação do alvo entre 2 e 3 cm, dessa forma a implantação de um marcador radiológico, fiducial, forneceria um ponto de referência fixo.
A implantação do fiducial pode ser realizada por meio da ecoendoscopia, cirurgia ou mesmo percutânea. Entretanto, o acesso pancreático percutâneo pode ser desafiador pelo risco de injúria vascular e/ou a órgãos adjacentes, além da maior possibilidade de implantação neoplásica peritoneal, sendo o acesso cirúrgico mais invasivo. Assim, a implantação por meio da ecoendoscopia tem surgido como primeira opção nesses casos.
Tipos
Os fiducials mais comuns são os sólidos feitos de ouro ou platina, sendo que ainda há modelos menos comuns de polímeros de carbono e ensaios clínicos iniciais utilizando líquidos. A utilização de líquidos (hydrogel) teria o benefício de não produzir artefatos, baixo risco de migração e seu desaparecimento local após o período de tratamento. Com relação ao formato, eles podem ser retos (cilíndricos) ou em forma de bobina (coil), que, em teoria, apresentaram um risco menor de migração, apesar de um recente estudo feito por Kashab não ter demonstrado diferença.
Em uma pesquisa feita entre médicos, os modelos mais utilizados são os cilíndricos ou coil, feitos de ouro (maior disponibilidade de modelos), com diâmetros entre 0,35 e 0,43 mm e comprimento de 5 a 10 mm, apresentando uma melhor relação entre contraste e artefatos. Entretanto, os estudos comparando os diversos modelos são conflitantes, não havendo definição sobre o melhor material ou formato.

Figura 1: Fiducials tipo coil e reto de platina (LumiCoil®)
Técnica
Sua implantação é realizada por meio de agulhas de FNA, sendo que os fiducials com diâmetro ≥ 0.75 mm necessitam de uma agulha de 19G. Entretanto, devido à facilidade técnica, sempre que possível o ideal é a utilização de agulhas 22G.
Existem duas diferentes técnicas de carregamento do fiducial: pela ponta e pelo luer da agulha. Pelo luer, a agulha FNA é locada à lesão, na sequência o estilete é removido, seguido da introdução do fiducial no lúmen da agulha, o qual é empurrado com o estilete. Essa técnica pode ser desafiadora nos casos em que a agulha está angulada, além da possibilidade de entrarem bolhas de ar na agulha após a retirada do estilete, prejudicando a visualização adequada do procedimento. Na técnica pela ponta, a agulha é carregada com o estilete previamente à sua introdução. Inicialmente, o estilete é retraído 10 mm, seguido da colocação do fiducial em sua ponta. Existem ainda agulhas já pré-carregadas com fiducials, que não demonstraram superioridade em estudos clínicos.
No Brasil, atualmente, está disponível o modelo da LumiCoil® da Boston Scientific, feito de platina, nos tamanhos 5 mm no formato reto e 10 mm no formato coil, ambos compatíveis com agulha FNA 22G, sendo possível o carregamento pela ponta e pelo luer na reta e apenas pela ponta na coil.
Resultados
Com relação ao sucesso técnico do procedimento, as revisões demonstraram resultados entre 96 e 98%. A dificuldade técnica ocorre principalmente nos casos de lesões em cabeça pancreática ou processo uncinado, utilizando agulhas de 19G e carregamento pelo luer.
O risco de migração fica em entre 3 e 4% e pode ocorrer de forma imediata devido a dificuldades técnicas ou mesmo tardio por regressão do tumor após terapia neoadjuvante. Inflamação e sangramento consequentes ao trauma na introdução do fiducial também podem levar à migração.
Os eventos adversos costumam ser leves, em torno de 4%, sendo os mais comuns pequenos sangramentos, pancreatites e infecções leves. Com o intuito de evitar infecções mais importantes, a profilaxia antibiótica deve ser sempre realizada.
Conclusão
A técnica de introdução de fiducials por meio da ecoendoscopia tem papel importante na radioterapia estereotáxica, auxiliando na utilização da técnica, porém ainda são necessários estudos prospectivos e randomizados para definição de melhor técnica e material. Dessa forma, a discussão prévia entre ecoendoscopistas, oncologistas, cirurgiões e radioterapeutas deve ser sempre realizada.
Veja abaixo o vídeo sobre esse fiducial:
Resumo
- Fiducial: marcador radiopaco para radioterapia estereotáxica;
- Material: sólidos (ouro, platina e carbono) e líquidos (em testes clínicos);
- Formato: reto e coil;
- Agulhas FNA para implantação: 22G e 19G.
Como citar este artigo
Oliveira JF. Você sabe o que é fiducial?. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/voce-sabe-o-que-e-fiducial/
Quer saber mais sobre fiducials?
Acesse os links abaixo:
- https://www.bostonscientific.com/en-US/products/fiducial-markers/lumicoil-platinum-fiducial-markers.html
- Kerdsirichairat T, Shin EJ. Role of endoscopic ultrasonography guided fiducial marker placement in gastrointestinal cancer. Curr Opin Gastroenterol. 2020 Sep;36(5):402-408. doi: 10.1097/MOG.0000000000000662. PMID: 32740001.
- Yoo J, Kistler CA, Yan L, Dargan A, Siddiqui AA. Endoscopic ultrasound in pancreatic cancer: innovative applications beyond the basics. J Gastrointest Oncol. 2016 Dec;7(6):1019-1029. doi: 10.21037/jgo.2016.08.07. PMID: 28078128; PMCID: PMC5177581.
- Kim SH, Shin EJ. Endoscopic Ultrasound-Guided Fiducial Placement for Stereotactic Body Radiation Therapy in Pancreatic Malignancy. Clin Endosc. 2021 May;54(3):314-323. doi: 10.5946/ce.2021.102. Epub 2021 May 28. PMID: 34082487; PMCID: PMC8182253.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Endoscopia no colangiocarcinoma
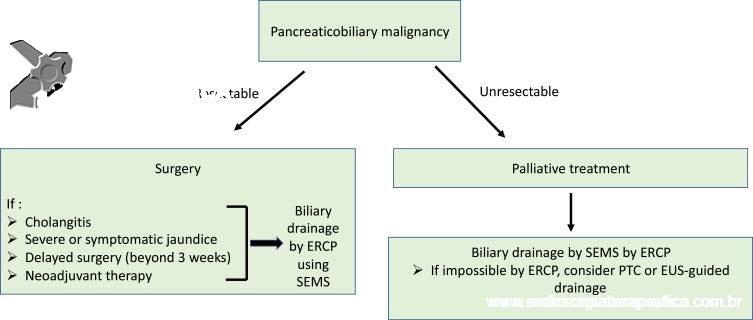
A obstrução biliar maligna é uma condição desafiadora, exigindo uma abordagem multimodal para diagnóstico e tratamento. O diagnóstico precoce é difícil de se estabelecer, pois a obstrução biliar costuma aparecer apenas em estágios avançados, consequentemente, na maioria dos pacientes (70%), os tumores são irressecáveis no momento do diagnóstico.
A maioria dos casos é esporádica, mas diferentes fatores que causam inflamação crônica da árvore biliar, como colangite esclerosante primária (CEP) e infecções crônicas, estão frequentemente implicados. Outras condições subjacentes são doença hepática policística, doença de Caroli e cistos de colédoco e contaminação por fascíola hepática.
Deve-se suspeitar com base em achados clínicos, como dor abdominal no quadrante superior direito e além de sintomas de obstrução biliar (síndrome ictérica). A ressonância magnética é o exame de escolha para avaliar a extensão da doença. Imagens ponderadas em T2, as quais exibem fluido com alto sinal de intensidade (branco), podem definir o nível de estenose biliar e identificar características malignas, como estenoses com mais de 1 cm de comprimento, margens irregulares e acotovelamentos.
A sobrevida média após ressecções R0 varia entre 1 e 4 anos, sendo as recorrências nesses casos de 50 a 70%. Além disso, a sobrevida nos tumores irressecáveis varia de 5 a 9 meses [1].
Abaixo, a classificação de Bismuth-Corlette, que divide esses tumores de acordo com sua localização:
Figura 1: classificação de Bismuth-Corlette
A endoscopia no colangiocarcinoma poderá ter três papéis de acordo com o estádio da doença:
- diagnóstico por imagem;
- obtenção de amostra tecidual;
- paliação.
Colangiopancreatografia endoscópica retrógrada (CPRE)
Principal exame do arsenal endoscópico com funções tanto diagnósticas como terapêuticas.
O escovado citológico apresenta sensibilidade de 26 a 72%, e a biópsia de 15 a 100%, sendo que a acurácia, quando utilizados em conjunto, chega a 75% [2].
Figura 2: CPRE em colangiocarcinoma hilar
Figura 3: escova citológica utilizada no caso anterior que confirmou diagnóstico
Ecoendoscopia (EUS)
Trabalhos recentes mostram que a EUS apresenta acurácia diagnóstica de 76%, semelhante à CPRE nas lesões biliares. Esta deve ser especialmente realizada nas lesões distais, principalmente nos casos de dúvida quanto a origem biliar ou pancreática e nas lesões acima de 4 cm. Quando associada à CPRE, apresenta acurácia de até 93% [2].
Outra importante função da EUS é o estadiamento linfonodal. Em um estudo realizado em pacientes com colangiocarcinoma e indicação de transplante hepático, a punção de linfonodos pela EUS evidenciou o acometimento em 17% desses pacientes, evitando assim uma cirurgia desnecessária, devendo dessa forma fazer parte do estadiamento pré-operatório [3].
Colangioscopia (SpyGlass®)
Endoscópio em “miniatura” utilizado através do canal de trabalho do duodenoscópio por um operador único, com acurácia diagnóstica de 94%, apresenta as seguintes funções [4]:
- avaliação visual de estenoses indeterminadas;
- amostra tecidual através da pinça de biópsia própria;
- direcionamento de fio guia para paliação.
Figura 4: sistema de colangioscopia SpyGlass®
Endomicroscopia confocal (Cellvizio®)
Consiste em uma sonda passada através do canal de trabalho do duodenoscópio até o local de estenose, realizando uma biópsia virtual e ao vivo, apresenta uma resolução até 1000x maior se comparado ao microscópio óptico padrão.
Após a injeção intravenosa de fluoresceína, esta se difunde através dos capilares e cora matriz extracelular do epitélio superficial. Os núcleos não absorvem o contraste e aparecem escuros, a diferença de contraste permite a análise arquitetônica da mucosa superficial, ajudando a diferenciar o tecido normal do neoplásico. Estudos demonstraram uma sensibilidade de 81 a 100% e especificidade de 61 a 88% [5].
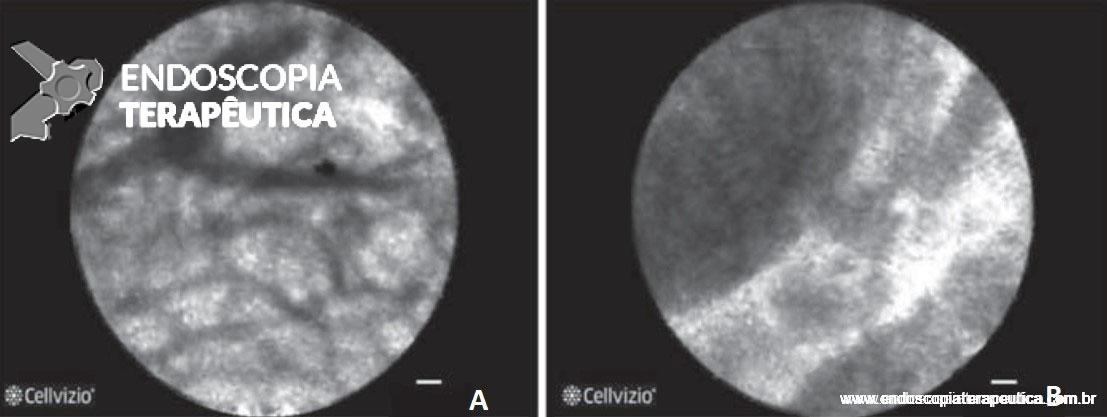 Figura 5. A: imagem de estenose biliar benigna; B: estenose biliar maligna demonstrado pelo espessamento e aglomerados escuros.
Figura 5. A: imagem de estenose biliar benigna; B: estenose biliar maligna demonstrado pelo espessamento e aglomerados escuros.
Drenagem biliar
Pré-operatória
Controversa, sendo que alguns estudos demonstraram maiores taxas de complicações pós-operatórias. Deve ser realizada nos seguintes casos [6]:
- cirurgia postergada > 2 semanas;
- quimioterapia neoadjuvante;
- colangite;
- icterícia sintomática (prurido).
Paliativa
Tem como objetivo a drenagem de, pelo menos, 50% do parênquima. Em geral, o lobo direito corresponde a quase 60% do volume, enquanto o lobo esquerdo e o lobo caudado correspondem a 30% e 10%, respectivamente [7].
Em comparação com a drenagem endoscópica através da CPRE, outras clássicas opções são:
- drenagem cirúrgica: igual sucesso e maior patência, porém maiores taxas de complicações e mortalidade;
- drenagem percutânea: mais eventos adversos, repetição de procedimentos, hospitalização prolongada, maior custo e desconforto do cateter externo, porém apresenta os melhores resultados no Bismuth IV e eventualmente no Bismuth III.
Stent metálico x plástico
Os metálicos apresentam menor disfunção e necessidade de reintervenções, sendo optados em pacientes com expectativa de vida acima de 4 meses. Apesar da preferência de muitos profissionais pelo descoberto, especialmente devido às estenoses hilares que correspondem a 60% dos casos, não há consenso na literatura. Os stents descobertos apresentam maiores taxas de obstrução, e os cobertos apresentam maiores taxas de migração.
Ablação por radiofrequência
Cateter introduzido através da CPRE, que produz energia térmica causando necrose tecidual tumoral, levando maior patência do stent e sobrevida [8].
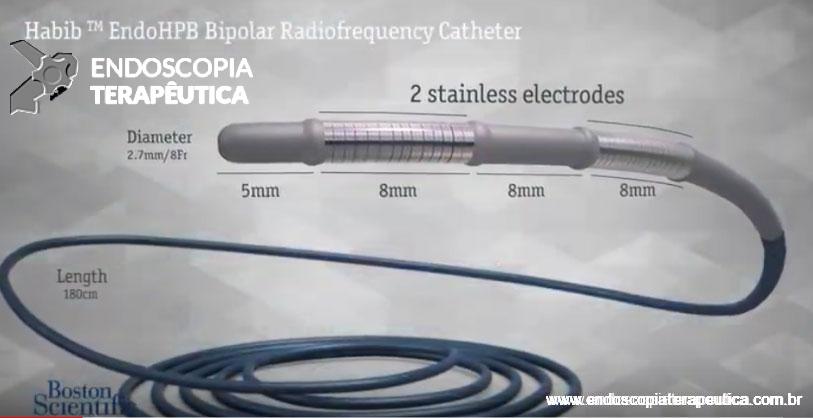
Figura 6: cateter de radiofrequência Habib®
Drenagem biliar ecoguiada
Alternativa normalmente reservada para casos de falha de CPRE. Entretanto, recentemente, ensaios clínicos randomizados comparando a drenagem ecoguiada e a CPRE demonstraram taxas similares de sucesso técnico, clínico, duração e eventos adversos, inclusive com menor taxa de disfunção de stent no grupo ecoguiado.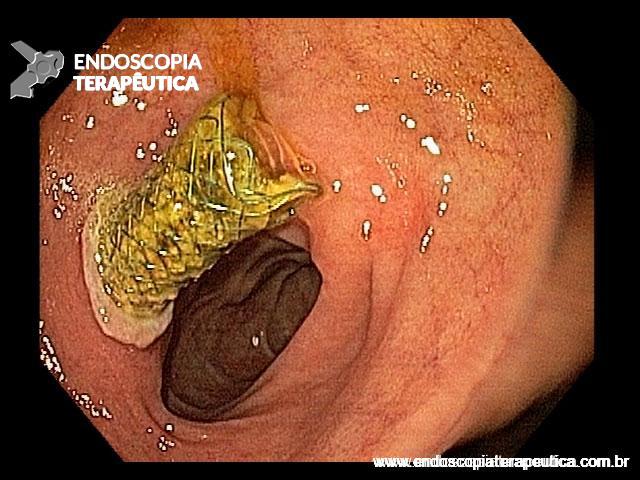
Figura 7: visão endoscópica tardia de drenagem coledocoduodenal
Número de stents
Tendo em vista o objetivo de drenagem de pelo menos 50% do parênquima, o número de stents é relativo, porém seguindo a regra abaixo deverá ser atingido esse objetivo:
- Bismuth I: 1 stent;
- Bismuth II, III e IV:≥ 2 stents.
Abaixo, um fluxograma da abordagem das obstruções biliares:
Quer saber mais sobre drenagem biliar ecoguiada? Acesse:
https://endoscopiaterapeutica.net/pt/assuntosgerais/drenagem-biliar-ecoguiada-breve-revisao/
Como citar este artigo
Fernandez J. Endoscopia no colangiocarcinoma. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/endoscopia-no-colangiocarcinoma
Referências
- Rerknimitr R, Angsuwatcharakon P, Ratanachu-ek T, et al. Asia-Pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma. J Gastroenterol Hepatol. 2013 Apr;28(4):593-607. doi: 10.1111/jgh.12128. PMID: 23350673.
- De Moura DTH, Moura EGH, Bernardo WM, et al. Endoscopic retrograde cholangiopancreatography versus endoscopic ultrasound for tissue diagnosis of malignant biliary stricture: Systematic review and meta-analysis. Endosc Ultrasound. 2018 Jan-Feb;7(1):10-19. doi: 10.4103/2303-9027.193597. PMID: 27824027; PMCID: PMC5838722.
- Jo JH, Cho CM, Jun JH, et al; Research Group for Endoscopic Ultrasonography in KSGE. Same-session endoscopic ultrasound-guided fine needle aspiration and endoscopic retrograde cholangiopancreatography-based tissue sampling in suspected malignant biliary obstruction: A multicenter experience. J Gastroenterol Hepatol. 2019 Apr;34(4):799-805. doi: 10.1111/jgh.14528. Epub 2018 Nov 21. PMID: 30378169.
- de Oliveira PVAG, de Moura DTH, Ribeiro IB, Bazarbashi AN, Franzini TAP, Dos Santos MEL, Bernardo WM, de Moura EGH. Efficacy of digital single-operator cholangioscopy in the visual interpretation of indeterminate biliary strictures: a systematic review and meta-analysis. Surg Endosc. 2020 Aug;34(8):3321-3329. doi: 10.1007/s00464-020-07583-8. Epub 2020 Apr 27. PMID: 32342216.
- Liu Y, Lu Y, Sun B, Zhang WM, Zhang ZZ, He YP, Yang XJ. Probe-based confocal laser endomicroscopy for the diagnosis of undetermined biliary stenoses: A meta-analysis. Clin Res Hepatol Gastroenterol. 2016 Dec;40(6):666-673. doi: 10.1016/j.clinre.2016.05.007. Epub 2016 Jun 24. PMID: 27350572.
- Dumonceau JM, Tringali A, Papanikolaou IS, et al. Endoscopic biliary stenting: indications, choice of stents, and results: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline – Updated October 2017. Endoscopy. 2018 Sep;50(9):910-930. doi: 10.1055/a-0659-9864. Epub 2018 Aug 7. PMID: 30086596.
- Fernandez Y Viesca M, Arvanitakis M. Early Diagnosis And Management Of Malignant Distal Biliary Obstruction: A Review On Current Recommendations And Guidelines. Clin Exp Gastroenterol. 2019 Nov 5;12:415-432. doi: 10.2147/CEG.S195714. PMID: 31807048; PMCID: PMC6842280.
- Sofi AA, Khan MA, Das A, et al. Radiofrequency ablation combined with biliary stent placement versus stent placement alone for malignant biliary strictures: a systematic review and meta-analysis. Gastrointest Endosc. 2018 Apr;87(4):944-951.e1. doi: 10.1016/j.gie.2017.10.029. Epub 2017 Nov 3. PMID: 29108980
- Logiudice FP, Bernardo WM, Galetti F, et al. Endoscopic ultrasound-guided vs endoscopic retrograde cholangiopancreatography biliary drainage for obstructed distal malignant biliary strictures: A systematic review and meta-analysis. World J Gastrointest Endosc. 2019 Apr 16;11(4):281-291. doi: 10.4253/wjge.v11.i4.281. PMID: 31040889; PMCID: PMC6475700.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Prótese metálica de aposição luminal (LAMS)
As próteses metálicas de aposição luminal, lumen-apposing metal stents (LAMS),
representam um avanço significativo devido ao seu desenho com flanges perpendiculares e capacidade de segurar duas
estruturas luminais em aposição.
São compostas de uma malha de nitinol trançada e totalmente recobertas por uma membrana
de silicone, prevenindo assim vazamentos, ingrowth (crescimento interno de tecido) e possibilitando sua remoção com certa facilidade.
Sua forma de haltere e amplo diâmetro interno oferecem uma melhor drenagem interna,
redução da taxa de oclusão, prevenção da migração, bem como passagem interna do endoscópio para procedimentos
terapêuticos adicionais [1].
Figura 1: prótese de aposição luminal Axios (Boston Scientific™
1ª Geração: requerem uma abordagem em múltiplas
etapas. As lesões são acessadas por punção com agulha 19-G, seguido da passagem de um fio guia de 0,025 ou 0,035
polegadas para manter a posição e subsequente dilatação (com cistótomo ou needle knife seguido de balão hidrostático)
do trato para passagem do dispositivo de introdução do LAMS. O introdutor LAMS é passado pelo aparelho, e o flange
distal é liberado sob controle ecoendoscópico. Uma vez que o flange distal está totalmente aberto, uma leve tensão é
aplicada para opor as 2 estruturas antes da liberação do flange proximal sob visualização endoscópica direta
[1].
2ª Geração (hot): possibilitam a realização em etapa
única usando eletrocauterização. A inserção hot é feita por meio da aplicação de corrente de corte de alta frequência pela ponta do
dispositivo, permitindo o acesso transmural sem dilatação prévia do trato. A inserção em uma única etapa minimiza
trocas de acessórios, reduzindo erros técnicos e tempo de procedimento [1].

Figura 2: sistema de liberação da LAMS
Axios (Boston Scientific™)
É a mais utilizada e bem estudada da literatura. Devido à facilidade de manejo,
atualmente, é mais optada a versão Hot Axios (2ª geração). Apresenta tamanhos de diâmetro de lúmen de 6, 8, 10, 15 e
20 mm.
O sistema de liberação é controlado por um único operador e é dividido em um controle de
introdução do cateter (inferior) e um controle de liberação do stent (superior). O mecanismo de liberação
do cateter também oferece uma parada rígida entre a implantação do flange distal e proximal, evitando liberação
inadvertida no lúmen do cisto.
Veja abaixo o vídeo do sistema de liberação:
Outros modelos de LAMS são: as sul-coreanas Spaxus (Taewoong Medical™), Nagi (Taewoong Medical™) e Hanarostent (M.I. Tech™), além da alemã Aixstent (Leufen
Medical™).
Indicações [2]
- Drenagem de coleções pancreáticas
(pseudocisto e walled-off necrosis); - Drenagem da via biliar:
coledocoduodenostomia; - Drenagem da vesícula biliar
(colecistite); - Gastrojejunostomia (obstruções
gastroduodenais); - Confecção de fístula gastrogástrica
(acesso à CPRE em paciente com by-pass); - Realização de enteroenteroanastomose
(tratamento da síndrome da alça aferente); - Estenoses benignas do trato
gastrointestinal (seu formato diminui a taxa de migração comparado com próteses tradicionais); - Drenagem de coleções cavitárias.
Drenagem de coleções pancreáticas
Representam um grupo heterogêneo de doenças, e a decisão de usar um LAMS em vez de
stents plásticos permanece uma
escolha caso a caso. Os stents
plásticos parecem ter eficácia equivalente para drenagem de pseudocisto simples e provavelmente são mais baratos
quando usados nesse cenário. Coleções heterogêneas e walled off
necrosis parecem mais adequados para o uso de LAMS, e resultados
clínicos superiores mostram essa direção [1]. Recente revisão sistemática e metanálise que incluiu 1534 pacientes
confirmou que o LAMS apresenta vantagens sobre os stents plásticos, com maior taxa de sucesso clínico e menor taxa de infecção e oclusão [3].
Outro benefício dos LAMS nas coleções complicadas é a possibilidade de acesso endoscópico direto para realização de
sessões de necrosectomias (LAMS de 15 e 20 mm). Os LAMS não podem ficar locados definitivamente, se após 3 ou 4
semanas a coleção já tiver sido resolvida, eles devem ser retirados e, apenas nos casos de ruptura de ducto
pancreático não resolvida, colocados stents plásticos duplos pigtail.
Vídeo 1: uso de LAMS seguido de passagem de prótese duplo pigtail na drenagem de
pseudocisto. Cortesia do Dr. Gustavo Luís Rodela Silva, GLR.
Drenagem biliar
São utilizados os stents de 6 e 8 mm. As indicações mais comuns para esse procedimento
são a falha na canulação papilar por neoplasia maligna avançada ou falta de acesso à papila devido à anatomia
alterada cirurgicamente. Em revisão sistemática e metanálise publicada em 2020, demonstrou segurança e efetividade
do uso de LAMS nos casos de falha na CPRE [4], entretanto, outra recente
revisão, apesar da facilidade técnica do uso das LAMS, demonstrou resultados semelhantes comparado à drenagem
ecoguiada com próteses metálicas biliares tradicionais [6].
Colecistite
Em pacientes sem condições cirúrgicas, a drenagem ecoendoscópica demonstrou sucesso
técnico e clínico comparável com a drenagem percutânea, além de menor tempo de internação, dor e necessidade de
reintervenções [6].
Gastrojejunostomia
Esse procedimento é uma alternativa nos casos de obstrução gastroduodenal, especialmente
tumoral, perante a passagem de prótese metálica ou mesmo a gastrojejunostomia cirúrgica. A técnica consiste em uma
punção através da parede gástrica de uma alça jejunal distendida por líquido infundido previamente, ou mesmo por um
balão preenchido, permitindo a identificação da alça. O procedimento ecoendoscópico tem o potencial de oferecer
permeabilidade luminal de longa duração, evitando o ingrowth que ocorre nas próteses duodenais
e tem menor morbidade comparado a um procedimento cirúrgico. Foi demonstrando um sucesso técnico de até 90% [7] e
taxa de reintervenção de 6,1%, comparado aos 30,3% nos stents
duodenais [8].
Confecção de fístula gastrogástrica
Nos pacientes com doenças pancreatobiliares com necessidade de CPRE, porém com anatomia
cirúrgica alterada (gastroplastia redutora em Y de Roux), é possível a realização de fístula com estômago excluso,
seguida de espera de 2 a 3 semanas para maturação local e posterior passagem do duodenoscópio para acesso à papila.
Apesar de rebuscada, pode ser uma opção à enteroscopia ou mesmo à realização de gastrostomia cirúrgica para passagem
do duodenoscópio.
Confecção de enteroenteroanastomose
Na síndrome da alça aferente ocorre uma obstrução na alça biliopancreática, levando a
dor, vômitos biliosos e distensão da alça. Apesar do tratamento ser tradicionalmente cirúrgico, uma opção de menor
morbidade é a colocação de LAMS drenando o segmento obstruído, criando um pertuito para drenagem local.
Estenoses benignas do trato gastrointestinal
Em algumas estenoses complexas, ou mesmo nos casos em que ocorreu migração prévia de
prótese metálica tradicional, o uso do LAMS pode ser uma opção de resgate no tratamento dessas condições. Outra
indicação é para casos de estenoses em reto distal, em que próteses longas causam tenesmo.
Drenagem de coleções cavitárias
O uso de LAMS para drenagem de abscessos surgiu como uma alternativa à técnica
percutânea, devido inclusive a algumas limitações, como interposição de órgãos e desconforto do paciente com a
drenagem externa. A drenagem ecoguiada não tem essas limitações, e os abscessos costumam estar próximos ao trato
gastrointestinal [9].
Outra possível aplicação futura pode ser no tratamento da obesidade. Após a sutura
endoscópica do piloro, uma fístula gastrojejunal pode ser criada usando LAMS, semelhante a uma gastroplastia em Y de
Roux [9].
Eventos adversos [9]
Sangramento intraprocedimento
O sangramento da mucosa pode ser interrompido pela aplicação local de corrente pelo
eletrocautério. Quando a hemorragia intralesional é observada, um fio guia pode ser avançado através do lúmen do
sistema introdutor do LAMS e trocado por uma agulha FNA 19-G. A ponta da agulha FNA é então posicionada no local do
sangramento, e a epinefrina pode ser administrada até que o sangramento cesse. Se o sangramento for persistente, a
radiointervenção pode ser necessária.
Sangramento tardio
São geralmente secundários à coagulopatia, entretanto podem ocorrer devido à trauma do
LAMS em vasos adjacentes, especialmente após drenagens pancreáticas. Dessa forma, após a resolução da coleção, devem
ser retirados para prevenir esse tipo de complicação.
Adesão à parede (burried)
Após longos períodos, o LAMS pode ficar aderido à parede gástrica, com dificuldade de
sua retirada. Nesses casos, deve ser realizada uma dilatação do lúmen para 15 mm, seguido de tração com pinça de
corpo estranho.
Obstrução biliar
Nas drenagens no duodeno proximal, uma vez que a
coleção foi resolvida, o flange distal do LAMS pode comprimir a via biliar causando icterícia. A remoção do LAMS e a
colocação de um stent plástico resolverão a complicação.
As LAMS representam um grande avanço técnico na
endoscopia terapêutica
transluminal, possibilitando o acesso de estruturas adjacentes, levando a uma gama de intervenções e diminuindo a
necessidade de acesso cirúrgico e/ou percutâneo. Sua pesquisa e desenvolvimento deverão aprimorar sua segurança, bem
como expansão de sua aplicação para outras indicações.
Veja também alguns casos com a utilização dos LAMS:
- Drenagem ecoguiada de formação pseudocística pancreática;
- Tratamento endoscópico da síndrome da alça aferente com LAMS;
- Gastroenterostomia guiada por EUS.
Quer saber mais sobre a prótese Hot Axios? Links com vídeos passo a passo da
utilização:
Dê uma conferida no site da empresa: https://www.bostonscientific.com/pt-BR/produtos/stents-gastrointestinais/axios-stent-e-sistema-de-entrega-aprimorado-de-eletrocautery.html
Agradecimentos
Agradeço ao Dr. Gustavo Luís Rodela Silva pela cessão do vídeo sobre LAMS.
Como citar este artigo
Oliveira JF. Prótese Metálica de Aposição Luminal (LAMS). Endoscopia Terapêutica; 2021.
Disponível em:
Referências
- Stier MW, Waxman I. Lumen-Apposing Metal Stents: Which One
and Why? Gastrointest Endosc Clin N Am. 2018 Apr;28(2):207-217. doi: 10.1016/j.giec.2017.11.008. Epub 2018
Feb 3. PMID: 29519333. - Saumoy M, Yarber C, Kahaleh M. Novel Uses of Lumen-Apposing
Metal Stents. Gastrointest Endosc Clin N Am. 2018 Apr;28(2):197-205. doi: 10.1016/j.giec.2017.11.007. PMID:
29519332. - Tan S, Zhong C, Ren Y, et al. Are Lumen-Apposing Metal
Stents More Effective Than Plastic Stents for the Management of Pancreatic Fluid Collections: An Updated
Systematic Review and Meta-analysis. Gastroenterol Res Pract. 2020 Apr 20;2020:4952721. doi:
10.1155/2020/4952721. PMID: 32382266; PMCID: PMC7189322. - Krishnamoorthi R, Dasari CS, Thoguluva Chandrasekar V, et
al. Effectiveness and safety of EUS-guided choledochoduodenostomy using lumen-apposing metal stents (LAMS):
a systematic review and meta-analysis. Surg Endosc. 2020 Jul;34(7):2866-2877. doi:
10.1007/s00464-020-07484-w. Epub 2020 Mar 5. PMID: 32140862. - Amato A, Sinagra E, Celsa C, et al. Efficacy of
lumen-apposing metal stents or self-expandable metal stents for endoscopic ultrasound-guided
choledochoduodenostomy: a systematic review and meta-analysis. Endoscopy. 2020 Nov 27. doi:
10.1055/a-1324-7919. Epub ahead of print. PMID: 33246343. - Irani S, Ngamruengphong S, Teoh A, et al. Similar Efficacies
of Endoscopic Ultrasound Gallbladder Drainage With a Lumen-Apposing Metal Stent Versus Percutaneous
Transhepatic Gallbladder Drainage for Acute Cholecystitis. Clin Gastroenterol Hepatol. 2017
May;15(5):738-745. doi: 10.1016/j.cgh.2016.12.021. Epub 2016 Dec 30. PMID: 28043931. - Itoi T, Baron TH, Khashab MA, Tsuchiya T, Irani S, Dhir V,
Bun Teoh AY. Technical review of endoscopic ultrasonography-guided gastroenterostomy in 2017. Dig Endosc.
2017 May;29(4):495-502. doi: 10.1111/den.12794. Epub 2017 Jan 27. PMID: 28032663. - Ge PS, Young JY, Dong W, Thompson CC. EUS-guided
gastroenterostomy versus enteral stent placement for palliation of malignant gastric outlet obstruction.
Surg Endosc. 2019 Oct;33(10):3404-3411. doi: 10.1007/s00464-018-06636-3. Epub 2019 Feb 6. PMID: 30725254;
PMCID: PMC6684873. - Bang JY, Varadarajulu S. Lumen-apposing metal stents for
endoscopic ultrasonography-guided interventions. Dig Endosc. 2019 Nov;31(6):619-626. doi: 10.1111/den.13428.
Epub 2019 Jun 5. PMID: 31050068.
Saiba mais: Pangastrite enantematosa leve
Acesse o Endoscopia Terapêutica para tomar contato
com mais artigos comentados, assuntos
gerais, casos
clínicos, quizzes, classificações e mais!
Melanose cólica – Melanosis coli
Melanose cólica (Melanosis coli ou Lipofuscinose) consiste na presença de pigmento marrom em macrófagos na mucosa do intestino grosso [1],[2]. A condição, descrita pela primeira vez por Cruveilhier em 1829 [3] e chamada de Melanosis coli por Virchow em 1857 [4], foi inicialmente pensada como sendo devido à presença de melanina. No entanto, estudos mostraram a presença de grânulos de lipofuscina ao invés de melanina em macrófagos do cólon [2],[5]. Desse modo, muitos sugerem o uso dos termos “pseudomelanosis coli” ou “lipofuscinose” do cólon para descrição dessa alteração.
Existe uma forte associação entre Melanosis coli e o uso excessivo de laxantes, em particular derivados de antraquinona [6], embora também possa ser visto em pacientes com doença inflamatória intestinal [5], diarreia crônica [7] ou com o uso de anti-inflamatórios não esteroidais [8]. É causada pela apoptose de células epiteliais do cólon induzida pela antraquinona, seguida de fagocitose dos restos celulares por macrófagos [9].
A Melanosis coli é mais frequentemente detectada durante a investigação da constipação de longa data e associação com uso crônico de catárticos de antraquinona (incluindo cáscara sagrada, senna, aloe vera e ruibarbo). Essa pigmentação ocorre, em geral, de forma mais pronunciada em cólon direito e raramente acomete o íleo, no entanto sua localização e intensidade podem ser variáveis [6]. Vide figuras 1 e 2.
Clique nas imagens para ampliá-las!
Figura 1: Melanosis coli em ceco
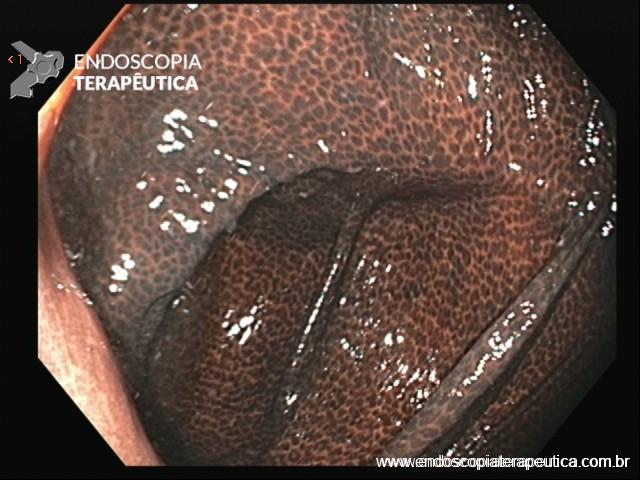
Figura 2: Melanosis coli em sigmoide
A presença de Melanosis coli tem associação com um aumento significativo na detecção de adenomas, em especial ≤ 5 mm e isolados. Isso se deve à maior facilidade de visualização dos adenomas mais claros em um fundo pigmentado (vide figuras 3, 4 e 5) [10]. Os adenomas raramente são pigmentados, embora haja relatos de melanosis neles [11].
Figura 3: adenoma em paciente com Melanosis coli
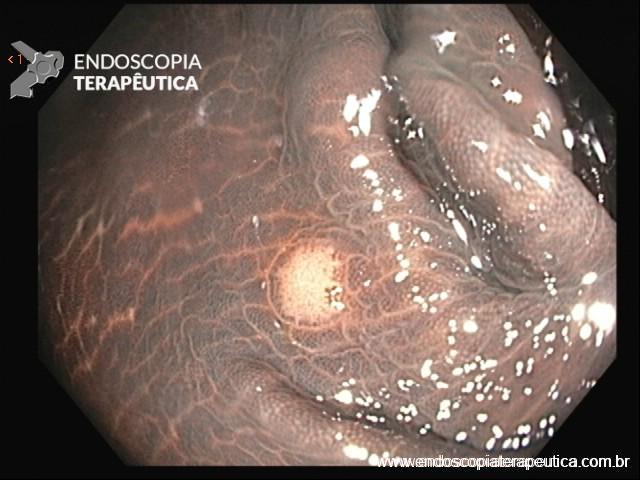
Figura 4: aspecto com cromoscopia óptica (NBI)
Figura 5: fotomicrografia de polipectomia. Área central (não pigmentada) correspondente a adenoma.
Como mostrado nas figuras 6 e 7, uma biópsia submetida à coloração de hematoxilina eosina mostra macrófagos em lâmina própria preenchidos com grânulos de pigmento de cor marrom.
Figura 6: fotomicrografia mostrando macrófagos com grânulos de pigmento na lâmina própria
Figura 7: fotomicrografia mostrando macrófagos com grânulos de pigmento (maior aumento)
A pigmentação pode ocorrer após o curto prazo de uso do laxativo, sendo encontrados relatos após 6 meses de uso. Além disso, esta é uma condição reversível, podendo regredir após 1 ano de interrupção [12].
Apesar da ausência de relação definida entre Melanosis coli e neoplasia [10], [11], esta pode não ser uma condição inofensiva, visto que demonstra um sinal de agressão crônica da mucosa, necessitando de mais estudos para uma conclusão definitiva.
Agradecimentos à patologista Dra. Rafaela Pinheiro pelo fornecimento das figuras das lâminas.
Como citar este artigo:
Oliveira JF. Melanose cólica – Melanosis coli. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/melanosis-coli/
Referências:
- Steer HW, Colin-Jones DG. Melanosis coli: studies of the toxic effects of irritant purgatives. J Pathol. 1975; 115(4):199±205. https://doi.org/10.1002/path.1711150403 PMID: 1159566.
- Ghadially FN, Parry EW. An electron-microscope and histochemical study of melanosis coli. J Pathol Bacteriol. 1966; 92(2):313±7. https://doi.org/10.1002/path.1700920207 PMID: 5964370.
- Cruveilhier J. Anatomie pathologique du corps humain, ou Descriptions, avec figures lithographie 301es et colorie301es, des diverses alte301rations morbides dont le corps humain est susceptible: Paris, 1829±1835; 1835.
- Virchow R. Die pathologischen Pigmente. Arch. Pathol. Ant, 1847; 1(2): 379±404. https://doi.org/10. 1007/BF01975874
- Byers RJ, Marsh P, Parkinson D, et al. Melanosis coli is associated with an increase in colonic epithelial apoptosis and not with laxative use. Histopathology. 1997;30:160–164.
- 6. Freeman HJ. “Melanosis” in the small and large intestine. World J Gastroenterol. 2008;14:4296–4299.
- 7. Marshall JB, Singh R, Diaz-Arias AA. Chronic, unexplained diarrhea: are biopsies necessary if colonoscopy is normal? Am J Gastroenterol. 1995; 90(3):372±6. PMID: 7872272.
- 8. Lee FD. Importance of apoptosis in the histopathology of drug related lesions in the large intestine. J Clin Pathol. 1993; 46(2):118±22. PMID: 8459031.
- 9. Walker NI, Smith MM, Smithers BM. Ultrastructure of human melanosis coli with reference to its pathogenesis. Pathology. 1993;25:120–123.
- 10. Blackett JW, Rosenberg R, Mahadev S, Green PHR, Lebwohl B. Adenoma Detection is Increased in the Setting of Melanosis Coli. J Clin Gastroenterol. 2018 Apr;52(4):313-318. doi: 10.1097/MCG.0000000000000756. PubMed PMID: 27820223.
- 11. Coyne JD. Melanosis coli in hyperplastic polyps and adenomas. Int J Surg Pathol. 2013;21:261–263.
- 12. Liu ZH, Foo DCC, Law WL, Chan FSY, Fan JKM, Peng JS. Melanosis coli: Harmless pigmentation? A case-control retrospective study of 657 cases. PLoS One. 2017 Oct 31;12(10):e0186668. doi: 10.1371/journal.pone.0186668. eCollection 2017. PubMed PMID: 29088250; PubMed Central PMCID: PMC5663380.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Usos do Plasma de Argônio em endoscopia
CONCEITO
A coagulação por plasma de argônio (APC) é um procedimento eletrocirúrgico que combina uma corrente monopolar com o gás argônio para obter a coagulação. O gás é ionizado por meio de uma faísca de alta voltagem liberada na extremidade do cateter, aplicando, desse modo, o plasma de energia no tecido adjacente.
Após o efeito térmico, a superfície do tecido perde sua condutividade elétrica, e o feixe de plasma muda sua direção para um tecido condutor adjacente (não coagulado). Isso resulta em uma profundidade limitada de trauma local.
Quando a distância não é suficiente, não há transmissão elétrica pelo gás, pois a resistência ao fluxo de corrente elétrica é muito alta, e a ativação do pedal resulta apenas no fluxo de gás argônio inerte. Em geral, a distância ideal entre a sonda e o tecido varia de 2 a 8 mm.
As vantagens do APC na hemostasia são:
- Hemostasia sem contato;
- Coagulação superficial homogênea para desvitalização;
- Baixo risco de perfuração;
- Carbonização e fumaça mínima.
INSTRUMENTOS
O sistema para APC consiste em um gerador eletrocirúrgico, um pedal de ativação, um medidor de fluxo de gás de argônio preso ao cilindro de gás, sondas de distribuição flexíveis (cateter) e uma placa de aterramento.
Figura 1. Estação de trabalho VIO 300 D – ERBE (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Os cateteres de APC são instrumentos flexíveis, capazes de fornecer, simultaneamente, o gás argônio e a corrente elétrica com a ativação de um único pedal. Essas sondas diferem de acordo com o seu diâmetro, comprimento e desenho da ponta.
Figura 2. Direção do fluxo de gás argônio (setas) depende da posição do desenho da ponta da sonda (A); efeitos das diferentes sondas (B) (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
MODOS DO APC
Forced APC: energia elevada no tecido alvo, resultando em coagulação profunda e desvitalização efetiva. Apresenta uma potência fixa, forte efeito hemostático e aplicação contínua de energia.
Aplicações para a coagulação por plasma de argônio:
- Sangramentos tumorais;
- Ablação tumoral;
- Recanalização de stents (in-growth e over-growth);
- Redução de stents metálicos;
- Sangramento agudo não varicoso;
- Sangramento pós-dissecção endoscópica submucosa (ESD).
Video 1. APC modo Forced (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Pulsed APC: esse modo é baseado em ativação pulsada. Utilizado no tratamento de lesões superficiais grandes, situadas, principalmente, em estruturas de paredes finas e termossensíveis. Devido à saída de energia intermitente, o risco de perfuração é reduzido em comparação com aquele que utiliza um feixe de APC contínuo.
Utiliza duas frequências diferentes:
Efeito 1: 1 pulso/seg. Alta energia de saída por pulso.
Efeito 2: 16 pulsos/seg. Baixa energia de saída por pulso.
Aplicações:
- Sangramento crônico – ectasia vascular de antro gástrico (GAVE), retite actínica, angiodisplasias;
- Sangramento difuso do cólon e reto;
- Desvitalização tecidual (adenoma remanescente e esôfago de Barret);
- Divertículo de Zenker.
Video 2. APC modo Pulsed (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Precise APC: efeito de coagulação superficial por meio de uma saída de baixa energia por unidade de tempo, adequado em tecidos delicados. Possui controle de ajuste automático do plasma de argônio, ou seja, o efeito tissular é independente da distância (em até 5 mm).
Aplicações:
- Hemostasia em sangramentos superficiais;
- Áreas termossensíveis e/ou estruturas de paredes finas (duodeno, intestino delgado e ceco);
- Em situações em que é difícil manter uma distância contínua do cateter para tecido (intervenção enteroscópica com intenso peristaltismo).
Video 3. APC modo Precise (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Na Figura 3, demonstramos os diferentes efeitos tissulares e, na Figura 4, a sensibilidade térmica nos diferentes tecidos.
Figura 3. Efeitos dos diferentes modos de APC (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)

Figura 4. Sensibilidade térmica nos diferentes tecidos

EVENTOS ADVERSOS
- Dor: devido à falta de inervação na maior parte do trato gastrointestinal (TGI), a dor não é comum após o uso do APC. No entanto, na parte distal do canal anal (ao nível da linha pectínea), os pacientes podem apresentar estímulo álgico que, em geral, cessa rapidamente com analgésicos e/ou anti-inflamatórios. Outros efeitos indiretos de dor durante o procedimento podem ser causados por distensão excessiva devido ao gás ou após a aplicação de APC no esôfago (dor retroesternal ou odinofagia).
- Enfisema gasoso: é uma coleção reversível de gás em área do tecido-alvo e/ou no tecido próximo, em geral sem importância clínica.
- Explosão/combustão: ao aplicar APC e outras fontes de energia no TGI, devido à presença de gases inflamáveis potencialmente presentes no intestino, pode resultar em uma explosão.
- Perfuração: apesar de seu efeito superficial, a perfuração pode ocorrer ao usar APC. As seguintes medidas preventivas são, portanto, recomendadas: aplicações curtas (1-2 seg.), levar em conta a indicação e localização da lesão e a distância entre a sonda e o tecido deve ser de 2 a 8 mm.
RECOMENDAÇÕES DE AJUSTES
- GAVE: Pulsed APC, efeito 2, 20-50 Watt
- ANGIODISPLASIA DE CÓLON: Pulsed APC, efeito 2, 10-30 Watt ou Precise APC
- RETITE ACTÍNICA: Pulsed APC, efeito 2, 10-30 Watt
- Fluxo 0,8 – 1,0 L/min
Como citar esse artigo:
Fernandez J. Usos do Plasma de Argônio em endoscopia. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/plasma-de-argonio/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Dicas em colonoscopia: intubação cecal.
A intubação cecal ou mesmo do íleo-terminal é um importante critério de qualidade em colonoscopia. Ela pode ser extremante frustrante no início da curva de aprendizado do residente, sendo que mesmo profissionais experientes podem encontrar casos desafiadores. O objetivo deste artigo é solidificar conhecimentos da prática diária para que possamos atingir esse objetivo inicial.
Anatomia da dor
O cólon é fixado pelo mesentério à parede abdominal posterior. É o alongamento do mesentério, e não a distensão, o principal responsável pelo desconforto abdominal durante a colonoscopia. Sempre que o instrumento é avançado, o mesentério retossigmoide é esticado o que leva ao quadro álgico sendo que nas pessoas mais jovens, especialmente nas mulheres onde o cólon tende a envolver o útero, a dor pode ser bastante intensa.
A única maneira de aliviar o desconforto é puxar o instrumento e relaxar a tensão. Em pacientes idosos ou obesos, o mesentério é mais complacente e se estende mais facilmente, geralmente sem dor.
Posição do paciente
Tradicionalmente o exame é iniciado com o paciente em decúbito lateral esquerdo. Uma mudança na posição do paciente pode, em alguns casos, ajudar o colonoscópio a avançar, particularmente eu uso esse recurso apenas após falha nas manobras de compressão abdominal. Entretanto muitos endoscopistas usam a mudança de posição de maneira sistemática para melhorar a configuração do cólon, especialmente o cólon sigmoide e descendente, onde a posição em decúbito dorsal ou lateral direita, frequentemente abre angulações agudas e ajuda no avanço do colonoscópio.
Gás X água
Sempre que possível, o dióxido de carbono deve ser usado para insuflar o intestino, e não o ar, o qual é eliminado mais lentamente podendo contribuir para o desconforto pós-procedimento. O cólon é como um balão cujo comprimento e diâmetro diminuem com a remoção do gás. Ao avançar o instrumento, assim que uma visão luminal for obtida, o gás deve ser aspirado para diminuir a tensão e tornar o eixo do instrumento mais estável. Por sua vez, isso minimiza o comprimento do cólon, reduzindo o potencial de formação de angulações a montante.
Outra opção é o preenchimento do cólon com água e não com gás. Não há regra sobre o volume de água, devendo ser pelo menos o suficiente para ver a direção luminal. Se o preparo estiver abaixo do ideal, faça a trocas de água conforme necessário. Quando forem encontradas bolsas de gás aspire-as. O enchimento de água mantém o cólon curto o que pode ajudar muito em alguns casos.
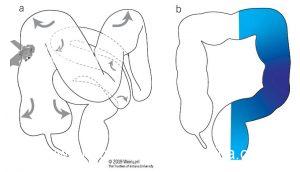
Figura 1. Esquema do impacto do enchimento de água e gás durante a inserção no cólon (a) Insuflação de gás na posição em decúbito lateral esquerdo. O gás (setas) distende e alonga o cólon, movendo o sigmoide medialmente abdome e o cólon transverso em direção à pelve. (b) O enchimento de água na posição em decúbito lateral esquerdo faz com que o sigmoide se deite no abdômen esquerdo, e o cólon permaneca mais curto e mais estreito em comparação com a insuflação de gás.
Compressão abdominal
Seu objetivo é diminuir a formação de alças direcionando o aparelho, sendo que raramente precisa ser aplicada por mais de 30 a 60 segundos. O conceito baseia-se que quando uma alça é sentida deve-se retificar o aparelho, pressionar nessa localização e após isso progredir o instrumento.
Tendo em vista que a maioria das alças são feitas no cólon sigmoide podemos iniciar realizando uma compressão sobre a área suprapúbica quando a ponta do colonoscópio retificada está entre 20 e 30 cm da borda anal ou uma compressão do quadrante inferior esquerdo, à medida que o instrumento está progredindo em direção à flexão esplênica ou cólon transverso.
Um erro comum é o técnico simplesmente empurrar o abdômen diretamente em uma direção posterior, mas pode-se obter um maior sucesso empurrando do flanco em direção à linha média ou empurrando o abdome inferior em uma direção superior. Outro ponto é que em pacientes obesos, quatro mãos podem ser úteis na compressão. Na figura 2 temos um esquema dos locais de compressão de acordo com a formação de alças.
Figura 2. Locais e direções padrões da compressão abdominal: A. para alça em sigmoide. B. para passar a flexão esplênica. C. para alça em transverso. D. para passar do ascendente ao ceco.
Casos específicos
Cólon redundante
– Devido ao fato desse paciente tradicionalmente apresentar o cólon dilatado, pode muitas vezes ter histórico de preparo inadequado ou mesmo constipação crônica. Devemos nos certificar se esse paciente não necessita de um preparo diferenciado;
– Evite usar colonoscópios pediátricos pois esses têm uma maior tendências a formação de alças;
– Utilização de água ou invés de ar;
– Manobras de compressão abdominal;
– Mudança de decúbito;
– Overtube pode ser utilizado em casos extremos.
Angulação em sigmoide
– Principal causa é a doença diverticular;
– Utilização de aparelhos de menor diâmetro (colonoscópios pediátricos, enteroscópios ou mesmo gastroscópios);
– Utilização de água para evitar aumento de angulações e barotrauma.
Hérnias
– A hérnia inguinal esquerda é resolvida reduzindo a hérnia manualmente antes do procedimento e mantendo-se a mão sobre a abertura. Depois que a ponta do instrumento passa pelo cólon sigmoide, o problema está resolvido;
– Nos casos de hérnias em topografia de cólon transverso o paciente deve ser colocado em decúbito dorsal sendo que a hérnia deve ser reduzida com pressão manual e preferencialmente realizar a distensão do cólon com água ao invés de gás. Se encontrada uma resistência fixa não progredir o aparelho devido ao risco de iatrogenia.
Conclusão
Devemos ter em mente que o paciente merece o melhor tratamento possível, assim dedicando nossa total atenção tendo consciência dos nossos limites. Não podemos deixar de ter humildade para encaminhar o paciente a um colega mais experiente quando necessário.
Outro ponto importante é descrever as manobras utilizadas nos laudos, a fim de se contribuir com futuros exames nos casos desafiadores.
Referências
Waye JD, Thomas-Gibson S. How I do colonoscopy. Gastrointest Endosc. 2018;87(3):621‐624. doi:10.1016/j.gie.2017.09.002
Rex DK. How I Approach Colonoscopy in Anatomically Difficult Colons. Am J Gastroenterol. 2020;115(2):151‐154. doi:10.14309/ajg.0000000000000481
QUIZ ! Endoscopia e COVID 19 !
Estenoses benignas do cólon
Introdução
Estenoses cólicas benignas não são tão raras em nossa prática clínica. A maioria dos casos é devido a anastomose colorretal, mas também pode ser secundária a doença de Crohn, doença diverticular, ou mesmo após ressecções endoscópicas extensas.
Etiologia
Anastomose colorretal: principal causa de estenose benigna, podendo ocorrer em 3,6% a 22% dos casos1 . Os fatores de risco mais comuns são obesidade, anastomoses baixas, diverticulite, infecção pélvica, radioterapia pós-operatória, anastomose mecânica, inadequada mobilização da flexura esplênica e fístulas locais. 2; 3; 4.
Doença de Crohn: estenoses sintomáticas ocorrem em cerca de um terço dos paciente após 10 anos de doença ativa5, sendo que nos pacientes pós-operatórios o local mais comum é na anastomose íleo-cólica6. Apesar de a cirurgia ter sido o tratamento padrão, a dilatação balonada pode evitar o tratamento cirúrgico em 1, 3 e 5 anos em cerca de 80%, 57% e 52% dos pacientes respectivamente7.
Doença Diverticular: secundária a repetidos episódios de inflamação, sendo o local mais comum o colon sigmoide. Importante lembrar que a presença de estenose não transponível ao colonoscópio, por si só, não é uma indicação cirúrgica absoluta.8.
Ressecção endoscópica extensa: evidências demonstram que dissecções endoscópicas submucosas (ESD) acometendo mais de 90% da circunferência do reto são um importante fator de risco de estenose local. Essa complicação pode ocorrer em 11,1% nas ressecções ≥90% e <100% , e em 50% das totalmente circunferenciais9.
Endometriose: apesar da prevalência cada vez maior dessa doença, a obstrução é uma complicação muito rara (1,7% dos casos cirúrgicos) sendo que o tratamento cirúrgico deve ser a escolha10; 11.
Radioterapia: as estenoses são mais comuns na junção anorretal e o tratamento ciúrgico deve ser evitado, tendo em vista a dificuldade técnica e alta incidência de complicações12; 13.
Isquemia: os pacientes oligo ou assintomáticos devem ser apenas observados, pois a maioria apresentará melhora em 12 a 24 meses. Nos casos sintomáticos a dilatação balonada deve ser ser considerada e nos refratários a terapia cirúrgica14.
Preparo de cólon
Como a maioria desses paciente são assintomáticos o preparo tradicional pode ser realizado sem intercorrências. Entretanto, no caso de pacientes sintomáticos, com história de vômitos ou distensão abdominal, o preparo anterógrado não deverá ser realizado, sendo que, dois enemas devem ser suficientes15. Nos pacientes oligossintomáticos o preparo fracionado pode ser considerado.
Tratamento endoscópico
Dilatação digital ou instrumental: apesar dos bons resultados nos casos distais e simples16, a dilatação endoscópica deve ser a escolha nas estenoses acima de 4 cm da borda anal.
Dilatação Balonada: principal técnica de tratamento endoscópico com resultados satisfatórios em cerca de três quartos dos casos17; 18. Deve-se sempre transpor a estenose com um fio-guia para o correto posicionamento do balão e no caso de estenoses longas e tortuosas a fluoroscopia poderá ser necessária19. Idealmente, o objetivo é alcançar um diâmetro de 18 a 20 mm, preferencialmente através de sessões semanais com aumento gradual.
Dilatação balonada e injeção local de corticoide: apesar da evidência bem documentada do uso local de triancinolona nos casos de estenose de esôfago, os resultados em colon são conflitantes20 . Porém, apesar do baixo nível de evidência, esta técnica pode ser considerada antes de uma abordagem cirúrgica agressiva.
Incisão endoscópica: incluída nessa técnica estão a estenotomia, que consiste em incisões radiais (preferencialmente seguido da dilatação balonada), e a estenectomia, que configura a ressecção em arco ou mesmo anelar da área de fibrose (sem a necessidade de dilatação). Apesar dos bons resultados dessa técnica, com taxas de sucesso de até 98,4%23, ela deve ser limitada a estenoses curtas (<1 cm)24; 25; 26.
Prótese metálica: apesar de ainda não ser possível a indicação rotineira desse tratamento, tendo em vista taxas de migração de até 70%27, nos casos de estenose refratária e especialmente associado a fístula, sem áreas de inflamação ou trajeto complexo, esta pode ser uma opção. A literatura ainda mostra relatos como ponte cirúrgica na diverticulite com estenose 28; 29; 30 e uso de stents de aposição luminal para estenoses severas, baixas (distais) e refratárias31; 32. Deve-se sempre manter uma margem distal de 2 cm acima do canal anal para evitar sintomas como tenesmo, dor anal e incontinência15.
Conclusão
A dilatação endoscópica balonada continua sendo uma modalidade segura e eficaz para o tratamento de estenoses benignas do cólon em pacientes selecionados. Para uma estenose fibrostenótica intestinal isolada com comprimento igual ou inferior a 5 cm, sem fistulização ou perfuração adjacente, a dilatação balonada deve ser considerada como terapia de primeira linha.
Em casos selecionados, outras terapias, como injeção intramural de corticóide, incisão endoscópica e colocação de próteses podem ser realizadas antes de se optar pela abordagem cirúrgica.
Para saber mais sobre este tema e outros relacionados, acesse o site Gastropedia clicando aqui!
Referências
- PENNA, M. et al. Incidence and Risk Factors for Anastomotic Failure in 1594 Patients Treated by Transanal Total Mesorectal Excision: Results From the International TaTME Registry. Ann Surg, v. 269, n. 4, p. 700-711, Apr 2019. ISSN 1528-1140. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/29315090 >.
- LUCHTEFELD, M. A. et al. Colorectal anastomotic stenosis. Results of a survey of the ASCRS membership. Dis Colon Rectum, v. 32, n. 9, p. 733-6, Sep 1989. ISSN 0012-3706. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/2667922 >.
- TUSON, J. R.; EVERETT, W. G. A retrospective study of colostomies, leaks and strictures after colorectal anastomosis. Int J Colorectal Dis, v. 5, n. 1, p. 44-8, Feb 1990. ISSN 0179-1958. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/2313156 >.
- HIRANYAKAS, A. et al. Colorectal anastomotic stricture: is it associated with inadequate colonic mobilization? Tech Coloproctol, v. 17, n. 4, p. 371-5, Aug 2013. ISSN 1128-045X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/23229558 >.
- BESSISSOW, T. et al. Endoscopic management of Crohn’s strictures. World J Gastroenterol, v. 24, n. 17, p. 1859-1867, May 2018. ISSN 2219-2840. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/29740201 >.
- COSNES, J. et al. Long-term evolution of disease behavior of Crohn’s disease. Inflamm Bowel Dis, v. 8, n. 4, p. 244-50, Jul 2002. ISSN 1078-0998. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/12131607 >.
- GUSTAVSSON, A. et al. Endoscopic dilation is an efficacious and safe treatment of intestinal strictures in Crohn’s disease. Aliment Pharmacol Ther, v. 36, n. 2, p. 151-8, Jul 2012. ISSN 1365-2036. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/22612326 >.
- WEDEL, T. et al. Morphologic Basis for Developing Diverticular Disease, Diverticulitis, and Diverticular Bleeding. Viszeralmedizin, v. 31, n. 2, p. 76-82, Apr 2015. ISSN 1662-6664. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/26989376 >.
- HAYASHI, T. et al. Management and risk factor of stenosis after endoscopic submucosal dissection for colorectal neoplasms. Gastrointest Endosc, v. 86, n. 2, p. 358-369, Aug 2017. ISSN 1097-6779. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/27940103 >.
- RUFFO, G. et al. Management of rectosigmoid obstruction due to severe bowel endometriosis. Updates Surg, v. 66, n. 1, p. 59-64, Mar 2014. ISSN 2038-131X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/24288011 >.
- DONG, C.; NGU, W. S.; WAKEFIELD, S. E. Endometriosis masquerading as Crohn’s disease in a patient with acute small bowel obstruction. BMJ Case Rep, v. 2015, Apr 2015. ISSN 1757-790X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/25903200 >.
- KOUNTOURAS, J.; ZAVOS, C. Recent advances in the management of radiation colitis. World J Gastroenterol, v. 14, n. 48, p. 7289-301, Dec 2008. ISSN 1007-9327. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/19109862 >.
- QADEER, M. A.; VARGO, J. J. Approaches to the prevention and management of radiation colitis. Curr Gastroenterol Rep, v. 10, n. 5, p. 507-13, Oct 2008. ISSN 1534-312X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/18799128 >.
- FEUERSTADT, P.; BRANDT, L. J. Colon ischemia: recent insights and advances. Curr Gastroenterol Rep, v. 12, n. 5, p. 383-90, Oct 2010. ISSN 1534-312X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/20690005 >.
- BARON, T. H. Colonic stenting: technique, technology, and outcomes for malignant and benign disease. Gastrointest Endosc Clin N Am, v. 15, n. 4, p. 757-71, Oct 2005. ISSN 1052-5157. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/16278137 >.
- KRAENZLER, A. et al. Anastomotic stenosis after coloanal, colorectal and ileoanal anastomosis: what is the best management? Colorectal Dis, v. 19, n. 2, p. O90-O96, Feb 2017. ISSN 1463-1318. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/27996184 >.
- RAGG, J. et al. Balloon dilatation of benign rectal anastomotic strictures — a review. Dig Surg, v. 29, n. 4, p. 287-91, 2012. ISSN 1421-9883. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/22922944 >.
- NAVANEETHAN, U. et al. Endoscopic balloon dilation in the management of strictures in Crohn’s disease: a systematic review and meta-analysis of non-randomized trials. Surg Endosc, v. 30, n. 12, p. 5434-5443, 12 2016. ISSN 1432-2218. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/27126619 >.
- ADLER, D. G. Colonic strictures: dilation and stents. Gastrointest Endosc Clin N Am, v. 25, n. 2, p. 359-71, Apr 2015. ISSN 1558-1950. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/25839690 >.
- CARROLL, L. A. et al. Triamcinolone stimulates bFGF production and inhibits TGF-beta1 production by human dermal fibroblasts. Dermatol Surg, v. 28, n. 8, p. 704-9, Aug 2002. ISSN 1076-0512. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/12174062 >.
- DI NARDO, G. et al. Intralesional steroid injection after endoscopic balloon dilation in pediatric Crohn’s disease with stricture: a prospective, randomized, double-blind, controlled trial. Gastrointest Endosc, v. 72, n. 6, p. 1201-8, Dec 2010. ISSN 1097-6779. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/20951986 >.
- BEVAN, R. et al. Review of the use of intralesional steroid injections in the management of ileocolonic Crohn’s strictures. Frontline Gastroenterol, v. 4, n. 4, p. 238-243, Oct 2013. ISSN 2041-4137. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/28839732 >.
- JAIN, D.; SANDHU, N.; SINGHAL, S. Endoscopic electrocautery incision therapy for benign lower gastrointestinal tract anastomotic strictures. Ann Gastroenterol, v. 30, n. 5, p. 473-485, 2017. ISSN 1108-7471. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/28845102 >.
- TRUONG, S.; WILLIS, S.; SCHUMPELICK, V. Endoscopic therapy of benign anastomotic strictures of the colorectum by electroincision and balloon dilatation. Endoscopy, v. 29, n. 9, p. 845-9, Nov 1997. ISSN 0013-726X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/9476768 >.
- KAWAGUTI, F. S. et al. Endoscopic radial incision and cutting procedure for a colorectal anastomotic stricture. Gastrointest Endosc, v. 82, n. 2, p. 408-9, Aug 2015. ISSN 1097-6779. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/25957477 >.
- OSERA, S. et al. Efficacy and safety of endoscopic radial incision and cutting for benign severe anastomotic stricture after surgery for lower rectal cancer (with video). Gastrointest Endosc, v. 81, n. 3, p. 770-3, Mar 2015. ISSN 1097-6779. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/25708767 >.
- ATTAR, A. et al. Safety and efficacy of extractible self-expandable metal stents in the treatment of Crohn’s disease intestinal strictures: a prospective pilot study. Inflamm Bowel Dis, v. 18, n. 10, p. 1849-54, Oct 2012. ISSN 1536-4844. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/22161935 >.
- BARON, T. H. et al. Expandable metal stents for the treatment of colonic obstruction: techniques and outcomes. Gastrointest Endosc, v. 47, n. 3, p. 277-86, Mar 1998. ISSN 0016-5107. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/9540883 >.
- LAASCH, H. U. et al. Treatment of colovaginal fistula with coaxial placement of covered and uncovered stents. Endoscopy, v. 35, n. 12, p. 1081, Dec 2003. ISSN 0013-726X. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/14648427 >.
- MEISNER, S. et al. Self-expanding metal stents for colonic obstruction: experiences from 104 procedures in a single center. Dis Colon Rectum, v. 47, n. 4, p. 444-50, Apr 2004. ISSN 0012-3706. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/14994110 >.
- MARTÍNEZ ALCALÁ, F. et al. Treatment of a benign, anastomotic refractory rectal stricture with an AXIOS stent. Endoscopy, v. 47 Suppl 1 UCTN, p. E413-4, 2015. ISSN 1438-8812. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/26397845 >.
- AXELRAD, J. E.; LICHTIGER, S.; SETHI, A. Treatment of Crohn’s Disease Anastomotic Stricture With a Lumen-apposing Metal Stent. Clin Gastroenterol Hepatol, v. 16, n. 3, p. A25-A26, 03 2018. ISSN 1542-7714. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/28529163 >.