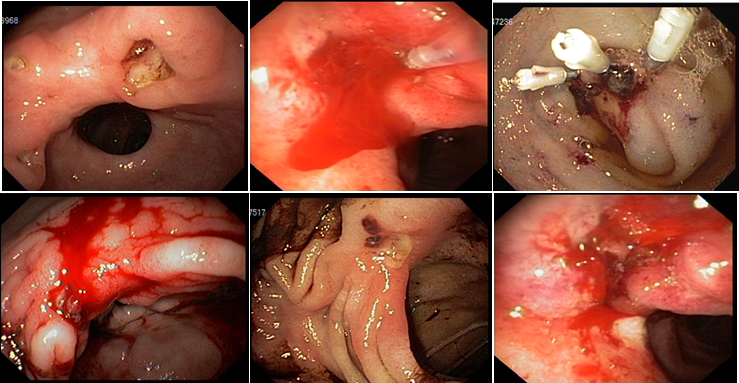
Passagem de prótese biliar em paciente com prótese duodenal prévia
Paciente do sexo feminino, 76 anos, com história de perda de peso e dor em região epigástrica com irradiação para o dorso. Realizou endoscopia digestiva que demonstrou abaulamento em parede posterior de antro e bulbo duodenal com mucosa infiltrada e irregular. As biópsias não foram conclusivas.
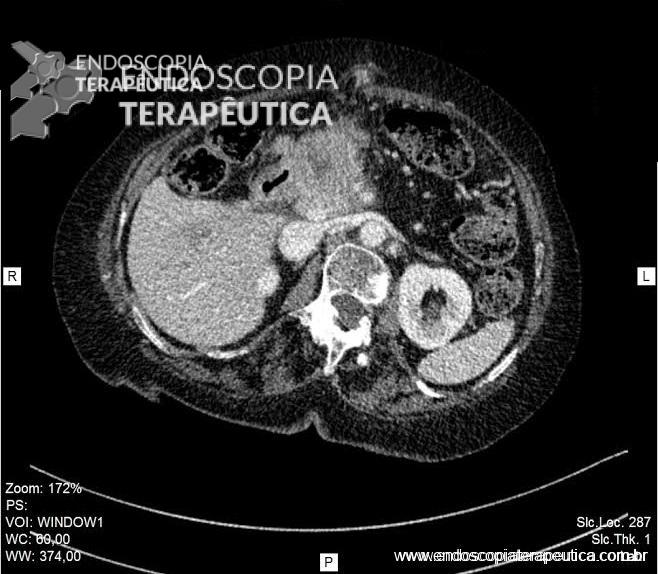
A paciente então foi submetida à tomografia de abdome que evidenciou volumosa lesão no corpo e colo do pâncreas invadindo a parede do antro gástrico e bulbo duodenal além de envolver o tronco celíaco e apresentar amplo contato com a artéria mesentérica superior.
Indicada ecoendoscopia para punção biópsia da lesão, que confirmou adenocarcinoma de pâncreas.
A paciente foi encaminhada para iniciar quimioterapia. Dois meses depois evoluiu com quadro de vômitos pós prandiais. Realizou nova endoscopia que demonstrou obstrução pilórica e duodenal pela lesão. Foi realizada passagem de sonda nasoenteral e encaminhada para avaliação de prótese duodenal.
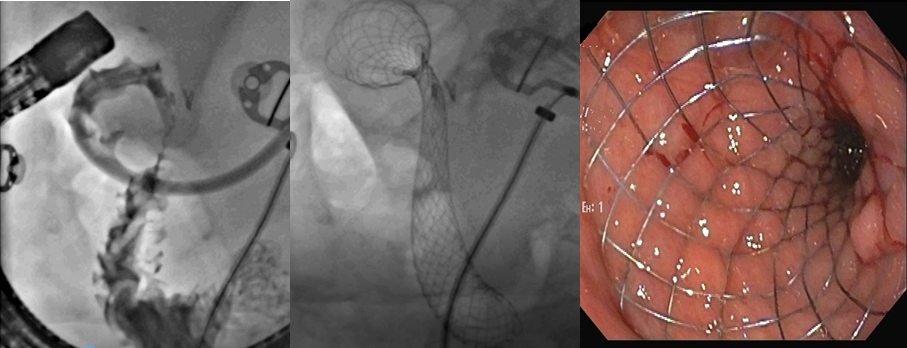
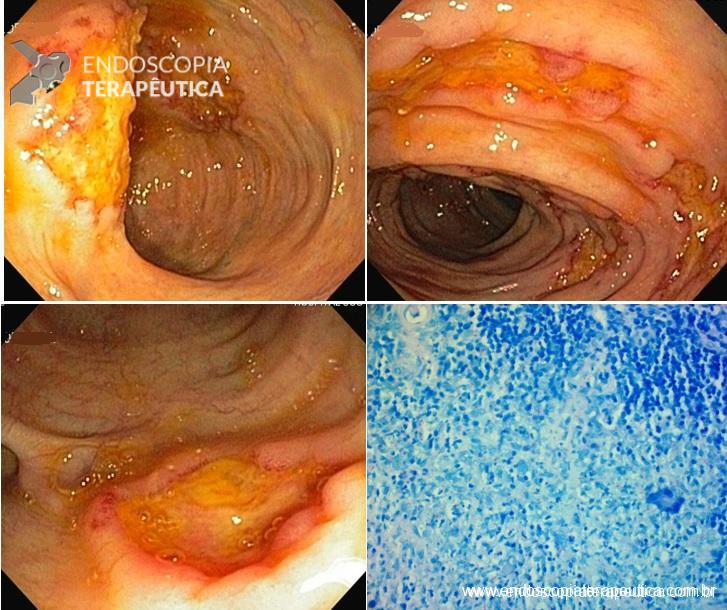
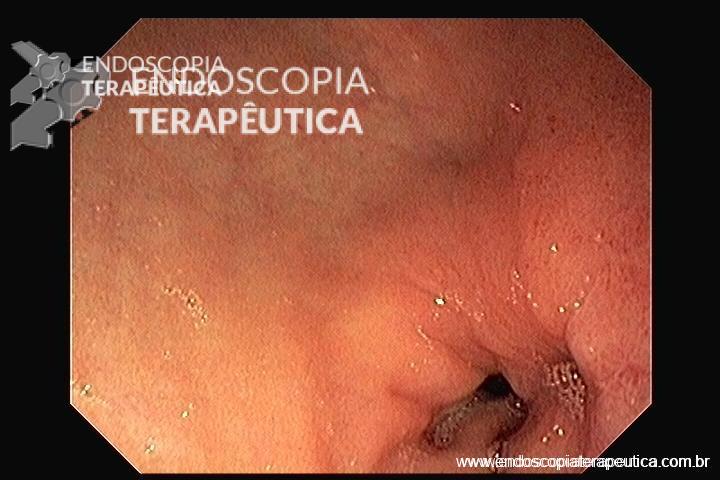
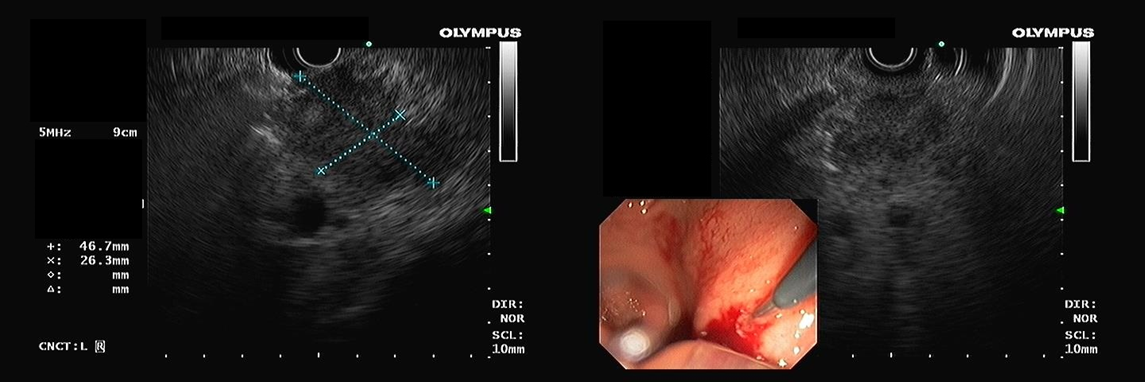
Injeção de contraste pela SNE demonstrando a estenose do piloro e duodeno. Aspecto radiológico e endoscópico da prótese duodenal.
Realizou passagem da prótese sem intercorrências. Foi utilizada prótese duodenal não recoberta de 22 mm por 90 mm com liberação em posição antro-pilórica. A paciente evoluiu com melhora dos vômitos e boa aceitação alimentar.
Um mês após a passagem da prótese duodenal a paciente evoluiu com icterícia. Realizou novo exame de imagem que demonstrou progressão da lesão com invasão do colédoco intrapancreático e dilatação das vias biliares intra e extra hepáticas.
Indicada nova CPRE para tentativa de drenagem biliar.
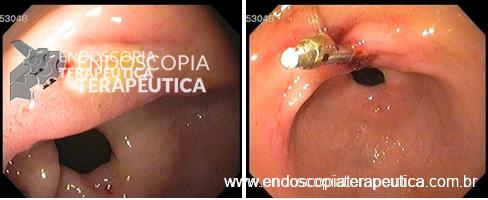
Realizada passagem do aparelho através da prótese duodenal que estava integrada à mucosa da região antropilórica. Tentativa de canulação da papila através da malha da prótese sem sucesso. Introdução do duodenoscópio até ultrapassar a prótese permitindo bom acesso à papila. A colangiografia demonstrou dilatação das vias biliares intra e extra hepáticas com extensa estenose tumoral intrapancreática. Passagem de prótese metálica parcialmente recoberta de 10 mm por 80 mm.
A paciente evoluiu com melhora da icterícia. Após o procedimento teve sobrevida de 3 meses sem sintomas de obstrução biliar ou de saída gástrica.
Quiz! Múltiplas angiectasias gastrointestinais
Paciente do sexo feminino com 72 anos e anemia crônica desde a juventude. Relata episódios frequentes de melena e epistaxe. Tem um irmão e uma irmã com sintomas semelhantes.
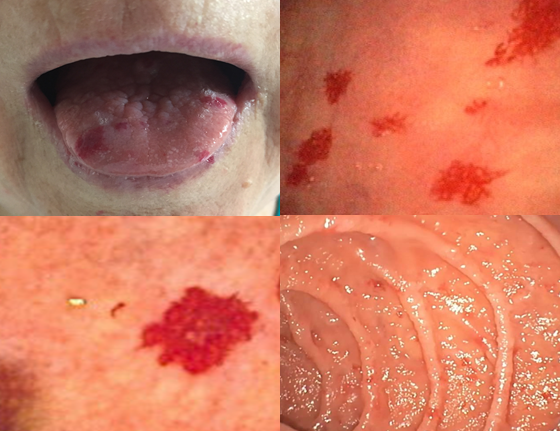
No exame físico notam-se lesões avermelhadas nos lábios e língua.
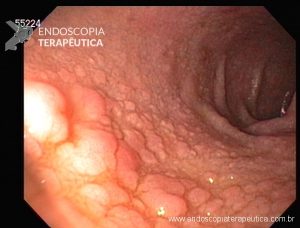
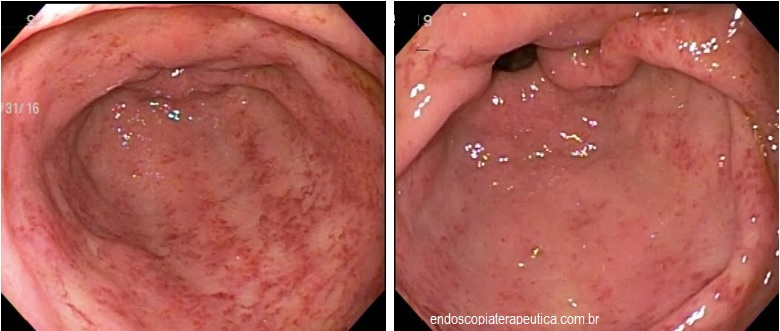
Realizou endoscopia digestiva alta que mostrou múltiplas angiectasias gástricas, bulbares, de segunda e terceira porção duodenal. O restante do trato gastrointestinal não foi estudado até o momento.
Pneumoperitônio após gastrostomia endoscópica – O que você faria neste caso?
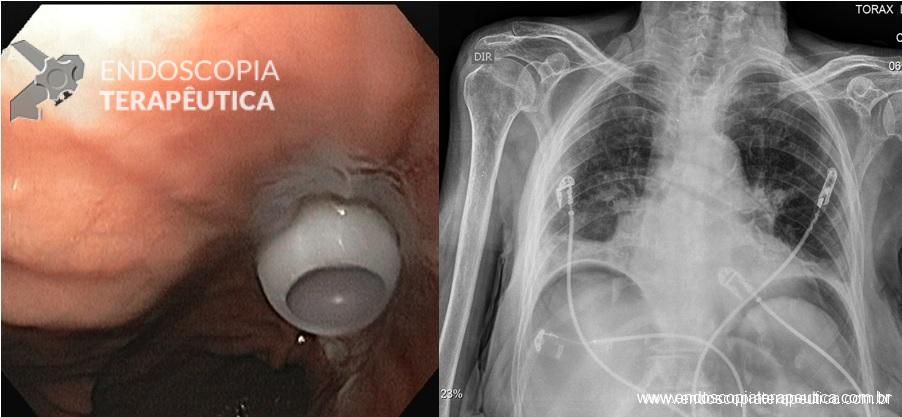
Paciente de 78 anos com sequela de AVC, internada em unidade de terapia intensiva. Foi submetida à gastrostomia endoscópica sem intercorrências. No dia seguinte ao procedimento foi obtida a radiografia acima.
A paciente é não comunicante, estava hemodinamicamente normal, com abdome flácido e sem sinais de dor a palpação. A sonda de gastrostomia estava na mesma posição em que havia sido fixada no dia do procedimento (2,5 cm). Qual seria a sua conduta em relação à este achado?
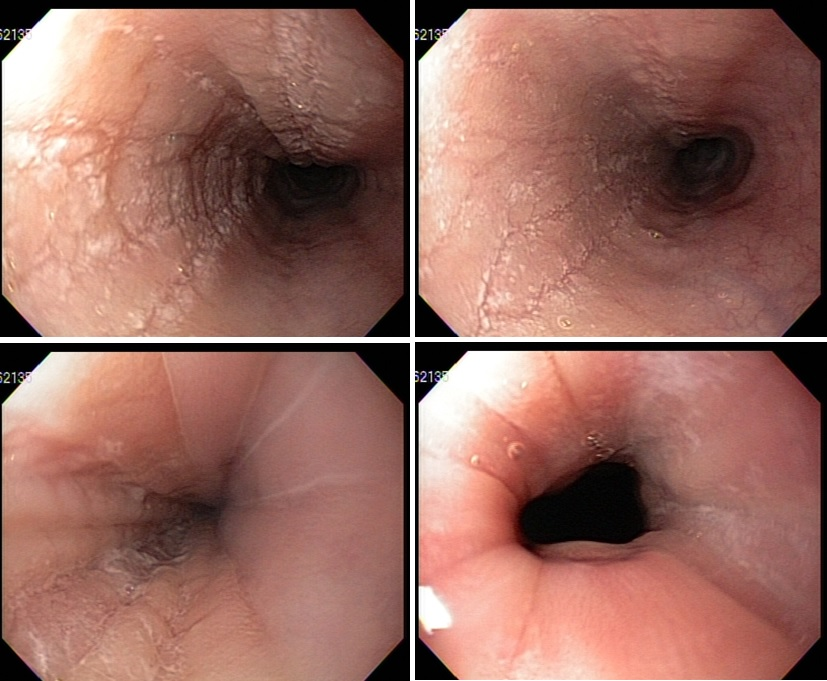
Qual a sua hipótese diagnóstica para estes achados no esôfago?
Como tratar a úlcera péptica hemorrágica?
A hemorragia digestiva alta (HDA) é uma condição frequente no mundo todo. Esta complicação leva a internações hospitalares prolongadas e está associada à significativa morbidade e mortalidade, principalmente nos idosos. As causas mais comuns de HDA são as não varicosas, sendo a úlcera péptica a mais frequente.
O manejo adequado do paciente e o uso de técnicas endoscópicas apropriadas melhoram o prognóstico e reduzem a taxa ressangramento.
Neste artigo será abordado exclusivamente o tratamento endoscópico. Para o ver o manejo completo do paciente, desde a admissão até a alta acesse o link a seguir: Algorritmo para tratamento da HDA
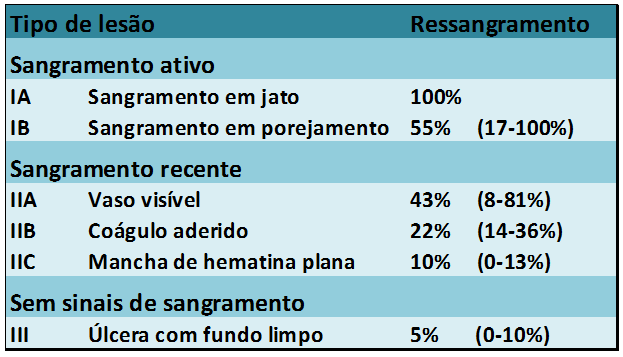
Classificação de Forrest
Esta classificação divide as úlceras em sangramento ativo, sinais de sangramento recente e úlceras sem sinais de sangramento. Através dela é possível estimar o risco de ressangramento se a lesão não for tratada e avaliar a necessidade de tratamento endoscópico.
Indicação de Tratamento Endoscópico
- Todas as úlceras com sangramento ativo devem ser tratadas (Forrest IA e IB).
- Todas as úlceras com vaso visível, mesmo sem sangramento, devem ser tratadas (Forrest IIA).
- O tratamento de úlceras com coágulos firmemente aderidos (Forrest IIB) que não são removidos após a lavagem vigorosa é controverso. Se o coágulo é facilmente removido com a lavagem e evidencia um vaso visível abaixo ou sangramento ativo, deve ser tratado. Porém, se o coágulo é firme e de difícil remoção, a literatura não demonstra uma vantagem evidente no tratamento. Neste caso a conduta deve ser individualizada.
- As lesões com manchas hematínicas planas (Forrest IIC) não necessitam tratamento endoscópico.
- As úlceras de base fibrinosa limpa (Forrest III) não necessitam tratamento endoscópico.
Técnicas Endoscópicas
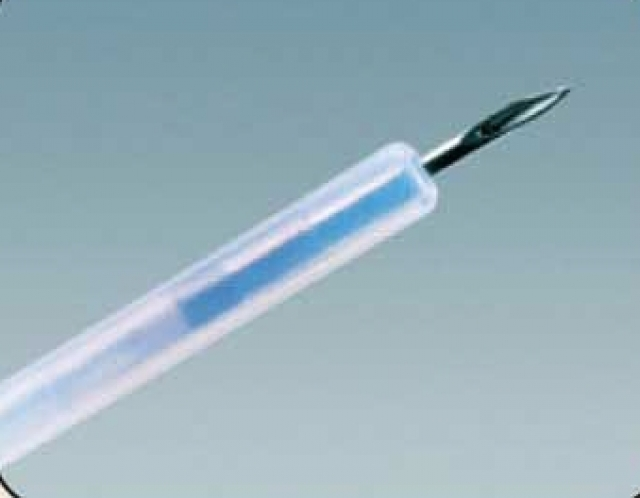
Hemostasia com injeção de solução fisiológica e adrenalina
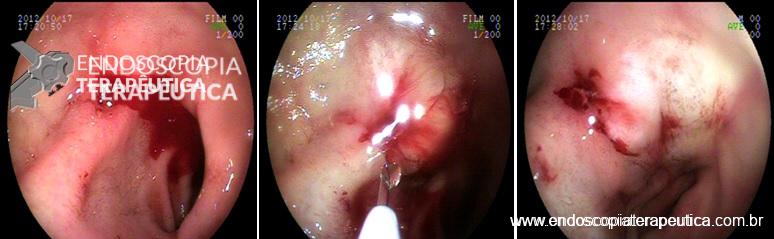
Úlcera bulbar Forrest Ib. Injeção de solução de soro e adrenalina com controle do sangramento. Após a injeção com solução de adrenalina um segundo método deve ser aplicado.
A injeção de solução de soro fisiológico com adrenalina não deve ser utilizada como monoterapia. Após a injeção a hemostasia ocorre através do tamponamento do vaso pela bolha submucosa formada pelo soro e também pela vasoconstrição causada pela adrenalina. Porém, este efeito é efêmero e se outro método não for aplicado o sangramento vai recidivar em um curto período de tempo.
Esta é uma ótima técnica para parar ou reduzir bastante o sangramento ativo facilitando a identificação do ponto sangrante e permitir a aplicação de um segundo método hemostático com mais precisão.
A diluição da solução de adrenalina e soro deve ser de 1:10000 ou 1:20000. Esta diluição é obtida através da mistura de uma ampola (1 ml) de adrenalina em 9 ml de soro fisiológico ou de 1 ml de adrenalina em 19 ml de soro fisiológico.
A injeção deve ser realizada nas bordas da úlcera, nos 4 quadrantes, formando uma bolha. Geralmente é necessário um grande volume (10-20 ml) para se obter uma hemostasia adequada.
Ela é indicada apenas em úlceras com sangramento ativo para facilitar a aplicação de um segundo método endoscópico. Nas úlceras com estigmas de sangramento recente (FIIa e FIIb) e sem sangramento ativo o tratamento definitivo com agentes esclerosantes, métodos térmicos ou mecânicos pode ser realizado diretamente.
Injeção de agentes esclerosantes
A injeção de agentes esclerosantes, diferente da injeção de solução de adrenalina, pode ser usada como terapia definitiva, associada ou não à injeção de adrenalina. Esta técnica apresenta resultados que podem ser comparados aos métodos térmicos e mecânicos. As substâncias que costumam ser utilizadas são o álcool absoluto e a etalonamina. A injeção destas substâncias deve ser realizada em pequeno volume (0,5 à 2 ml por punção) nos quatro quadrantes, bem próximo do vaso visível ou sangrante. A injeção direto no vaso não é recomendada. Estes agentes esclerosantes não são utilizados com frequência no tratamento da úlcera hemorrágica e estão associados ao aumento do tamanho da úlcera e a um risco aumentado de perfuração no caso de injeção profunda ou em grande volume.
Uma outra classe separada de agentes injetáveis são as colas de fibrina e o cianoacrilato que podem ser utilizados para obliterar o vaso e formar um tecido selante sobre a área sangrante.
A solução de glicose 50% e adrenalina (1:10000) pode ser utilizada em um volume maior do que as outras substâncias esclerosantes. Com isso é possível se obter um efeito de tamponamento, vasoconstrição e também esclerose do vaso sangrante. Esta é uma boa opção, melhor do que a injeção de solução fisiológica e adrenalina isolada, quando não se tem outros métodos disponíveis (infelizmente esta é uma realidade dura para quem trabalha com serviço público fora de grandes centros).
Terapia térmica
Para a coagulação do vaso sangrante podem ser utilizados cateteres de contato como o Heater probe ou o cateter bipolar e métodos de não contato como o plasma de argônio (APC).
Quando se utiliza os cateteres de contato é importante pressionar o cateter sobre o vaso, comprimindo o mesmo até o seu completo colabamento e cauterizando até formar uma depressão, confirmando a completa coagulação do vaso.
Já o APC deve ser utilizado sem encostar na mucosa ou no vaso, evitando a aderência da crosta formada na extremidade do cateter. Geralmente ele é regulado com fluxo de 1,5 à 2 l/min e 30 – 40 w de potência.
Uma outra opção, muito utilizada no controle de vasos sangrantes durante a realização de ESD, é o uso de pinças de coagulação (coagrasper). Estas pinças são utilizadas no modo soft coagulation e tem a vantagem de permitir uma coagulação precisa, somente do vaso sangrante, preservando o tecido adjacente.
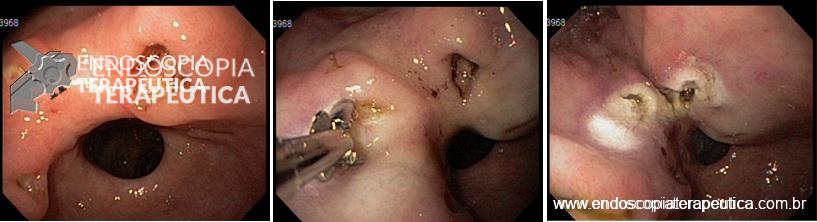
Presença de 2 pequenas ulcerações com vasos visíveis (Forrest IIA). Realizada coagulação dos vasos com coagrasper.
Em último caso, na indisponibilidade de um cateter bipolar, APC ou coagrasper, uma alça de polipectomia com a pontinha exposta, em modo soft coagulation pode salvar o dia…
Clipes
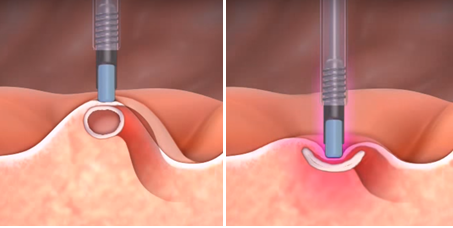
Os clipes endoscópicos tem um excelente resultado na obtenção da hemostasia e redução do ressangramento. Os modelos recentes permitem a rotação do clipe facilitando ainda mais a sua utilização. Eles devem ser aplicados diretamente sobre o vaso sangrante e de preferência utilizando pelo menos 2 clipes obstruindo os dois lados do vaso.
Esta técnica tem uma vantagem teórica sobre os outros métodos no tratamento de pacientes em uso de anticoagulantes ou antiagregantes plaquetários, pois causa menor trauma ao tecido adjacente reduzindo o risco de sangramentos adicionais. Também é a técnica de escolha em pacientes que apresentaram ressangramento.
Hemospray
É um pó hemostático desenvolvido para uso endoscópico. Ele é composto de partículas não orgânicas, biologicamente inertes, que se tornam aderentes e coesas quando entram em contato com a humidade do TGI, funcionando como uma barreira hemostática mecânica. Sua indicação é exclusiva em sangramentos ativos.
A grande aplicação é para aqueles sangramentos volumosos onde a terapêutica endoscópica inicial falha, funcionando como um método de resgate, evitando a cirurgia. Ele está liberado para uso em lesões sangrantes não varicosas mas já existem estudos demonstrando sua aplicação também no sangramento varicoso.
A desvantagem é que é um método temporário, geralmente necessitando uma revisão endoscópica e também de alto custo.
Conclusão
Existem várias opções endoscópicas para o controle do sangramento da úlcera péptica. É importante reforçar os seguintes conceitos:
- Sempre tratar úlceras F IA, F IB e F IIA
- Lavar vigorosamente os coágulos aderidos (F IIB). Se sangrarem ou um vaso visível for exposto ele deve ser tratado. Nos coágulos firmemente aderidos a conduta deve ser individualizada.
- Injeção de solução de adrenalina é excelente para reduzir o sangramento ativo mas nunca deve ser utilizada como monoterapia
- De preferência utilizar técnicas térmicas ou mecânicas
- Novas tecnologias como o Hemospray e clipes maiores como o OVESCO logo farão parte das nossas opções para o tratamento da hemorragia digestiva de difícil controle.
Referências
Resultados a longo prazo da ressecção de neoplasias escamosas do esôfago por técnica de mucosectomia com ligadura elástica.
Este é um estudo retrospectivo, relatando resultados com seguimento médio maior do que 2 anos do tratamento das neoplasias escamosas precoces esofágicas por técnica de mucosectomia com ligadura elástica.
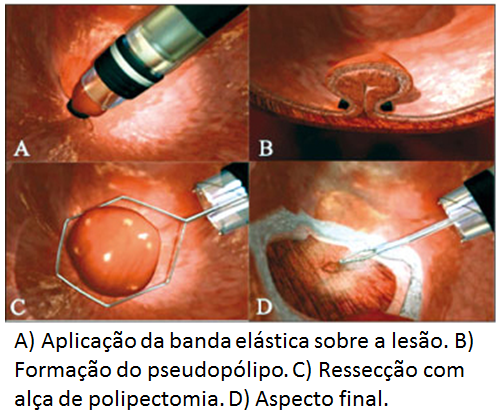
A mucosectomia esofágica através da ligadura elástica e posterior ressecção com alça da lesão tem sido bastante utilizada no tratamento das neoplasias da transição esôfago gástrica e também nas lesões precoces do esôfago de Barret. Apesar disso, raramente se encontram relatos da utilização desta técnica para o tratamento das neoplasias precoces de células escamosas.
A técnica consiste primeiramente na marcação das margens da lesão. Após isso é aplicada uma ligadura elástica, transformando-a em uma lesão polipóide. Este pólipo então é ressecado com o auxílio de uma alça de polipectomia. Se a lesão não for ressecada em uma única ligadura uma outra banda elástica pode ser aplicada e novamente ressecada até a remoção completa da lesão.
Este estudo incluiu 125 pacientes. As lesões foram ressecadas conforme a técnica descrita anteriormente. Nestes pacientes foram identificadas 135 lesões (40 neoplasias intra-epiteliais de baixo grau, 57 neoplasias intra-epiteliais de alto grau, 34 CEC precoces e 4 lesões não neoplásicas).
Tamanho médio das lesões de 4,63 cm2.
Seguimento médio de 27,7 meses.
Recorrência local de apenas 2,4% (3 casos em 135), todas tratadas endoscopicamente.
Houve apenas uma perfuração tratada endoscopicamente através da utilização de clipes.
COMENTÁRIOS
Este artigo foi publicado na edição de dezembro de 2016 da Gastrointestinal Endoscopy. Foi realizado no Departamento de Gastroenterologia e Hepatologia do Hospital Jinling na China. É um estudo retrospectivo e de centro único. Ele concluiu que a técnica de mucosectomia com auxílio de ligadura elástica é segura e pode ser utilizada em pacientes com neoplasia precoce de células escamosas. Além disso, concluíram que a taxa de recorrência com a utilização desta técnica é baixa.
Após uma breve revisão bibliográfica foi possível encontrar uma grande quantidade de artigos demonstrando um ótimo resultado desta técnica no esôfago de Barret. Apesar disso, foi encontrado apenas um artigo, publicado na Endoscopy em 2006 (link aqui), relatando o uso desta técnica em lesões escamosas. Neste artigo foram demonstrados 5 casos de lesões grandes, ocupando mais da metada da circunferência esofágica, todas ressecados com sucesso através desta técnica, sem complicações e sem recidiva em um seguimento médio de 14 meses.
Já é muito bem estabelecido que a ressecção das lesões precoces através de técnicas de dissecção submucosa (ESD) em um único bloco tem uma menor incidência de recidiva e facilita bastante a avaliação histológica. Porém, esta é uma técnica difícil, de curva de aprendizado longa e no ocidente é realizada em pouquíssimos serviços de endoscopia. Este artigo demonstra que a remoção destas lesões através de mucosectomia com ligadura elástica é uma opção que aparentemente apresenta segurança e bons resultados a longo prazo. Apesar dos ótimos resultados apresentados, na literatura ainda existe pouca evidência confirmando estes achados.
REFERÊNCIA
Zhenkai Wang, Heng Lu, Lin Wu, Boshi Yuan, Jiong Liu, Hui Shi, Fangyu Wang
PMAE – paliação da disfagia em recidiva tumoral após gastrectomia total
A disfagia é o sintoma mais comum do câncer esofágico obstrutivo e pode ser facilmente tratado através da colocação de próteses esofágicas. As próteses auto expansíveis permitem o retorno da ingestão via oral aumentando muito a qualidade de vida destes pacientes.
Neste vídeo demonstramos a paliação da disfagia em um paciente com recidiva tumoral na anastomose esofagojejunal 4 anos após a gastrectomia total.