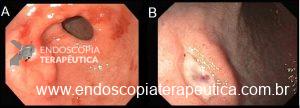
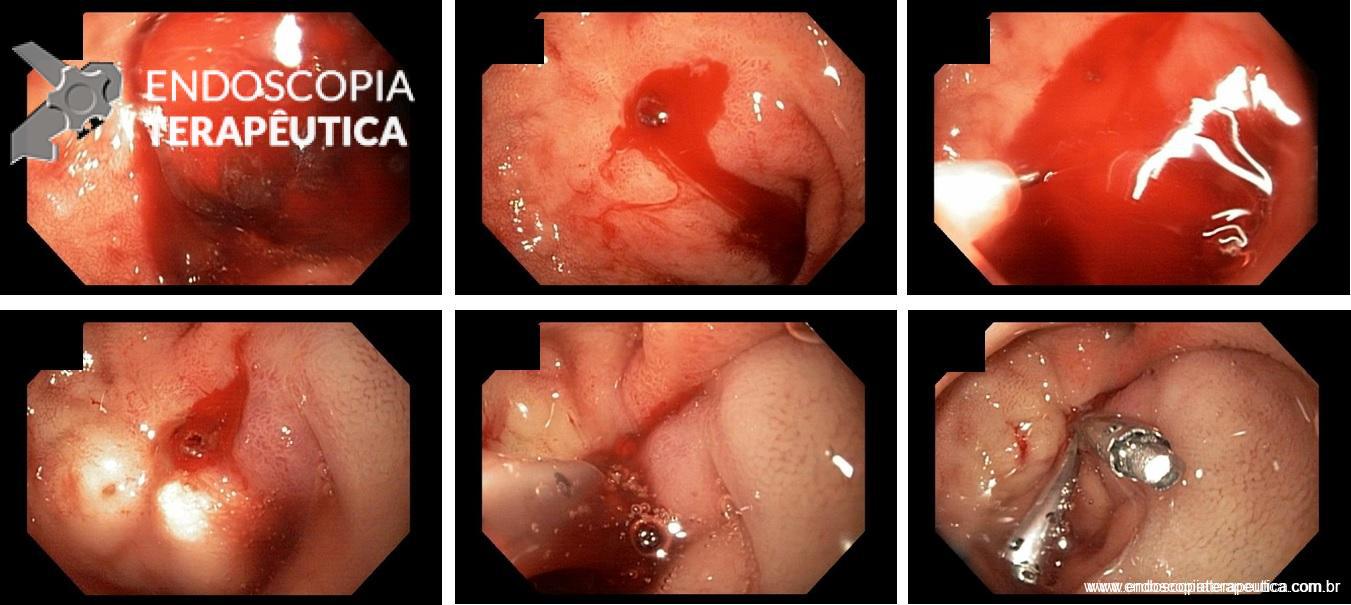
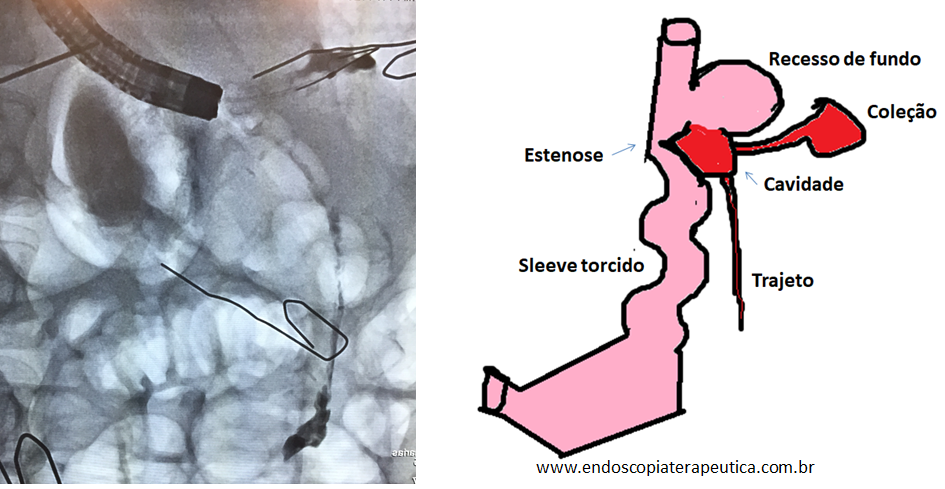
Atualmente, existem vários tipos de balão intragástrico no mercado e em estudo. Os tipos de balão incluem os preenchidos com ar, líquido, os duplos, ajustáveis e deglutíveis.

Tipos de balão intragástrico. Imagens divulgação.
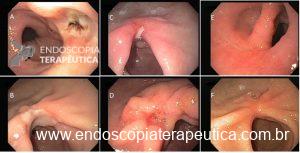
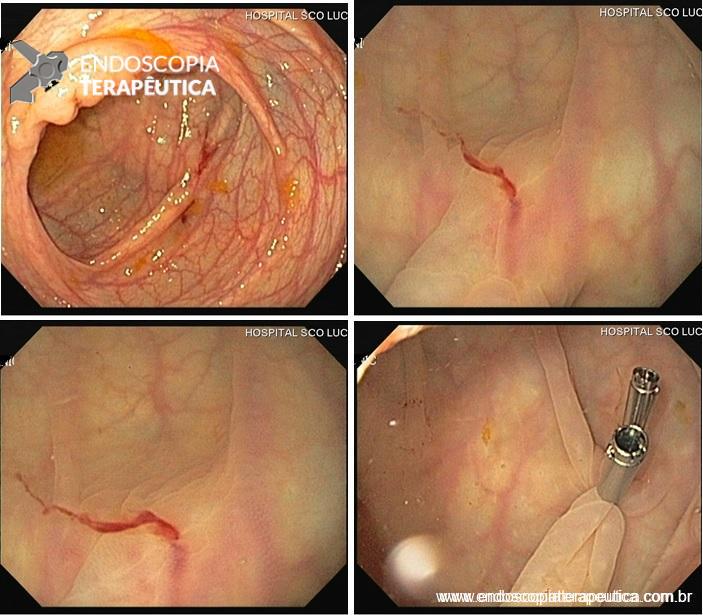
Porém, nesta revisão, iremos abordar apenas os preenchidos com líquido e implantados por endoscopia, que são os mais usados no nosso meio.
O primeiro balão intragástrico disponível no Brasil foi o balão de líquido, que podia permanecer no estômago por um período de 6 meses. Esse balão foi por bastante tempo a única opção para os nossos pacientes. Com o passar do tempo, o balão de líquido ajustável para tratamentos com um ano de duração chegou ao mercado e, mais recentemente, o balão de 1 ano não ajustável.
Com um maior número de opções, surgiu a dúvida: quando e para quem indicar cada tipo de balão intragástrico?

Balões intragástricos colocados por endoscopia e preenchidos com líquido. Imagens divulgação.
Para tentar responder a essa pergunta, realizei uma breve revisão de literatura comparando os balões em relação a vários fatores, incluindo custo, volume, resultados, tempo de permanência, ajuste e complicações.
Vamos lá!
Existe diferença no preço dos balões?
O valor pago pelo balão pode variar bastante dependendo da região, do número de balões comprados e da relação do médico com a empresa fornecedora. Porém o balão de seis meses tende a ter um preço mais baixo quando comparado com o balão de um ano ajustável e não ajustável.
O volume de preenchimento faz diferença?
Não existe diferença no volume de preenchimento entre os três tipos de balão intragástrico comparados. Os três sugerem em bula um preenchimento de, pelo menos, 400 ml e, no máximo, 700 ml. Sabemos que os balões toleram volumes maiores, mas seu uso é off label.
Em relação ao volume, vale a pena citar uma meta-análise publicada em 2017 que avaliou 5549 pacientes com balões preenchidos com volumes variando de 400 a 700 ml (1). Por incrível que pareça, não houve associação entre maiores volumes de preenchimento do balão com maiores perdas de peso. O que se observou foi que balões com menos de 600 ml apresentavam uma maior taxa de impactação antral e refluxo quando comparados com balões acima desse volume, sem diferença nas outras complicações. Com isso, o estudo sugeriu que o volume utilizado para o preenchimento do balão intragástrico deve ser entre 600 e 650 ml.
O tempo de permanência faz diferença na perda de peso?
Com o lançamento do balão para tratamento de um ano de duração, houve uma grande expectativa em relação aos seus resultados. Será que os pacientes continuariam perdendo peso após os 6 meses? Vários estudos foram realizados comparando a perda de peso entre os tratamento de seis meses e um ano de duração (2-8).
Os resultados variam um pouco, com alguns estudos mostrando perdas discretamente melhores para o tratamento de 6 meses e outros para o de um ano, mas, na média, não existe diferença significativa na perda de peso máxima entre os dois tratamentos. Os resultados são semelhantes e variam entre 13 e 20% de perda de peso total.
E no reganho de peso? Existe diferença em relação ao tempo de permanência do balão?
Um estudo muito interessante publicado por Russo et al (6) avaliou prospectivamente dois grupos de pacientes após removerem o balão intragástrico. Um grupo que utilizou o balão de 6 meses e um grupo que utilizou o balão de um ano. No momento da remoção, os dois grupos haviam apresentado a mesma média de perda de peso (20 kg + 3). Os grupos foram acompanhados por 9 meses, e o reganho de peso após a remoção foi semelhante entre os dois grupos, como pode ser observado na tabela abaixo.
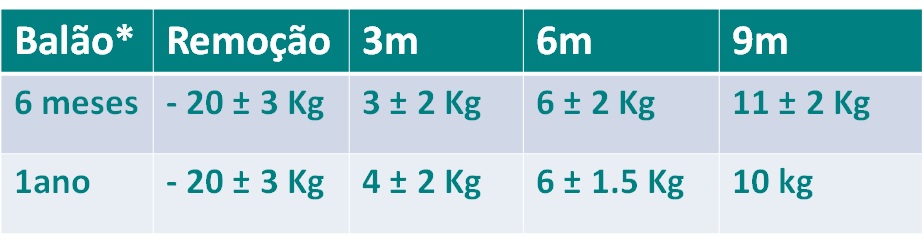
Tabela l. Os dois grupos perderam 20+ 3 Kg ao final do tratamento. As células seguintes mostram o reganho médio de peso em cada uma das visitas de acompanhamento.
Tabela l. Os dois grupos perderam 20+ 3 Kg ao final do tratamento. As células seguintes mostram o reganho médio de peso em cada uma das visitas de acompanhamento.
Apesar disso, o balão de 1 ano apresenta uma vantagem muito interessante em relação ao balão de seis meses. O reganho de peso começa 6 meses depois quando comparado com o balão semestral, dando um maior tempo para o paciente se adaptar aos hábitos mais saudáveis.
Ajuste para aumentar o balão faz diferença?
A possibilidade de ajustar o balão também foi uma novidade muito esperada, e acreditava-se que poderia fazer uma grande diferença quando o paciente atingisse o platô de perda de peso.
Fittipaldi-Fernandes et al publicaram um estudo prospectivo randomizado muito interessante avaliando esse tema. Eles estudaram 180 pacientes. Um grupo no qual o balão foi preenchido com 600 ml e mantido durante um ano e outro grupo no qual o balão foi preenchido com 600 ml e após 6 meses reajustado com mais 250 ml. O grupo que foi ajustado apresentou uma perda média de 4,35 kg a mais do que o grupo não ajustado, mas sem diferença estatística na porcentagem de perda de peso total, na perda de excesso de peso ou no IMC (9).
Isso ocorre porque os pacientes que não perdem peso inicialmente com o balão (em torno de 8% dos pacientes) não costumam responder com o aumento do volume do balão. Esses casos são mais bem manejados com medicações para perda de peso. Os pacientes que mantêm sensação de saciedade e perdendo bem peso também não se beneficiam muito com os ajustes. Talvez, o grupo que mais tenha resultado são os pacientes que apresentaram uma boa perda de peso e queixam de perda da saciedade (10).
Importante lembrar também que ajustes com volume muito baixo não são efetivos nem, muitas vezes, notados pelos pacientes. Se um ajuste para mais for realizado, ele deve ser de no mínimo 150 ml.
Aqui, sim, em minha opinião, é a maior vantagem do balão ajustável. De acordo com dados do Consenso Brasileiro de Balão Intragástrico, que avaliou mais de 40.000 casos, a incidência de intolerância ao balão é de 2,2%. Além disso, há mais 0,9% dos pacientes que apresentam a hiperinsuflação espontânea do balão (11).
Se essas complicações ocorrerem com um balão não ajustável, o único tratamento possível é a remoção do balão. Quem trabalha com balão sabe que a interrupção precoce do tratamento é sempre uma grande dor de cabeça com queixas e questionamentos dos pacientes.
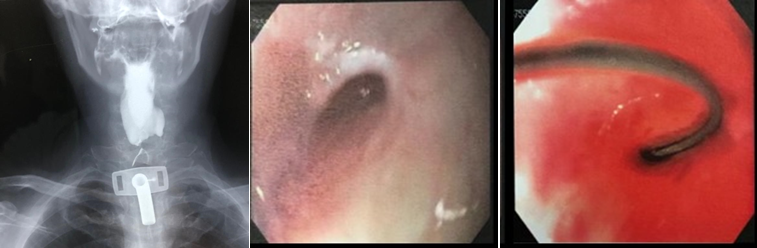
Se isso ocorrer com um balão ajustável, é possível resolver a complicação sem necessitar remoção e interrupção do tratamento. No caso de intolerância, o balão deve ser esvaziado até perder o seu formato esférico. Isso ocorre com volumes próximos ou um pouco menores do que 400 ml. No caso da hiperinsuflação, o balão deve ser esvaziado completamente e reenchido com um novo líquido. Sempre importante orientar o paciente que a hiperinsuflação pode ocorrer novamente.
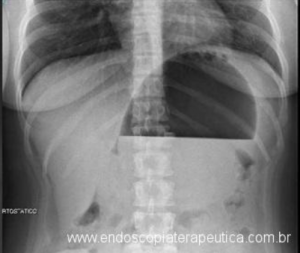
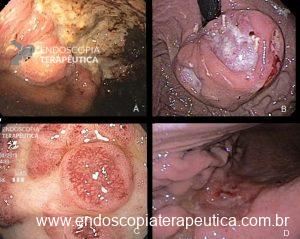
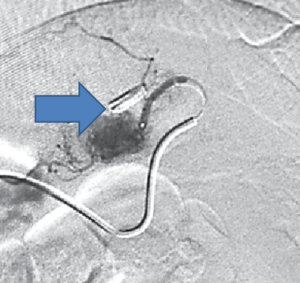
Imagem de radiografia de abdome demonstrando balão hiperinsuflado com nível líquido.
Complicações! Existe diferença na taxa de complicações entre os balões?
O Consenso Brasileiro de Balão Intragástrico (11) avaliou as complicações entre os diferentes tipos de balão. Não existe diferença significativa na taxa de incidência de hiperinsuflação, esvaziamento espontâneo, migração e perfuração no implante e explante.
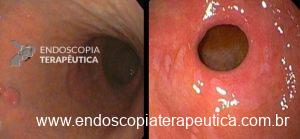
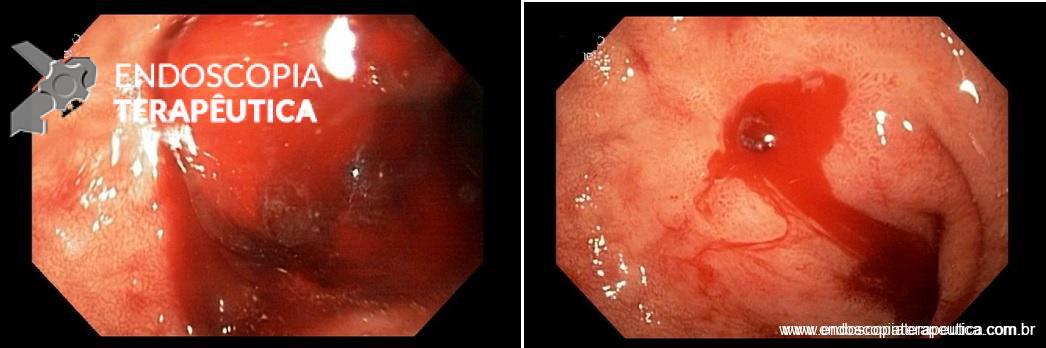
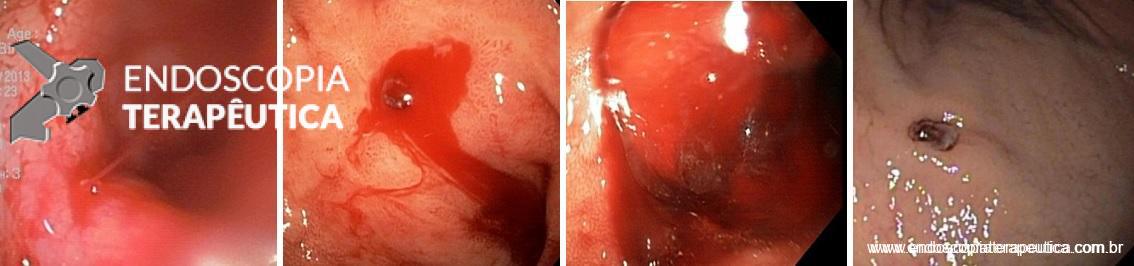
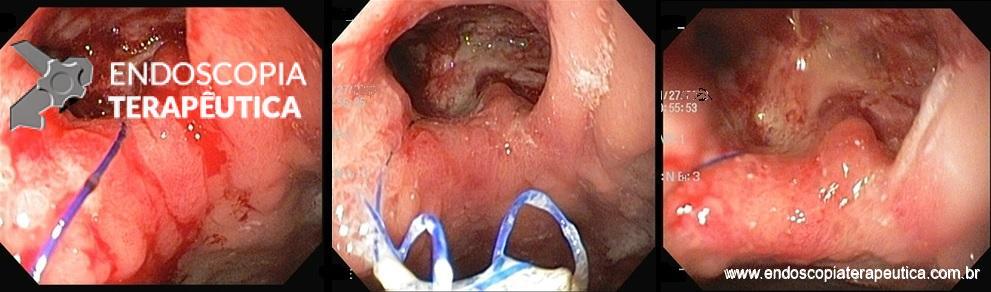
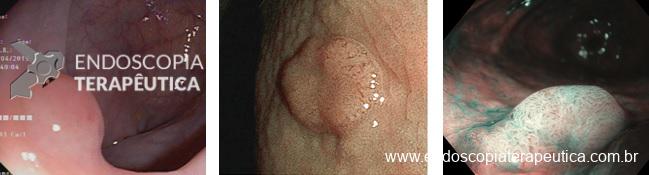
Em relação às úlceras gástricas, o balão ajustável tem uma taxa de incidência de 5,7%, enquanto os outros balões apresentam taxas de apenas 0,4%. Dentre esses pacientes com úlcera no balão ajustável, 0,6% necessita interromper o tratamento. A maior incidência de úlceras com o balão ajustável está relacionada à presença do cateter de ajuste.
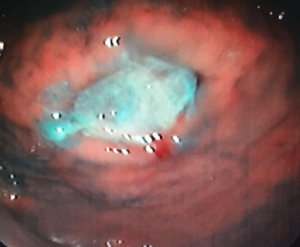
Úlcera pós-balão intragástrico.
Enfim, quando usar cada tipo de balão?
Importante ressaltar que não existe contraindicação de nenhum dos tipos de balão para algum tipo específico de paciente, desde que as indicações e contraindicações do método sejam respeitadas.
Mas algumas sugestões podem ser feitas, sem nenhum critério de obrigatoriedade.
- Pacientes preocupados com o custo do tratamento podem utilizar o balão mais barato;
- Pacientes que precisam perder pouco peso ou que têm uma data para terminar o tratamento (algumas vezes um evento ou uma cirurgia que exigia perder peso para realizar) podem se beneficiar do tratamento mais curto – 6 meses;
- Pacientes mais pesados ou com obesidade mais crônica: um tratamento mais longo é interessante;
- Pacientes que moram longe ou que têm maior dificuldade para retornar para reavaliações: um balão com menor taxa de incidência de úlceras pode ser indicado;
- Para aqueles pacientes que têm um maior risco de intolerância, como, por exemplo, pacientes colocando o seu segundo balão, a possibilidade de ajuste para reduzir o balão é importante.
Esses são alguns exemplos de situações em que um balão pode ser mais vantajoso do que os outros. Claro que nada disso é lei, como já escrevi, são apenas sugestões. Espero que esta revisão tenha sido útil.
Você também pode contribuir nos comentários com a sua opinião e experiência! Quando usa cada tipo de balão? Concorda com as sugestões acima? Conte para nós!
Como citar este artigo
Orso IRB. Quando e para quem indicar cada tipo de balão intragástrico?. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/quando-e-para-quem-indicar-cada-tipo-de-balao-intragastrico/
Referências
- Nitin Kumar et al. The Influence of the Orbera Intragastric Balloon Filling Volumes on Weight Loss, Tolerability, and Adverse Events: a Systematic Review and Meta-Analysis. OBES SURG. DOI 10.1007/s11695-017-2636-3. 2017
- Eisa Lari , Waleed Burhamah, Ali Lari, Talal Alsaeed, Khalid Al-Yaqout, Salman Al-Sabah. Intragastric balloons – The past, present and future. Annals of Medicine and Surgery. 2021.
- Seong Ji Choi and Hyuk Soon Choi. Various Intragastric Balloons Under Clinical Investigation. Clin Endosc 2018.
- Alfredo Genco, Daniela Dellepiane, Giovanni Baglio et al. Adjustable Intragastric Balloon vs Non-Adjustable Intragastric Balloon: Case–Control Study on Complications, Tolerance, and Efficacy. OBES SURG. 2013.
- Maíra L SCHWAAB1, Eduardo N USUY JR2, Maurício M de ALBUQUERQUE1, Daniel Medeiros MOREIRA1,
Victor O DEROSSI1 and Renata T USUY2Assessment of weight loss after non-adjustable and adjustable intragastric balloon use. Arq Gastroenterol 2020.
- Teresa Russo a, Giovanni Aprea a, Cesare Formisano a, Simona Ruggiero a, Gennaro Quarto a, Raffaele Serra b, Guido Massa a, Luigi Sivero. BioEnterics Intragastric Balloon (BIB) versus Spatz Adjustable BalloonSystem (ABS): Our experience in the elderly. International Journal of Surgery. 2016.
- Vitor O. Brunaldi, Manoel Galvao Neto. Endoscopic techniques for weight loss and treating metabolic syndrome. Current opinion Gastroenterology. 2019.
- Diogo Moura, Joel Oliveira, Eduardo G.H. De Moura, Wanderlei Bernardo, Manuel Galvão Neto, Josemberg Campos, Violeta B. Popov, Cristopher Thompson. Effectiveness of Intragastric Balloon for Obesity: A
Systematic Review and Meta-Analysis Based on Randomized Control Trials. Surgery for Obesity and Related Diseases. 2015.
- Ricardo José Fittipaldi-Fernandez, Idiberto José Zotarelli-Filho, Cristina Fajardo Diestel, Márcia Regina Simas Torres Klein, Marcelo Falcão de Santana, João Henrique Felicio de Lima, Fernando Santos Silva Bastos, Newton Teixeira dos Santos. Randomized Prospective Clinical Study of Spatz3® Adjustable Intragastric Balloon Treatment with a Control Group: a Large-Scale Brazilian Experiment. Obesity Surgery. 2020.
- Books J. One-Year Adjustable Intragastric Balloons: Do They Offer More than Two Consecutive Nonadjustable
6-Month Balloons? Obesity Surgery. 2013.
- ManoelGalvao Neto, Lyz Bezerra Silva, EduardoGrecco, LuizGustavodeQuadros, André Teixeira, Thiago Souza, JimiScarparo, ArturA.Parad a, RicardoDib, Josemberg Campos, RenaMoon. Brazilian Intragastric Balloon Consensus Statement (BIBC): practical guidelines based on experience of over 40,000 cases. SOARD. 2017.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!