A hipertensão portal é a condição hemodinâmica associada às complicações mais graves de cirrose hepática, incluindo ascite, encefalopatia hepática e sangramento de varizes gastroesofágicas. O sangramento de varizes é uma emergência médica associada a elevadas taxas de mortalidade, alcançando níveis entre 10-20% no período de 6 semanas, apesar de todos os avanços terapêuticos atuais. A avaliação de ferramentas de diagnóstico e a realização de bons ensaios clínicos para o tratamento da hipertensão portal sempre foram temas difíceis e desafiadores e, por este motivo, desde 1986, estudiosos sobre o tema se reúnem em Baveno, Itália, para discutir diretrizes baseadas em elevado rigor científico e traçar metas de pesquisa científica.
Em abril de 2015 ocorreu o último workshop intitulado ”Estratificação de risco e individualização do cuidado da hipertensão portal ”, onde foram traçadas as diretrizes do Baveno VI. Os principais pontos de discussão foram o uso de métodos invasivos e não invasivos para o rastreio e vigilância das varizes gastroesofágicas e da hipertensão portal, o impacto do tratamento do fator etiológico na cirrose, prevenção primária da descompensação, manejo do episódio de sangramento agudo, prevenção de recorrência de hemorragia, outros eventos de descompensação hepática e doenças vasculares do fígado.
A primeira modificação proposta neste novo consenso tratou sobre a introdução do termo “doença hepática crônica avançada compensada”(cACLD). Acredita-se que, após introdução de novos métodos não invasivos de avaliação de fibrose hepática, como a elastografia transitória (TE), seja possível a identificação da doença hepática avançada em fases mais precoces e assintomáticas (1b; A). A proposta do termo doença hepática crônica avançada compensada foi proposto por acreditar que refletiria de forma mais abrangente o espectro dinâmico do processo de evolução entre a fibrose avançada e cirrose (5;D).
Segundo diretrizes do Baveno VI, a elastografia hepática transitória seria suficiente para suspeitar de cACLD, desde que em pacientes assintomáticos e com etiologia da doença hepática conhecida. Definiu-se como pontos de corte para validação da TE:
- <10 Kpa na ausência de outros sinais clínicos, afasta-se cACLD;
- entre 10-15 Kpa são necessários outros testes confirmatórios e,
- TE >15 Kpa são altamente sugestivos de doença hepática crônica (1b;A).
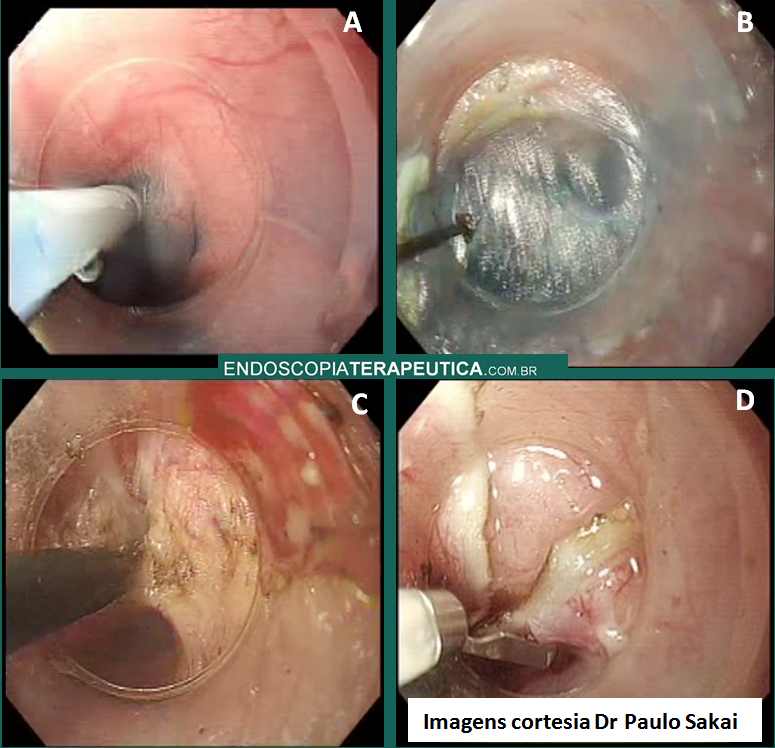
Foi recomendado, a fim de aumentar a confiabilidade do método, realização sempre de duas medidas da TE, em dias diferentes e em jejum, a despeito de não ser recomendação consensual para este procedimento. Os métodos invasivos deverão ser aplicados apenas quando o diagnóstico da doença hepática crônica for duvidoso ou em caso de necessidade de testes confirmatórios, sendo eles: endoscopia digestiva alta com pesquisa de varizes (1b;A), biópsia hepática (1a;A), quantificação de colágeno por histologia(2b;B) e medida do gradiente de pressão da veia hepática (GPVH)> 5mmHg (1b;A).
Define-se por hipertensão portal clinicamente significante (HPCS) níveis de GPVH superiores a 10mmHg, ponto de corte também para formação de varizes esofágicas. Mais uma vez, o método não invasivo ganhou espaço, podendo, a elastografia hepática, ser utilizada para inferir HPCS em pacientes com hepatites crônicas virais, identificando o grupo sob risco de apresentar varizes na endoscopia digestiva alta (EDA)(2b;B). Em pacientes com cACLD e resistência hepática ≤ 20 KPa associada a níveis de plaquetas ≥ 150.000, perfil com baixo risco de apresentar varizes com indicação de tratamento endoscópico, pode-se evitar screening endoscópico de varizes com segurança (1b;A). Estes pacientes precisam ser seguidos anualmente com elastografia transitória e contagem de plaquetas (5;D), caso a resistência hepática aumente ou contagem de plaquetas reduza, os pacientes deverão ser submetidos a endoscopia digestiva alta (5;D).
Entre os cenários apresentados no Baveno VI, destacou-se o impacto do tratamento etiológico da cirrose hepática, na intenção de prevenir hipertensão portal clinicamente significante, reduzindo níveis de pressão do sistema porta, e prevenindo descompensação da doença hepática (1b;A). Cofatores associados a progressão da doença hepática também foram pontuados, sendo encorajada abstinência alcoólica em todos os pacientes independente da etiologia (2b;B). O Baveno VI destacou o papel do estado nutricional dos indivíduos como fator prognóstico associado a doença hepática, chamando atenção para obesidade como marcador de agravamento de doença hepática avançada de qualquer etiologia. Recomendou-se, assim, mudança de estilo de vida baseada em dieta e exercício e, especialmente, redução de peso com objetivo de levar ao decréscimo do GPVH em pacientes obesos com cirrose hepática(2b;B). A desnutrição, por sua vez, tem impacto na sobrevida e desenvolvimento de ascite, encefalopatia e infecção de pacientes cirróticos (1b;A), sendo sugerido como pauta de novos estudos, a avaliação do impacto de tratamentos para melhorar o status nutricional no prognóstico e mortalidade de pacientes com cirrose hepática avançada(5;D).
Os betabloqueadores não seletivos (nadolol ou propranolol) ou tratamento endoscópico (ligadura elástica) permaneceram como recomendação de profilaxia primária de sangramento digestivo proveniente de varizes esofágicas de médio e grosso calibres (1a;B), sendo a escolha do método baseada na expertise do local (5;D). A novidade foi a introdução do carvedilol como opção de tratamento de primeira linha para profilaxia primária, considerado opção mais eficaz para este fim, a despeito da carência de mais estudos comparativos (1b;A).
No manejo do sangramento digestivo agudo varicoso, no momento pré-endoscopia, foi consenso uso de eritromicina intravenosa (250mg IV 30-120min antes da EDA), com objetivo de aumentar a visibilidade durante a endoscopia e reduzir a necessidade da realização de segundo exame para conclusão diagnóstica/terapêutica(1b;A). Mantiveram-se as orientações relacionadas às drogas vasoativas(1B), optando-se entre terlipressina, octreoctide ou somatostatina com igual eficácia para controle do sangramento agudo quando associado ao tratamento endoscópico. O Baveno VI orienta monitorar hiponatremia em pacientes em uso de terlipressina, especialmente aqueles com função hepática preservada.
Antibioticoprofilaxia deve ser iniciada na admissão hospitalar(1a;A), sendo optado pela ceftriaxona 1g/24h intravenosa em pacientes com doença hepática avançada (1b;A), em hospitais com elevada prevalência de resistência a quinolonas ou em uso de profilaxia prévia (5;D). As características do paciente e do local devem ser avaliadas para determinar a melhor profilaxia (5;D). Atualmente, rediscute-se a indicação de profilaxia de infecções em pacientes Child A, pois admite-se baixo risco de infecção neste grupo; porém, estudos ainda necessitam ser realizados (2b;B). O Baveno VI embasou a recomendação do tratamento profilático de encefalopatia hepática em pacientes com sangramento digestivo varicoso, sendo sugerido uso de rifaximina e lactulose para este fim (1b;A), baseando-se, também, em diretrizes da European Association for the Study of the Liver.
No manejo do sangramento agudo, a sequencia que inclui estabilização hemodinâmica e realização de endoscopia nas primeiras 12h da apresentação não foi alterada:
- Ligadura elástica (LE) permanece como a melhor opção de terapêutica endoscópica para varizes esofágicas (1b;A)
- LE ou adesivo tissular são recomendados para hemorragia digestiva por variz gástrica GOV-1 (5;D).
- Em caso de varizes gástricas GOV-2 (5;D) e variz gástrica isolada (IGV) (1b;A), a primeira escolha é o adesivo tissular N-butil-cianoacrilato.
Neste item, merece destaque a recomendação de prevenção do ressangramento por VG, com injeção adicional de cola após 2 a 4 semanas após o episódio inicial, podendo, alternativamente, ser introduzido BBNS ou ambos tratamentos combinados ou TIPS (5;D). Em pacientes Child C<14 ou Child B com sangramento ativo por VE, GOV1 e GOV2, considerados com alto risco para falha de tratamento ao tratamento farmacológico e endoscópico inicial, foi reforçada indicação do TIPS precoce nas primeiras 72h, idealmente nas primeiras 24h, mas os critérios de alto risco ainda precisam ser refinados.
Em sangramentos agudos refratários, o stent metálico esofágico coberto autoexpansível foi apontado como opção mais segura e eficaz (4;C). Já o balão tamponado não foi contraindicado, entretanto, as chances de complicações foram destacadas, além da necessidade de monitoramento intensivo (5;D). Técnicas como hemospray, BRTO (balloon-occluded retrograde transvenous obliteration) e coil foram discutidos, contudo ainda não haviam evidências que sustentassem recomendações neste consenso.
No tocante a profilaxia secundária de ressangramento, a primeira linha de tratamento permaneceu a combinação de terapêutica endoscópica e medicamentosa(1a;A). Ratificou-se que BBNS podem ser utilizados como monoterapia em pacientes com cirrose inaptos ao tratamento com LE (1a;A), contudo LE não deve ser considerada como monoterapia, a menos em caso de intolerância ou contraindicações para os BBNS (1a;A). O carvedilol não foi recomendado para profilaxia secundária de sangramento varicoso (5;D), por falta de evidências científicas. O TIPS é o tratamento de escolha para pacientes que falharam ao esquema terapêutico de primeira linha (LE+BBNS) (2b;B).
Baseado em ressalvas dos últimos guidelines internacionais, os quais demonstraram aumento de mortalidade associado ao uso de betabloqueadores em pacientes cirróticos com doença avançada e descompensada, ponderou-se a recomendação de uso. A indicação de BBNS para profilaxia primária de sangramento digestivo varicoso em caso de ascite refratária e/ou diagnóstico de peritonite bacteriana deve ser feita com prudência, sendo a medicação descontinuada na presença de hipotensão (2b;B). Porém, uma vez interrompido o uso de BBNS, a ligadura elástica deve ser o método de escolha.
Em pacientes com ascite refratária e indicação de profilaxia secundária de sangramento varicoso, orienta-se uso de BBNS de forma cautelosa, monitorando dados laboratoriais e hemodinâmicos (4;C). Os BBNS devem ter a dose reduzida ou ser descontinuados caso os pacientes desenvolvam hipotensão sistólica (PAS<90mmHg), insuficiência renal aguda ou hiponatremia (Na<130mEq/L) (5;D). Entretanto, as consequências da descontinuação do BBNS na profilaxia secundaria são desconhecidas. Em caso de intolerância persistente aos BBNS, o TIPS deverá ser considerado. Ao se identificar um evento claramente precipitante da descompensação hepática, p. ex. peritonite bacteriana espontânea, após resolução desta condição, o BBNS poderá ser reiniciado em doses tituladas (5; D). Salientou-se a necessidade de novos estudos avaliando a segurança de BBNS no contexto da doença avançada descompensada.
O Baveno VI revisou o tópico sobre doenças vasculares do fígado na síndrome de hipertensão portal de etiologia cirrótica e não cirrótica, as orientações sobre anticoagulação e uso de drogas antiplaquetárias. Chama atenção neste item os dados que corroboram com uso de heparina de baixo peso molecular e antagonistas da vitamina K, medicamentos largamente aceitos e utilizados em tromboses primárias do sistema venoso portal (1b;A) e em pacientes com cACLD. Além disso, devido número limitado de dados na literatura, nenhuma indicação pôde ser feita para o uso de novos anticoagulantes orais e drogas antiplaquetárias para pacientes com doença crônica avançada do fígado(5;A). Descreveu-se, também, a definição de critérios diagnósticos para hipertensão portal idiopática ou fibrose portal não-cirrótica e orientações de manejo, incluindo doppler a cada 6 meses (5;D) e início de anticoagulação em caso de trombose de veia porta (5;D).
O consenso foi publicado no Journal of Hepatology e pode ser acessado gratuitamente aqui.
Referência:
de Franchis R; Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52. doi: 10.1016/j.jhep.2015.05.022
http://www.journal-of-hepatology.eu/article/S0168-8278(15)00349-9/fulltext