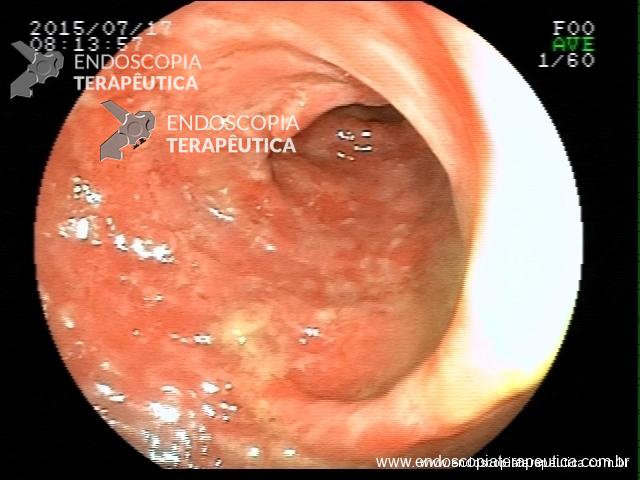
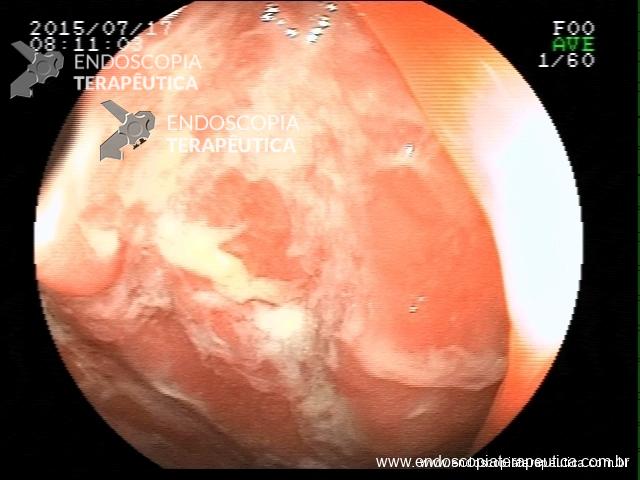
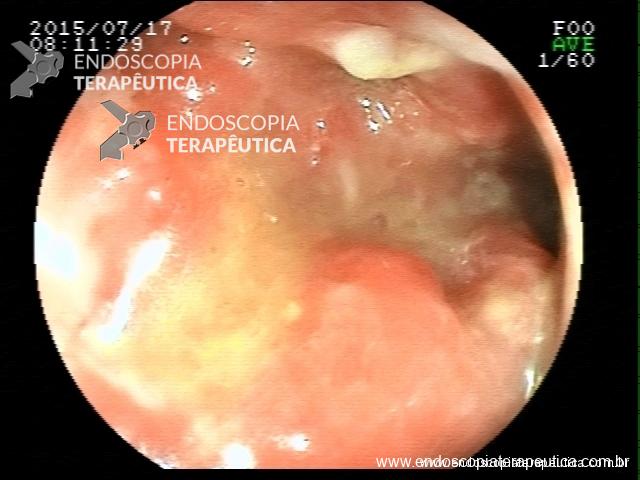
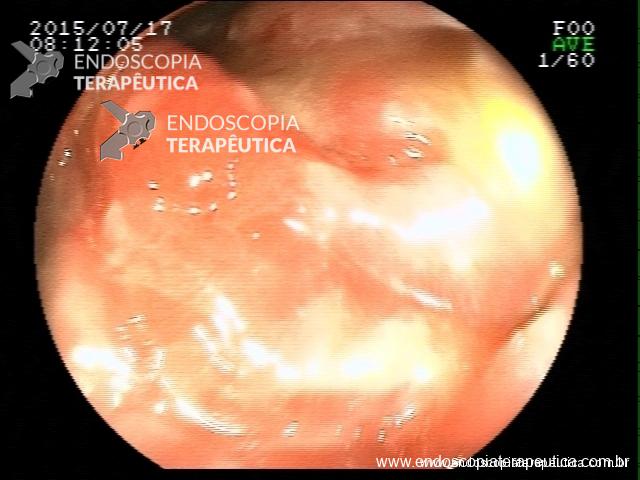
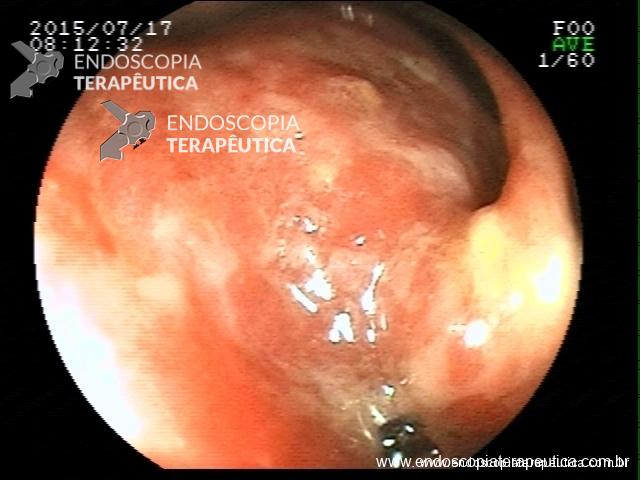
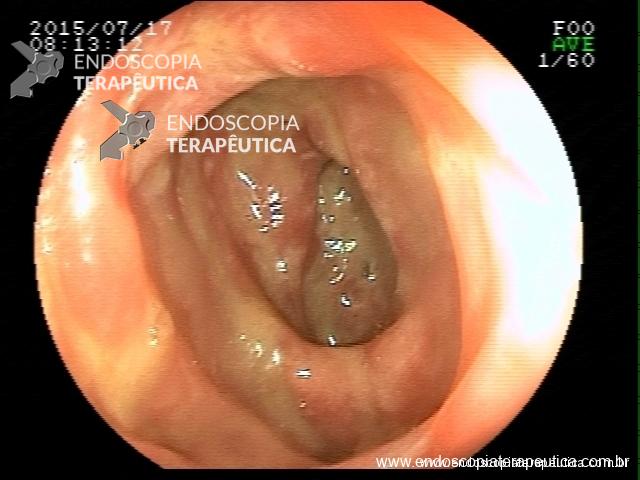
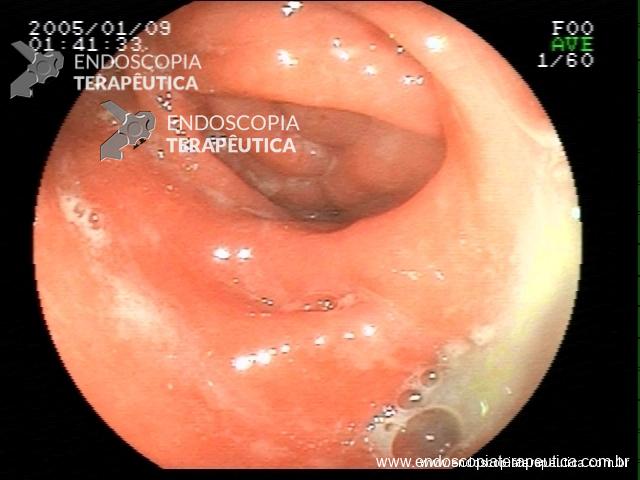
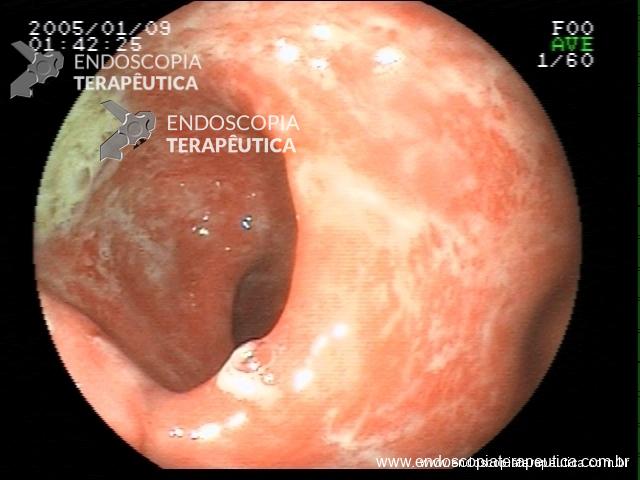
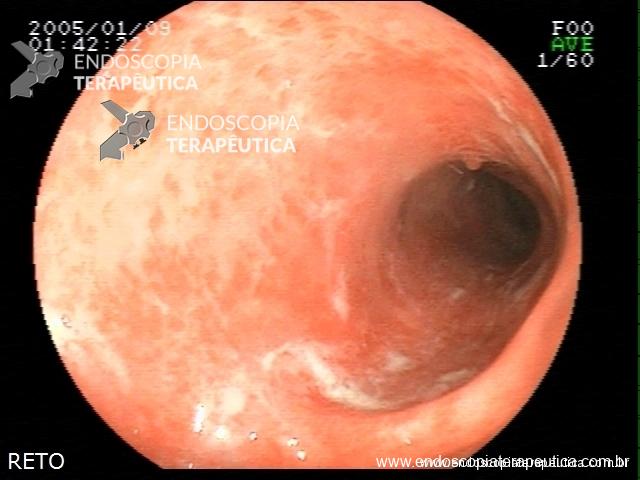
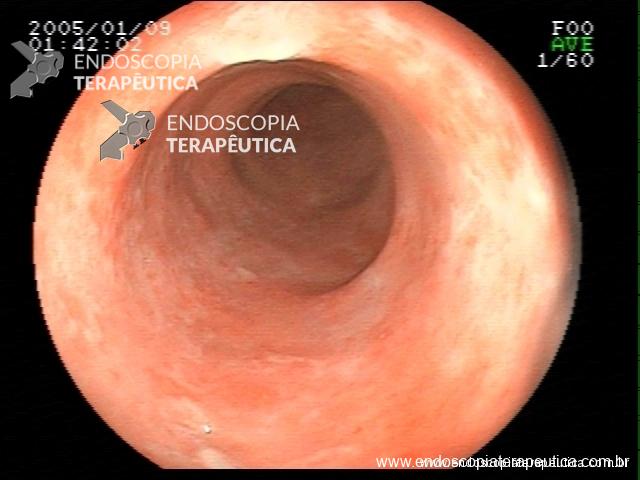
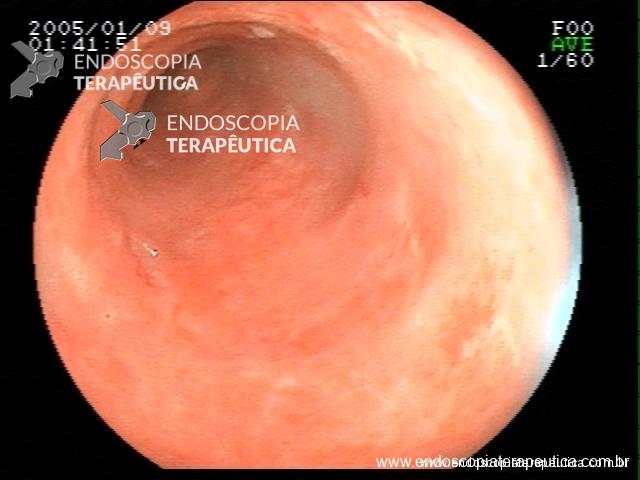
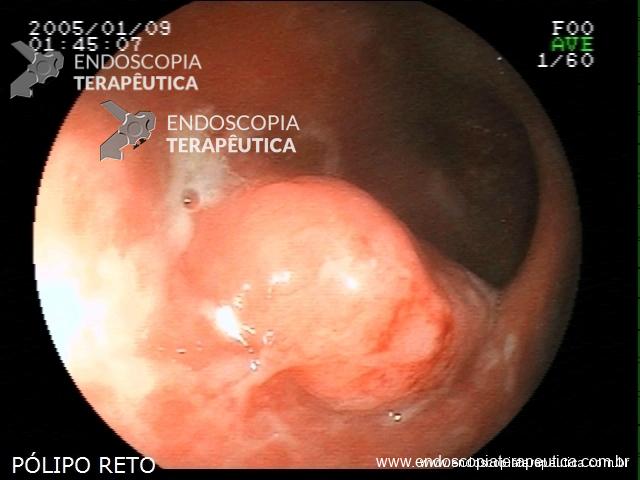
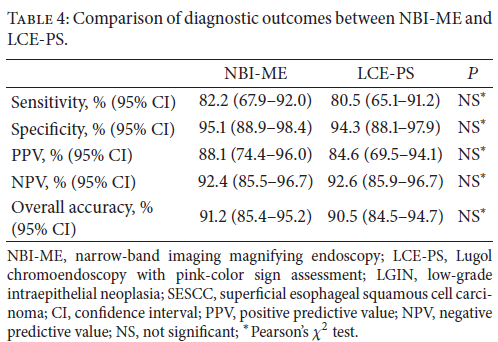
Contamos com o auxílio da cromoendoscopia para melhor visualização de estruturas, definir limite de lesões, auxiliar a visualizar lesões precoces entre outras. O uso de substancias para este fim já são clássicas e bem difundidas em nosso meio. Porém, para serem realizadas, necessitam de materiais específicos para sua aplicação, não são disponíveis em todos os centros, e podem levar a danos no aparelho utilizado.
Visando manter os benefícios da cromoendoscopia, porém, sem os aspectos negativos, as grandes empresas fabricantes de aparelhos de endoscopia, desenvolveram sistemas de cromoscopia, baseados em alterações computadorizadas das imagens geradas pelo endoscópio, ou através de filtros adicionados as fontes de luz dos mesmos, tentando assim reproduzir os benefícios da cromoendoscopia habitual.
Três são os métodos chamados de cromoscopia virtual computadorizada (ou óptica): o NBI, FICE e o i-SCAN
- NBI (Narrow Band Imaging – Olympus)
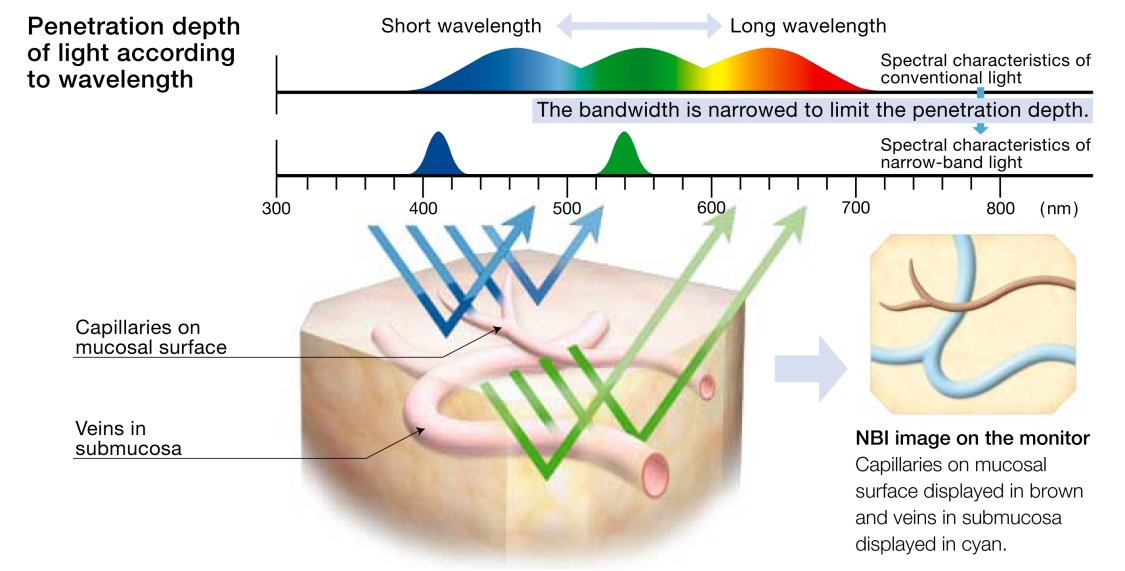
A luz branca natural visível, produzida pelo endoscópio tem um comprimento de onda entre 300 a 700nm, estando contido neste espectro, todas as cores, que juntas, compõe a luz branca. Quanto maior a onda, mais ela penetra nas estruturas da mucosa, formando assim a imagem do aparelho.
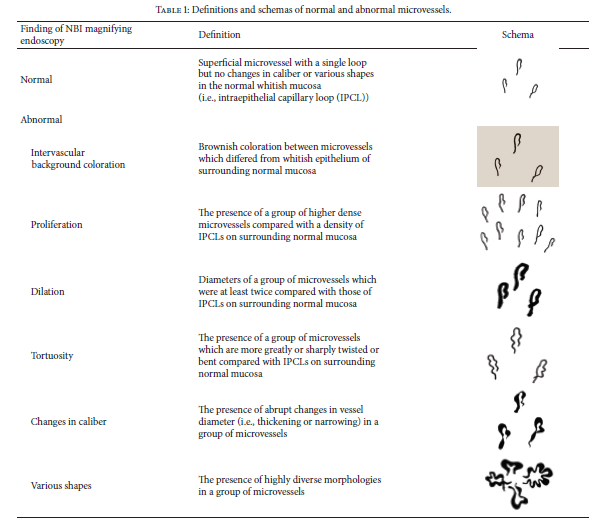
O NBI baseia-se no uso de um filtro, junto a fonte de luz branca xenom do aparelho, que permite apenas a passagem de espectro da ondas, com 415 e 540 nm . Estes dois espectros da luz, coincidem com a absorção de luz da hemoglobina, mais superficial no feixe de 415nm , e mais profunda no feixe de 540nm . Na prática, a imagem formada, realça em um tom acinzentado os vasos mais superficiais, e em um tom mais azul-esverdeado, os vasos mais profundos, em contraste com as áreas circunvizinhas, avasculares, mais escurecidas.
Para utilizar o recurso de NBI, basta apertar um botão na manopla do aparelho, que aciona e desliga o sistema de filtros da fonte.
Como serve para caracterizar os vasos da mucosa e submucosa, o NBI tem seu uso em lesões que alteram a vasculatura habitual, sendo seu uso acoplado a magnificação , importante em determinar áreas de displasia em regiões de Barret, caracterizar casos de refluxo com poucas alterações mucosas, avaliar o potencial malignos de pólipos e lesões de crescimento lateral entre outras.
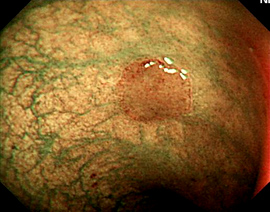
- FICE ( Flexibe Spectral Imaging Color Enhancement – Fujinon)
A Fujinon, trabalha com uma metodologia digital de tratamento da imagem. Após a imagem com luz branca ser obtida pelo aparelho, a processadora de imagem realizada cálculos matemáticos na mesma, conseguindo então separar os comprimentos de onda adquiridos, reforçando aquele de interesse (alterando sua cor).
Como a imagem é tratada, e não por meio de filtros de luz, pode-se obter vários tipos de recomposição da mesma, gerando contraste maior entre as estruturas visualizadas, facilitando assim a sua interpretação, ou alterando a imagem de forma a melhor visualização de vasos mucosos. Também é acionado por um simples comando na manopla do aparelho, dispondo de vários “presets”, cada um com uma melhor aplicabilidade (melhor visualização de criptas em pólipos, alterações vasculares ou lesões displásicas em áreas de Barret).
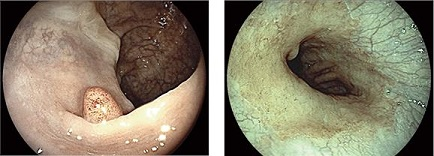
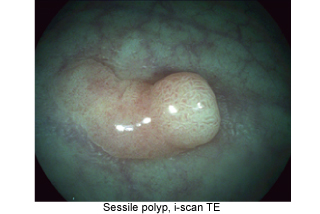
Como metodologia de tratamento de imagem por software, o i-scan é muito semelhante ao sistema FICE, também gerando imagens trabalhadas, onde é possível melhor avaliação de superfícies mucosas, limites e alterações capilares, através de imagens aprimoradas.
Possui três tipos (i-scan 1,2 e 3), sendo o subtipo1 mais utilizado para aumentar o constraste entre as estruturas da mucosa (melhor definição de margens por exemplo), o subtipo 2, além do melhor contraste, também gera maior individulização de vasos mucosos e o subtipo3, gera melhor avaliação de estruturas um pouco mais distantes (não e necessária muita aproximação do local a ser estudado, maior campo pode ser explorado).
Muitos estudos tem sido publicados sobre tais tecnologias, principalmente, com o uso do NBI, porém deve ser ressaltado, que o uso de tais metodologias ainda não substituem o uso da cromoendoscopia tradicional, e principalmente o treinamento exaustivo do endoscopista e um exame bem realizado.
Em especial, em nosso país, os aparelhos com esta tecnologia, tem um custo elevado, o seu uso, assim como o uso de corantes tradicionais, não são pagos por alguns convênios, o que dificulta seu uso indiscriminado.
Pessoalmente, uso aparelho equipado com FICE, que uso de rotina em avaliação de pacientes com Barret e em acompanhamento de doenças inflamatórias de longa data (screening para tumores). Ressalto, que além da tecnologia já descrita acima, estes aparelhos por serem mais modernos, em geral possuem melhor imagem (em High Definition), fator já associado a um exame de maior qualidade (detecção de lesões).
Bibliografia (também para visualizar ótimas imagens) :
1 : Subramanian V, Ragunath K. Advanced endoscopic imaging: a review of commercially available technologies. Clin Gastroenterol Hepatol. 2014 Mar;12(3):368-76.e1. doi: 10.1016/j.cgh.2013.06.015
2 : ASGE Technology Committee, Manfredi MA, Abu Dayyeh BK, Bhat YM, Chauhan SS, Gottlieb KT, Hwang JH, Komanduri S, Konda V, Lo SK, Maple JT, Murad FM, Siddiqui UD, Wallace MB, Banerjee S. Electronic chromoendoscopy. Gastrointest Endosc. 2015 Feb;81(2):249-61. doi: 10.1016/j.gie.2014.06.020
Veja também :
Como realizar cromoscopia no rastreamento de displasia em casos de doença inflamatória intestinal?
CASO CLÍNICO – Passo a passo : Importância da endoscopia do diagnóstico ao tratamento da neoplasia precoce de esôfago.
Artigo Comentado – Cromoendoscopia com ácido acético na vigilância do esôfago de Barrett é superior ao protocolo padronizado de biópsias aleatórias : resultados obtidos através de um grande estudo de coorte