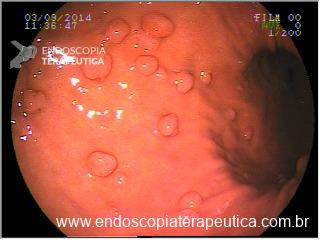
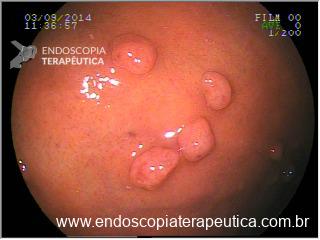
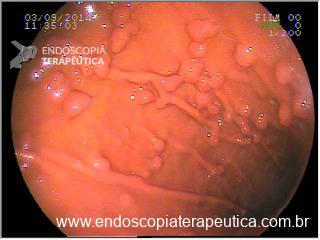
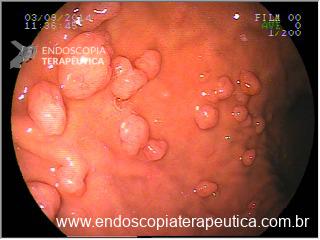
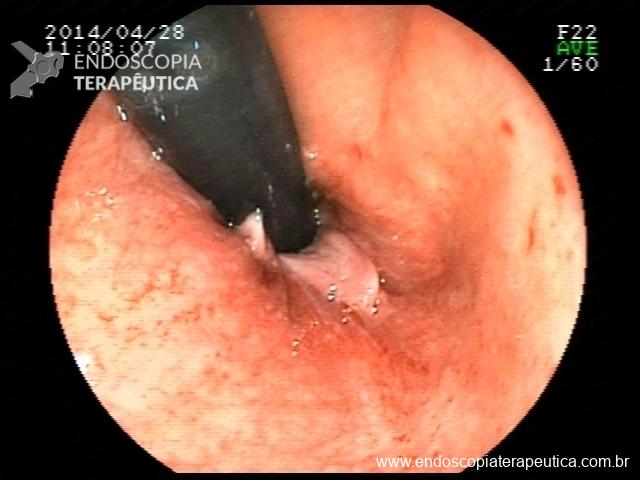
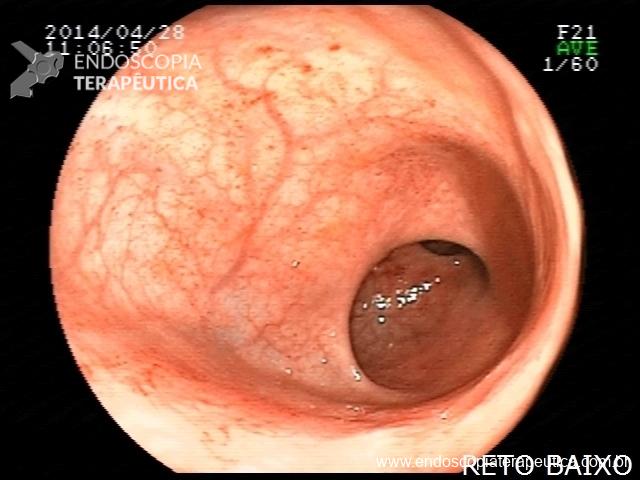
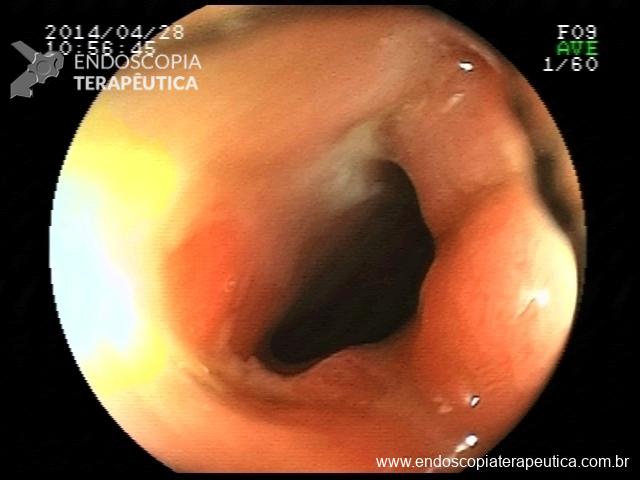
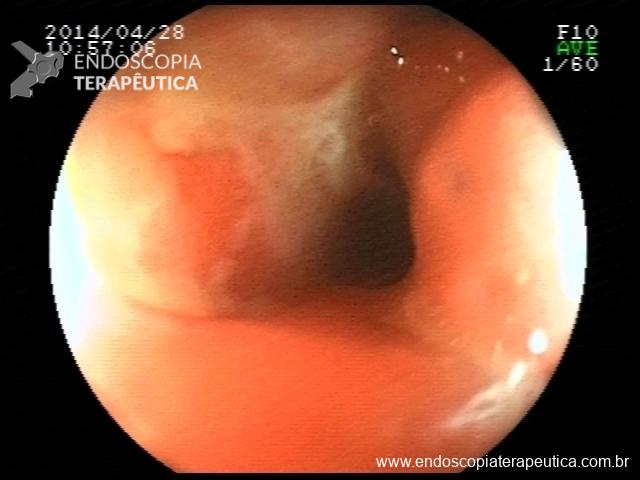
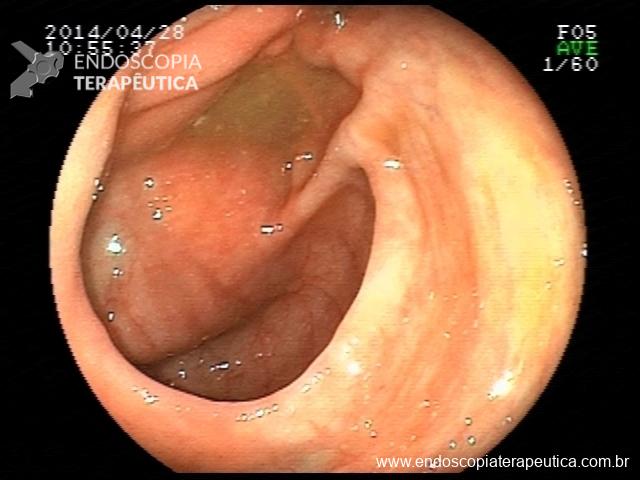
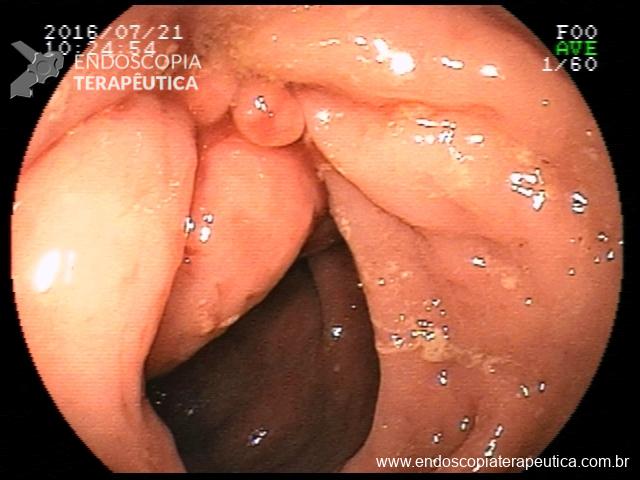
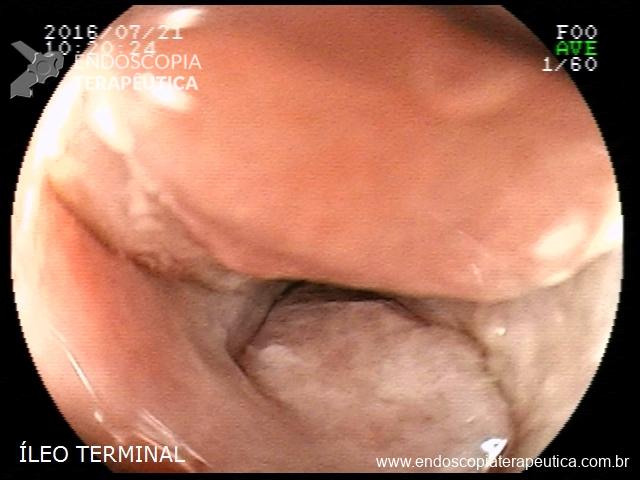
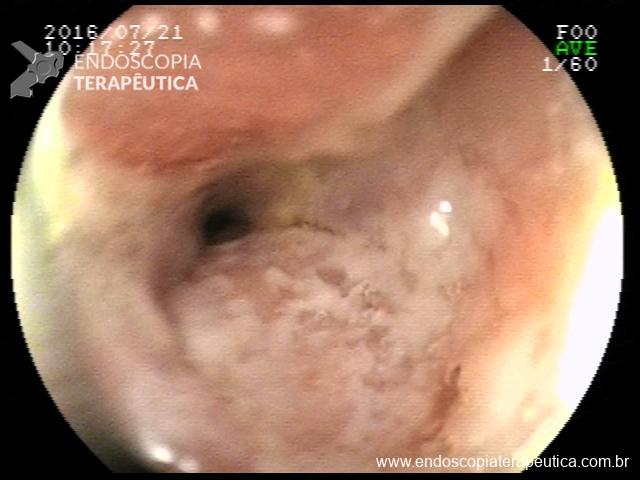
Há uma idade limite para o rastreamento de câncer de cólon?
Atualmente, várias entidades médicas discutem em qual idade começar o screening colonoscópico para o câncer de cólon e suas lesões precursoras em pacientes sem risco de câncer ou síndromes genéticas. Para esses casos, aparentemente, a idade ideal de início do rastreio deva ser aos 45 anos, 5 anos antes do que se orientava anteriormente.
Mas quando parar? Existe uma idade limite, na qual não se orienta mais realizar o screening colonoscópico?
Nos guidelines de recomendações de screening da ASGE, conjunta com a U.S. Multy-Society task Force on Colorectal Cancer, diz que o screening é potencialmente benéfico para pacientes até cerca de 86 anos, que nunca fizeram colonoscopia antes, porém levando em conta a expectativa de vida e comorbidades. Caso o paciente possua exames de rastreios negativos nos últimos anos, em especial colonoscopias, o rastreio pode ser encerrado aos 75 anos. Uma variação dessa recomendação diz que, se a expectativa de vida (baseada nas comorbidades e estado atual de saúde do paciente) for de menos de dez anos , o screening pode ser encerrado.
Em seu site, a Clínica Mayo orienta que o screening, após os 75 anos, deve ser indicado a paciente com risco de câncer, como antecedente familiar, diagnóstico anterior de câncer ou colonoscopias prévias com pólipos adenomatosos.
O Center for Diseases Control and Prevention, em seu site para pacientes, orienta screening dos 45 aos 75 anos, porém não especifica se após essa idade há situações de indicação.
As recomendações do site de revisões UpToDate sobre screening de câncer colorretal também seguem as orientações da ASGE, discutindo, porém, que o momento de parada deve ser individualizada e envolve uma decisão conjunta do médico e paciente, levando em conta as comorbidades do paciente, sua expectativa de vida, resultados de exames anteriores e também suas expectativas com relação ao exame e sua vontade de realizá-lo.
Assim, orienta-se o screening até os 75 anos, se houver expectativa de vida maior de 10 anos, ou em até mais velhos, caso nunca tenham realizado uma colonoscopia. Entre os 76 e 85 anos, a decisão deve levar em conta a vontade do paciente, seu estado de saúde e resultados de testes anteriores.
Apesar das recomendações, nenhuma das anteriores indica uma idade limite. Apenas a American Cancer Society realmente coloca a idade de 85 anos para término do screening, sem exceções.
O American College of Gastroenterology não possui orientações para o término do rastreio, assim como o site do Inca (Instituto Nacional de Câncer) no Brasil.
Lembrando que o screening pode ser feito também com tomografia computadorizada, teste de sangue oculto, cápsula endoscópica e outros. Logicamente, a colonoscopia é a melhor opção, porém, mais invasiva. Assim, podemos, mesmo em pacientes mais idosos e debilitados, ainda oferecer algum exame de rastreio, já que, nessa idade, a cancerofobia é um importante fator limitador de qualidade de vida.
Em minha prática clínica, com relação à colonoscopia, a idade não é o limite, mas sim as comorbidades e a avaliação de risco cardiológico, e, principalmente, a vontade do paciente de ser submetido a um exame, seja ele qual for.
Também, nunca deixei de realizar exame solicitado por outro colega em pacientes idosos, desde que a avaliação de risco cardiológico e a situação clínica do paciente permitam o exame.
E você, como procede em sua clínica?
Como citar esse artigo:
Sauniti G. Há uma idade limite para o rastreamento de câncer de cólon? Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/aerossois-e-transmissibilidade-na-pratica-endoscopica-a-duvida-que-paira-no-ar/
Bibliografia
- ASGE GUIDELINES: Colorectal cancer screening: Recommendations for physicians and patients from the U.S. Multi-Society Task Force on Colorectal Cancer.
- UpToDate 2020.
- CDC WEBSITE.
- American Cancer Society Guideline for Colorectal Cancer Screening.
- Appointments at Mayo Clinic: Colon Cancer screening: At what age can you stop?
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais.