QUANTAS ENDOSCOPIAS DIGESTIVAS ALTAS QUALIFICADAS PODEM SER REALIZADAS EM 6h?
Você já parou para pensar nesta pergunta? No quanto ela é relevante para nossa especialidade, justamente por ser a Endoscopia Digestiva Alta (EDA) o principal e mais comum procedimento realizado dentro da Endoscopia Digestiva?
Tipos de pagamento
Pagamento por serviço executado (ou “Fee-for-Service”)
O modelo de remuneração preponderante no Brasil ainda é o baseado no pagamento por serviço executado (ou “Fee-for-Service”), que foi criado nos Estados Unidos na década de 1930. A crítica a este conceito é o estímulo ao volume e à complexidade dos serviços, por vezes desconsiderando a qualidade, que deveria ser o foco de todo hospital, e incentivando práticas inconsequentes de custo.
Pagamento baseado em valor (ou “value-based payment”)
Em todo o mundo há uma nítida transição deste modelo, em virtude das críticas mencionadas, para um modelo de pagamento baseado em valor (ou “value-based payment”). Nesta modalidade muda a ênfase do atendimento, passando do simples reembolso por exames e serviços solicitados para recompensar médicos por fornecer um cuidado coordenado e adequado, que mantém os pacientes saudáveis. Os programas de assistência com base em valor são projetados para reduzir os custos da assistência médica e melhorar o atendimento global ao paciente, alcançando uma melhor relação custo-benefício e otimizando resultados.
Verticalização
Paralelamente aos dois modelos descritos, surge o fenômeno da “verticalização” do mercado, onde grupos e corporações estabelecem trabalhos por turnos, costumeiramente de 6h, mas que também pode ser de 12h, quase como um “plantão”. Neste contexto é acordado com o Endoscopista realizar uma quantidade (habitualmente grande) de exames por um valor fixo, pré-determinado. É exatamente neste cenário que cabe o questionamento do limite de EDA´s que podem ser agendadas por turno de trabalho, mantendo uma produtividade efetiva, todavia sem causar qualquer prejuízo a qualidade do exame.
Primeiramente se faz necessário tentar conceituar o que seria uma EDA qualificada: “procedimento com indicação precisa, onde diagnósticos corretos/relevantes são reconhecidos ou excluídos, as terapias realizadas são apropriadas e todas as etapas que minimizam os riscos foram cumpridas”. No entanto, para sabermos se uma EDA realizada foi efetivamente qualificada, é mandatório comparar as performances individuais, ou de um serviço, com um benchmark ideal. Eis que surge o primeiro desafio: qual seria este benchmarkideal?!
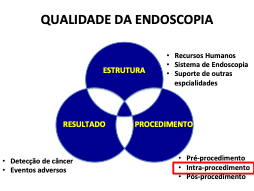
Para Colonoscopias os parâmetros já estão relativamente bem estabelecidos, sendo os principais: taxa de intubação cecal, taxa de detecção de adenoma (ADR) e tempo de retirada em exames de screening negativos. Porém para EDA os critérios relevantes não estão devidamente pacificados. Nós sabemos que a Qualidade na Endoscopia orbita em torno de um tripé constituído por três grandes variáveis: Estrutura x Resultado x Procedimento
Qualidade da endoscopia
Concernente a estrutura, destacamos a importância de Endoscopistas com treinamento apropriado e certificação da proficiência através dos meios competentes (no Brasil, certificado de conclusão de residência médica ou aprovação no título de especialista em endoscopia – AMB/SOBED); aparelhos com imagens em alta definição e cromoscopia virtual; reprocessamento de preferência automatizado, que cumpra todas as etapas e atenda a todos os pré-requisitos legais/sanitários; além de suporte de outras especialidades correlatas para condução adequada dos casos, como Patologia e Radiologia.
Os resultados devem ser regularmente aferidos e confrontados com os dados da literatura para parametrização, como as taxas de detecção de câncer e notificação de eventos adversos, quer sejam relacionados à sedação ou ao procedimento endoscópico propriamente dito.
Quanto ao procedimento, convém separar a etapa que antecede o mesmo (confirmação de tempo de jejum, preenchimento de termos de consentimento, coleta apropriada de história clínica/uso de medicações, etc), da etapa durante (documentação fotográfica, tempo de inspeção, etc) e da etapa após (critérios de alta, índice de satisfação do paciente, etc).
Para responder a pergunta original deste Post, que se refere a uma métrica temporal, vamos focar no tempo de inspeção propriamente dito da EDA, até porque esta é a principal variável do intraprocedimento e uma das maiores balizadoras da qualidade, além de buscar a melhor evidência científica disponível para tentar estabelecer o número de exames qualificados que podem ser realizados em 6h.
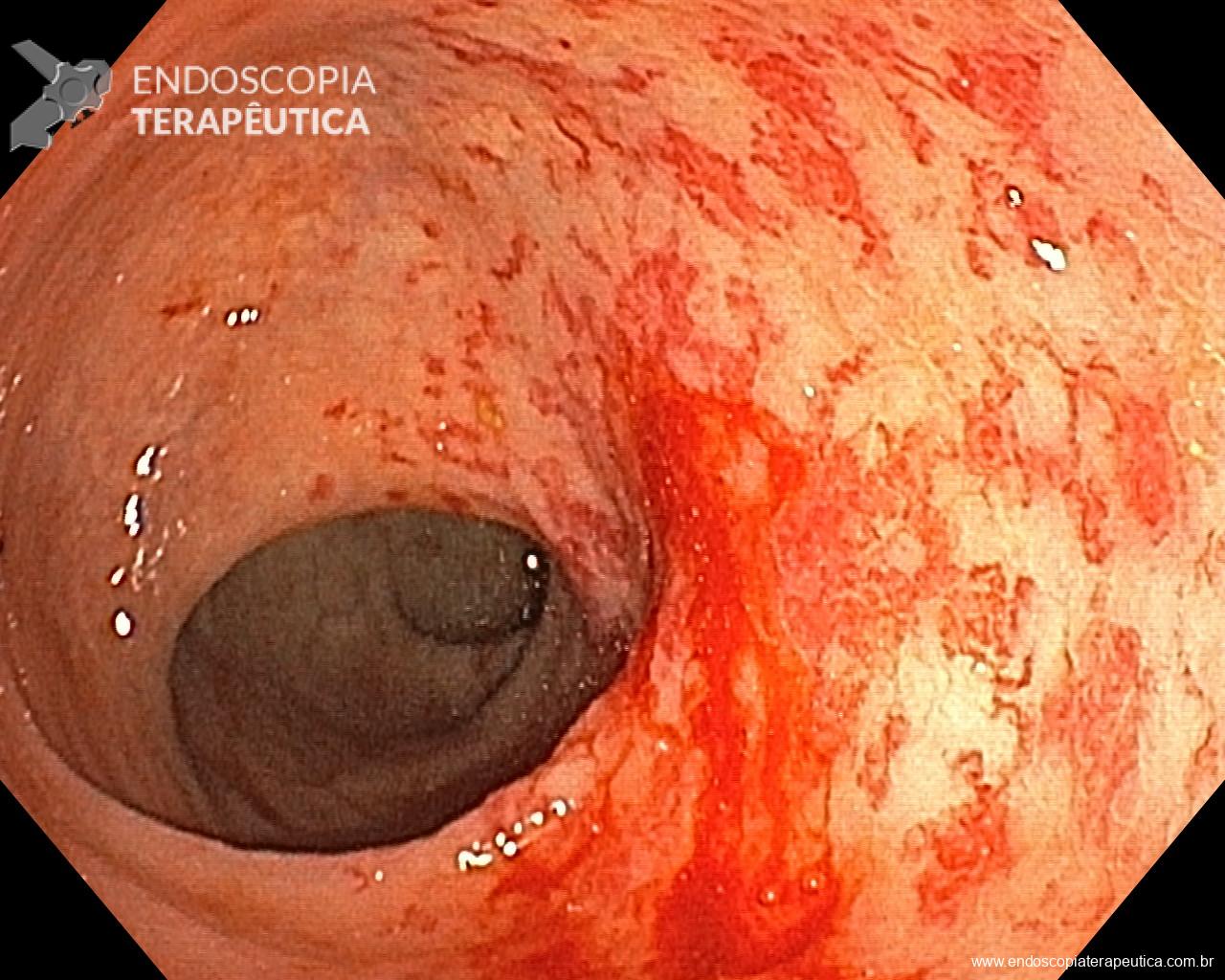
Antes, porém, para contextualizar a indiscutível importância do controle de qualidade na EDA, gostaria de apresentar os resultados de uma Meta-análise publicada por Shyam Menon e Nigel Trudgillno Endoscopy Internacional Open em 2014, que se propôs a avaliar o quão comum é a perda diagnóstica do câncer do trato gastrointestinal alto (TGI) à EDA e traz números alarmantes. Foram 10 estudos, 3.787 pacientes diagnosticados com câncer do TGI alto. Como conclusão, obteve-se que 11,3% e 6,4% dos CA’s não foram identificados em endoscopias prévias realizadas até 3 anos e 1 ano antes do diagnóstico, respectivamente.
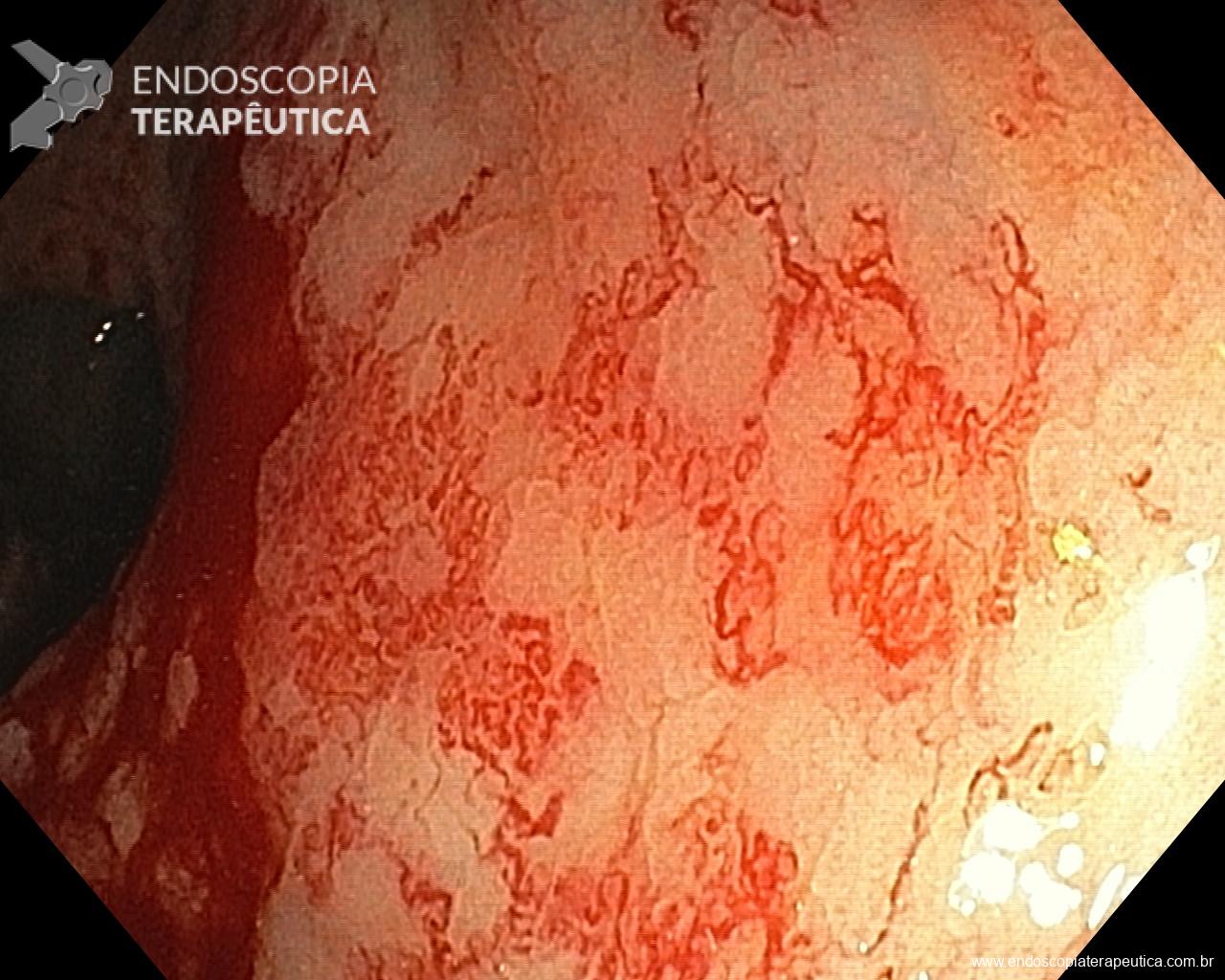
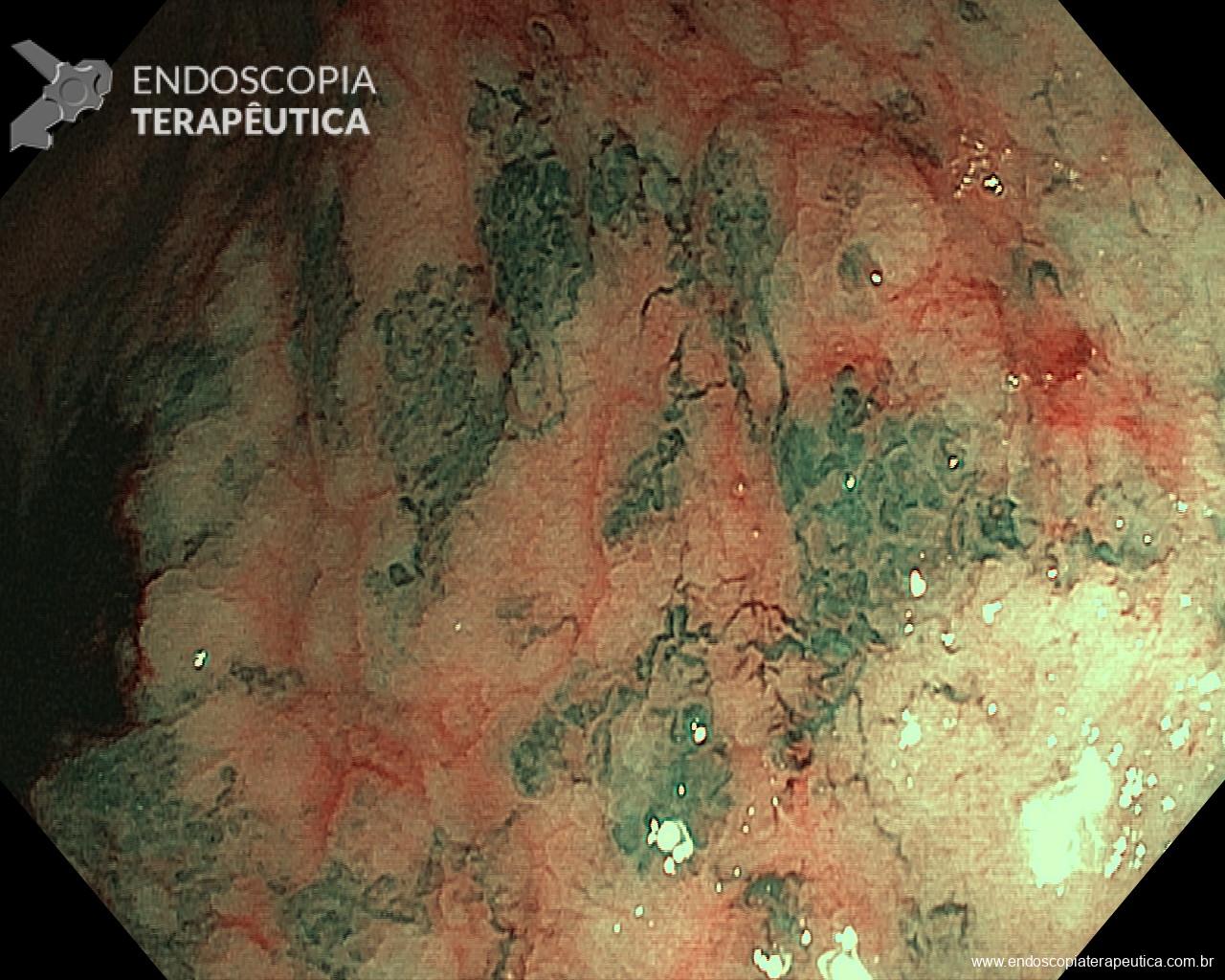
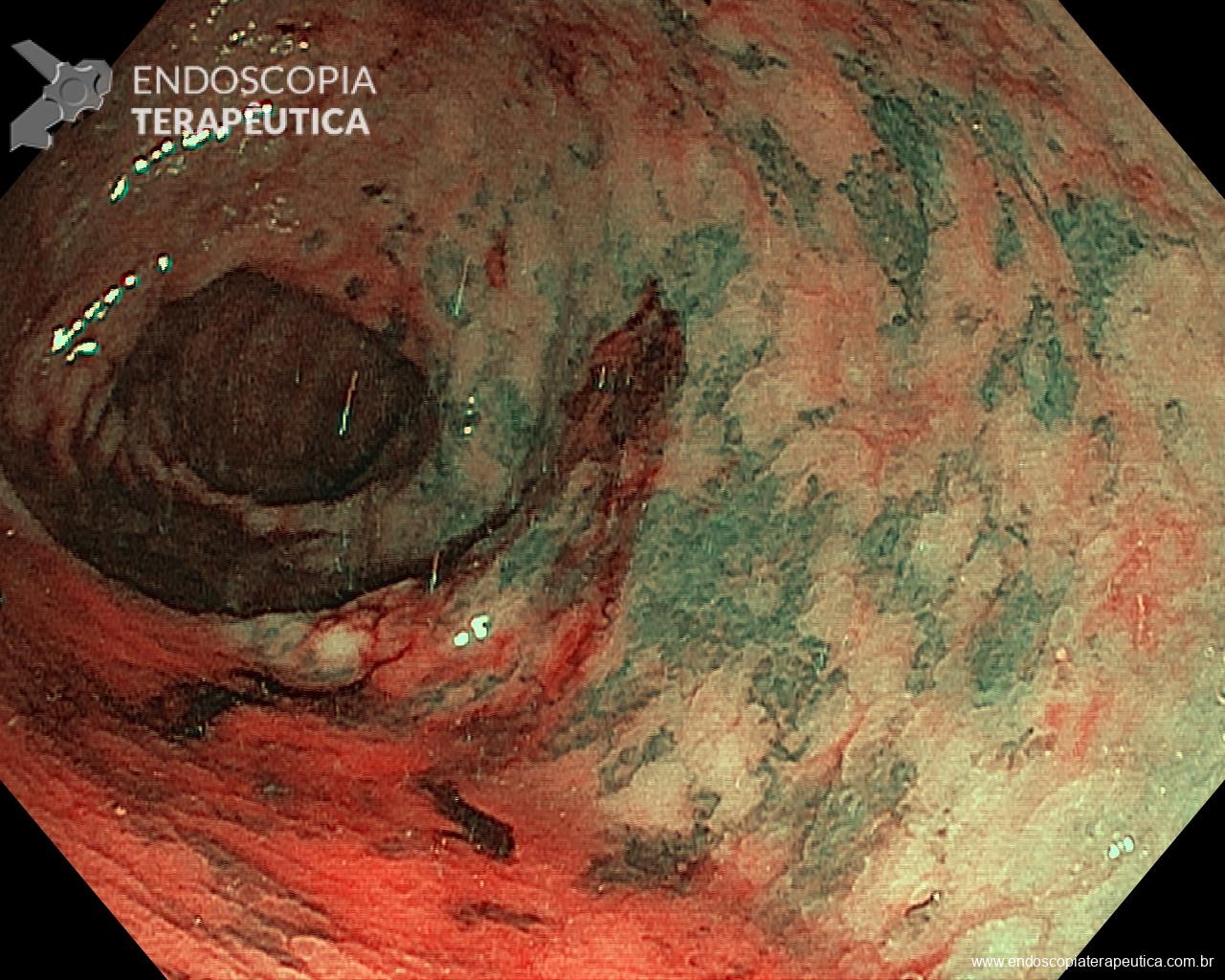
O tempo de inspeção apropriado para o exame de EDA está diretamente relacionado a uma maior detecção de câncer no TGI, um dos mais importantes resultados esperados deste procedimento. O professor Kenshi Yao numa publicação de 2013 no Annals of Gastroenterologyacerca do diagnóstico endoscópico do câncer gástrico faz uma sistematização do exame de EDA, estabelecendo 8-10min como tempo mínimo necessário de efetiva avaliação do esôfago (2min), estômago (4min) e duodeno (2min), levando em consideração a adequada limpeza, insuflação e análise minuciosa de checkpointspré-estabelecidos. Vários outros trabalhos corroboram inequivocamente esta associação, sendo na maioria deles 7min o ponto de corte da duração do exame para alcançar a significância na detecção do câncer. Fizemos uma compilação das principais publicações acerca do tema, as quais sugerimos a leitura na íntegra:
O cálculo do número máximo de EDA’s que podem ser realizadas num determinado intervalo de tempo precisa partir de algumas condições pré-concebidas:
-
EDA’s diagnósticas padrão (“standard”)– exames diagnósticos de condições de alto risco (Barrett, Atrofia gástrica, antecedente neoplasia cabeça/pescoço, etc) ou exames terapêuticos não se enquadram nesta definição
-
EDA’s realizadas em sala única –múltiplas salas para conduzir uma agenda alteram a conta
-
Número suficiente de endoscópios – não havendo atrasos para esperar a finalização do reprocessamento
-
Número suficiente de auxiliares de sala – peças fundamentais da engrenagem para otimizar o tempo
-
Reprocessamento adequado dos endoscópios – todas as etapas e normas regulatórias seguidas fielmente
-
Estrutura física apropriada – que comporte um fluxo contínuo de pacientes sem prejuízo a segurança
As etapas que imediatamente antecedem o exame endoscópico consumem em média mais 8-10min, a saber: assinatura dos termos de consentimento livre e informado; breve entrevista clínica, abordando tempo de jejum, sintomas, alergias, comorbidades, antecedente, etc; realização do ”time out”. Ainda há de considerar a retirada do paciente da sala ao término do procedimento.
Sendo assim, levando em consideração as etapas descritas, chegamos a conclusão que a duração completa de uma EDA é de, no mínimo, 20 (vinte) minutos. O Guideline de padrões de qualidade em EDA da Sociedade Britânica de Gastroenterologia (BSG) é a única publicação identificada por nós que faz a recomendação explícita de destinar 20min por EDA dentro de um agenda de exames.
Por fim, como hipoteticamente consideramos um turno de trabalho de 6h, temos que a resposta direta para o questionamento inicial é 18 (dezoito) exames de EDA qualificadas.