Gastrite atrófica – guia prático sobre OLGA e OLGIM
A gastrite atrófica é um achado frequente de exames endoscópicos, sendo um dos fatores de risco para o desenvolvimento de câncer gástrico. Para identificar e estratificar grupos de risco foi criada uma classificação denominada OLGA (Operative Link of Gastritis Assesment), baseada na localização das biópsias e achados histológicos avaliando de forma objetiva o grau de atrofia. A classificação é reprodutível, de fácil execução, permitindo selecionar o grupo de pacientes de maior risco que devem ter seguimento mais rígido, mantendo a custo-efetividade do rastreamento.
Resumidamente, as biópsias devem ser realizadas nos seguintes locais e identificadas em três frascos separados, com ao menos dois fragmentos de cada local:
- Parede anterior e parede posterior de corpo (C1 e C2)
- Incisura angular (A3)
- Pequena e grande curvatura de antro (A1 e A2)
Obs: se quiser uma discussão mais aprofundada a respeito dos locais de biópsia, confira esse outro artigo: onde coletar as biópsias para estadiamento OLGA?
O escore OLGA é classificado de acordo com o resultado destas biópsias, conforme tabela abaixo:
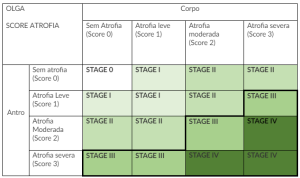
Essa classificação não leva em consideração a avaliação de outro fator de risco relevante caracterizado pela metaplasia intestinal. Para suprir esta deficiência, a classificação de OLGIM foi criada e basicamente reproduz a mesma ideia de avaliar a localização de biópsias com aspectos histológicos, porém voltadas para a metaplasia intestinal.
Os estágios são muito parecidos conforme disposto na tabela abaixo:
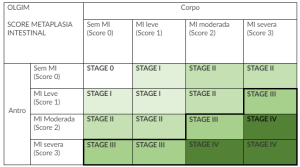
É realmente necessário fazer essas biópsias? A avaliação endoscópica não é suficiente??
Diversas publicações mostraram ao longo do tempo que os scores OLGA III/IV possuem maior risco para desenvolvimento de câncer gástrico, sendo relevante realizar seguimento cuidadoso neste subgrupo. Dentre elas destaca-se a publicação da GUT de 2007 envolvendo 448 pacientes estratificados utilizando o sistema OLGA com identificação de aumento gradativo da faixa etária e prevalência de infeção com H. Pylori (HP) nos escores maiores. Além disso, lesões neoplásicas foram identificadas apenas nos estágios OLGA III e IV.
Publicações mais recentes corroboram estes achados como a extensa metanálise envolvendo cerca de 2700 pacientes (8 estudos , dos quais 6 caso-controle) realizada por Yue H et al em 2018. Nessa publicação, foi descrito maior risco de desenvolvimento de câncer gástrico em escores OLGA III e IV (OR 2,64; 95% IC p<0,00001) e OLGIM III e IV (OR 3.99; 95% IC , p< 0,00001), confirmando a importância dos escores descritos nesse post e ressaltando a importância de fazer sim as biópsias.
O que dizem então os guidelines?
ASGE (2021 )
- As biópsias devem ser realizadas em antro, incisura e corpo;
- A presença de metaplasia intestinal implica em diagnóstico de gastrite atrófica;
- Achados endoscópicos típicos: mucosa gástrica pálida, aumento da visualização de vascularização submucosa e perda de pregas gástricas;
- Pacientes com gastrite atrófica e com HP + devem realizar tratamento e confirmar erradicação;
- Rastreamento a cada 3 anos em pacientes com atrofia gástrica avançada (baseado na histologia e extensão de acometimento);
- Na presença de gastrite autoimune, pesquisar vitamina B12, Ferro e anticorpos anticorpos anti-célula parietal e anti-fator intrínseco, doenças tireoideanas. Suspeitar de gastrite autoimune em pacientes com deficiência de B12 e/ou de Ferro;
- Anemia perniciosa é uma manifestação tardia de gastrite autoimune – no diagnóstico realizar biópsias para confirmar predominância de atrofia em corpo e excluir neoplasia e tumores neuroendócrinos;
- Pacientes com gastrite autoimune devem ser rastreados para tumor neuroendócrino tipo 1 e os menores que 1cm devem ser ressecados. Controle endoscópico a cada 1-2 anos.
ESGE (2019 – MAPSII)
- Pacientes com gastrite atrófica ou metaplasia intestinal possuem risco aumentado de adenocarcinoma;
- Endoscopia com equipamentos de alta definição e cromoscopia (CE) são superiores a endoscópios de alta definição com luz convencional
- Cromoscopia pode direcionar as biópsias para áreas mais representativas, com maior risco de malignidade;
- Realizar biópsias em ao menos dois locais (corpo e antro – grande e pequena curvaturas) e enviar em frascos separados;
- Pacientes com atrofia leve a moderada restrita ao antro não possuem evidência para recomendação de rastreamento;
- Pacientes com metaplasia intestinal em uma única região porém com histórico familiar de câncer gástrico, metaplasia incompleta ou gastrite crônica com HP persistente – considerar rastreamento e biópsias guiadas por CE em 3 anos;
- Casos de gastrite atrófica severa devem ser rastreados a cada 3 anos;
- Displasia, sem lesão endoscópica definida devem ser submetidos a endoscopia com CE;
- Lesão endoscópica com displasia de baixo ou alto grau / carcinoma devem ser estadiados e tratados;
- Erradicação de H. pylori traz cicatrização do tecido não atrófico reduzindo o risco de câncer.
Referências:
- Yue, H., Shan, L., & Bin, L. (2018). The significance of OLGA and OLGIM staging systems in the risk assessment of gastric cancer: a systematic review and meta-analysis. In Gastric Cancer (Vol. 21, Issue 4, pp. 579–587).
- Rugge, M., Meggio, A., Pennelli, G., Piscioli, F., Giacomelli, L., de Pretis, G., & Graham, D. Y. (2007). Gastritis staging in clinical practice: The OLGA staging system. Gut, 56(5), 631–636.
- Coelho, M. C. F., et al. (2021). Helicobacter pylori chronic gastritis on patients with premalignant conditions: Olga and olgim evaluation and serum biomarkers performance. Arquivos de Gastroenterologia, 58(1), 39–47.
- Pimentel-Nunes, P., Libânio, D., Marcos-Pinto, R., et al. (2019). Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy, 51(4)
Quer saber mais? Acompanhe esse outro post que preparamos para você.
Quiz: você conhece este tipo de lesão?
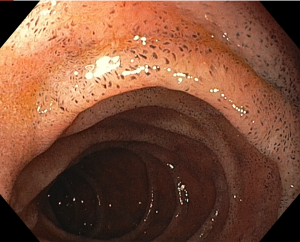
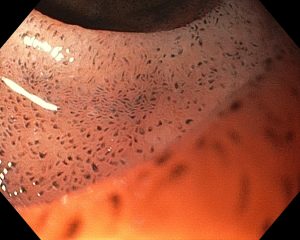
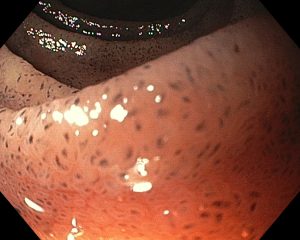
Paciente de 56 anos, hipertensa, com queixa de dor epigástrica e retroesternal, tosse persistente, pigarro e queimor. Realizou endoscopia que evidenciou esofagite de refluxo, gastrite antral leve e as alterações evidenciadas nas imagens abaixo:
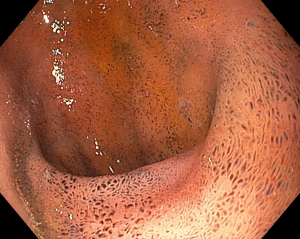
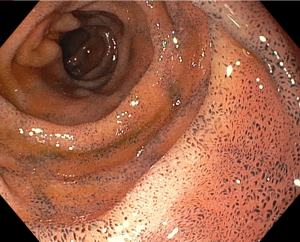
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Estudo comparativo (RCT) entre realização de ESD para remoção de neoplasia gástrica precoce através de método convencional e ESD com auxílio de método de tração
Artigo original: Comparing a conventional and a spring-and-loop with clip traction method of endoscopic submucosal dissection for superficial gastric neoplasms: a randomized controlled trial (with videos). Nagata M, Fujikawa T, Munakata H. Gastrointest Endosc. 2021 May;93(5):1097-1109.
Técnicas de dissecção endoscópica da submucosa permitem o tratamento de lesões neoplásicas precoces, com vasto suporte na literatura sobre eficácia, segurança e menor taxa de recorrência que outros métodos endoscópicos, seguindo os critérios adequados para indicação do procedimento. Na prática, observamos que a dificuldade técnica inerente ao procedimento e tempo prolongado para sua realização acabam por limitar as indicações, sendo realizado apenas por alguns experts. A incapacidade de realizar contratração do tecido a ser removido é citada por vários como uma das principais dificuldades do procedimento.
Existem algumas publicações mostrando dispositivos diferentes com o objetivo de promover contratração utilizando fios, clips, elásticos ou, até mesmo, magnetos. No estudo em questão, foi utilizado um dispositivo que consiste em uma mola acoplada a um loop em uma extremidade e um clip na outra, sendo denominado apenas como “mola” no decorrer do texto. A tração é realizada ancorando o clip do próprio dispositivo na lesão e utilizando um clip convencional para apreender o loop, deslocá-lo ao local desejado e ancorar no tecido gástrico com o clip.
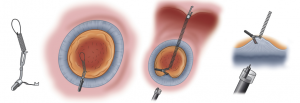
Figura 1 – Legenda : Dispositivo loop-mola-clip (SLC, Zeon Medical, Tokyo-Japão) com mola de 5 mm (extensível até 8 cm), loop de 4 mm e clip metálico.
Métodos
Estudo prospectivo, em único centro, randomizado, envolvendo o tratamento de neoplasia gástrica precoce através de dois braços – ESD convencional (ESD-C) e ESD com loop-mola-clip (ESD-M).
A randomização foi realizada com auxílio de software, porém os pacientes e pesquisadores tinham conhecimento sobre os grupos (não cego).
Foram avaliados, como objetivo primário, o tempo do procedimento em minutos e, como objetivos secundários, taxas de efeitos adversos, ressecção en bloc, avaliação histológica da amostra e dados referentes ao dispositivo de mola, os quais foram detalhados em:
- a) tempo de liberação do dispositivo – tempo entre visualização do clip no monitor e fixação na parede gástrica para promover tração. Havendo necessidade de reposicionamento, esse tempo também foi incluído;
- b) dano tecidual – presença de lacerações ou ruptura do tecido relacionada ao dispositivo de tração durante ESD;
- c) quebra do dispositivo – perda da elasticidade da mola.
Critérios de inclusão: ausência de cirurgia gástrica, confirmação histológica de adenoma ou adenocarcinoma precoce por biópsias prévias, de acordo com o esquema abaixo:
- a) carcinoma diferenciado de qualquer tamanho, sem ulceração/cicatriz;
- b) carcinoma diferenciado ≤ 30 mm, com ulceração/cicatriz;
- c) carcinoma indiferenciado ≤ 20 mm, sem ulceração/cicatriz.
Todos os procedimentos foram realizados por um único endoscopista, expert em dissecção endoscópica da submucosa com mais de 750 casos de ESD convencional e mais de 50 casos de ESD-M. Os procedimentos foram realizados com insuflação de CO2, utilizando overtube, gastroscópio convencional e cap.
A técnica de ESD convencional não utilizou qualquer dispositivo de tração, técnicas underwater ou pocket.
A técnica de ESD-M foi realizada da seguinte forma, resumidamente:
- Marcação da lesão de forma convencional.
- Avaliação da melhor forma de ressecção, através de visão frontal ou retroversão.
- Posicionamento da mola na lesão de acordo com o acesso para ESD:
- visão frontal – mola na face proximal/oral da lesão;
- retroversão – mola na face distal/anal da lesão.
- Após posicionamento de uma extremidade do dispositivo, um clipador convencional era utilizado para apreender o loop e fixá-lo na posição desejada.
- Nos casos em que a dissecção foi realizada em retroversão, foi necessário avaliar o local de posicionamento do clip na parede gástrica para reduzir o risco de deslocamento ou tração exagerada do dispositivo com a mobilização do endoscópio.
Figura 2 – imagens demonstrando localização da lesão e posicionamento do dispositivo de mola para auxiliar na tração durante ESD-M. Vídeo disponível em www.giejournal.org (artigo completo disponível gratuitamente).
Resultados
Foram selecionados, inicialmente, 87 pacientes, sendo excluídos 7 (recusa em participar, não atendimento aos critérios de indicação, outras causas), totalizando 80 pacientes, 40 em cada braço do estudo – todos esses completaram o estudo e tiveram seus dados analisados.
O perfil dos pacientes foi muito semelhante entre o grupo de ESD-M e ESD-C em idade (75,3 x 74,6) e predominância de sexo masculino (75% vs. 72,5%), respectivamente. As outras características das lesões também foram bastante uniformes.
| ESD-M (n=40) | ESD-C (n=40) | ||
| Tamanho lesão (mm) | Mean (Range) | 15,9 (5-48) | 15,7 (1,4-45) |
| Localização | Proximal | 7 (17,5%) | 6 (15%) |
| Médio | 19 (47,5%) | 19 (47,5%) | |
| Distal | 14 (35%) | 15 (37,5%) | |
| Posição | Grande curvatura | 10 (25%) | 7 (17,5%) |
| Pequena curvatura | 19 (47,5%) | 15 (37,5%) | |
| Parede anterior | 6 (15%) | 7 (17,5%) | |
| Parede posterior | 5 (12,5%) | 11 (27,5%) | |
| Morfologia | Deprimida (0-IIc; 0-III) | 19 (47,5%) | 24 (60%) |
| Plana (0-IIb) | 1 (2,5%) | 2 (5%) | |
| Elevada (0-I; 0-IIa) | 20 (50%) | 14 (35%) | |
| Histologia | Adenoma | 6 (15%) | 7 (17,5%) |
| Adenocarcinoma diferenciado | 34 (85%) | 30 (75%) | |
| Adenocarcinoma não diferenciado | 0 (0%) | 3 (7,5%) |
Em relação ao uso do dispositivo de aplicação da mola, foi evidenciado tempo de liberação médio de 1,82 minutos (0,8 a 4,25). Não houve dano ao tecido a ser ressecado, e todas as âncoras foram removidas ao término do procedimento. Foi necessário usar um segundo dispositivo (média de 1,15) em 15% dos casos (n=6) por soltura do dispositivo (n=1), falha em fixar o dispositivo (n=2) e necessidade de tração adicional (n=3).
Foi observado menor tempo para realização de ESD-M e maior velocidade de dissecção neste grupo, ambos com diferenças estatisticamente significantes. Não houve diferença entre taxas de ressecção en bloc, perfuração e efeitos adversos. Os resultados estão dispostos na tabela abaixo.
| ESD-M (n=40) | ESD-C (n=40) | p-value | ||
| ESD procedure time | Mean (Range) | 42,9 (10,4-125,1) | 61.7 (13,6-217,3) | 0,019 |
| Dissection speed, mm2/min | Mean (Range) | 28,1 (9-66,6) | 1,5 (5,8-40,4) | <0,001 |
| Specimen size, mm | Mean (Range) | 36,1 (22-61) | 37 (22-67) | 0,705 |
| Depth (size,mm / %) | Mucosa | 33 (82.5%) | 34 (85%) | 0,415 |
| Submucosa <500 µm | 1 (2,5%) | 3 (7,5%) | ||
| Submucosa ≥500 µm | 6 (15%) | 3 (7,5%) | ||
| Presence of ulceration | 7 (17,5%) | 7 (17,5%) | ||
| En bloc resection | 40 (100%) | 40 (100%) | ||
| Complete resection | 36 (90%) | 39 (97,5%) | 0,359 | |
| Adverse events | Post-ESD bleeding | 2 (5) | 3 (7,5) | |
| Perforation | 0 | 0 | ||
| Others | 0 | 0 |
Houve diferença no posicionamento do endoscópio para a realização da dissecção endoscópica, sendo observada preferência por abordagem frontal no grupo de ESD-M e uma equivalência entre abordagem frontal e retroversão no grupo de ESD-C.
Na análise de subgrupo, foi constatada vantagem para o grupo de ESD-M, com tempo menor para realização do procedimento para lesões nos terços superiores e lesões menores que 20 mm.
Comentários
Modificações na técnica e desenvolvimento de novos dispositivos, como o descrito no trabalho, têm potencial muito grande de trazer auxílio para a realização de ESD, facilitando sua reprodutibilidade e ampliando as indicações.
Foi discutido no artigo que não houve diferença significativa no tempo de execução entre ESD convencional e tipo ESD-M para lesões em terço distal do estômago, no entanto, esta posição é mais favorável para a dissecção, potencialmente reduzindo as vantagens do uso do dispositivo tipo mola. Apesar dessa citação, é importante observar que o expert já realizou mais de 800 casos de ESD, possuindo técnica e habilidade suficiente para a realização dos procedimentos de maneira rápida e segura. Para médicos com menor experiência, é possível imaginar que os resultados entre ESD-M e ESD-C sejam ainda mais distintos.
Como citar este artigo
Ferreira F. Estudo comparativo (RCT) entre realização de ESD para remoção de neoplasia gástrica precoce através de método convencional vs ESD com auxílio de método de tração. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/estudo-comparativo-rct-entre-realizacao-de-esd-para-remocao-de-neoplasia-gastrica-precoce-atraves-de-metodo-convencional-e-esd-com-auxilio-de-metodo-de-tracao
Referências
- Nagata M, Fujikawa T, Munakata H. Comparing a conventional and a spring-and-loop with clip traction method of endoscopic submucosal dissection for superficial gastric neoplasms: a randomized controlled trial (with videos). Gastrointest Endosc. 2021 May;93(5):1097-1109. Epub 2020 Oct 12
- Okagawa Y, Abe S, Takamaru H, Sekiguchi M, Yamada M, Sakamoto T, Saito Y. A novel technique for adjusting traction direction during colorectal endoscopic submucosal dissection using S-O clip. Endoscopy. 2021 May;53(5):E177-E178. doi: 10.1055/a-1216-1167. Epub 2020 Aug 20. PMID: 32818993.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Como remover pólipos e lesões planas do cólon? Mucosectomia convencional (EMR) vs. underwater EMR
A remoção de pólipos faz parte da rotina da colonoscopia, sendo encontrados com maior frequência pólipos pequenos, inferiores a 10 mm e nos quais a incidência de neoplasia é extremamente baixa. Pólipos maiores ou lesões planas do cólon, no entanto, requerem maior atenção tanto por poderem estar associados à neoplasia e, portanto, necessitarem de remoção en bloc quanto pelas complicações relacionadas aos procedimentos de ressecção.
Dispomos de diversas opções para remoção de lesões colônicas, como remoção simples com pinças de biópsias, polipectomia com alça “a frio”, mucosectomia convencional (EMR), mucosectomia por técnica underwater (U-EMR) e técnicas de dissecação endoscópica da submucosa (ESD). A escolha da técnica depende, dentre outros fatores, de características da lesão e treinamento do endoscopista.
Um dos métodos mais empregados em nosso meio é a mucosectomia convencional, realizada por meio de injeção submucosa de solução salina abaixo da lesão, seguida de ressecção com alça diatérmica. Em 2012, foi publicada por Binmoeller a técnica de ressecção underwater, realizada com instilação de líquido no interior do cólon e aspiração do gás, reduzindo a tensão na parede do cólon, o que por sua vez determina um afastamento das camadas mucosa e submucosa em relação à camada muscular. Após instilação de líquido, a lesão é apreendida e removida com alça diatérmica.
Selecionamos um artigo muito interessante com revisão da literatura e meta-análise, comparando essas duas técnicas de ressecção de lesões colônicas.
Artigo: Underwater versus conventional endoscopic mucosal resection for colorectal polyps: a systematic review and meta-analysis. Publicado na Gastrointest Endosc. 2021 Feb;93(2):378-389
Métodos
Na revisão da literatura, foram inclusos estudos de 2012 e 2020 envolvendo apenas estudos comparando ressecção de lesões maiores de 10 mm por técnicas de EMR e U-EMR nas seguintes bases de dados: MEDLINE/PubMed, The Cochrane Library, Google Scholar, CINAHL, Scopus.
Dos estudos que continham dados sobre pólipos de vários tamanhos, foram inclusos apenas os dados referentes às lesões maiores de 10 mm.
Foram descritos como sangramento tanto casos precoces como tardios; sobre localização, foi estratificado em proximal (ceco, ascendente e transverso) e distal (descendente e sigmoide).
Recorrência: recorrência de adenoma na histologia ou colonoscopia de controle 3-6 meses após ressecção.
Resultados
Foram avaliados títulos de 481 estudos, dos quais foram analisados 42 estudos na íntegra. Após exclusão de estudos com perfil diferente do estabelecido, restaram 7 estudos, sendo 3 estudos prospectivos randomizados, 1 estudo prospectivo e 3 retrospectivos. Os três estudos randomizados realizaram randomização de 1:1 reduzindo viés, e as quatro coortes foram consideradas de boa qualidade.
- Total de pólipos removidos: 1237, dos quais 614 foram ressecados por U-EMR e 623 por EMR;
- Ressecção “en bloc”: superioridade no grupo de U-EMR (odds ratio 1,84 IC:95%), no entanto, análise de subgrupos não evidenciou diferença significativa entre as técnicas para pólipos menores que 20 mm;
- Recorrência: 4 estudos relataram dados sobre recorrência, avaliando 667 pólipos.
Houve menor recorrência no grupo de U-EMR (odds ratio 0,30 ; p=0,001), a qual foi de 6,82% em comparação com a taxa de 18,99% no grupo de EMR.
Estratificando essa incidência relacionada ao tamanho dos pólipos (3 estudos), houve diferença significativa no grupo de pólipos de 20 mm ou mais (odds ratio 0,29 p=0,001), porém não houve diferença significativa nos pólipos inferiores a 20 mm.
- Sangramento pós-procedimento e perfuração: não houve diferença significativa entre os grupos em relação à perfuração ou à sangramento (total ou por segmentos).
Comentários
Ambas técnicas tiveram desempenho muito semelhante para lesões abaixo de 20 mm, que, felizmente, correspondem a maioria das lesões. O estudo mostra a mesma segurança, porém superioridade da técnica de ressecção underwater em relação à mucosectomia convencional para lesões maiores de 20 mm nos dois principais pontos: recidiva e recorrência. Apesar desse dado, vale ressaltar que lesões com essas características são melhor tratadas por técnica de dissecção endoscópica da submucosa (ESD), devendo ser avaliada com cautela e de forma individualizada a realização de outras técnicas de ressecção, seja por mucosectomia convencional seja por underwater.
Como citar este artigo
Ferreira F. Como remover pólipos e lesões planas do cólon? – mucosectomia convencional (EMR) vs underwater EMR. Endoscopia Terapêutica; 2021. Disponível em:
Leia também
- Underwater EMR – mucosectomia de lesões colônicas sem injeção submucosa.
- Pólipos colorretais menores que 20 mm: guia de sobrevivência para o endoscopista.
Referências
- Choi AY, Moosvi Z, Shah S, Roccato MK, Wang AY, Hamerski CM, et al. Underwater versus conventional EMR for colorectal polyps: systematic review and meta-analysis. Gastrointest Endosc. 2021;93(2):378–89. Available from: https://doi.org/10.1016/j.gie.2020.10.009
- Nett A, Binmoeller K. Underwater Endoscopic Mucosal Resection. Gastrointest Endosc Clin N Am. 2019;29(4):659–73. Available from: https://doi.org/10.1016/j.giec.2019.05.004
Síndrome pós-polipectomia
A realização de polipectomias faz parte do dia a dia do colonoscopista, como parte de procedimentos de rotina, exames diagnósticos etc. As principais complicações evidenciadas incluem ressecção incompleta da lesão, sangramento e perfuração. A síndrome pós-polipectomia é uma complicação pouco frequente e menos conhecida que as demais, no entanto, de extrema relevância. Sobre ela comentamos:
Confira mais sobre a síndrome pós-polipectomia
A síndrome de coagulação pós-polipectomia (post-polypectomy coagulation syndrome – PPCS) foi descrita por J. Waye ao observar pacientes que apresentaram quadro de dor abdominal de forte intensidade, sinais de peritonismo, taquicardia e febre após polipectomia com uso de corrente elétrica, porém, que não apresentavam evidência de perfuração colônica nos exames de imagem.
O diagnóstico dessa síndrome é de exclusão, sendo imprescindível avaliar e descartar a presença de pneumoperitôneo.
O principal sintoma é dor abdominal após colonoscopia, o que pode ocorrer nas primeiras 12h após o procedimento, porém são descritos casos tardios, após até 5–7 dias.
Considera-se que a síndrome decorre de lesão transmural secundária à corrente diatérmica, com preservação da serosa, não havendo, portanto, pneumoperitôneo.
A incidência é baixa, sendo estimada entre 0,5 e 1,2%, porém de grande relevância, pois faz diagnóstico diferencial com perfuração colônica pós-polipectomia.
Exames de imagem (tomografia computadorizada com contraste) evidenciam: ausência de pneumoperitôneo, espessamento da parede colônica com infiltrado inflamatório adjacente e presença de líquido na camada muscular do cólon.
O tratamento é conservador, baseado em internamento hospitalar, jejum, antibioticoterapia e vigilância. Não há necessidade de intervenção cirúrgica.
É importante ressaltar que a etiologia da lesão está associada à queimadura de camadas profundas do cólon. A evolução destes casos, via de regra, é satisfatória. Havendo intercorrências ou evolução insatisfatória, a possibilidade de perfuração tardia ou diagnóstico inicial equivocado (falha nos exames de imagem) deve ser suspeitado, sendo crucial a reavaliação do caso com o cirurgião.
Alguns autores usam o termo transmural burn syndrome ou simplesmente coagulation syndrome (CS) para incluir pacientes submetidos a ressecções endoscópicas por mucosectomia (EMR) ou dissecção endoscópica da submucosa (ESD), que apresentam quadro clínico semelhante a PPCS.
Embora não haja relato de perfuração tardia em PPCS, há descrição de perfuração tardia após CS (caso de ESD), indicando a importância de manter o paciente em internamento hospitalar e vigilância.
Bacteremia transitória pode ocorrer após procedimentos diagnósticos ou terapêuticos, correspondendo à translocação de bactérias da flora do próprio paciente para a corrente sanguínea. De acordo com a ASGE, a incidência após colonoscopia com ou sem polipectomia é de aproximadamente 4%, porém raramente associadas a casos de infecção propriamente dita, como endocardite ou peritonite.
Referências:
- CT findings of post-polypectomy coagulation syndrome and colonic perforation in patients who underwent colonoscopy polypectomy. Shin et al. Clinical Radiology 2016;e1-e7
- Features of electrocoagulation syndrome after endoscopic submucosal dissection for colorectal neoplasm. Yamashina et al Gastroenterology and Hepatology 2016; 31:615–620
- Coagulation syndrome: Delayed perforation after colorectal endoscopic treatments. Hirasawa et al. World J Gastrointest Endosc 2015: 7(12): 1055-1061
- What Is Different between Postpolypectomy Fever and Postpolypectomy Coagulation Syndrome? Hyung Wook Kim. Clin Endosc 2014;47:205-206
Como citar este artigo:
Ferreira F. Síndrome pós-polipectomia. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/sindrome-pos-polipectomia/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Agora responda a esse QUIZ sobre Síndrome pós-polipectomia.
Como você informa seu paciente sobre notícias difíceis?
Como médicos, muitas vezes, fazemos diagnósticos de doenças graves, tratamentos complexos, cirurgias, complicações, tumores, em suma: condições que trarão graus variáveis de desconforto ao paciente, seja por meio de sintomas, modificação de seus hábitos (alimentares, exercícios, lazer etc), limitações físicas/psicológicas, até de sua morte. É comum que tenhamos dificuldades e temores em passar essas notícias aos pacientes e familiares pela própria natureza das informações como por nosso receio de:
- Não sabermos lidar bem as emoções e reações dos pacientes e familiares;
- Trazermos consequências negativas ao paciente, removendo suas esperanças frente a condições graves e reduzindo a aderência ao tratamento;
- Passarmos informações que sejam interpretadas erroneamente pelo paciente, transmitindo falsas esperanças e/ou omitirmos informações relevantes.
Embora situações como essas sejam frequentes no meio médico, é incomum recebermos treinamento adequado sobre como informar más notícias nas faculdades, universidades, cursos de residência médica ou especializações ao longo de nossa formação. Muitos acreditam que notícias difíceis são assim por sua própria natureza e, portanto, independem ou sofrem pouco impacto pela forma como são apresentadas. Na verdade, é um processo difícil, pois nunca sabemos ao certo como essas notícias afetam a vida dos pacientes, como eles irão processar e reagir a essas informações.
Algumas especialidades frequentemente precisam informar seus pacientes sobre diagnósticos difíceis, seja por sua gravidade, repercussões e decisões que devem ser tomadas para seu tratamento, notadamente a oncologia e cirurgia oncológica.
Foi publicado na revista The Oncologist um trabalho clássico sobre como passar informações difíceis a pacientes oncológicos por meio de um protocolo de seis passos, denominado SPIKES. Esse trabalho tornou-se referência, alimentando a discussão sobre o tema e originando outras publicações relevantes. Resumidamente, o protocolo SPIKES consiste em seis passos:
Passo 1 – Setting up (preparo)
Nesta etapa, deve-se criar um ambiente adequado, garantindo o máximo de privacidade ao paciente, reservando tempo e evitando interrupções. Recomenda-se convidar os envolvidos a sentarem em local calmo, com telefones desligados, mantendo contato visual durante o diálogo.
Passo 2 – Perception (percepção)
Nesta etapa, avalia-se o conhecimento que o paciente tem sobre sua doença ou complicação. Perguntas simples e objetivas podem ser feitas para avaliar o conhecimento prévio ou expectativas do paciente sobre a situação. Dessa forma é mais fácil corrigir informações incorretas e identificar mecanismos de defesa do paciente, como negação, por exemplo.
Passo 3 – Invitation (convite)
A maioria dos pacientes prefere ter o máximo de informações sobre suas doenças e possíveis tratamentos, porém, outros preferem saber apenas de informações mais importantes e transferem as decisões para o próprio médico. É importante avaliar e respeitar o padrão no qual o paciente se encaixa para definir como as informações serão passadas.
Passo 4 – Knowledge (conhecimento)
Etapa na qual as informações sobre a doença ou complicação são passadas ao paciente, de acordo com seu poder de compreensão. Sugere-se evitar ou reduzir a quantidade de termos técnicos, simplificando as informações, fazendo a comunicação de forma gradual, tanto para que o paciente possa absorver como reagir às informações recebidas. Evitar ser muito direto ou negativo sobre prognósticos mais reservados, lembrando que existem diversas opções tanto para tratamento curativo como paliativo.
Passo 5 – Emotions (emoções)
Ao receber notícias difíceis, o paciente pode apresentar reações muito diversas, como frustração, raiva, negação, tristeza, assim como alternar entre estas ou outras no decorrer do diálogo. Recomenda-se observar e tentar identificar as reações do paciente, dando tempo para que ele expresse seus sentimentos ou dúvidas. Deve-se manter uma postura receptiva, mostrando empatia, tentando compreender como o paciente se sente diante da notícia e/ou de suas repercussões.
Passo 6 – Strategy , Summary (estratégia e resumo)
Nesta etapa, são apresentadas as possíveis estratégias de tratamento e quais soluções serão apresentadas, caso o paciente esteja preparado para tal e deseje tomar essas decisões no momento. Estimula-se que as decisões sejam tomadas com participação ativa do paciente, dividindo as responsabilidades e respeitando suas opções.
Na endoscopia, a transmissão de notícias difíceis felizmente não é frequente, ocorrendo principalmente no diagnóstico de neoplasias, na presença de alguma complicação do próprio exame endoscópico ou de procedimentos cirúrgicos prévios. Torna-se mais difícil, particularmente, em casos de diagnóstico incidental de tumores em exames de rastreamento quando os sintomas são frustros ou negligenciados.
O protocolo SPIKES é bastante simples, no entanto, agrega muito valor para que a comunicação de uma notícia difícil consiga ser realizada de forma eficaz com o menor ruído possível, entregando ao paciente e familiares as informações técnicas para que seja possível realizar o tratamento de forma humanizada. São passos simples, porém frequentemente negligenciados ou realizados de forma incompleta ou desordenada, dificultando a recepção da notícia e possivelmente trazendo prejuízo à relação médico-paciente.
Na endoscopia, temos ainda dois fatores importantes a considerar:
Sedação: Quase todos exames endoscópicos são realizados sob sedação venosa, o que traz implicações sobre os atos que o paciente pode realizar e ser responsabilizado durante o período de recuperação pós-anestésica, uma vez que sua atenção e compreensão podem estar prejudicadas pelo uso das medicações, motivo pelo qual não é permitido ao paciente dirigir ou trabalhar nesse momento. As orientações e decisões tomadas no período pós-sedação devem ser realizadas com participação ou na presença do acompanhante do paciente, uma vez que este último está sob influência de fatores que limitam seu raciocínio e tomada de decisões, havendo determinação do próprio Ministério da Saúde, por meio da RDC no 6 de 2013, sobre a obrigatoriedade da presença de um acompanhante para liberação de paciente após realização de procedimento endoscópico sob sedação não tópica. No caso de complicações pós-exame, a definição do tratamento da complicação ou de orientações específicas fazem parte do exame e devem ser realizadas na presença do acompanhante.
Médico assistente: Geralmente, recebemos pacientes de outras especialidades, realizamos diagnósticos e terapêuticas específicas, orientamos sobre tratamento e seguimento realizando um papel específico focado principalmente no exame/procedimento enquanto o médico solicitante assume papel de médico assistente, realizando a condução do caso. A atuação desses dois médicos permite a criação de uma zona de interseção que deve ser tratada com cautela para minimizar choque de informações que possam deixar o paciente inseguro ou confuso. Não há regra clara para definir onde começa e termina o papel de cada um, quais informações e condutas são de responsabilidade de um e outro, cabendo ao bom senso definir esses passos.
No caso de notícias difíceis, essa atenção deve ser redobrada para passarmos as informações mais relevantes ao paciente e acompanhante. Tenho a opinião de que devemos ter bastante cautela como endoscopistas para não nortear condutas e não assumir o papel de médico assistente, pois não é nosso principal papel como médicos especialistas na realização dos exames e procedimentos endoscópicos. Obviamente, muitas vezes, o endoscopista atua nas duas funções, como endoscopista e médico assistente (gastroenterologista, cirurgião etc), não havendo, portanto, conflito de informações.
E você, como informa notícias difíceis ao seu paciente? Comente abaixo.
Como citar este artigo:
Ferreira F. Como você informa seu paciente sobre notícias difíceis?. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntos-gerais-como-voce-informa-seu-paciente-sobre-noticias-dificeis
Fonte: Baile et al. SPIKES – A Six‐Step Protocol for Delivering Bad News: Application to the Patient with Cancer. The Oncologist, 2000
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Gastroplastia Endoscópica
A técnica de Gastroplastia Endoscópica (ESG – Endoscopic Sleeve Gastroplasty) consiste na utilização de um dispositivo de sutura endoscópica (Apollo Overstitch) acoplado na extremidade de endoscópio de duplo canal para confecção de plicaturas na parede gástrica, tornando-o com aspecto tubulizado e, portanto, reduzindo seu volume.
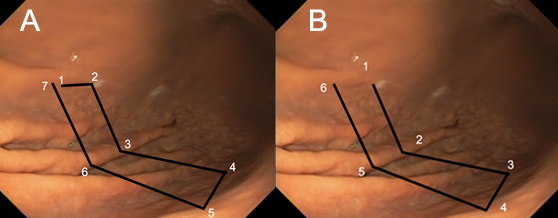
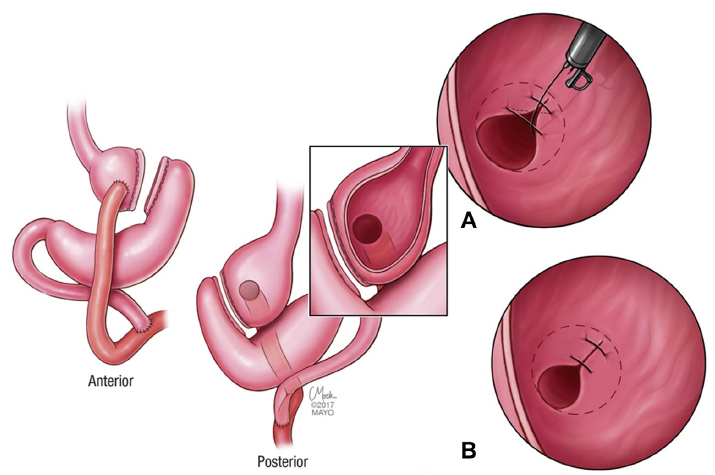
As suturas podem ser realizadas em padrões distintos, iniciando-se em corpo distal, podendo ser restritas a corpo ou incluir parte do fórnix gástrico. A realização de suturas em antro não está indicada.
Imagem esquemática evidenciando o padrão de sutura em quadrado/retângulo (A) e padrão em “U” (B) para facilitar a compreensão, embora, na prática, as suturas sejam realizadas com uma distância maior entre si.
A população-alvo do procedimento é composta por pacientes que, apesar de serem obesos, não são candidatos à cirurgia bariátrica ou recusam o procedimento cirúrgico.
A perda de peso associada a ESG varia entre 16 e 19% do peso total e de 47 a 55% do excesso de peso após um ano do procedimento, de acordo com as maiores séries publicadas.
As principais complicações do procedimento estão associadas à dor ou vômitos que necessitem de prolongamento do internamento hospitalar, sangramento e coleções perigástricas (relato de tratamento conservador e laparoscopia).
Revisão sistemática e meta-análise publicada no ano passado abrangeu oito estudos, no período entre 2016 e 2019, envolvendo 1772 pacientes submetidos a ESG:
- Perda de peso total de 16,5% em um ano e de 17,2% em dois anos.
- Taxa de eventos adversos de 2,2% predominantemente por prolongamento do internamento hospitalar por náuseas ou dor (1%), sangramento (0,5%) e vazamento perigástrico/coleção (0,48%).
- Nessa publicação foram avaliados 3 coortes retrospectivas e 5 prospectivas, a maior delas, envolvendo 1000 pacientes, foi de caráter prospectivo.
Estudo prospectivo realizado no Brasil envolvendo 233 casos de ESG, todos utilizando mesmo padrão de sutura (em U), encontrou valores semelhantes em relação à perda de peso total após 6 meses (17,1%) e um ano (19,7%).
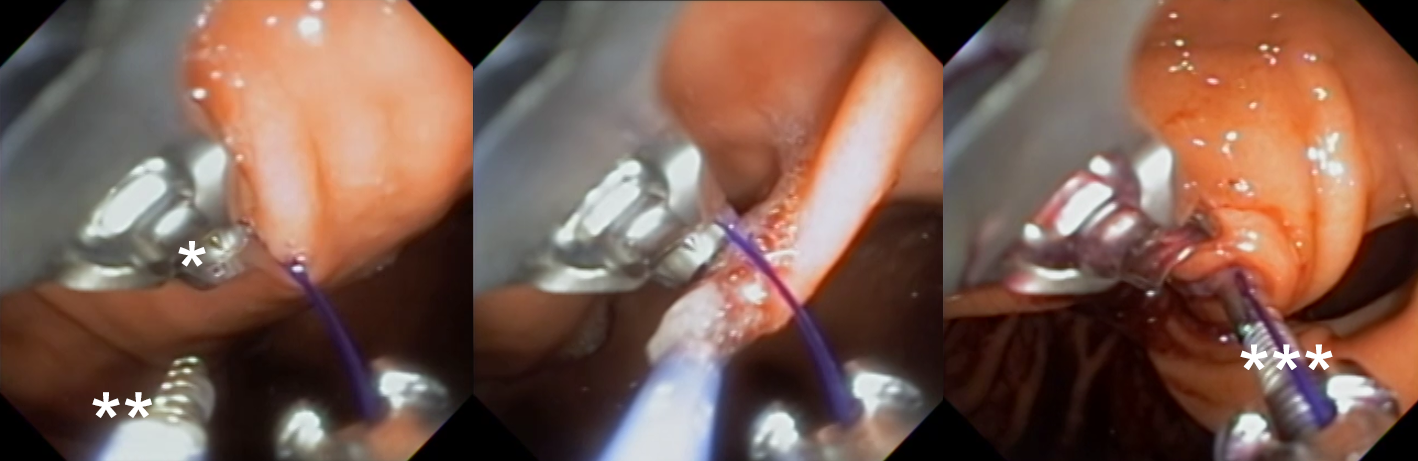
Etapas para realização da sutura: Com o fio já posicionado no porta agulha(*), é realizado o posicionamento da hélice/helix (**) na região desejada. Tração da helix trazendo o tecido para dentro do dispositivo de sutura. Na última imagem, liberação do fio(***).
O Brasil é um dos principais expoentes no campo da cirurgia e endoscopia bariátrica e, recentemente, publicou o Consenso Brasileiro sobre ESG, envolvendo 1828 procedimentos realizados por 47 endoscopistas.
Foi relatado pelo grupo taxa de eventos adversos maiores de 0,8% (15 casos), principalmente por sangramento manejados por tratamento conservador ou endoscópico. Dentre as outras causas de eventos adversos foram citados dor abdominal por persistência de pneumoperitônio (3 casos), vômitos persistentes (1 caso), insuficiência respiratória sem necessidade de ventilação mecânica, no pós-operatório imediato (1 caso, paciente com DPOC), e três casos que necessitaram de intervenção cirúrgica por laparoscopia: dois abscessos retrogástricos e uma perfuração de vesícula biliar. Houve um caso de óbito por tromboembolismo pulmonar no 5º DPO em paciente hipertenso, com sequela de AVC e IMC de 31 Kg/m2.
Dentre os principais pontos de consenso (concordância de 70% ou mais dos participantes), cita-se:
- Indicação: IMC ideal entre 30 e 35 Kg/m2, com IMC mínimo de 27 Kg/m2;
- Contraindicação absoluta: úlceras ativas em corpo ou fórnix gástrico (com ou sem sinais de sangramento), gastropatia congestiva, polipose gástrica, varizes esofágicas ou gástricas, distúrbios psiquiátricos não tratados/compensados.
Técnica de Gastroplastia Endoscópica:
- Procedimento realizado sob supervisão anestésica e intubação traqueal, uso de antibioticoprofilaxia de rotina, insuflação gástrica usando CO2, não realizar suturas em antro.
- A técnica de sutura mais utilizada foi em quadrado/retângulo, em média sendo utilizadas 4 a 6 suturas por caso.
- O procedimento pode ser realizado em caráter ambulatorial.
- Recomenda-se uso de IBPs, ondansetrona, buscopan, analgésicos e dexametasona no pós-operatório imediato e manutenção de IBPs por 1 a 3 meses após procedimento.
Considerações sobre a Técnica de Gastroplastia Endoscópica:
A técnica é bastante promissora, segura, com bons resultados nos primeiros dois anos após o procedimento, obedecendo aos critérios determinados pela ASGE e ASMBS. Uma das principais limitações do método está relacionada ao custo ainda muito elevado do procedimento, tanto pelo custo do próprio dispositivo e do treinamento em manejá-lo quanto pela necessidade de dispor de aparelho de duplo canal, overtube e insuflador de CO2.
Embora já seja realizada há certo tempo, muitos cirurgiões e endoscopistas ainda desconhecem a técnica ou não conhecem bem as diversas publicações sobre o tema, o que acaba gerando comparações entre a técnica de ESG e a cirurgia de sleeve, sem levar em consideração que tanto seus resultados como suas indicações são distintas.
A seguir, teste seus conhecimentos e responda o nosso QUIZ!
Como citar esse artigo:
Ferreira F. Gastroplastia Endoscópica. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/gastroplastia-endoscopica/
Referências
- Laparoscopic Sleeve Gastrectomy After Endoscopic Sleeve Gastroplasty: Technical Aspects and Short-Term Outcomes; Aayed R Alqahtani, Mohamed Elahmedi, Yara A Alqahtani, Abdullah Al-Darwish; Obes Surg 2019 Nov;29(11):3547-3552
- Gastroplastia sleeve endoscópica para tratamento da obesidade: dois anos de experiência; Gontrand Lopez-Nava, MP Galvão, I Bautista-Castaño, JP Fernandez-Corbelle, M Trell, N Lopez; ABCD Arq Bras Cir Dig 2017;30(1):18-20
- Safety and short‑term effectiveness of endoscopic sleeve gastroplasty using overstitch: preliminary report from a multicenter study; Surgical Endoscopy; Manoel Galvao Neto, Rena C. Moon, Luiz Gustavo de Quadros, Eduardo Grecco, Admar Concon Filho, Thiago Ferreira de Souza, Luis Augusto Mattar, Jose Americo Gomides de Sousa, Barham K. Abu Dayyeh, Helmut Morais, Felipe Matz, Muhammad A. Jawad, Andre F. Teixeira; Surgical endoscopy 2019
- Brazilian Consensus on Endoscopic Sleeve Gastroplasty – Manoel Galvão Neto, Lyz Bezerra Silva, Luiz Gustavo de Quadros, Eduardo Grecco, Admar Concon Filho, Artagnan Menezes Barbosa de Amorim, Marcelo Falcao de Santana, Newton Teixeira dos Santos et al; Obesity Surgery 2020
- Efficacy and Safety of Endoscopic Sleeve Gastroplasty: A Systematic Review and Meta-Analysis – Abdellah Hedjoudje, Barham Abu Dayyeh, Lawrence J. Cheskin, Atif Adam, Manoel Galvão Neto, Dilhana Badurdeen, Javier Graus Morales, Adrian Sartoretto, Gontrand Lopez Nava, Eric Vargas, Sui Zhixian, Lea Fayad, Jad Farha, Mouen A. Khashab, Anthony N. Kalloo, Aayed R. Alqahtani, Christopher Thompson, and Vivek Kumbhari; Clinical Gastroenterology and Hepatology 2019
- Re-suturing after primary endoscopic sleeve gastroplasty (ESG) for obesity – Gontrand Lopez-Nava , Ravishankar Asokkumar , Anuradha Negi , Enrique Normand , Inmaculada Bautista ; Surg Endosc 2020 Jun 24
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Quiz! Teste seus conhecimentos sobre ESG (Endoscopic Sleeve Gastroplasty)
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
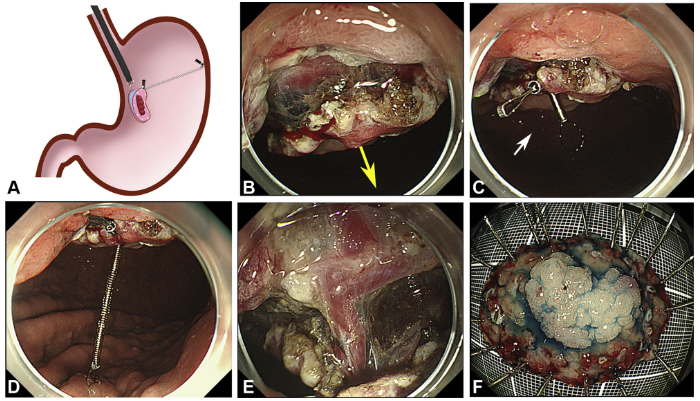
Manejo endoscópico de dumping após bypass gástrico em Y de Roux através de dispositivo de sutura (TORe)
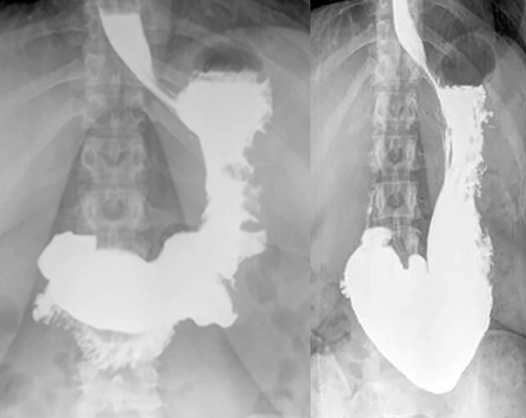
O bypass gástrico em Y de Roux é uma técnica cirúrgica consagrada para o tratamento da obesidade com comprovada eficácia e segurança. Queixas de dumping são consideradas comuns principalmente no primeiro e segundo ano após a cirurgia, sendo habitualmente de leve intensidade e manejadas com orientação dietética.
A síndrome de dumping ocorre pelo trânsito acelerado de secreção digestiva e alimentar para o intestino proximal podendo estar relacionado a distensão de alças e hipersecreção com alteração da osmolaridade, estímulo vagal e hipoglicemia por hiperinsulinemia. As queixas podem ser precoces, quando ocorrem até 30 minutos após a alimentação, ou tardias, quando ocorrem entre 1-3h após a ingesta alimentar. Pacientes com dumping tardio também podem apresentar dumping precoce.
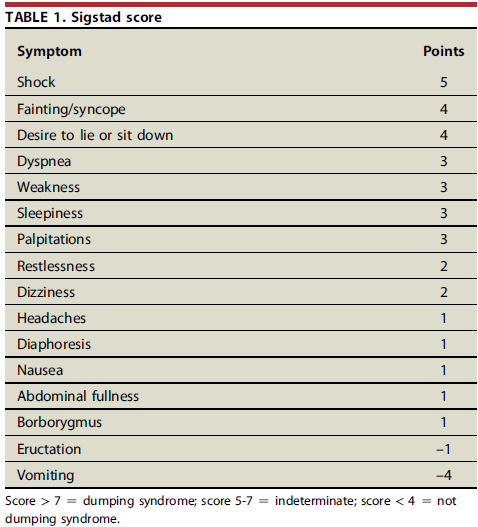
O escore de Sigstad é utilizado como uma maneira de identificar se a etiologia dos sintomas está relacionada ao dumping e mesmo estratificar sua gravidade e a resposta ao tratamento. Este escore é realizado através da ingestão de dieta rica em glicose e avaliação dos sintomas posteriormente atribuindo uma pontuação para cada um, estando descritos na tabela 1. Escores iguais ou superiores a 7 sugerem que a etiologia está relacionada a dumping e estimam a gravidade do quadro.
O manejo clínico envolve fracionamento da dieta com baixo volume (6 ou mais refeições por dia), restrição de ingesta de líquido durante as refeições (fazer ingesta 1h antes ou 1h depois), restrição de açúcar e carboidratos simples, aumento de ingesta de fibras e proteínas. O tratamento medicamentoso tem como objetivo retardar o trânsito alimentar e pode ser realizado com espessantes como goma guar e pectina porém a aderência ao tratamento é baixa devido ao paladar. Octreotide pode ser usado em casos de dumping precoce ou tardio, porém possui algumas desvantagens como administração subcutânea, custo elevado e tendência a formação de cálculos, sendo pouco utilizado. A medicação mais utilizada é a acarbose, um inibidor da alfa-glicosidase intestinal, que interfere na digestão de carboidratos reduzindo a resposta insulínica e hipoglicemia, com boa resposta para casos de dumping tardio.
Alguns pacientes apresentam quadros moderados a graves de difícil manejo, sendo refratários a modificação dos hábitos alimentares e ao tratamento medicamentoso. Em situações assim, acabamos nos deparando com uma encruzilhada entre o impacto negativo na qualidade de vida do paciente que consegue reduzir um pouco os sintomas do dumping, porém ainda possui queixas persistentes, enquanto o tratamento através de abordagem cirúrgica revisional possui sua própria morbidade e riscos.
Métodos:
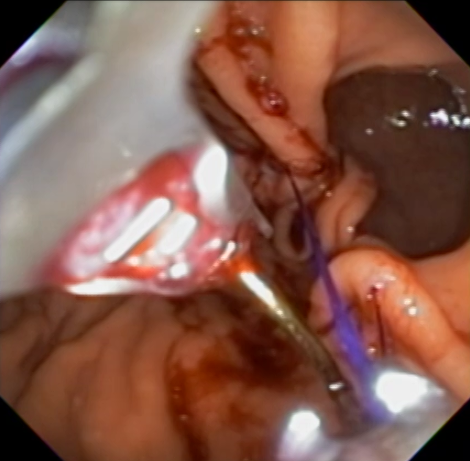
Os autores realizaram um estudo prospectivo, em dois centros terciários (Estados Unidos e Alemanha), entre os anos de 2014 e 2018, envolvendo pacientes com queixa de dumping no pós operatório de bypass gástrico em Y de Roux, submetidos a tratamento endoscópico através de remodelamento da anastomose gastrojejunal (endoscopic transoral outlet reducion – TORe) com uso de sutura endoscópica e plasma de argônio.
Foram avaliados o peso e IMC em três momentos (antes da cirurgia, no momento da intervenção endoscópica e no seguimento com 3 meses), a intensidade das queixas de dumping através do escore de Sigstad e uso de medicação sintomática para dumping (antes e depois da intervenção).
O procedimento foi realizado por apenas um médico especialista em cada centro, utilizando aparelho terapêutico (duplo canal). Inicialmente foi realizada aplicação de plasma de argônio no pouch gástrico com potência de 55W. Foi utilizado dispositivo de sutura de parede total modelo Overstich, iniciando a sutura na face jejunal utilizando fio de prolene, com pontos interrompidos em forma de oito ou separados, com objetivo final de reduzir a anastomose para 10mm. Os pacientes receberam prescrição de antieméticos, analgésicos e foram orientados a manter dieta específica por 2 semanas. Não há detalhamento sobre o tipo de dieta prescrita.
Foi definida como falha terapêutica a necessidade de repetir o procedimento (TORe), utilizar sondas alimentares ou necessitar de cirurgia de reversão do bypass.
Resultados:
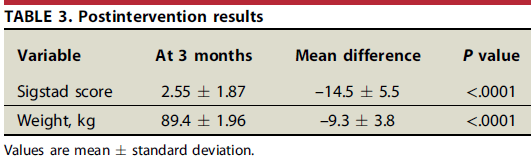
O procedimento foi realizado em 115 pacientes, com idade média de 44,7 ± 9 anos, predominantemente sexo feminino (84%), em média 8,9 ± 1,1 anos após o bypass. A anastomose gastrojejunal possuia em média 39,8 ± 6,7mm antes do procedimento. A maior parte dos pacientes (87%, n=100) fazia uso de terapêutica medicamentosa com acarbose para controle do quadro de dumping. O escore de sigstad era de 17,02 ± 6,1 no momento da intervenção.
Foi obtido sucesso técnico em 100% dos casos, com tempo médio de 38,9 ± 17,3min para realização do procedimento, necessitando em média de 3 suturas (2-5).
O procedimento teve sucesso em controlar o dumping após 3 meses em 97% dos casos (n=109), com interrupção do uso de medicação em todos pacientes nesse grupo.
Houve falha em 6 pacientes, dos quais três foram referenciados para tratamento cirúrgico e três foram submetidos a novo procedimento endoscópico por apresentarem anastomose gastrojejunal ampla durante exame de controle. Não há relato do índice de sucesso nesse grupo de três pacientes que foi submetido a novo procedimento (TORe).
Não houve eventos adversos graves como sangramento, perfuração, estenose ou óbito.
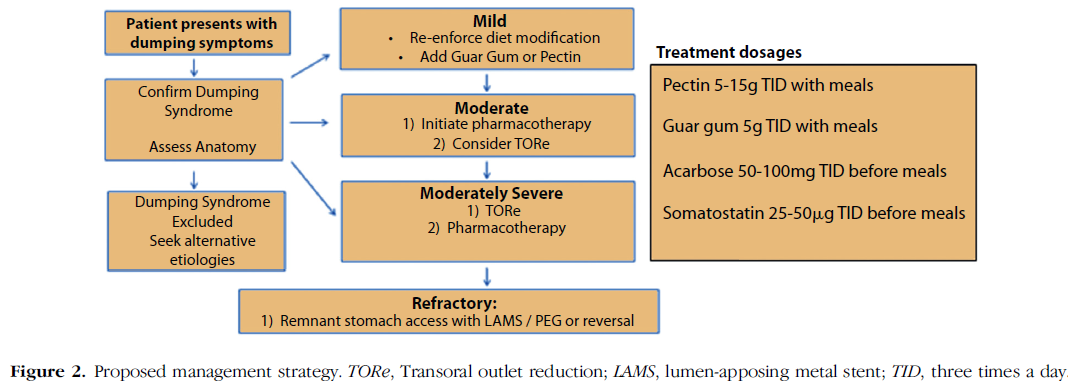
Os autores sugerem o seguinte fluxograma para manejo de dumping após bypass gástrico em Y de Roux.
Considerações
A publicação é muito interessante por apresentar uma alternativa eficaz, segura e minimamente invasiva para tratamento de casos refratários ou muito sintomáticos de dumping pós bypass gástrico em Y de Roux. Trata-se de estudo prospectivo, embora sem caso controle, com casuística bastante relevante, envolvendo 115 pacientes, majoritariamente com dumping moderado a severo (escore de 17) com resposta satisfatória na redução do escore para valores inferiores a 7 (não sugestivo de dumping) em 97% dos casos. Dos 6 casos de falha terapêutica, apenas três foram encaminhados para cirurgia. O artigo incluiu como falha três pacientes que foram submetidos a novo procedimento endoscópico através da técnica de TORe porém seria interessante que fosse relatada a resposta deste pequeno grupo ao procedimento.
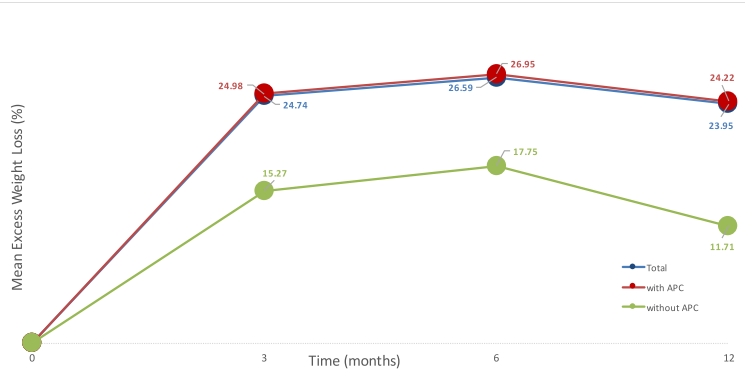
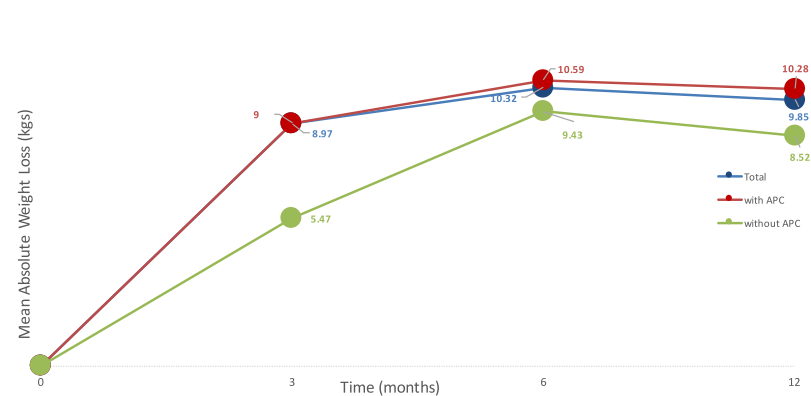
Embora o seguimento seja curto, de apenas 3 meses, temos outras publicações na literatura mostrando manutenção de perda de peso após TORe com seguimento mais longo, sendo razoável extrapolar esses resultados para o caso de dumping. Brunaldi publicou trabalho comparando sutura isoladamente e sutura associada a plasma de argônio para perda de peso sendo evidenciada de perda do excesso de peso após TORe de 24,98%, 26,95% e 24,22% em 3, 6 e 12 meses, respectivamente.
Uma importante limitação do procedimento está relacionada ao custo elevado que ainda está associado aos dispositivos de sutura endoscópica, além de quantidade restrita de endoscopistas com experiência em seu uso. Com o tempo, espera-se uma redução dos custos e popularização do método.
Para saber mais sobre este tema e outros relacionados, acesse o site Gastropedia clicando aqui!
Referências:
Artigo original: Vargas EJ, Abu Dayyeh BK, Storm AC, Bazerbachi F, Matar R, Vella A, et al. Endoscopic management of dumping syndrome after Roux-en-Y gastric bypass: a large international series and proposed management strategy. Gastrointest Endosc 2020;92(1):91–6.
Outras referências:
Brunaldi VO, Jirapinyo P, Turiani D, De Moura H, Okazaki O, Bernardo WM, et al. Endoscopic Treatment of Weight Regain Following Roux-en-Y Gastric Bypass: a Systematic Review and Meta-analysis. 2017;
Berg P, McCallum R. Dumping Syndrome: A Review of the Current Concepts of Pathophysiology, Diagnosis, and Treatment. Dig Dis Sci. 2016;61(1):11–8.
Moon RC, Teixeira AF, Neto MG, Zundel N, Sander BQ, Ramos FM, et al. Efficacy of Utilizing Argon Plasma Coagulation for Weight Regain in Roux-en-Y Gastric Bypass Patients: a Multi-center Study. Obes Surg. 2018;28(9):2737–44.