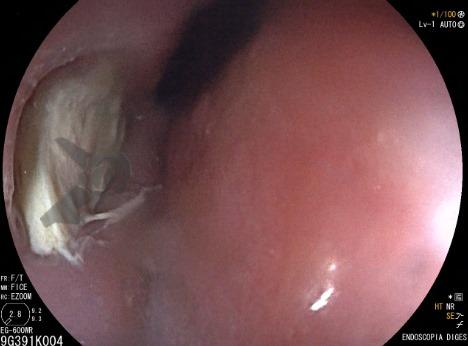
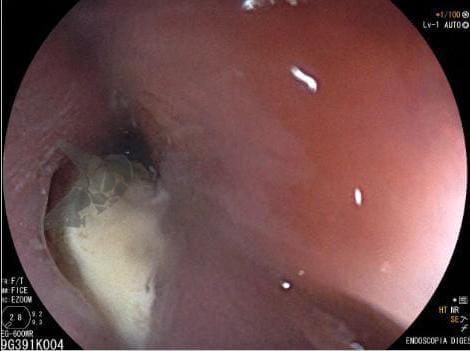
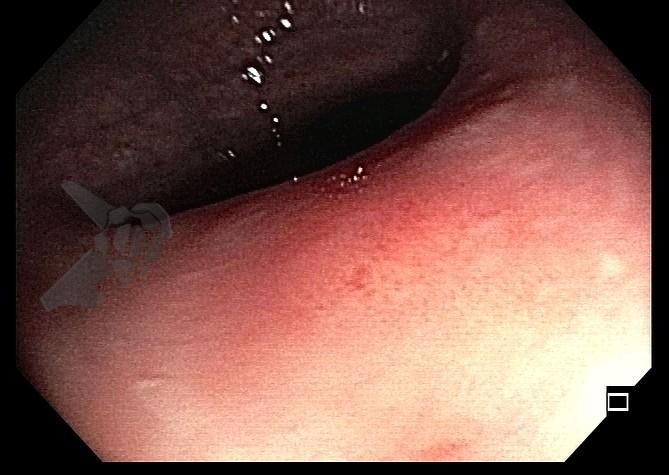
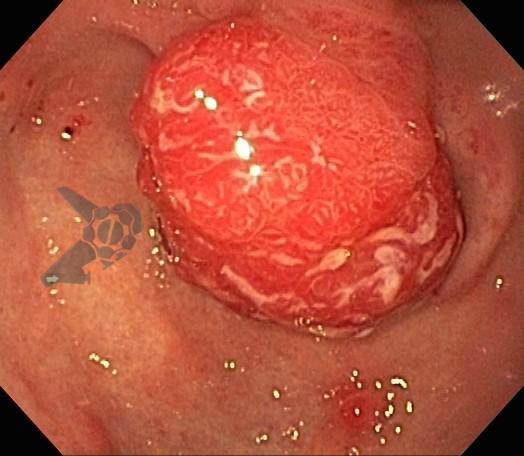
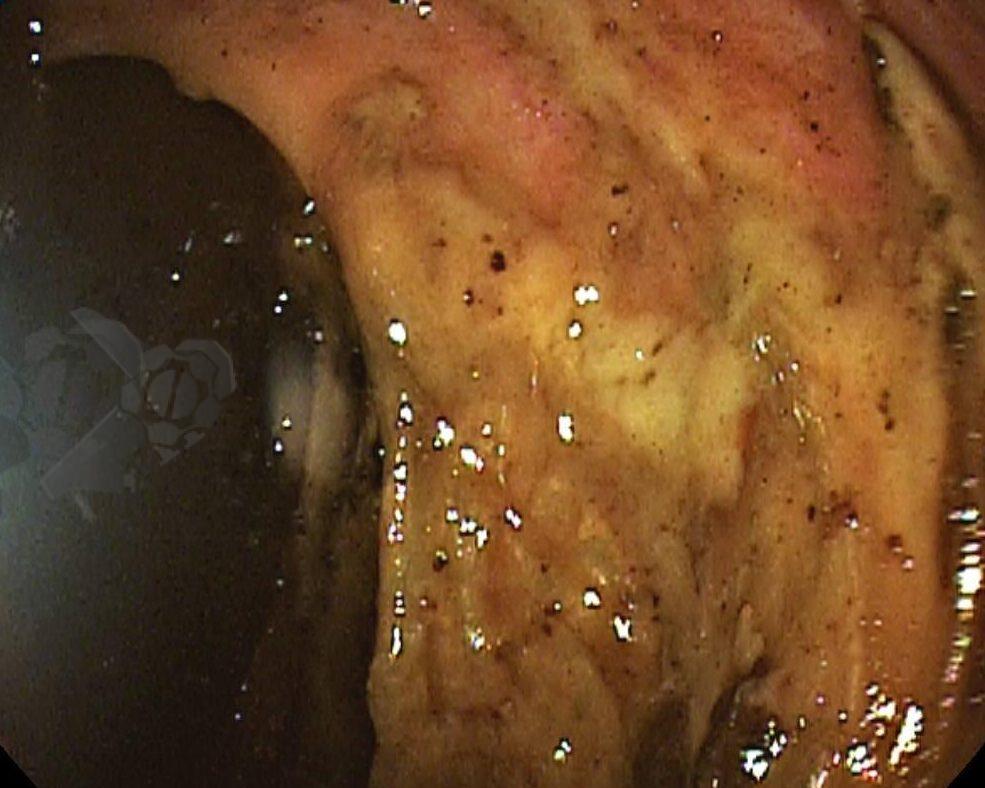
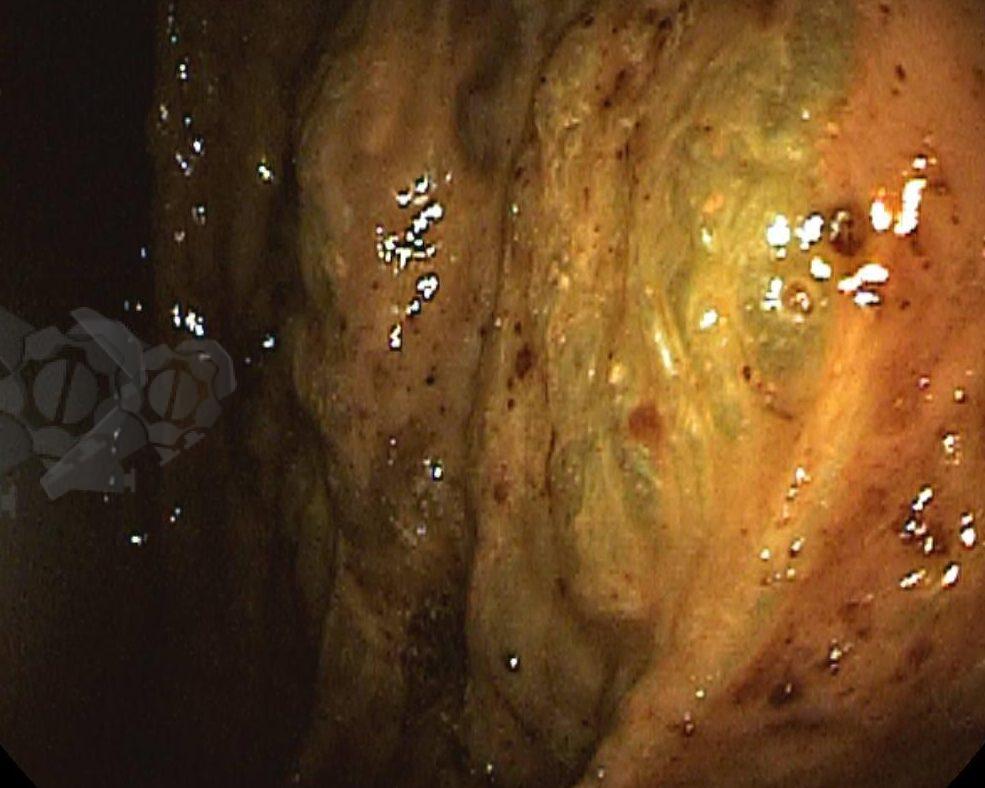
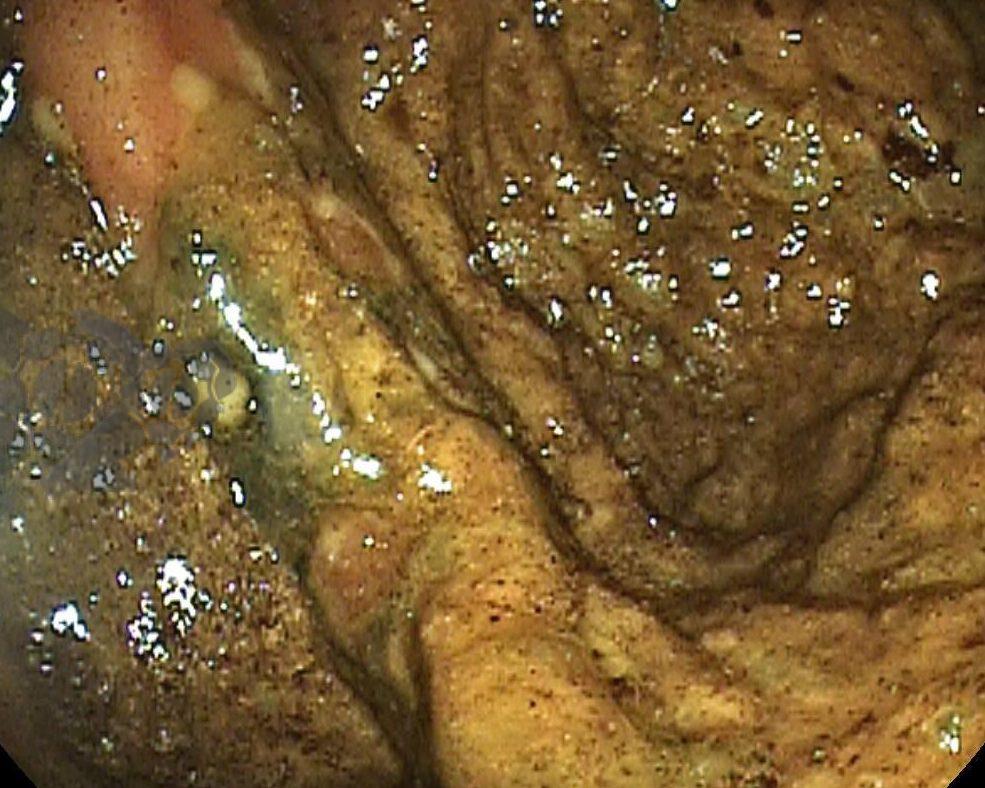
Esôfago de Barrett e Vigilância Endoscópica: o que as diretrizes recomendam e o que o BOSS Trial revela
Introdução
O adenocarcinoma de esôfago apresenta incidência crescente nas últimas décadas e mantém prognóstico reservado, com taxa global de sobrevida em cinco anos de aproximadamente 17%¹.
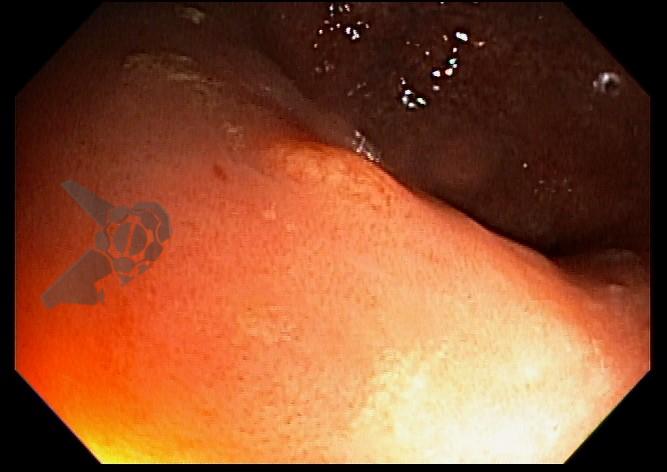
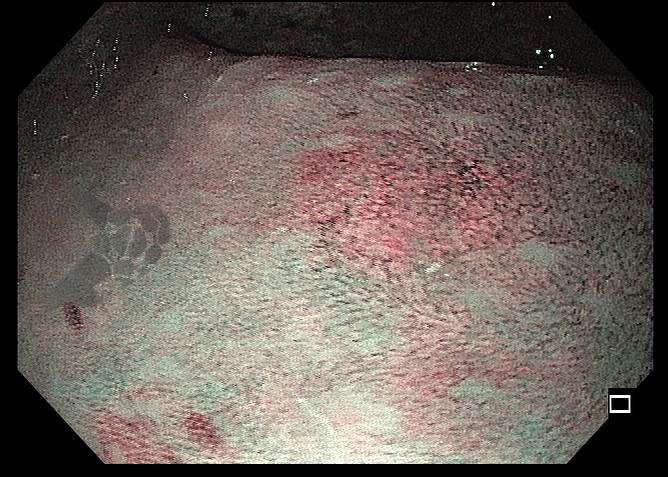
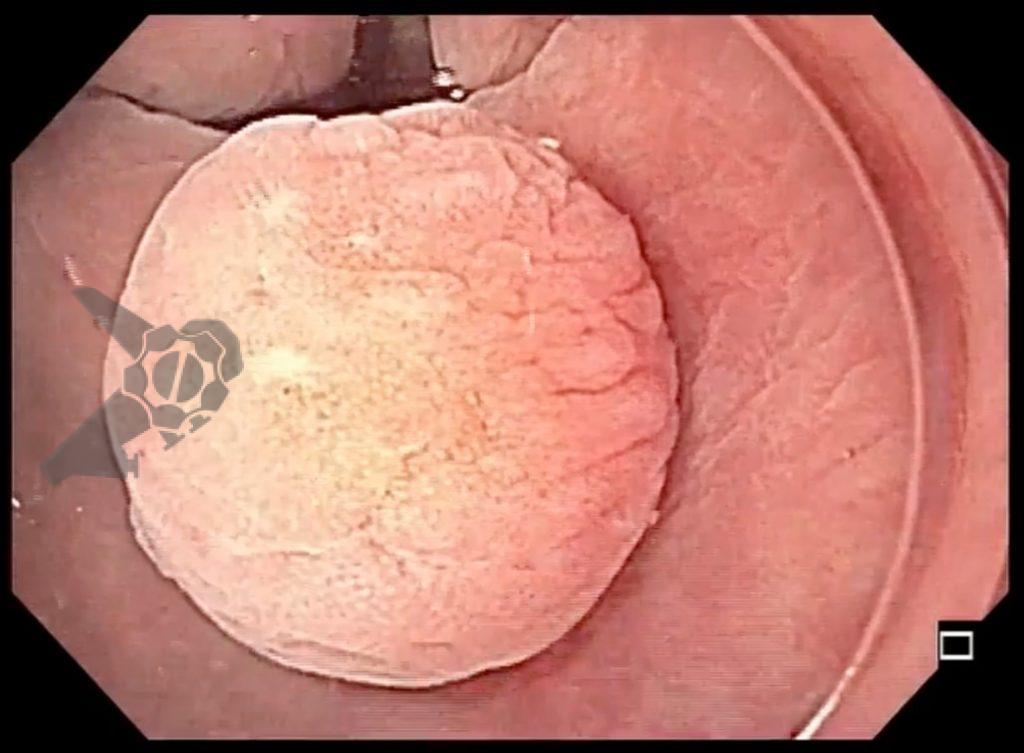
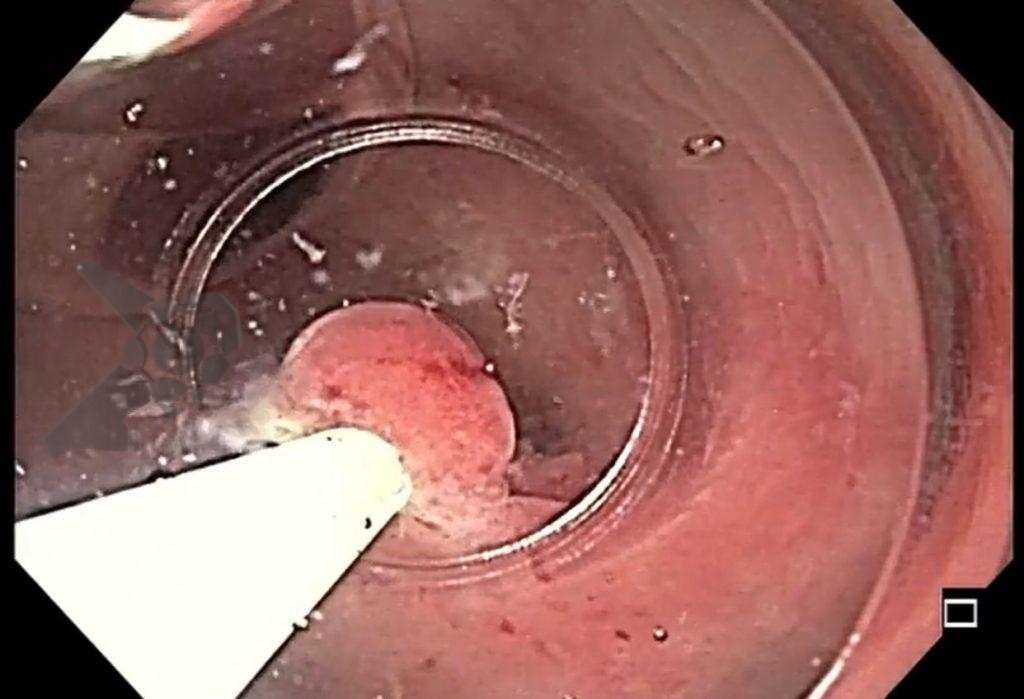
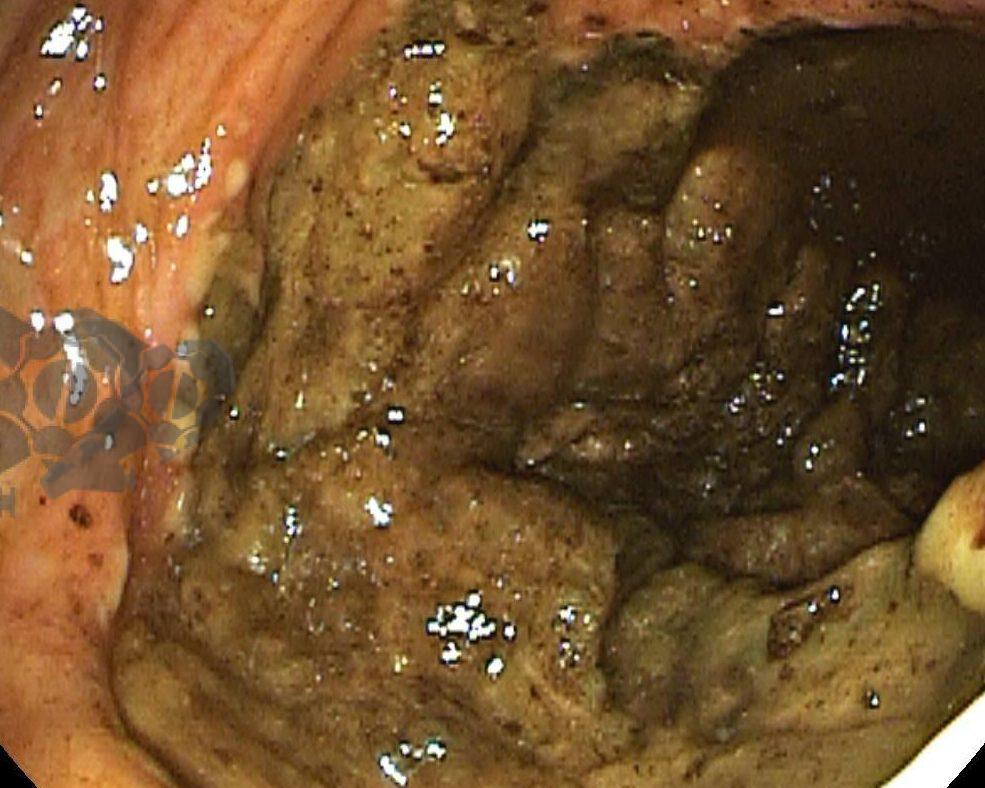
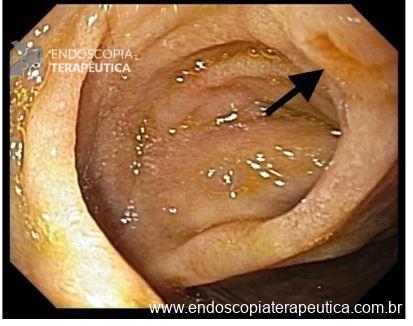
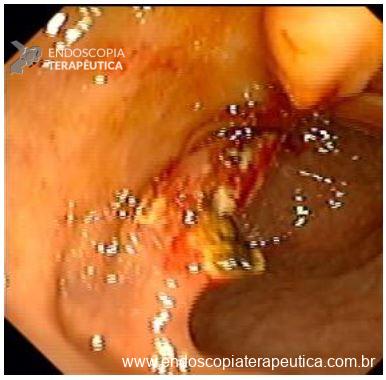
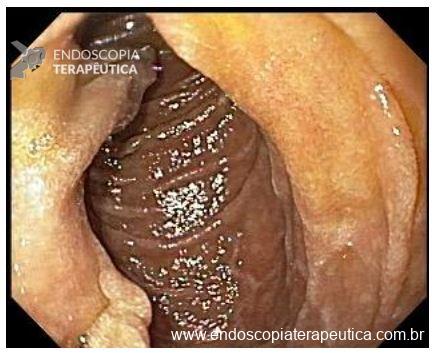
O esôfago de Barrett constitui a principal lesão precursora desse tipo de neoplasia, razão pela qual múltiplas sociedades médicas recomendam a vigilância endoscópica periódica como estratégia para detecção precoce de displasia e câncer inicial. Entretanto, as evidências que embasam a vigilância endoscópica em pacientes com esôfago de Barrett, em especial no que se refere ao intervalo ideal entre os exames, permanecem limitadas já que a maioria vem de estudos observacionais. Estudos populacionais indicam risco anual relativamente baixo de progressão para adenocarcinoma, variando de 0,12% a 0,22%¹. Portanto, atualmente, a qualidade da evidência que sustenta a vigilância endoscópica é muito baixa.
Nesse contexto, um recente estudo multicêntrico randomizado realizado no Reino Unido trouxe uma visão diferente da vigilância endoscópica dos pacientes diagnosticados com Esôfago de Barrett: a vigilância não melhorou a sobrevida global ou a sobrevida específica do câncer. A endoscopia sob demanda pode ser uma alternativa segura para pacientes de baixo risco¹.
Diretrizes atuais
As recomendações de vigilância endoscópica para pacientes com esôfago de Barrett apresentam pequenas variações entre as sociedades americana e europeia. A diretriz da American College of Gastroenterology (ACG) orienta que, na ausência de displasia, pacientes com segmentos <3 cm sejam submetidos à vigilância a cada 5 anos, enquanto aqueles com segmentos ≥3 cm devem ser acompanhados a cada 3 anos. Para casos de displasia de baixo grau não tratados endoscopicamente, a recomendação é de vigilância semestral no primeiro ano, seguida de acompanhamento anual².
Já a European Society of Gastrointestinal Endoscopy (ESGE) estabelece intervalos de 5 anos para segmentos de 1 a 3 cm e de 3 anos para segmentos entre 3 e 10 cm, recomendando ainda que pacientes com segmentos ≥10 cm sejam encaminhados a centros especializados³.
O artigo
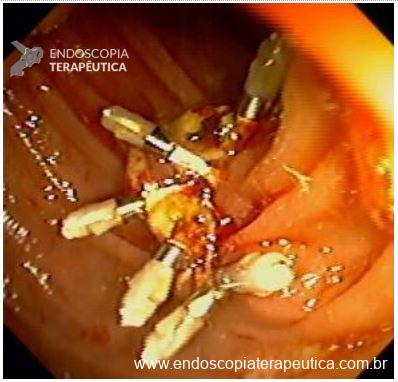
O estudo BOSS foi o primeiro ensaio clínico randomizado e o maior já realizado sobre vigilância endoscópica no esôfago de Barrett. Foi um estudo multicêntrico aberto realizado no Reino Unido com 3452 pacientes randomizados e mais de 39.500 anos-paciente de seguimento. O objetivo foi comparar duas estratégias: endoscopia programada a cada 2 anos versus endoscopia apenas em caso de sintomas ou necessidade clínica.
O desfecho primário foi mortalidade por todas as causas, enquanto os desfechos secundários incluíram mortalidade por câncer, incidência de adenocarcinoma de esôfago e estágio da doença ao diagnóstico. O seguimento mediano foi de 12,8 anos, o que permitiu uma avaliação robusta da evolução da doença.
Nos resultados, observou-se que não houve diferença significativa entre os grupos em relação à mortalidade global: 333 mortes (19,2%) no grupo de vigilância versus 356 mortes (20,7%) no grupo sob demanda (HR 0,95; IC 95% 0,82–1,10). Da mesma forma, a mortalidade por câncer foi semelhante: 108 óbitos (32,4% das mortes) no grupo de vigilância contra 106 (29,8%) no grupo sob demanda (HR 1,01; IC 95% 0,77–1,33). Em relação à progressão para adenocarcinoma de esôfago, os números também foram muito próximos: 40 casos (2,3%) no grupo de vigilância e 31 casos (1,8%) no grupo sob demanda (HR 1,32; IC 95% 0,82–2,11), sem diferença estatisticamente significativa. Além disso, o estágio do câncer no momento do diagnóstico foi semelhante nos dois grupos, sem evidências de detecção mais precoce entre os pacientes em vigilância regular.
Outro achado relevante foi o impacto no uso de recursos: o grupo de vigilância realizou 6124 endoscopias, em comparação com 2424 no grupo sob demanda, resultando em uma taxa 1,6 vezes maior de procedimentos. Apesar do número elevado de exames, não houve melhora nos desfechos clínicos principais¹.
Limitações do estudo
1- Desfecho primário escolhido:
O estudo usou mortalidade geral como desfecho primário, porque a causa específica de morte pode ser registrada de forma imprecisa.
Embora essa escolha aumente a robustez, pode diluir um eventual efeito específico da vigilância sobre a mortalidade por câncer de esôfago.
2- Estimativas iniciais superestimadas
O cálculo do tamanho amostral foi baseado em um risco de progressão para adenocarcinoma de esôfago de 1% ao ano, valor aceito em 2009.
Estudos mais recentes e os próprios dados do BOSS mostraram que o risco real é muito menor (~0,2% ao ano). Isso reduziu o poder do estudo para detectar diferenças entre os grupos.
3- Contaminação entre grupos:
Parte dos pacientes do grupo de vigilância não fez todas as endoscopias programadas. Enquanto no grupo “sob demanda”, 59% acabaram fazendo ao menos uma endoscopia. Essa sobreposição de condutas pode ter aproximado os resultados dos dois braços.
4- Intervalo prático entre endoscopias:
Embora o protocolo previsse exames a cada 2 anos, na prática o intervalo médio foi de 3 anos, refletindo dificuldades logísticas e adesão incompleta. Isso pode ter atenuado potenciais diferenças.
5- População estudada:
A maioria dos participantes era de raça branca, o que limita a generalização dos achados para outras populações.
6- Não cegamento:
Nem pacientes nem médicos puderam ser cegados quanto à alocação, o que pode introduzir algum viés em desfechos subjetivos, como estadiamento do câncer.
7- Avanços tecnológicos não incorporados:
Durante o período do estudo, surgiram novas técnicas endoscópicas e ferramentas de inteligência artificial para detecção precoce, que não foram avaliadas¹.
Conclusão
Os resultados do estudo BOSS trazem uma contribuição importante para a compreensão do real papel da vigilância endoscópica no esôfago de Barrett. Apesar de as principais diretrizes internacionais recomendarem endoscopias periódicas como forma de detectar precocemente displasias e adenocarcinomas, o estudo demonstrou que a estratégia de vigilância programada a cada dois anos não reduziu a mortalidade global nem a mortalidade específica por câncer, quando comparada à realização de endoscopias apenas sob demanda. O estágio dos tumores diagnosticados foi semelhante entre os grupos, o que indica que a vigilância intensiva não resultou em detecção mais precoce da doença. Esses achados desafiam o as diretrizes atuais e colocam em discussão a real efetividade da vigilância sistemática em pacientes com Barrett não displásico.
Outro ponto relevante do estudo foi a constatação de que o risco anual de progressão para adenocarcinoma é baixo, em torno de 0,2% ao ano, valor inferior ao que embasou as recomendações das diretrizes vigentes. Mesmo com quase três vezes mais endoscopias realizadas no grupo de vigilância, não houve ganho clínico significativo, o que levanta questionamentos sobre a custo-efetividade e a necessidade de exames tão frequentes. Embora tenha sido observada uma tendência de menor mortalidade entre pacientes acima de 65 anos submetidos à vigilância periódica, os autores ressaltam que esse achado deve ser interpretado com cautela, por se tratar de uma análise exploratória e sem base causal definida.
Embora esse único estudo não seja suficiente para alterar as atuais recomendações, ele levanta questionamentos sobre as estratégias de acompanhamento do esôfago de Barrett. Talvez a vigilância endoscópica deva ser direcionada de forma mais individualizada, considerando fatores como idade, extensão do segmento, sexo, comorbidades e presença de displasia. A endoscopia sob demanda pode vir a ser uma alternativa segura e com menos custo em pacientes de baixo risco.
Veja mais: Esôfago de Barrett: guideline da ACG 2022 • Endoscopia Terapeutica
Referências
- Old O, Jankowski J, Attwood S, Stokes C, Kendall C, Rasdell C, Zimmermann A, Massa MS, Love S, Sanders S, Deidda M, Briggs A, Hapeshi J, Foy C, Moayyedi P, Barr H; BOSS Trial Team. Barrett’s Oesophagus Surveillance Versus Endoscopy at Need Study (BOSS): A randomized controlled trial.
Gastroenterology.
2025 Apr 1:S0016-5085(25)00587-6. doi: 10.1053/j.gastro.2025.03.021. Epub ahead of print. PMID: 40180292. - Shaheen NJ, Falk GW, Iyer PG, Souza RF, Yadlapati RH, Sauer BG, Wani S. Diagnóstico e tratamento do esôfago de Barrett: uma diretriz atualizada da ACG.
Am J Gastroenterol.
2022 Apr;117(4):559-587. doi: 10.14309/ajg.0000000000001680. - Weusten BLAM, Bisschops R, Dinis-Ribeiro M, di Pietro M, Pech O, Spaander MCW, Baldaque-Silva F, Barret M, Coron E, Fernández-Esparrach G, Fitzgerald RC, Jansen M, Jovani M, Marques-de-Sa I, Rattan A, Tan WK, Verheij EPD, Zellenrath PA, Triantafyllou K, Pouw RE. Diagnosis and management of Barrett esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Guideline.
Endoscopy.
2023 Dec;55(12):1124-1146. doi: 10.1055/a-2176-2440. Epub 2023 Oct 9. PMID: 37813356.
Como citar este artigo
Rabelo PS, Retes FA. Esôfago de Barrett e Vigilância Endoscópica: o que as diretrizes recomendam e o que o BOSS Trial revela. Endoscopia Terapeutica, 2025 Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/esofago-de-barrett-e-vigilancia-endoscopica-o-que-as-diretrizes-recomendam-e-o-que-o-boss-trial-revela/