MAPS III (ESGE 2025): Novas Recomendações para Lesões Gástricas
A ESGE atualizou as diretrizes para o manejo de condições gástricas pré-neoplásicas e neoplasias precoces, incorporando novas ferramentas de estratificação de risco, vigilância endoscópica e recomendações práticas para a rotina do endoscopista.
Principais Novidades
- Introdução do rastreamento endoscópico para câncer gástrico.
- Estratificação de risco baseada em atrofia e metaplasia intestinal.
- Definição de intervalos de vigilância conforme grau de alteração histológica.
- Uso recomendado das classificações Kimura-Takemoto (atrofia) e EGGIM (metaplasia).
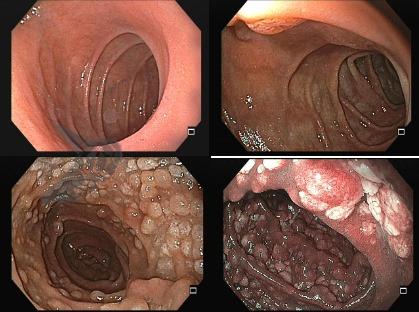
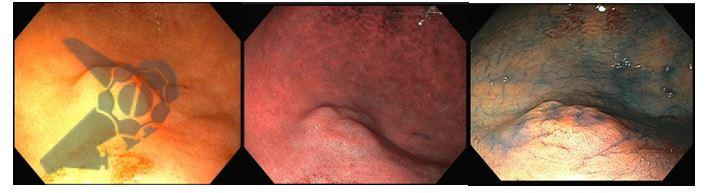
- Implementação rotineira de cromoscopia virtual (NBI/BLI) para guiar biópsias.
O que Permanece
- Protocolo de biópsias de acordo com o Protocolo de Sydney.
- Erradicação do H. pylori como pilar central.
- Critérios de indicação e cura pós-ESD.
- Vigilância individualizada para grupos de risco.
Aplicações Práticas
1. Rastreamento populacional
Risco populacional:
- Alto risco (>20/100.000): EDA a cada 2–3 anos.
- Risco intermediário (10–20/100.000): EDA a cada 5 anos.
- Baixo risco (<10/100.000): não indicado.
Risco familiar (1º grau):
- Início da EDA aos 45 anos ou 10 anos antes do diagnóstico do familiar.
- Testes não invasivos para H. pylori entre 20–30 anos.
Idosos (>80 anos assintomáticos):
- Screening e vigilância devem ser suspensos.
2. Exame Endoscópico de Alta Qualidade
- Cromoscopia virtual para rastreamento, estadiamento e vigilância.
- Biópsias dirigidas: 2 fragmentos de antro/incisura e 2 do corpo.
- Incisura angularis é opcional (útil se não houver cromoscopia).
- Usar Kimura-Takemoto e EGGIM para estratificação de risco.
- Caracterização detalhada de lesões (Paris, padrão mucoso e vascular, etc).
- Fotodocumentação adequada.
- Uso de IA, se disponível.
3. Exames de Estadiamento Pré-Ressecção
- EUS, TC e RM não são rotineiros.
- Indicados apenas se suspeita de invasão submucosa ou ausência de critério para ressecção endoscópica.
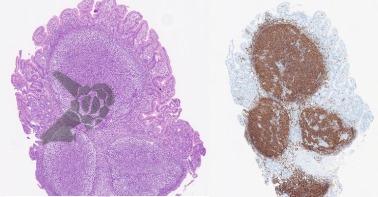
4. Exame Histopatológico
- Avaliar grau de displasia, tipo histológico (Lauren/WHO).
- Severidade de atrofia e metaplasia intestinal.
- Infecção por H. pylori.
- Usar termos metaplasia completa/incompleta (não usar tipo I/II/III).
- Recomenda-se uso de OLGA/OLGIM para estratificação.
5. Indicações de Ressecção Endoscópica (não modificada)
- Displasia em biópsias randomizadas: repetir EDA em 6-12 meses conforme o grau.
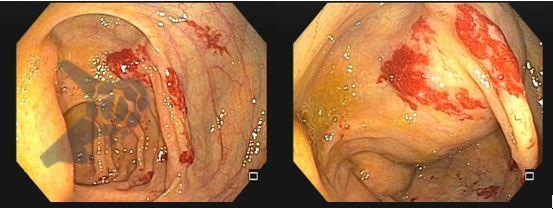
- ESD é o tratamento de escolha nas lesões superficiais.
- EMR: alternativa para IIa ≤ 10 mm de baixo risco.
- Indicações de ESD: depende de diferenciação, ulceração e tamanho.
- Lesões bem diferenciadas (displasias ou neoplasia intramucosa)
- qualquer tamanho se NÃO ulcerada
- ≤ 30 mm se ulcerada
- Lesões com invasão mínima da submucosa, NÃO ulcerada, pode ser considerado ESD nas seguintes situações:
- bem diferenciadas e ≤ 30 mm
- indiferenciadas e ≤ 20 mm
- Levar em consideração idade e comorbidades na tomada de decisão
- Lesões bem diferenciadas (displasias ou neoplasia intramucosa)
- Levar em consideração idade e comorbidades na tomada de decisão
6. Critérios de Cura Pós-Ressecção (não modificados)
Curativo / muito baixo risco (risco de LFN < 0,5-1%): ressecção en bloc, displasia ou pT1a, bem diferenciado, sem invasão linfovascular – Sem necessidade de investigação ou tratamento adicional.
- independentemente do T se não houver ulceração OU
- ≤ 30 mm se ulcerado
Curativo / baixo risco (risco de LFN < 3%) – Estadiamento + discussão multidisciplinar
Ressecção en bloc, sem invasão linfovascular E:
- pT1b, invasão ≤ 500 µm, bem diferenciado, ≤ 30 mm OU
- pT1a, pouco diferenciado, ≤ 20 mm, sem ulceração
Risco local (muito baixo risco de LFN, alto risco de recorrência local ou persistência da lesão) – Vigilância, Retratamento)
Ressecção em piecemeal ou com margens horizontais comprometidas em lesão de muito baixo risco (ou baixo risco sem lesão submucosa na margem em caso de piecemeal ou sem margem horizontal positiva se pT1b)
NÃO curativo / Alto risco – ESTADIAMENTO e TRATAMENTO ADICIONAL (CIRURGIA)
- margem vertical positiva se CARCINOMA ou invasão LFV ou invasão profunda da submucosa (≥ 500 µm)
- pouco diferenciado se ulceração ou tamanho > 20 mm
- pT1b, bem diferenciado, SM ≤ 500 µm se ≥ 30 mm
- lesão intramucosa ulcerada > 30 mm
7. Seguimento
- EDA em 3–6 meses e anual após ressecção curativa ou risco local de recorrência.
- EDA 3/3 anos:
- Kimura C3+, EGGIM 5+, OLGA/OLGIM III/IV.
- Metaplasia gástrica intestinal em 1 segmento + história familiar 1º grau positiva ou metaplasia intestinal incompleta ou persistência da infecção pelo H. pylori
- EDA 1–2 anos
- Kimura C3+, EGGIM 5+, OLGA/OLGIM III/IV + história familiar 1º GRAU positiva
- Sem seguimento: atrofia leve/moderada ou metaplasia restrita ao antro sem fatores adicionais.
- Utilizar classificações endoscópicas validadas para estadiamento e estratificação de risco de atrofia e metaplasia intestinal (Kimura-Takemoto; EGGIM)
- Preferir biópsias dirigidas em relação a biópsias randomizadas no seguimento por estadiamentos avançados de Olga/Olgim.
- Recomenda-se erradicação do H. pylori em pacientes com gastrite (atrófica ou não), lesões pré-neoplásicas, neoplasia precoce após ressecção endoscópica, neoplasia avançada após ressecção cirúrgica.
Outras Recomendações
- Erradicar H. pylori em gastrite, lesões pré-neoplásicas e após ressecção.
- Cessar tabagismo.
- Manter IBP se houver indicação clínica.
- Considerar AAS em baixa dose se alto risco cardiovascular.
- Não usar suplementos (probióticos) preventivamente.
- Gastrite autoimune: EDA a cada 3 anos.
- Síndromes hereditárias ou câncer gástrico difuso: seguir diretrizes específicas.
Referência
Dinis-Ribeiro M, Libânio D, Uchima H, et al. Management of epithelial precancerous conditions and early neoplasia of the stomach (MAPS III): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), and European Society of Pathology (ESP) Guideline update 2025. Endoscopy. 2025;57(5):504–554. doi:10.1055/a-2529-5025.
Como citar este artigo
Casamali C. MAPS III (ESGE 2025): Novas Recomendações para Lesões Gástricas. Endoscopia Terapeutica 2025, Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/maps-iii-esge-2025-novas-recomendacoes-para-lesoes-gastricas/