Novos Antiagregantes e Anticoagulantes Orais – Manejo na endoscopia
Um grande número de pacientes tem feito uso de antiagregação plaquetária e anticoagulação contínuas em situações clínicas como fibrilação atrial, implante de valvas mecânicas, trombose venosa profunda e tromboembolismo pulmonar. Além das drogas tradicionalmente usadas, nos últimos anos, tornaram-se disponíveis novas drogas antitrombóticas para manejo destas patologias, com mecanismos de ação específico e que ainda são pouco familiares aos gastroenterologistas e endoscopistas.
Visando redução do riscos e um uso adequado das drogas antitrombóticas periprocedimentos, incluindo aqueles com abordagens endoscópicas, se faz necessário um adequado entendimento dos processos de hemostasia, dos mecanismos de ação dessas medicações, sua indicações de uso, farmacocinética e abordagem em caso de sangramento.
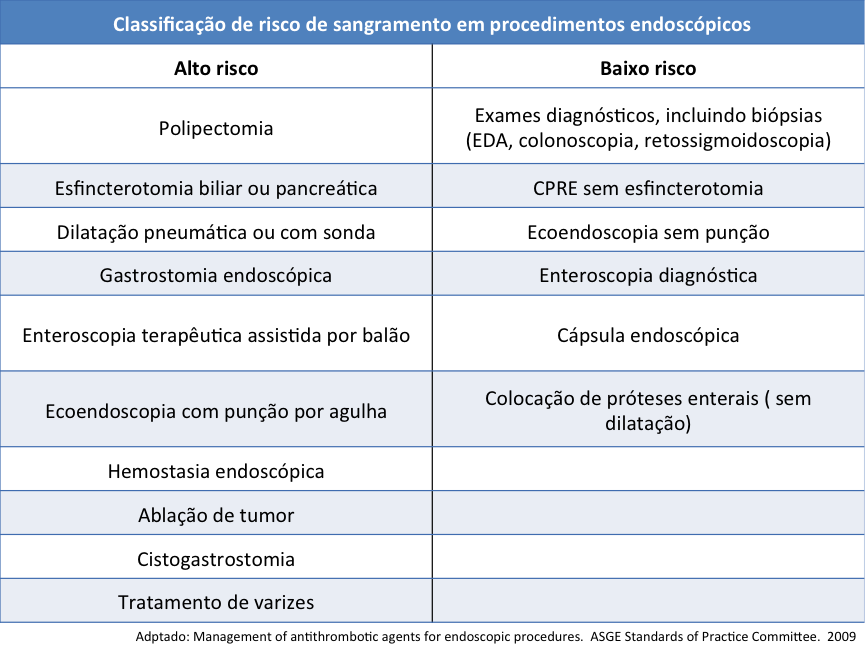
É importante salientar também, que o manejo dos antitrombóticos tem relação estrita com o risco benefício inerente a situação clínica do paciente e ao potencial sangramento do procedimento a ser realizado. A tabela abaixo classifica os principais procedimentos endoscópicos segundo seu risco de sangramento.
Tabela 1. Risco de sangramento em procedimentos endoscópicos
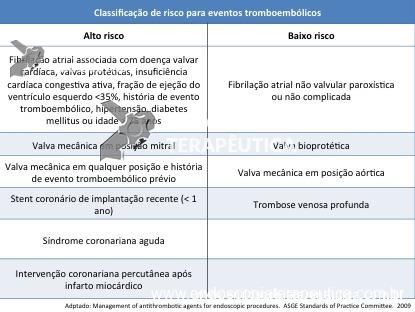
Tabela 2. Risco de eventos tromboembólicos associado a patologias
Vias de coagulação
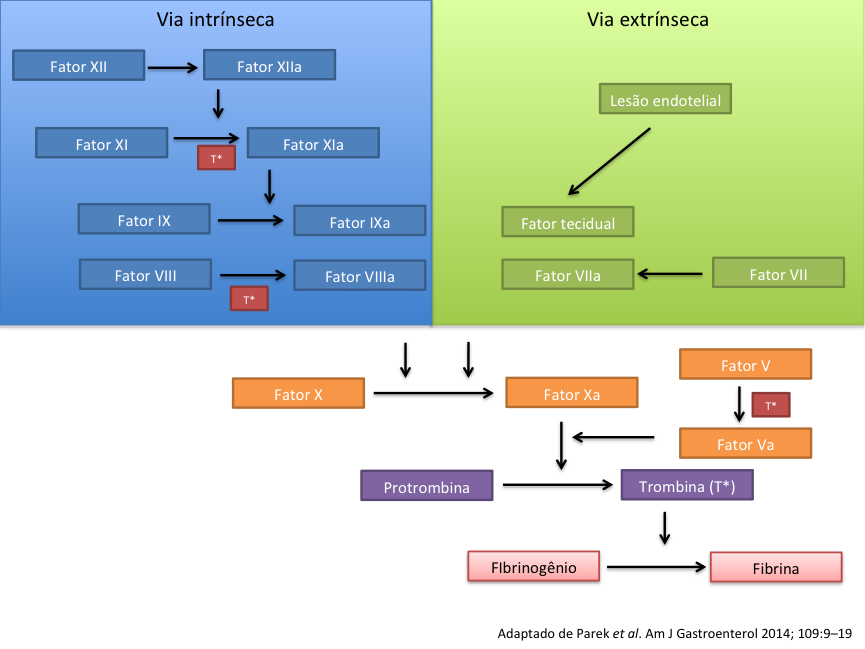
Para entender o sítio de atuação de cada droga, se faz fundamental uma breve revisão sobre hemostasia.
Sabe-se que interação entre o endotélio e a cascata de coagulação funciona como o ponto principal da hemostasia. Na hemostasia primária, o endotélio do vaso lesado libera difosfato de adenosina, serotonina e tromboxano A2. As plaquetas respondem a essas citocinas com a expressão de glicoproteína IIb/IIIa e a molécula de adesão celular plaqueta endotélio tipo 1 que levam a formação de um tampão plaquetário inicial. Após o lesão do endotélio também se desencadeiam as cascatas de coagulação em suas vias intrínseca e extrínseca que por fim resultam na formação de fibrina (Vide Figura 1)
Figura 1. Vias de coagulação intrínseca e extrínseca evidenciando os principais sítios de ações das novas drogas antitrombóticas
Novos Antitrombóticos
O termo antitrombóticos compila as drogas que possuem efeito ou anticoagulante, ou antiagregante plaquetário. Antes de abordarmos essas novas drogas vale lembrar que classicamente as principais drogas de uso antitrombótico são a Varfarina, que é um antagonista de vitamina K e funciona como anticoagulante, e o ácido acetil salicílico, que é um antiagregante plaquetário.
Apesar de possuir largo tempo de utilização e efetividade bem definida, a Varfarina possui alguns desvantagens frente as novas drogas anticoagulantes que são: sua estreita janela terapêutica e margem de segurança necessitando de monitorização laboratorial frequente, inicio lento de ação, com alcance de faixa terapêutica somente após alguns dias em muitos casos, e a potencial influência da dieta e outras medicações na sua atividade. Por outro lado, é uma droga difusamente conhecida, com potencial de reversão dos seus efeitos de modo rápido e fácil com uso de vitamina K ou mesmo plasma.
Entre os novos antitrombóticos disponíveis existem drogas que podem ser administradas oralmente, por via subcutânea ou intravenosos. Diante do cenário clínico mais frequente de pacientes fazendo uso de drogas por via oral, essas drogas serão as preferencialmente abordadas no texto.
Anticoagulante – Inibidores Xa
Representando pelo Rivaroxaban (Xarelto), os inibidores do fator Xa inibem competitivamente o fator X ativado e atuam da cascata como um todo, já que o fator X unifica as vias intrínseca e extrínseca da coagulação. Ao se associar com o fator Va o fator X forma um complexo chamado protrombinase que atua na transformação da protrombina em trombina. O rivaroxaban atua portanto prevenindo a formação da protrombinase e consequentemente da trombina.
Principais indicações: Fibrilação atrial não valvular e trombose venosa profunda.
Farmacodinâmica: Tomado oralmente uma ou duas vezes ao dia, com pico de concentração entre 2,5-4h e meia vida de 5-9h. Requer uso cauteloso em doentes renais crônicos e hepatopatas. Pode interagir com outras drogas que atuam no complexo do citocromo p450 e nos transportadores da glicoproteína P.
Anticoagulante – Inibidores diretos da trombina
Os inibidores diretos da trombina são representados pelas drogas Bivalirudina (Angiomax) e Dabigatran (Pradaxa). A Bivalirudina é um droga utilizada principalmente em procedimentos de intervenção coronariana percutânea. Já o Dabigatran é uma droga aprovada na prevenção de isquemia cerebral em casos de fibrilação atrial não valvular e no tromboembolismo venoso. Devido a sua maior importância clínica, será abordado preferencialmente o Dabigatran nesse texto
– Dabigatran
Farmacodinâmica : Dose oral, duas vezes ao dia, alcança um pico plasmático após 1-2 h e tem meia vida de 12- 17h. Possui eliminação renal principalmente, devendo ter dose reduzida em pacientes com ClCr 30–50 ml/min e evitado em pacientes com ClCr < 30 ml/min
Agentes reversores: Não há agente reversor disponível atualmente. Pode ser utilizado, se necessário, plasma fresco congelado.
Manejo em procedimentos endoscópicos: Em pacientes com função renal normal e submetidos a procedimentos com maior risco de sangramento, recomenda-se suspensão nos dois dias anteriores. Em procedimentos de baixo risco a suspensão 24 h antes é aceita.
Antiagregante plaquetários
As Tienopiridinas atuam bloqueando a agregação plaquetária dependente da adenosina difosfato que é liberada após a lesão endotelial, durante a hemostasia primária.
As principais drogas desse grupos são Clopidogrel (Plavix), Prasugrel (Effient) e Ticagrelor (Brillinta)
– Clopidogrel
Principais indicações: Síndrome coronariana aguda, prevenção de novo infarto miocárdico ou isquemia cerebral.
Farmacodinâmica: Via oral, uma vez ao dia, com pico plasmático após 1h e meia vida de 7-8h. Deve ser evitado em uso combinado com Omeprazol e Esomeprazol (metabolismo associado ao CYP2C19).
Agentes reversores: Não há agente reversor especifico disponível. Recomenda-se transfusão de plasma fresco congelado ou crioprecipitado.
Manejo em procedimentos endoscópicos: Clopidogrel deve ser descontinuado 5-7 dias antes de qualquer procedimento em que haja necessidade de terapêutica.
– Ticagrelor
Principais indicações: Usado na prevenção e tratamento de eventos isquêmicos cardiovasculares.
Farmacodinâmica : Dose única ou duas vezes ao dia, oral, com pico plasmático em 1,5 h e meia vida de 7 – 8,5h. Excreção hepática.
Agentes reversores: Não há agente reversor específico.Recomenda-se o uso de plasma fresco congelado e crioprecipitado;
Manejo em procedimentos endoscópicos: Ticagrelor deve ser descontinuado por pelo menos 5 dias antes de qualquer procedimento endoscópico terapêutico
– Prasugrel
Principais indicações: Usado na prevenção de eventos cardiovasculares trombóticos, em angina instável e infartos miocárdicos sem elevação do segmento ST
Farmacodinâmica: Indicado por via oral, em dose única diária, com pico de concentração plasmática de 0,5 h e meia vida de 2 – 15 h. Excretado principalmente na urina, contudo sem necessidade de modificação de doses em casos de disfunçãoo renal e hepática.
Agentes reversores: Não há agente reversor específico que possa ser usado em casos de sangramento em uso do Prasugrel. Recomenda-se uso de plasma fresco congelado ou crioprecipitados.
Manejo em procedimentos endoscópicos: Deve ser descontinuado pelo menos 7 dias antes de qualquer procedimento endoscópicos que envolva terapêutica.
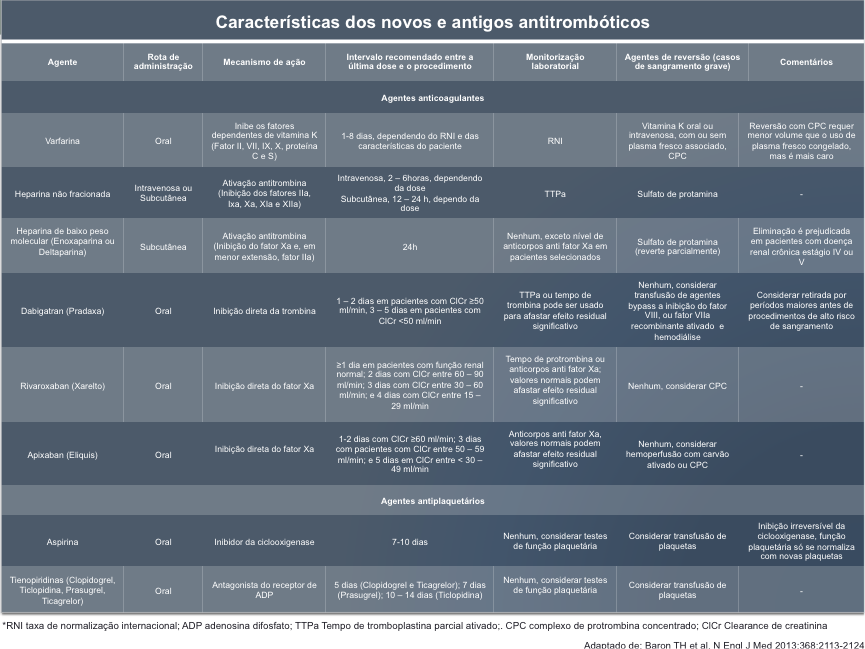
Tabela 2. Principais características das drogas antitrombóticas antigas e novas
Reintrodução dos Antitrombóticos
O tempo ideal de reintrodução do antitrombóticos, principalmente em procedimentos de alto risco de sangramento ou mesmo após hemostasia endoscópica não é bem determinado. É necessário sempre balancear os risco de trombose e sangramento precoce e tardio frente ao quadro clínico apresentando. Pacientes com menor risco de sangramento tardio, podem ser manejados com reintrodução das drogas após 12-24 h. Já nos pacientes com maior risco de sangramento tardio o ideal seria aguardar ao menos 48 h para reinicio de anticoagulação.
Referências:
1. Boustiere C, Veitch A, Vanbiervliet G, et al. Endoscopy and antiplatelet agents: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2011;43:445-461
2. Anderson MA, Ben-Menachem T, Gan SI, et al. Management of antithrombotic agents for endoscopic procedures. Gastrointest Endosc 2009;70:1060-1070
3. Todd H. Baron, Patrick S. Kamath, and Robert D. McBane. Management of Antithrombotic Therapy in Patients Undergoing Invasive Procedures. N Engl J Med 2013; 368:2113-2124
4. Parekh PJ, Merrell J, Clary M, et al. New anticoagulants and antiplatelet agents: a primer for the clinical gastroenterologist. Am J Gastroenterol 2014; 109:9–19.