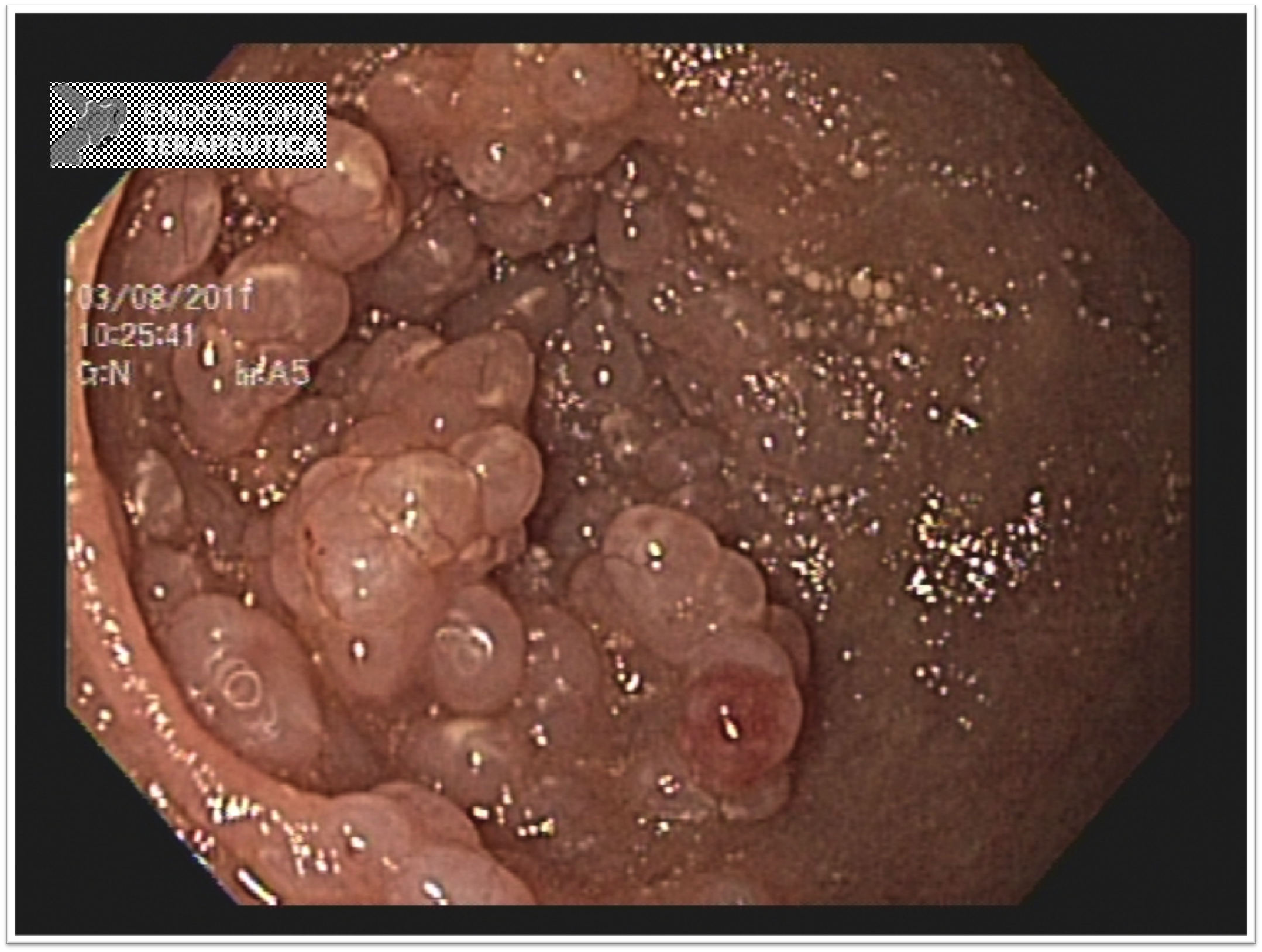
Tratamento endoscópico de varizes de fundo gástrico
O sangramento digestivo originado de varizes gástricas (VG) costuma ser menos frequente, contudo, com uma potencial maior gravidade do que o sangramento proveniente de varizes esofágicas.
Sabe-se que até 50% dos pacientes com doença crônica parenquimatosa do fígado podem apresentar VG. Entre os principais fatores de risco para o sangramento de VG estão:
- Localização de varizes gástricas (IGV1 > GOV2 > GOV1)
- Tamanho das varizes (grosso > médio > pequeno)
- Gravidade da disfunção hepática (Child C > B > A) ou MELD (Model for End-Stage Liver Disease) maior ou igual a 17
- Presença de sinais da cor vermelha na VG
- Carcinoma hepatocelular concomitante
- Presença de gastropatia hipertensiva portal
A classificação endoscópica mais utilizada no caso de varizes gástrica é a de Sarin que se baseia na localização das varizes no estômago e estuda a sua relação com as varizes esofagianas propondo 04 subtipos:
– Variz esofagogástrica (GOV) tipo 1 – associa a presença de varizes esofágicas com varizes gástricas seguindo pela pequena curvatura
– Variz esofagogástrica (GOV) tipo 2 – associa a presença de varizes esofágicas com varizes gástricas seguindo pelo fundo gástrico
– Variz gástrica isolada (IGV) tipo 1 – varizes de fundo gástrico isoladas
– Variz gástrica isolada (IGV) tipo 2 – varizes gástricas ectópicas ou na primeira parte do duodeno
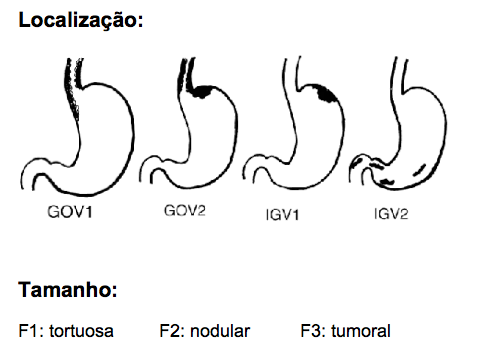
Sabe-se que cerca de 70% das VG são representadas pelo subtipo GOV 1.
Tratamento endoscópico de varizes gástricas
Entre as modalidades endoscópicas disponíveis no tratamento de VG sangrantes podemos citar:
- Escleroterapia de VG
Apesar de ser uma técnica potencialmente efetiva, costuma requerer alto volume de injeção de solução esclerosante com maiores taxas de complicação e menos sucesso técnico. As taxas de controle de sangramento relatadas com essa técnica variam entre 60 – 100% dos casos, mas com taxas variáveis de ressangramento, podendo alcançar até 90%, principalmente nos casos de GOV 2 e IGV 1. A escleroterapia portanto é uma técnica que pode ser útil no sangramento principalmente de GOV 1. As soluções usualmente utilizadas são as mesmas para varizes esofagianas, entre eles cita-se principalmente o oleato de etanolamina
- Obturação (ou obliteração) de VG com cola:
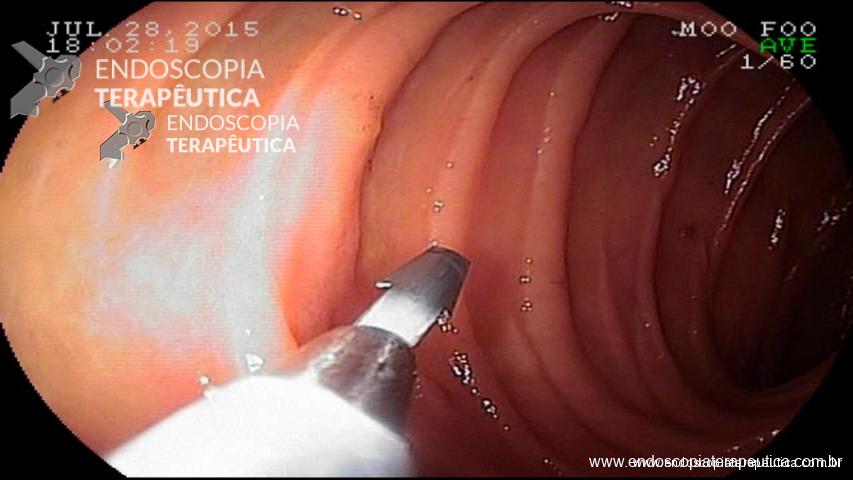
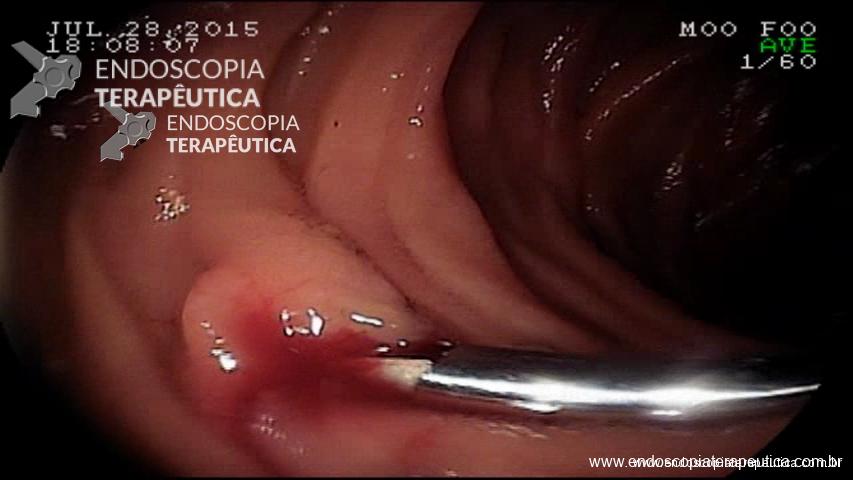
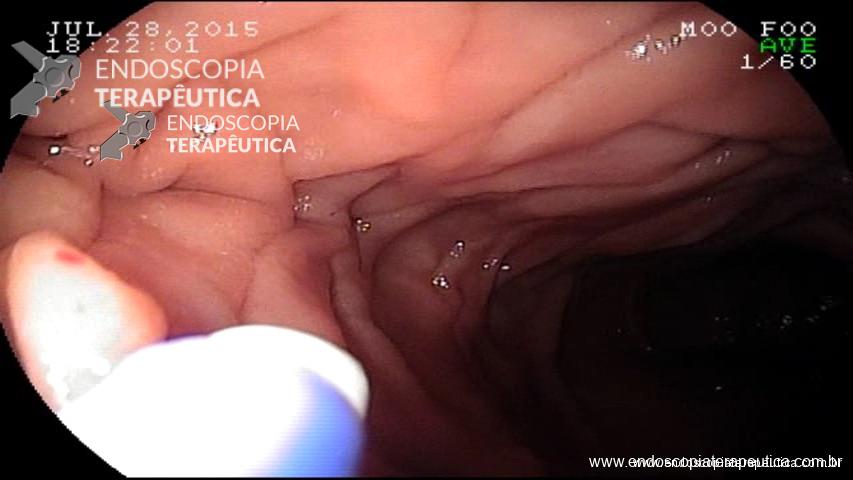
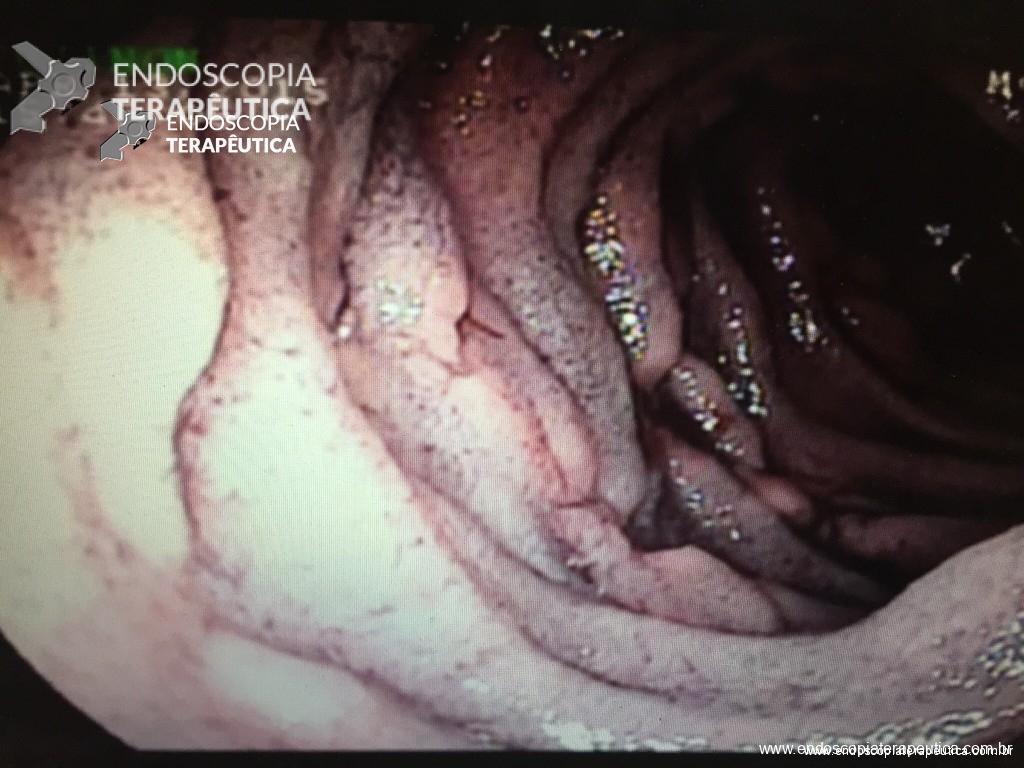
É uma técnica que se utiliza de adesivos tissulares (N-butil-2-cianoacrilato ou 2-octil-cianoacrilato) que se polimerizam rapidamente em contato com os tecidos, com a finalidade de preencher o lúmen da variz e extinguir seu fluxo. Atualmente é a principal técnica utilizada atingindo hemostasia adequada em mais de 90% dos casos. A seguir uma breve descrição da técnica de sua aplicação.
Cuidados técnicos:
– Utilizar proteção ocular durante a preparação e injeção
– Utilizar aparelho endoscópio de visão frontal lubrificando sua estrutura externa distal com silicone ou lipiodol, prevenindo a adesão do cianoacrilato ao aparelho
– Inserir também no canal de trabalho do aparelho soluções lubrificantes como silicone para facilitar a inserção do cateter e evitar adesão potencial do cianoacrilato
– Evitar realizar sucção de secreções durante o procedimento (evita possível sucção acidental de cianoacrilato extravasado)
– Utilizar cateter injetor pré escovado com solução salina
– Preparar o adesivo tissular a ser injetado em solução habitual de 1:1 de cianoacrilato e lipiodol
– Após a punção da variz injetar a solução de cianoacrilato e seguir com a injeção de solução salina para total remoção do adesivo tissualr de dentro do cateter e inserção no lúmen do vaso
– Quando retirar a agulha do interior do vaso (atentar para realizar isso de forma ágil após a injeção para evitar impactação do cateter ao adesivo tissular dispensado no vaso), realizar nova injeção de solução salina para lavagem completa do cateter do lúmen gástrico
– Logo que a injeção for completa e a hemostasia atingida, retirar o aparelho com a agulha recolhida e o cateter no seu interior. Com o aparelho removido do paciente, expõe-se o cateter e corta-se a sua ponta, evitando o contato do cianoacrilato residual do cateter com o canal de trabalho.
– Limpar a ponta do aparelho com silicone e atentar para uma lavagem adequado dos canais de trabalho
Algumas complicações são descritas com o uso do cianoacrilato, principalmente as relacionadas a embolização da cola aplicada. O lipiodol atua nesse contexto como marcador radiológico permitindo observar-se através de radiografia convencional a permanência da solução de cianoacrilato em posição adequada ou, quando de embolizações, em localizações anômalas.
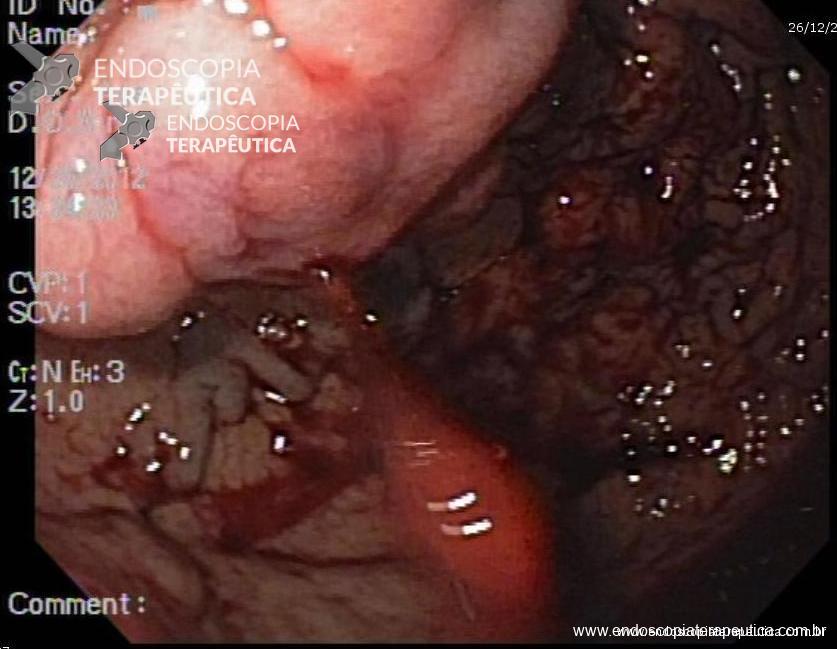
Variz de fundo com sangramento
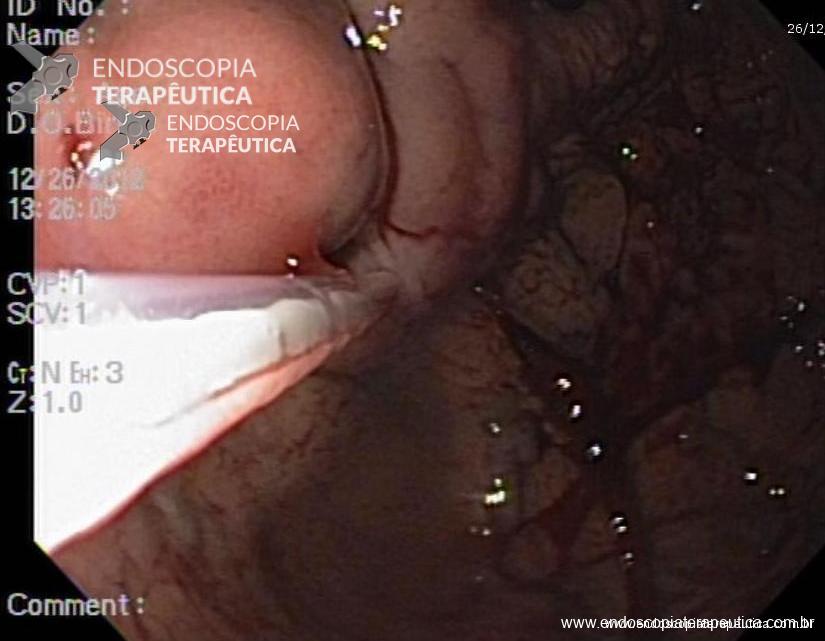
Injeção de cianoacrilato
- Ligadura com banda elástica
A utilização de ligadura elástica é um método bem estabelecido no tratamento e prevenção de sangramento de varizes de esôfago e tem uso também descrito em varizes gástricas com resultados conflitantes devido a altas taxas de ressangramento em algumas séries. Melhores resultados tem sido descritos com o seu uso de sangramento de subtipos GOV 1, contudo não deve ser utilizada como primeira escolha no tratamento de varizes gástricas, principalmente as de maior calibre.
- Terapia endoscópica combinada (cianoacrilato e molas)
Nos últimos anos temos visto o surgimento de uma interessante discussão no uso de molas associado ou não ao cianoacrilato com ótimos resultados. Série recente publicado apontou um sucesso técnico de 99% com uso dessa técnica e com taxa de obliteração completa em controle precoce por ecoendoscopia de 93%. Os resultados são animadores.
Seguimento:
Conforme consenso de Baveno VI, após a realização de tratamento de uma variz gástrica sangrante, uma reavaliação da patência da mesma com continuação de profilaxia secundária endoscópica é recomendada no período compreendido entre 2 a 4 semanas. Entre outras opções o paciente também pode ser manejado com uso de betabloqueadores e mesmo com shunt iuntrahepático portosistêmico transjugular (TIPS)
Profilaxia primária:
Embora trabalho recente tenha apontado benefício do cianoacrilato na profilaxia primária de pacientes com GOV 2 e IGV 1 de grosso calibre, quando comparado ao uso de betabloqueadores, ainda não há na literatura uma recomendação formal para tal conduta.
Considerações finais:
Conforme os dados apresentado e seguindo a recomendação atual do Baveno no que concerne as varizes gástricas pode-se concluir:
- GOV 1 é a variz gástrica mais comum e pode ser abordada de diferentes formas com bons resultados no controle do sangramento. BavenoVI:Ligadura elástica ou adesivo tissular são recomendados para hemorragia digestiva por variz gástrica GOV-1 (5;D).
- Varizes tipo GOV 2 e IGV possuem outras opções terapêutica contudo o adesivo tissular consiste na terapêutica com melhor benefício evidente . Baveno VI: Em caso de varizes gástricas GOV-2 (5;D) e variz gástrica isolada (IGV) (1b;A), a primeira escolha é o adesivo tissular N-butil-cianoacrilato.
- A terapêutica ecoguiada com uso de molas associadas ao cianoacrilato parece ser uma técnica promissora com alto sucesso clínico e baixas taxas de complicação.
Referências:
de Franchis R; Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52. doi: 10.1016/j.jhep.2015.05.022
Sarin S.K., Lahoti D., Saxena S.P., et al: Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology 1992; 16: pp. 1343-1349
Bhat YM, Weilert FF, Fredrick RT, Kane SD, Shah JN, Hamerski CM, Binmoeller KF. EUS-guided treatment of gastric fundal varices with combined injection of coils and cyanoacrylate glue: a large U.S. experience over 6 years (with video). Gastrointest Endosc. 2015 Oct 6. pii: S0016-5107(15)02955-7
S.R. Mishra, B.C. Sharma, A. Kumar, et al. Primary prophylaxis of gastric variceal bleeding comparing cyanoacrylate injection and beta-blockers: a randomized controlled trial. J Hepatol, 54 (2011), pp. 1161–1167
Veja também:
Classificação de Sarin para varizes gástricas
HDA: guia resumido de condutas desde admissão à alta hospitalar