ARTIGO COMENTADO – Utilidade da fistulotomia com needle-knife como método inicial na canulação biliar para prevenção de pancreatite pós CPRE
A CPRE é um procedimento amplamente utilizado no diagnóstico e tratamento de doenças do trato biliar e pancreáticas. Pancreatite pós CPRE (PEP) é o evento adverso mais comum após o procedimento, variando de 2-10% em casos não selecionados e podendo elevar substancialmente a morbidade, mortalidade e custos médicos associados. Entre os fatores de risco associados a PEP cita-se: pacientes jovens (<60 anos), sexo feminino, com ducto biliar comum (CBD) de calibre normal (<9 mm), disfunção de esfíncter de Oddi (SOD), ou uma história prévia de pancreatite. Diante da associação de fatores de risco as taxas de PEP podem alcançar até 67%.
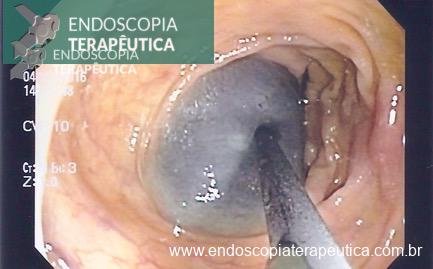
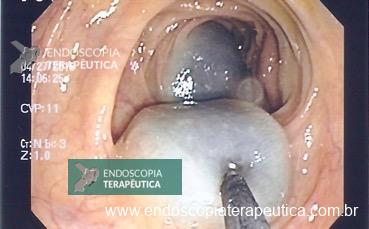
A fistulotomia suprapapilar com needle-knife (NKF) tem sido usada como uma técnica alternativa a falha de canulação convencional via óstio papilar em casos difíceis, e pode ser recomendada como um artifício em casos de canulação pancreática repetida não intencional. O uso dessa técnica está associada a uma redução potencial do risco de PEP, enquanto a canulação biliar difícil aumenta o risco.
Objetivo:
Em artigo publicado na edição de novembro de 2016 da Gastrointestinal Endoscopy, Young-Joo Jin e colaboradores apresentaram um estudo prospectivo preliminar que objetivou avaliar a viabilidade do NKF como procedimento inicial no acesso biliar em pacientes com cálculos biliares e que possuíam risco aumentado de PEP. Foram avaliadas: taxa de incidência de pancreatite pós CPRE após NKF e taxas de sucesso da canulação biliar e remoção de cálculos após NKF.
Metodologia:
Prospectivamente, entre Julho de 2013 e Maio de 2015, foram selecionados 55 pacientes que se submeteram a CPRE com NKF por cálculos biliares em um centro de referência na Coréia do Sul. Todos os casos possuíam um ou mais do seguintes fatores de risco para PEP: pacientes jovens (<60 anos), sexo feminino ou CBD de calibre normal (<9 mm).
Resultados:
- Risco para PEP:
- 1 fator: 17 pacientes
- 2 fatores: 27 pacientes
- 3 fatores: 11 pacientes
- Tempo médio de procedimento para NKF: 2.1 minutos (0.2–8.7 min)
- Tempo médio de remoção de calculo biliar: 6.5 minutos (1.1–28.3 min)
- Taxas de sucesso na canulação biliar usando NKF: 96.3% (53/55)
- Taxas de sucesso na remoção de cálculo biliar: 92.7% (51/55)
- Complicações:
- Não houve caso de PEP
- Dor: 4 pacientes (7,3%)
- Febre: 9 pacientes (16,4%)
- Sangramento: 2 pacientes (3,6%)
- Perfuração duodenal retroperitoneal: 1 paciente (1.8%) que foi manejado conservadoramente
Conclui-se portanto, que NKF pode ser uma técnica viável como procedimento inicial no acesso biliar em pacientes com cálculos biliares que possuem risco elevado de pancreatite pós CPRE se o procedimento é realizado por um endoscopista biliar experiente.
Comentários:
A pancreatite é um evento comum e muito temido após CPRE. Muito tem sido discutido sobre estratégias de prevenção de PEP nos últimos anos e algumas condutas tem sido implementadas de forma regular em centros de referência como uso de AINE e de próteses pancreáticas¹.
A fistulotomia suprapapilar é uma estratégia previamente conhecida e discutida como alternativa técnica ao acesso biliar, potencialmente reduzindo o risco de pancreatite quando implementada de forma precoce².
O estudo apresentado traz novos dados a literatura atualmente existente por abordar de forma prospectiva e chamar a atenção para a potencial prevenção de pancreatite pós CPRE com uso de fistulotomia suprapapilar em pacientes de risco. Contudo, o estudo possui limitações a serem consideradas como: ter sido realizado de forma não randomizada, em centro único, com somente um endoscopista realizando os procedimentos. Novos estudos com desenho multicêntrico, prospectivos e randomizados seriam recomendáveis.
Referência e link para o artigo:
Outras referências:
- Dumonceau, J.M., Andriulli, A., Elmunzer, B.J. et al. Prophylaxis of post-ERCP pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – updated June 2014. Endoscopy. 2014; 46: 799–815
- Mariani A, Di Leo M, Giardullo N, et al. Early precut sphincterotomy for difficult biliary access to reduce post-ERCP pancreatitis: a randomized trial. Endoscopy. 2016;48:530–535.