Como aumentar sua taxa de detecção de adenomas?
A Taxa de Detecção de Adenoma (TDA) atualmente é o principal indicador de qualidade de colonoscopia. Dentre os vários indicadores propostos, este é o único que comprovadamente se correlaciona com a incidência de câncer de intervalo. Quanto maior a TDA de um colonoscopista (ou de um serviço de colonoscopia), menor a chance do paciente apresentar um câncer de intervalo.
Na população assintomática acima de 50 anos submetida a screening, a TDA deve ser
- ≥ 30% nos homens
- ≥ 20% nas mulheres
Portanto, medidas que possam melhorar nossa TDA são bem-vindas e benéficas para os pacientes. Nesse artigo vamos discorrer sobre as principais medidas estudadas, variando desde medidas simples e sem custos, até modernas tecnologias desenvolvidas para este fim.
Qualidade do preparo: este é um indicador de qualidade ressaltado por quase todas as sociedades internacionais. A qualidade do preparo está diretamente relacionada com o tempo de chegada ao ceco e com a detecção de pólipos. É importante cada serviço estar habituado com a solução de preparo de cólon padrão, bem como saber individualizar o preparo de cólon para situares especiais.
Mudança de posição: visam melhorar a distensão dos segmentos do cólon, melhorando sua inspeção. O cólon direito pode ser melhor inspecionado no DLE, o transverso em DDH e o cólon esquerdo em DLD. Em dezembro de 2015 tivemos um artigo comentado estudando essa técnica que demonstrou aumento na detecção de pólipos apenas no cólon direito. Dois outros estudos também foram favoráveis à mudança de decúbito. No entanto, devido ao desenho destes estudos (examinava uma vez numa posição, depois examinava uma segunda vez em outra posição), o aumento da TDA pode ser explicados pelo simples second-look, ou seja, não seria necessário mudar o decúbito, apenas examinar pela segunda vez.1 De fato, um RCT publicado em 2014 em que a mudança de decúbito programada e proposital foi comparada com mudança apenas quando encontrava-se uma dificuldade, falhou em demonstrar aumento na TDA.2
Segundo observador: a participação da enfermagem como um segundo observador durante a retirada do aparelho mostrou aumento na detecção de pólipos e adenomas em ao menos dois estudos. Uma medida simples e sem custo.3
Horário do exame: a fadiga do endoscopista vai aumentando ao longo do dia e pode afetar a TDA. Sanaka et al foram os primeiros a mostrar que a TDA foi significativamente maior nas colonoscopias agendadas pela manhã do que nas agendadas a tarde. Vários outros estudos também chegaram a mesma conclusão. Gurudu et al4 mostraram que quando os exames eram divididos em blocos de meio-dia, não havia diferença entre a TDA dos exames realizados pela manhã ou à tarde.
Water-imersion/ Water-exchange: a colono sob imersão foi idealizada para facilitar a chegada ao ceco. A colono com troca de água almeja a aspiração de todo o resíduo líquido do cólon e instilação de grandes volumes de água que é mantida durante a retirada do aparelho. Seus defensores relatam melhor visualização dos pólipos devido um efeito de lente de aumento da água e visto que os pólipos tendem a boiar na água em vez de permanecerem achatados. Um estudo demonstrou aumento na TDA (25% vs 19%) e outro demonstrou tendência a maior detecção, porém sem poder estatístico (56.7% vs 43.3%).5,6
Visualização do cólon direito: a maioria dos adenomas não detectados (missed adenomas) ocorrem no cólon direito. Vários fatores contribuem para esse fato, como o preparo de cólon que tende a ser um pouco pior no cólon direito, a maior taxa de adenomas sésseis serrilhados, que por sua natureza plana são mais difíceis de detectar, as haustrações pronunciadas, etc. Portanto, vários autores advogam a necessidade de se examinar com maiores detalhes o cólon direito, utilizando-se manobras como retroflexão, direita e esquerda, mudança de decúbito, etc. Hewett e Rex 7 mostraram uma taxa adicional de 10% de adenomas detectados com a manobra de retrovisão, mas esta taxa também pode ser obtida com uma segunda inspeção com visão frontal. A retrovisão, portanto, não é imperativa.
Tempo de retirada do aparelho: esse é um assunto polêmico e que talvez mereça outro post. Embora vários estudos tenham demonstrado uma correlação entre tempo de retirada e detecção de pólipos, os achados não são unânimes. Um estudo da Universidade John Hopkins 8, por exemplo, falhou em demonstrar aumento da TDA com a política de obrigar os endoscopistas a gastarem 7 min ou mais para retirar o aparelho. Outro estudo ressaltou a importância da qualidade técnica do exame em detrimento ao tempo de retirada 9. Controvérsias a parte, fazer o exame com calma, “gastando” o tempo necessário, é importante, e o guideline da ASGE 2015 recomenda no mínimo 6 minutos dedicados à retirada do aparelho. 10
Antiespasmódicos: hioscina, escopolamina e outros agentes antiespasmódicos já foram testados em ensaios randomizados, mas os resultados não foram satisfatórios. Apesar de um RCT demonstrar uma tendência a maior detecção de pólipos com uso de hioscina (sem significância estatística), uma meta-análise destes estudos mostrou que não há benefício. Recentemente, Inoue e col demonstraram aumento da TDA com uso de L-mentol, também um agente antiespasmódico (60.2% vs 42.6%). Este achado ainda precisa ser confirmado com futuros estudos. 11-13
Cromoendoscopia: vários estudos avaliaram o impacto da cromoendoscopia com índigo-carmin na TDA. Os resultados não são unânimes. Um estudo prospectivo randomizado mostrou aumento da TDA com índigo (46% vs 36%). Uma metanálise que compilou 42 estudos comparando diferentes métodos (autofluorescência, FICE, NBI, i-Scan, cap e cromoendoscopia) mostrou que apenas a cromoendoscopia esteve relacionada com maior TDA. Por outro lado, um estudo prospectivo não evidenciou diferença. Neste estudo, os pacientes realizavam um primeiro exame sem cromoscopia e um segundo exame era realizado imediatamente após. Os pacientes foram então randomizados: 60 com índigo vs 70 convencional (luz branca). Adenomas adicionais foram detectados em 27 vs 33%, respectivamente. O segundo exame era limitado aos segmentos distais à flexura esplênica, o que pode ter limitado o impacto da cromoendoscopia na detecção de lesões planas serrilhadas do cólon direito.
Uso de cap (cap-assisted colonoscopy): o uso de um cap transparente na extremidade do aparelho é advogado por alguns autores pois facilita a inspeção atrás das haustrações. No entanto, em uma meta-análise incluindo 8991 pacientes, o uso de cap teve um impacto muito pequeno na TDA (RR 1.08 – IC 1.00-1.17). O tempo de inserção foi significativamente menor com o uso de cap, tanto para experts quanto para os trainees. 14
Aparelhos de alta resolução: esse é um tema ainda polêmico. Não há dúvidas que os aparelhos de alta resolução (HD-WL) ofereçam melhor qualidade de imagem do que os aparelhos convencionais (SD-WL), mas as evidências em relação a TDA não são tão contundentes quanto se esperava. Um RCT mostrou que os aparelho HD-WL aumentaram o número total de adenomas detectados e aumentaram a detecção de lesões planas no cólon direito. No entanto, não houve diferença estatística na quantidade de paciente com ao menos 1 adenoma (38.6% vs 45.7%, P = 0.17). Em uma meta-análise de 5 estudos (2 RCTs e 3 não-RCTs) o uso da alta resolução aumentou em apenas 3,5% a TDA (NNT de 28) e não houve impacto na taxa de detecção de adenomas de alto risco (maiores que 10 mm, componente viloso ou displasia de alto grau). Os autores alertam para a interpretação cuidados desses dados devido a heterogeneidade dos estudos (estudos não RCTs e TDA variando de 23-65%). 15 Atualmente, a ESGE recomenda o uso de aparelhos de alta resolução no screening da população de médio risco.
Cromoscopia óptica ou virtual: o uso de tecnologias como FICE, NBI e i-Scan foi testado por diversos estudos, sendo que a maioria não mostrou benefício na detecção de adenomas. Existem inclusive duas meta-análises mostrando que seu uso não melhor a TDA. Estes estudos compararam estas tecnologias com a luz branca de alta definição. 16, 17
NOVAS TECNOLOGIAS
Third-eye Retroscope: consiste em um fino cateter que é passado pelo canal do colonoscópio convencional e faz retrovisão de 180, permitindo melhor visualização atrás das pregas. Um estudo randomizado multicêntrico mostrou aumento de 29.8% na detecção de pólipos e 23.2% na detecção de adenomas, comparado com a colonoscopia convencional 18. No entanto, o cateter ocupa o canal de trabalho e necessita ser retirado para fazer biópsia ou polipectomia, além de ser descartável, agregando um custo considerável ao exame. Sua produção foi descontinuada e a segunda geração deste aparelho vem sendo testada: Third-eye panoramic device, que consiste em um cateter acoplado externamente ao aparelho, provido de uma luz de LED e uma microcâmera de cada lado do cateter, fornecendo visão de 330°, e com proposta de ser reutilizável.
Full Spectrum Endoscopy (FUSE): os colonoscópios convencionais permitem uma visão de 140-170°. O FUSE possui câmeras laterais na extremidade do aparelho, permitindo uma visão de 330°. No entanto, esta visão não é contínua, mas separada em 3 telas, exigindo um novo treinamento visual do endoscopista. Em um estudo com 185 pacientes, a taxa de adenomas que passaram despercebidos com o FUSE foi de 7% contra 41% com o uso dos aparelhos convencionais 19. O que chama a atenção neste estudo é a alta taxa de adenomas perdidos no grupo convencional (41%!). Não há dúvidas que novos estudos são necessários para comprovar o benefício desta tecnologia.
Endocuff: consiste em uma especie de borracha acoplada à extremidade do aparelho, com asas flexíveis que ajudam a esticar a mucosa, reduzindo as haustrações. O endocuff foi aprovado pelo FDA em 2012. Em um estudo com 498 pacientes, a taxa de detecção pólipos e de adenoma foi significativamente maior com o uso do Endocuff vs sem Endocuff: 56% vs 42% e 36% vs 28%, respectivamente. 20
G-Eye: consiste em um balão inflável alguns centímetros antes da extremidade do aparelho. Durante a fase de retirada do aparelho o balão é inflado com o acionamento de um pedal. Sua pressão é controlada pelo sistema, permitindo que o balão se acople ao diâmetro da luz do cólon. Conforme o aparelho vai sendo retirado, o balão estica as haustrações, permitindo uma excelente visualização de toda a mucosa. RCT multicêntrico demonstrou TDA de 59% vs 39% com aparelho convencional 21. Tive a oportunidade de assistir o uso deste aparelho e sem dúvida aparenta ser uma tecnologia promissora.

Colonoscópio FUSE
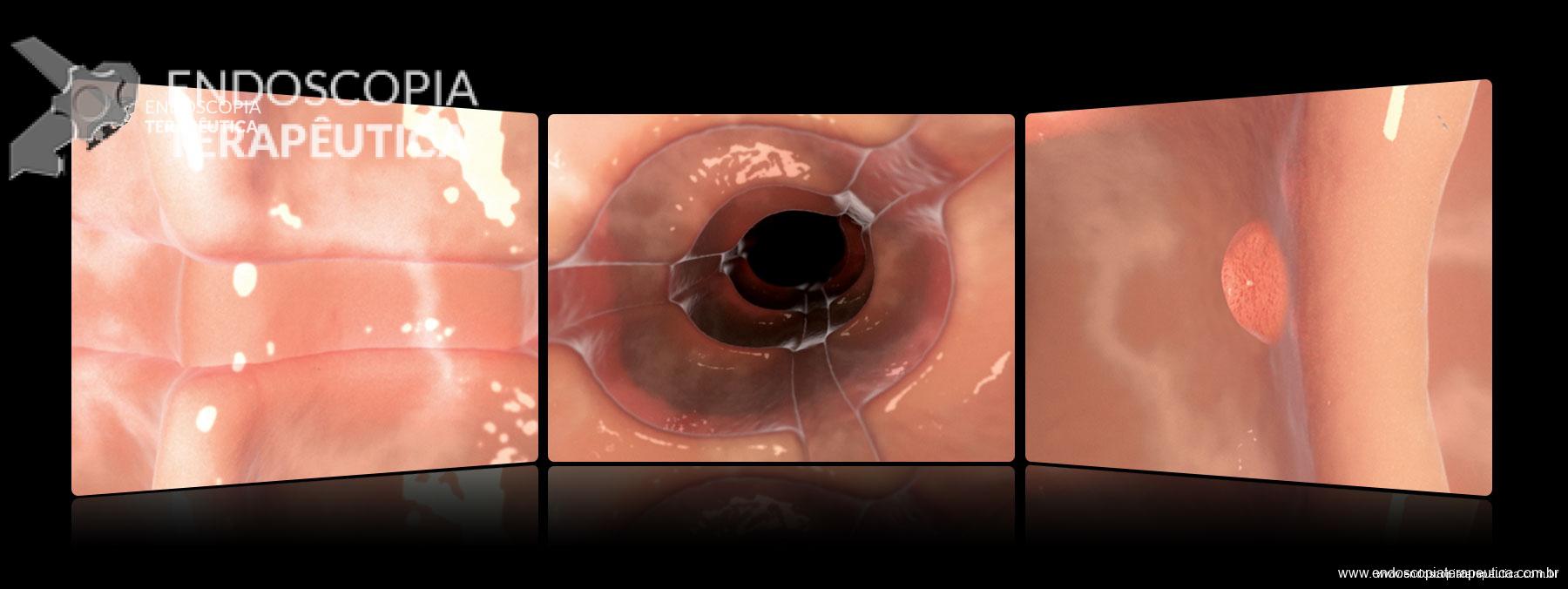
Colonoscópio FUSE projeta imagens em 3 monitores, ampliando o campo de visão
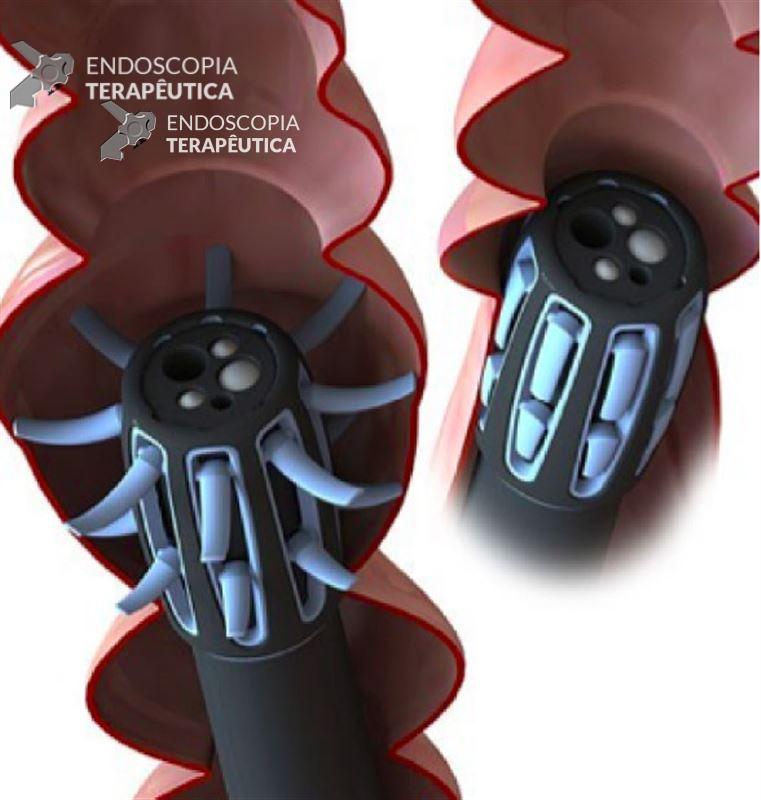
Endocuff

Colonoscópio G-Eye
SUMÁRIO
Técnicas com melhores evidências para aumentar a TDA:
- Preparo adequado
- Tempo de retirada
- Repetir o exame do cólon direito (com retrovisão ou não)
- Segundo observador
- Endoscopia de alta definição
- AM procedures
- Water-Exchange
Técnicas com evidências limitadas que favorecem maior TDA
- G-eye
- Endocuff
- FUSE
- L-Menthol
- Indigo-carmin
- Mudanças de decúbito
Técnicas que parecem não aumentar a TDA
- NBI, FICE e i-Scan
- Hioscina, escopolamina
- Cap
Referências:
- Dynamic patient position changes during colonoscope withdrawal increase adenoma detection: a randomized, crossover trial. Gastrointest Endosc 2011; 73: 456-463
- Ou G, et al. A randomized controlled trial assessing the effect of prescribed patient position changes during colonoscope withdrawal on adenoma detection. Gastrointest Endosc 2014; 80: 277-283
- Pullens and Siersema. Quality indicators for colonoscopy: Current insights and Caveats. World J Gastrointest Endosc 2014 December 16; 6(12): 571-583
- Gurudu SR, et al. Adenoma detection rate is not influenced by the timing of colonoscopy when performed in half-day blocks. Am J Gastroenterol 2011
- Cadoni S, et al. A two-center randomized controlled trial of water-aided colonoscopy versus air insufflation colonoscopy. Endoscopy 2014; 46: 212-218
- Hsieh YH, Koo M, Leung FW. A patient-blinded randomized, controlled trial comparing air insufflation, water immersion, and water exchange during minimally sedated colonoscopy. Am J Gastroenterol 2014; 109: 1390-1400
- Hewett DG, Rex DK. Miss rate of right-sided colon examination during colonoscopy defined by retroflexion: an observational study. Gastrointest Endosc 2011; 74: 246-252
- SAWHNEY MS, et al. GASTROENTEROLOGY 2008;135:1892–1898
- Lee RH. Quality of colonoscopy withdrawal technique. Gastrointest Endosc 2011.
- Quality indicators for colonoscopy. Gastrointest Endosc 2015; 81:1
- Corte C, et al. Hyoscine butylbromide administered at the cecum increases polyp detection: a randomized double-blind placebo controlled trial. Endoscopy 2012; 44: 917-922
- Rondonotti E, et al. The impact of hyoscine-N-butylbromide on adenoma detection during colonoscopy: meta-analysis of randomized, controlled studies. Gastrointest Endosc 2014;
- Inoue K, et al. L-menthol improves adenoma detection rate during colonoscopy: a randomized trial. Endoscopy 2014; 46: 196-202
- Ng SC, et al. The efficacy of cap-assisted colonoscopy in polyp detection and cecal intubation: a meta-analysis of randomized controlled trials. Am J Gastroenterol 2012
- Subramanian V, Mannath J, Hawkey CJ, Ragunath K. High definition colonoscopy vs. standard video endoscopy for the detection of colonic polyps: a meta-analysis. Endoscopy 2011; 43: 499-505
- Pasha SF, et al. Comparison of the yield and miss rate of narrow band imaging and white light endoscopy in patients undergoing screening or surveillance colonoscopy: a meta-analysis. Am J Gastroenterol 2012
- Chung SJ, et al. Comparison of detection and miss rates of narrow band imaging, flexible spectral imaging chromoendoscopy and white light at screening colonoscopy:a randomised controlled back-to-back study. Gut 2014; 63:785-791
- Leufkens AM, et al. Effect of a retrograde-viewing device on adenoma detection rate during colonoscopy: the TERRACE study. Gastrointest Endosc 2011; 73: 480-489
- Gralnek IM, et al. Standard forward viewing colonoscopy versus full-spectrum endoscopy: an international, multicentre, randomised, tandem colonoscopy trial. Lancet Oncol 2014; 15: 353-360
- Biecker E, et al. Novel endocuff-assisted colonoscopy significantly increases the polyp detection rate: a randomized controlled trial. J Clin Gastroenterol 2015; 49: 413-418
- Hendel J, et al. 435 Prospective Randomized Multicenter Trial to Compare Adenoma Detection Rate of HD Colonoscopy With Standard HD Colonoscopy – Intermediate Results. Gastrointest Endosc 2015; 81: AB145-AB146
Artigos de cromoendoscopia
- Hashimoto K, et al. Hepatogastroenterology. 2010 Nov-Dec;57(104):1399-404.
- Omata F, et al. Scand J Gastroenterol. 2014 Feb;49(2):222-37.
- Pohl J, et al. Gut. 2011 Apr;60(4):485-90.