Em nossos primeiros artigos sobre o tema (Laudos Endoscópicos e Fotodocumentação) abordamos como o laudo endoscópico deve ser estruturado, destacando a importância de uma boa foto documentação e da coerência entre o que está descrito e o que está documentado nas imagens.
A intenção deste documento é orientar como descrever as características mais importantes das principais alterações endoscópicas.
Obviamente existem preferências individuais na maneira de redigir o texto, sendo que alguns preferem texto corrido enquanto outros preferem separar em parágrafos, alguns preferem uso da voz passiva e outros voz ativa, e assim por diante. A escolha do estilo usado na descrição das alterações compete a cada profissional. No entanto, é importante estar atento a alguns princípios.
Fornecer as informações necessárias para enquadrar as lesões dentro de uma classificação validada pela literatura.
Exemplo: classificação de Los Angeles. O endoscopista deve descrever a extensão das erosões (maior ou menor do que 5 mm), se são confluentes ou não, e, em caso de erosões confluentes, descrever se acometem mais ou menos do que 75% da circunferência esofágica.
Escrever de forma objetiva
Evitar informações desnecessárias e um texto prolixo. Isso torna a leitura do seu relatório mais precisa e mais agradável. Vale a pela usar frases curtas sempre que possível.
Usar termos descritores padronizados e validados, de acordo com a Minimal Standard Terminology for Digestive Endoscopy (M.S.T. 3.0)
Segue abaixo uma lista com as alterações endoscópicas mais comuns e as sugestões para descrição que são um verdadeiro guia prático para você:
Esofagite erosiva
O que é importante?
- descrever a extensão das erosões (maiores ou menores do que 5 mm)
- presença de confluência ou não
- em caso de erosões confluentes, descrever se acometem mais ou menos do que 75% da circunferência esofágica.
Exemplos:
Mucosa encontra-se opacificada e espessada na região distal, com erosões (menores/maiores) do que 5 mm, não confluentes (ou confluentes em menos do que 75% da circunferência) ao nível da transição esofagogástrica.
Mucosa do segmento distal do esôfago, ao nível da transição esofagogástrica exibe coloração opaca e perda do padrão vascular. Notam-se erosões lineares menores/maiores do que 5 mm, sem confluência (ou exibindo confluência em menos/mais do que 75% da circunferência).
Esôfago de Barrett
O que é importante?
- descrever a extensão máxima do acometimento circunferencial (C) e a extensão máxima da projeção de epitélio colunar (M) segundo a classificação de Praga.
- descrever os achados da avaliação do epitélio colunar, com uso de cromoscopia ou magnificação quando disponível
- relatar a realização de biópsias e se foram realizadas de forma dirigida ou de acordo com protocolo de Seattle.
Exemplos de descrição:
Nota-se epitelização colunar em esôfago distal sendo circunferencial por 1,0 cm e com extensão máxima de 3,0 cm (Praga C1M3). Realizada cromoscopia virtual com (NBI/LCI), seguido de cromoscopia com solução de ácido acético, não se observando áreas suspeitas para displasia. Realizadas biópsias nos quatro quadrantes conforme protocolo de Seattle.
Nota-se em esôfago distal, junto à transição esofagogástrica (localizada a 38 cm dos incisivos), mucosa apresentando coloração rosa-salmão, com acometimento circunferencial de cerca de 1,0 cm (37-38 cm dos incisivos), e com duas projeções de até 3,0 cm pelas paredes anterior e posterior (35-38 cm). Realizada cromoscopia virtual com (NBI/LCI), seguido de cromoscopia com solução de ácido acético, não se observando áreas suspeitas para displasia. Realizadas biópsias nos quatro quadrantes conforme protocolo de Seattle.
Exemplos de Conclusão
- Epitelização colunar em esôfago distal.
- Esôfago de Barrett curto/longo (quando já existe a confirmação diagnóstica),
- Alterações endoscópicas sugestivas de epitelização colunar em esôfago distal
Esofagite eosinofílica
O que é importante?
- descrever os segmentos do esôfago acometidos.
- presença de estrias longitudinais ou não
- presença de exsudato na superfície mucosa ou não
- presença de padrão em “traqueização” ou não
- áreas de estenose
- a realização de biópsias nos segmentos proximal, médio e distal.
Exemplos de descrição no corpo do laudo:
Mucosa dos segmentos proximal, médio e distal apresenta edema e perda do padrão vascular habitual. Além disso notam-se estrias longitudinais, padrão em “traqueização” e exsudato puntiforme aderido. Não visualizamos segmento estenótico. Realizadas biópsias dos segmentos de esôfago.
Mucosa do esôfago médio e distal apresenta aspecto espessado e esbranquiçado, associado a estrias e fissuras longitudinais, anéis concêntricos e exsudato pontilhado esbranquiçado. Realizadas biópsias de esôfago proximal, médio e distal.
Exemplos de Conclusão
- Alterações endoscópicas compatíveis com esofagite eosinofílica.
- Esofagite eosinofílica?
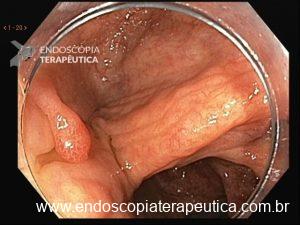
Hérnia hiatal
O que é importante?
- descrever a relação entre a transição esofagogástrica e o pinçamento diafragmático
- o endoscopista pode também descrever a distância entre as estruturas anatômicas e os incisivos (ou arcada dentária superior – ADS)
Exemplos de descrição no corpo do laudo:
Transição esofagogástrica situada 2,0 cm acima do pinçamento diafragmático.
Transição esofagogástrica situada a 38 cm da ADS, 2,0 cm acima do pinçamento diafragmático.
Exemplos de Conclusão
- Hérnia hiatal.
- Hérnia hiatal por deslizamento.
- Hérnia hiatal mista (tipo III)
Fundoplicatura
O que é importante?
- Descrever se a TEG está sob a zona de pressão constituída pela fundoplicatura + hiatoplastia ou se está deslizada (considera-se deslizamento da FPL quando a TEG está situada 2,0 cm acima da zona de pressão)
- descrever se a fundoplicatura está intra-abdominal ou migrada
- descrever se a fundoplicatura envolve toda a circunferência da cárdia, se envolve parcialmente a cárdia ou se está desgarrada.
- descrever se há hérnia paraesofágica ou não
Exemplos de descrição no corpo do laudo:
À retrovisão observa-se fundoplicatura intra-abdominal (ou migrada) envolvendo circunferencialmente (ou parcialmente) a cárdia.
À retrovisão observa-se fundoplicatura migrada e parcialmente desgarrada, associada a hérnia paraesofágica.
Exemplos de Conclusão
- Fundoplicatura íntegra
- Fundoplicatura em bom aspecto
- Fundoplicatura (total ou parcial) com bom aspecto
- Fundoplicatura migrada, porém não desgarrada
- Fundoplicatura desgarrada e migrada
Gastrite enantemática (ou enantematosa)
O que é importante?
- descrever a distribuição do enantema: restrito ao antro, restrito ao corpo, difuso.
- descrever a intensidade do enantema: leve, moderado ou acentuado
Exemplos de descrição:
Mucosa de (corpo/antro) apresenta enantema difuso de (leve/moderada) intensidade.
Exemplos de Conclusão
- Gastrite enantemática leve de antro
- Pangastrite enantematosa moderada
Gastrite erosiva
O que é importante?
- descrever a distribuição das erosões: restritas ao antro, ao corpo, difusas.
- descrever o aspecto das erosões: se planas ou elevadas
- descrever a intensidade do acometimento: leve, moderado ou acentuado
Exemplos de descrição:
Mucosa de (corpo/antro) apresenta erosões (planas/elevadas) em (pequena/grande) quantidade
Exemplos de Conclusão
- Gastrite erosiva plana leve de antro.
- Pangastrite erosiva intensa.
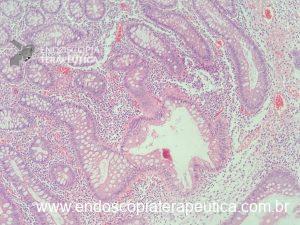
Gastrite atrófica
O que é importante?
- descrever as características da mucosa atrófica como presença de palidez, aspecto adelgaçado da mucosa, realce da vascularização subeptielial, se há redução numérica e/ou volumétrica das pregas do corpo (em caso de gastrite atrófica de corpo)
- descrever a extensão do acometimento: restrito ao antro, envolvendo antro e corpo, restrito ao corpo, envolvendo antro e pequena curvatura do corpo, etc.
- documentar caso haja a realização de biópsias e os respectivos locais
Nota: o endoscopista pode utilizar classificações como a classificação de Kimura-Takenoto ou estadiamento OLGA. Estadiamento OLGA depende da coleta de biópsias nos locais adequados e da solicitação do endoscopista no pedido de anatomopatológico.
Exemplos de descrição:
Mucosa de antro apresenta sinais de atrofia que se estendem para incisura angularis e pequena curvatura de corpo distal. Realizadas biópsias de acordo com protocolo OLGA.
Mucosa de antro e pequena curvatura de corpo exibem palidez, realce da vascularização subepitelial e aspecto adelgaçado, compatível com atrofia. Realizadas biópsias de corpo, antro e incisura de acordo com protocolo OLGA.
Mucosa de corpo e fundo apresenta-se adelgaçada e com maior visualização dos vasos submucosos. Além disso há redução numérica e volumétrica das pregas gástricas. Realizadas biópsias de corpo e antro em frascos separados.
Exemplos de conclusão:
- Gastrite atrófica de antro.
- Gastrite atrófica de corpo.
- Alterações endoscópicas sugestivas de gastrite atrófica de antro / corpo
- Alterações endoscópicas compatíveis com gastrite atrófica (tipo C-2 de Kimura-Takemoto)
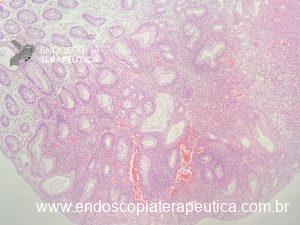
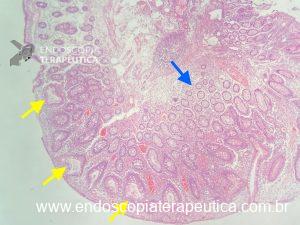
Metaplasia intestinal gástrica
O que é importante?
- descrever a extensão do acometimento: restrito ao antro, envolvendo antro e corpo, restrito ao corpo, envolvendo antro e pequena curvatura do corpo, etc.
- descrever se houve a realização de biópsias e os locais.
- Nota: o endoscopista pode decidir pela realização de biópsias de corpo, antro e incisura e solicitar ao patologista a classificação conforme protocolo OLGIM.
Nota: importante salientar que existem variações no fenótipo da metaplasia intestinal, a qual pode apresentar-se como placas esbranquiçadas levemente elevadas, ou placas superficialmente elevadas com centro deprimido (o centro geralmente é mais avermelhado), ou apenas como múltiplas áreas deprimidas. À magnificação é possível observar alteração do padrão de microarquitetura de superfície, presença de substância branca opaca e sinal da crista azul (light blue crest).
Exemplos de descrição:
Observam-se placas esbranquiçadas discretamente elevadas, sugestivas de metaplasia intestinal, distribuídas por toda extensão do antro. Realizada cromoscopia e biópsias de acordo com protocolo OLGIM.
Notam-se inúmeras áreas superficialmente elevadas, cm coloração vermelha, exibindo padrão de microarquitetura de superfície sugestivo de metaplasia intestinal. As lesões distribuem-se pelo corpo e antro, se destacam após cromoscopia. Realizadas biópsias.
Exemplos de conclusão:
- Alterações endoscópicas sugestivas de metaplasia intestinal em antro.
- Focos de metaplasia intestinal em corpo gástrico
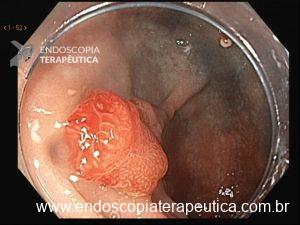
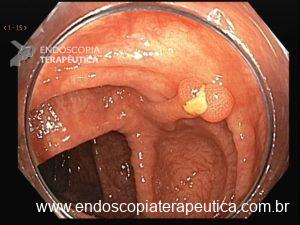
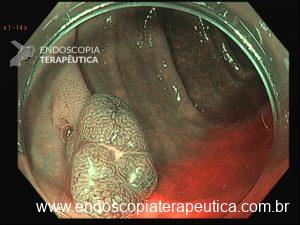
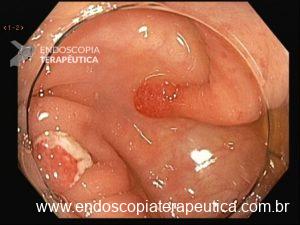
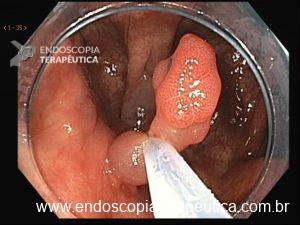
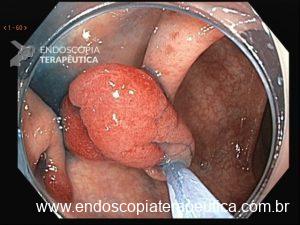
Lesão subepitelial
O que é importante?
- descrever a localização da lesão, seu tamanho estimado, consistência e mobilidade
- descrever o aspecto da mucosa que recobre a lesão (íntegra ou não)
Exemplos de descrição:
Observa-se lesão elevada recoberta por mucosa íntegra, medindo aproximadamente 10mm, móvel à palpação com a pinça, localizada em parede anterior de antro, compatível com lesão subepitelial.
Nota-se lesão elevada, recoberta por mucosa lisa, de aspecto subepitelial, medindo 2,5 cm, localizada em parede posterior de segmento médio de corpo, endurecida ao toque da pinça.
Exemplos de conclusão:
- Lesão subepitelial em corpo gástrico.
- Lesão subepitelial em antro gástrico
Úlcera gástrica
O que é importante?
Importante uma descrição detalhada da úlcera com informações importantes para guiar o tratamento, bem como para levantar suspeita quanto natureza benigna ou maligna. A descrição deve incluir:
- localização da úlcera
- tamanho
- formato (ovalada, alongada)
- profundidade (rasa, profunda)
- aspecto das bordas (regulares ou não / definidas ou não),
- retração ou deformidade das pregas,
- aspecto do fundo da úlcera (fibrina, restos necróticos, restos hematínicos, etc)
Finalmente, conclui-se a fase do ciclo da úlcera conforme a classificação de Sakita
No caso de úlcera hemorrágica, descrever a presença de estigmas de sangramento recente (vaso visível, coágulo aderido) conforme classificação de Forrest, e se foi realizada terapia endoscópica.
Exemplos de descrição:
Na parede anterior do antro distal observa-se uma ulceração profunda, com formato redondo, medindo cerca de 20 mm. A ulceração apresenta bordos regulares, edemaciados e com halo de enantema. O fundo da ulceração é recoberto por fibrina espessa com restos necróticos.
Na pequena curvatura do antro distal, nota-se úlcera superficial em cicatrização, com convergência de pregas, bordas regulares, hiperemiadas e com pequena área linear de fibrina medindo aproximadamente 5 mm.
Na pequena curvatura do antro, presença de retração cicatricial, compatível com cicatriz de úlcera gástrica.
Exemplos de conclusão:
- Úlcera em atividade no antro gástrico (Sakita A1)
- Retração cicatricial no antro gástrico (Sakita S2)
- Cicatriz de úlcera bulbar (Sakita S2)
Anatomia alterada cirurgicamente
O que é importante?
Descrever a alteração anatômica encontrada, o tamanho do remanescente gástrico (se houver) e sempre que possível identificar o tipo de reconstrução de trânsito que foi empregada. Importante descrever o tipo, tamanho e aspecto da anastomose.
A seguir, exemplificaremos as principais cirurgias que lidamos no nosso dia a dia.
Bypass gastrico
O que é importante?
Descrever o tamanho do remanescente gástrico, presença de constrição anelar se houver e estimar o diâmetro da anastomose. Importante avaliar presença de erosões ou ulceras perianastomoticas e se há torção de eixo na alça alimentar.
Exemplos de descrição:
Estômago operado, com evidências de gastroplastia redutora e reconstrução a Y de Roux.
Coto gástrico medindo 4 cm, com mucosa de aspecto preservado.
Anastomose gastrojejunal em bom aspecto, medindo aproximadamente 1,5 cm de diâmetro e sem lesões.
Alça alimentar sem alterações de eixo ou lesões de mucosa.
Exemplos de conclusão:
Gastroplastia redutora com reconstrução a Y de Roux (Bypass gástrico)
Status pós-operatório de gastroplastia redutora com reconstrução em Y de Roux
Gastrectomia Vertical
O que é importante?
Descrever a forma do remanescente gástrico, atentando-se para a transição corpo antro, próximo da incisura angularis, onde pode haver estenose ou torção de eixo.
Exemplos de descrição:
Presença de sutura longitudinal na grande curvatura do corpo, conferindo forma tubular ao órgão.
Transição corpo-antro (ou…. região da incisura angularis) permitindo a passagem do aparelho sem dificuldades.
Mucosa….
Exemplos de conclusão:
Gastrectomia vertical.
Status pós-operatório de gastrectomia vertical.
Como citar este artigo
Cardoso DMM. e Martins BC. Laudos em endoscopia digestiva alta-parte III Como descrever as alterações encontradas. Endoscopia Terapeutica 2023, vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/laudos-em-endoscopia-digestiva-alta-parte-iii-como-descrever-as-alteracoes-encontradas/