TRANSPLANTE DE MICROBIOTA FECAL
O transplante de microbiota fecal (TMF) ou transplante fecal consiste na infusão de fezes de um doador saudável no trato gastrointestinal de um paciente que possua alguma doença relacionada a alteração da flora intestinal.
Os primeiros relatos de TMF são de 1700 anos atrás em que um médico chinês administrava suspensões de fezes humanas por via oral a pacientes com intoxicação alimentar e/ou diarreia grave. Em 2013 foi publicado na New England Journal of Medicine o primeiro estudo bem desenhado sobre o sucesso do TMF em infeções por Clostridium difficile e que a partir daí tem motivado inúmeros outros trabalhos relacionados ao tema.
A indicação formal do TMF atualmente é nas infecções recorrentes por Clostridium difficile com uma taxa de cura de até 90%.
Há estudos em andamento de TMF em outras doenças gastrintestinais (doença inflamatória intestinal, síndrome do intestino irritável) assim como em doenças endócrinas (obesidade, síndrome metabólica), neurológicas (Parkinson, esclerose múltipla), hematológicas (PTI, GVHD) e psiquiátricas (autismo).
Para o bom andamento do TMF é necessário uma equipe multidisciplinar (médico assistente quer seja o clínico, gastroclínico ou geriatra, infectologista e o endoscopista) alinhada e com protocolo bem estabelecido no serviço.
ETAPAS DO PROCEDIMENTO
-
ESCOLHA DO DOADOR
O doador pode ser aparentado ou não. Este deverá passar por um screening infeccioso rigoroso e um questionário quanto a presença de outras doenças que possam inviabilizar a doação.
-
COLETA, PREPARO E ADMINISTRAÇÃO DO MATERIAL
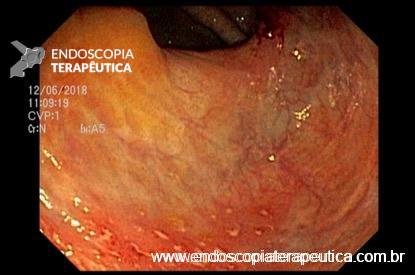
O doador deve chegar no laboratório do dia do procedimento e o tempo ideal entre a coleta das fezes e a infusão do material é de 6 horas. O peso fecal deve ser no mínimo de 50g e o volume total da suspensão é de 100 a 200ml, que será infundido a depender da rota escolhida. Há opção também de congelar o material mas é preferível a utilização de fezes frescas (vide imagem abaixo).
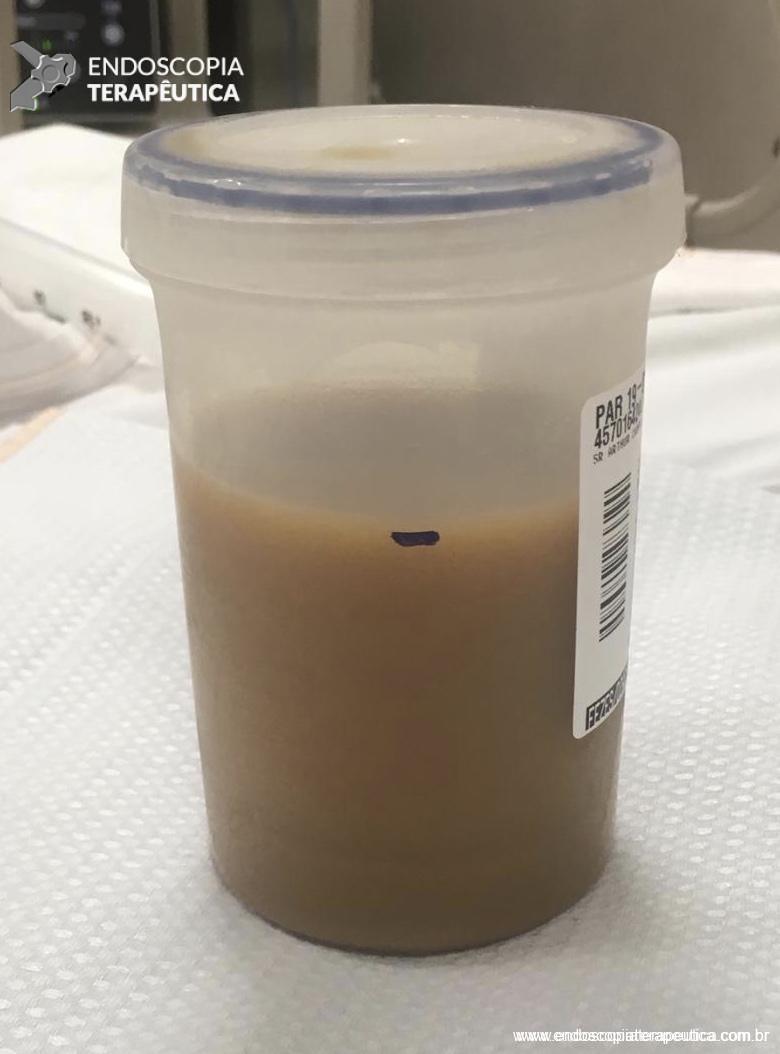
-
ROTA DE ADMINISTRAÇÃO
Segundo os artigos publicados até o momento todas as 5 rotas estudadas apresentam resultados semelhantes. Desta maneira o TMF pode ser realizado por:
- Endoscopia digestiva alta com sonda nasogástrica/nasoenteral
- Enteroscopia anterógrada
- Colonoscopia
- Retosigmoidoscopia
- Enema
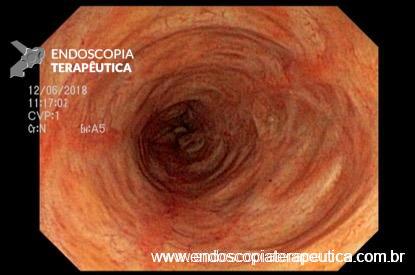
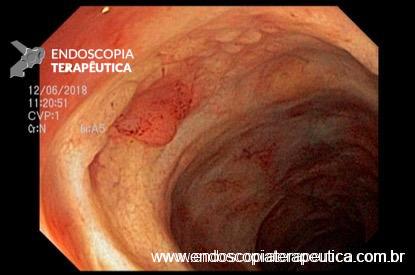
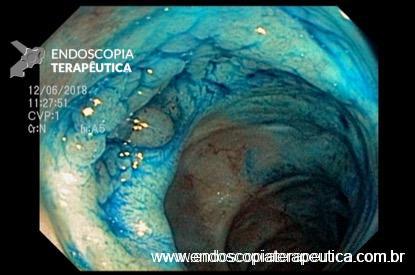
O que vai determinar a escolha do método será a condição clínica do paciente e experiência do endoscopista. Na via alta é sugerido infundir no intestino delgado até 100ml lentamente através da sonda nasoenteral ou pelo próprio canal de acessório ou por um cateter spray. Na rota baixa sugere-se infundir a maior quantidade possível do material (média de 200ml) no íleo terminal e cólon direito.
-
CUIDADOS PRÉ, PERI E PÓS TMF
O preparo do exame é o jejum adequado e nos casos de a rota escolhida ser baixa pode ser realizado preparo intestinal com solução de manitol ou polietilenoglicol.
Alguns cuidados podem ser tomados, no entanto ainda nada consensual, tais como:
- Uso de inibidores de bomba de prótons
- Uso de procinéticos
- Uso de antidiarreicos (loperamida)
É preconizada a infusão de cerca de 100ml do material fecal de forma lenta quando utilizada a via alta ao passo que quando o TMF é feito por via baixa utilizam volumes pouco maiores (cerca de 200ml).
-
EVENTOS ADVERSOS
Os eventos adversos podem ocorrer em até 30% dos casos sendo geralmente nas primeiras 48 horas pós procedimento e tratados conservadoramente. Os mais comuns são febre, diarreia, cólicas abdominais e eructações. Já foram descritos casos raros de óbito por regurgitação com broncoaspiração do material fecal e perfuração por megacolon tóxico.
CONSIDERAÇÕES FINAIS
Até o momento a única indicação do TMF com evidência científica comprovada é nas infecções graves por Clostridium difficile. Por conta do aumento na incidência e morbimortalidade relacionada a infecção pelos C difficile o transplante de microbiota fecal tem sido um boa opção terapêutica nos casos selecionados. No Brasil ainda não há um regimento bem definido para o procedimento e são poucos centros que tem feito o TMF. No entanto com as descobertas recentes da influência da microbiota intestinal na resposta imune, pode ser que no futuro novas indicações surjam e o TMF seja um procedimento largamente utilizado no nosso país.
REFERÊNCIAS BIBLIOGRÁFICAS
- Bennet JD, et al. Lancet. 1989 Jan 21;1(8630):164.
- Zhang F, et al. Am J Gastroenterol. 2012 Nov;107(11):1755
- Van Nood E, et al. N Engl J Med. 2013 Jan 31;368(5):407-15
- Cammarota G, et al. Gut 2017;66:569–580
- Mullish BH, et al. Gut 2018;0:1–22
- Choi HH, et al. Clin Endosc. 2016 May;49(3):257-65