Mais vale uma mucosectomia de cólon em piecemeal (EPMR) bem feita, do que uma tentativa de mucosectomia en-bloc (EMR) frustrada – Dicas para realizar sem receios!
Caso da vida real, que encontramos durante as agendas de Colonoscopia:
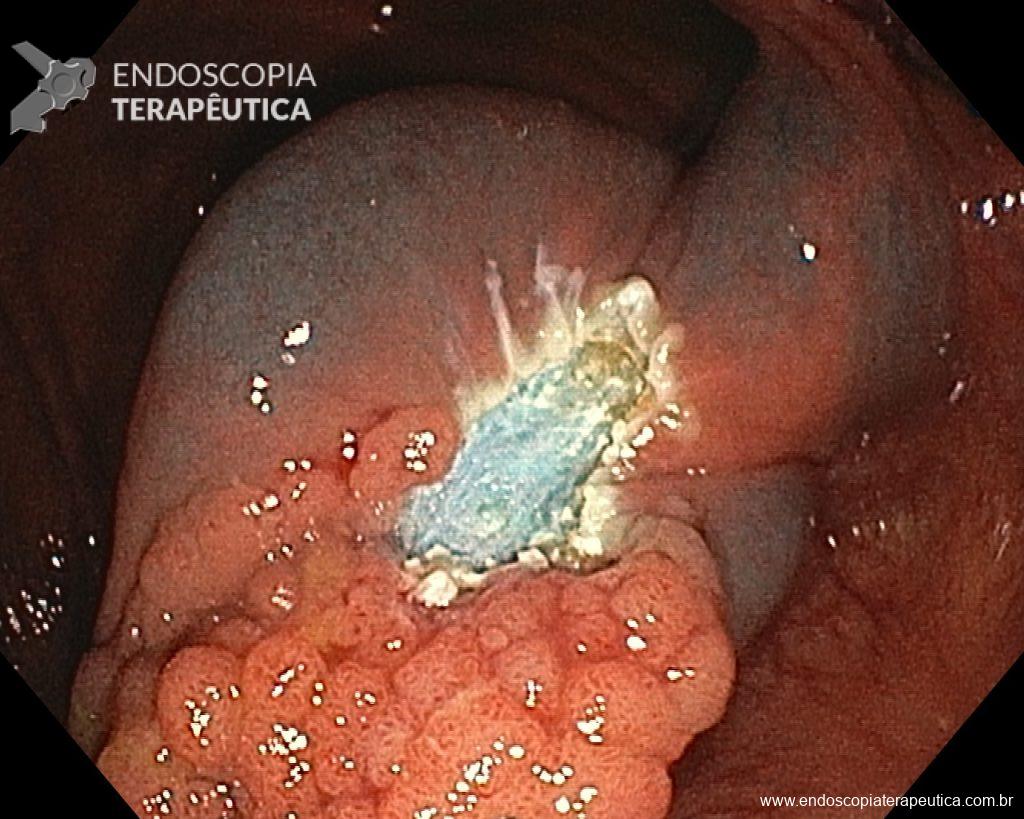
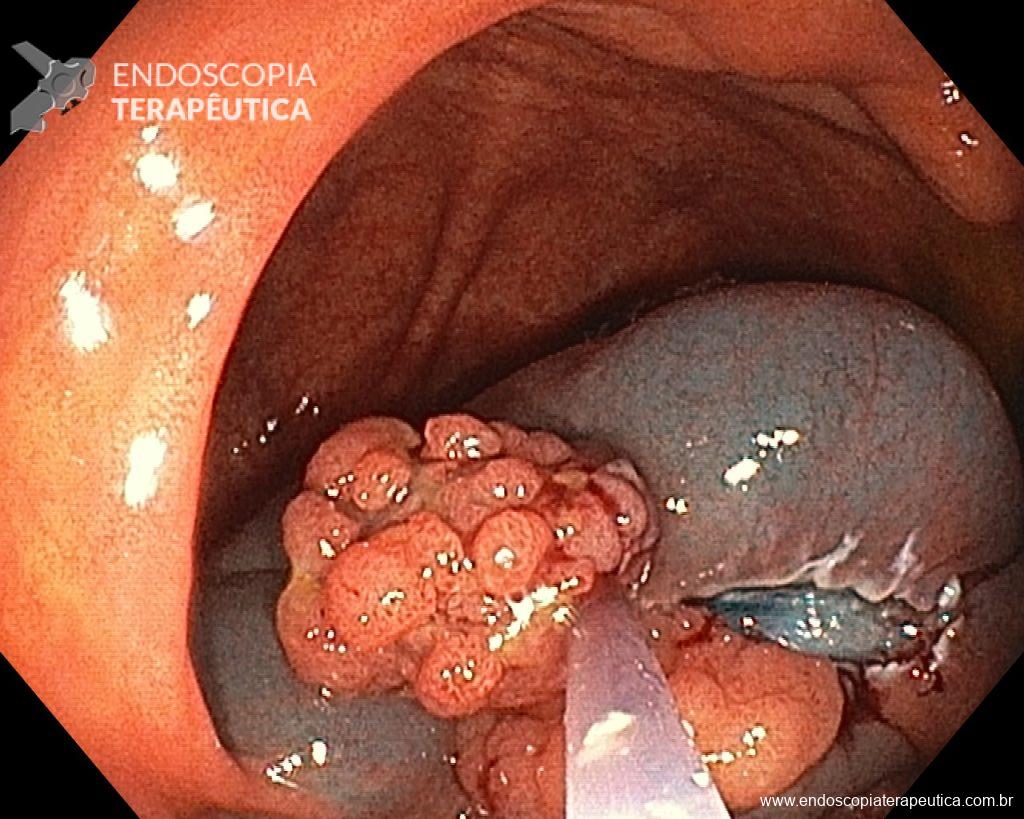
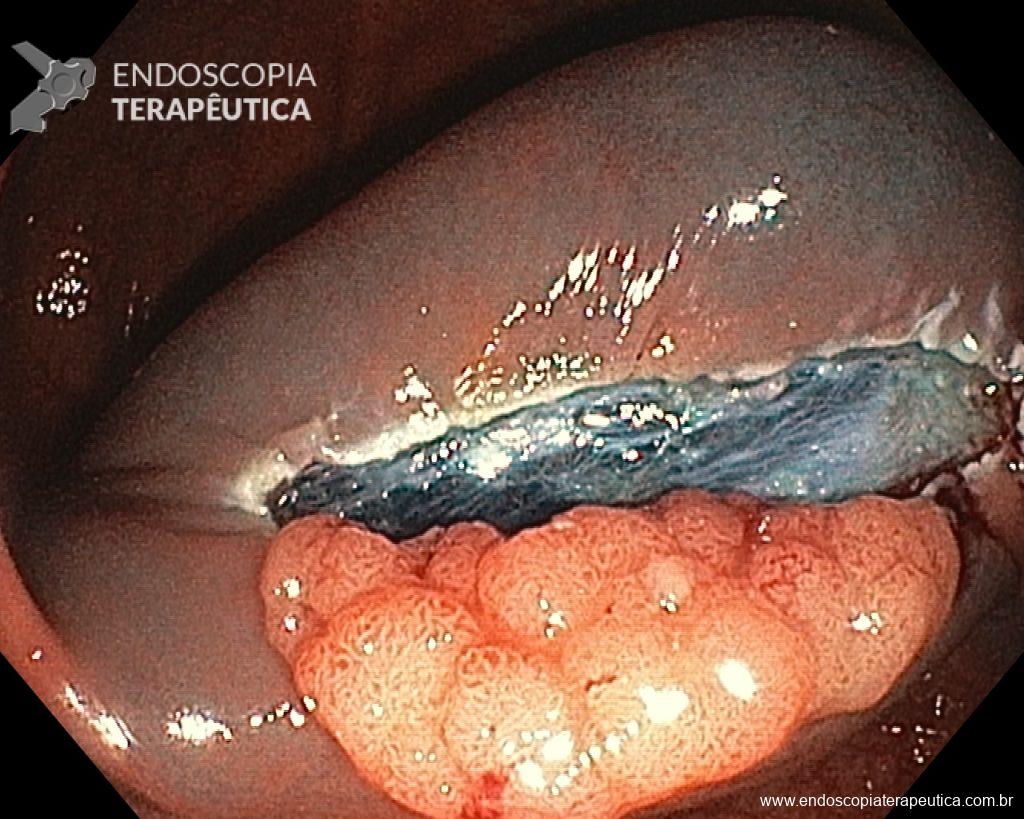
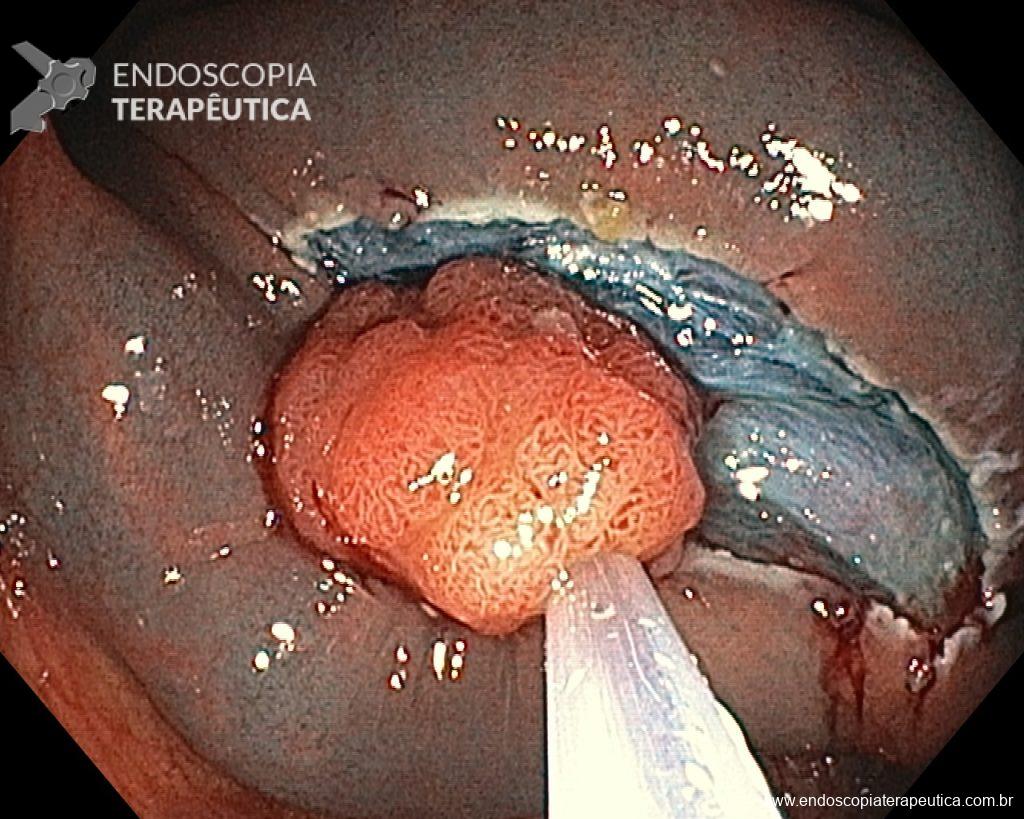
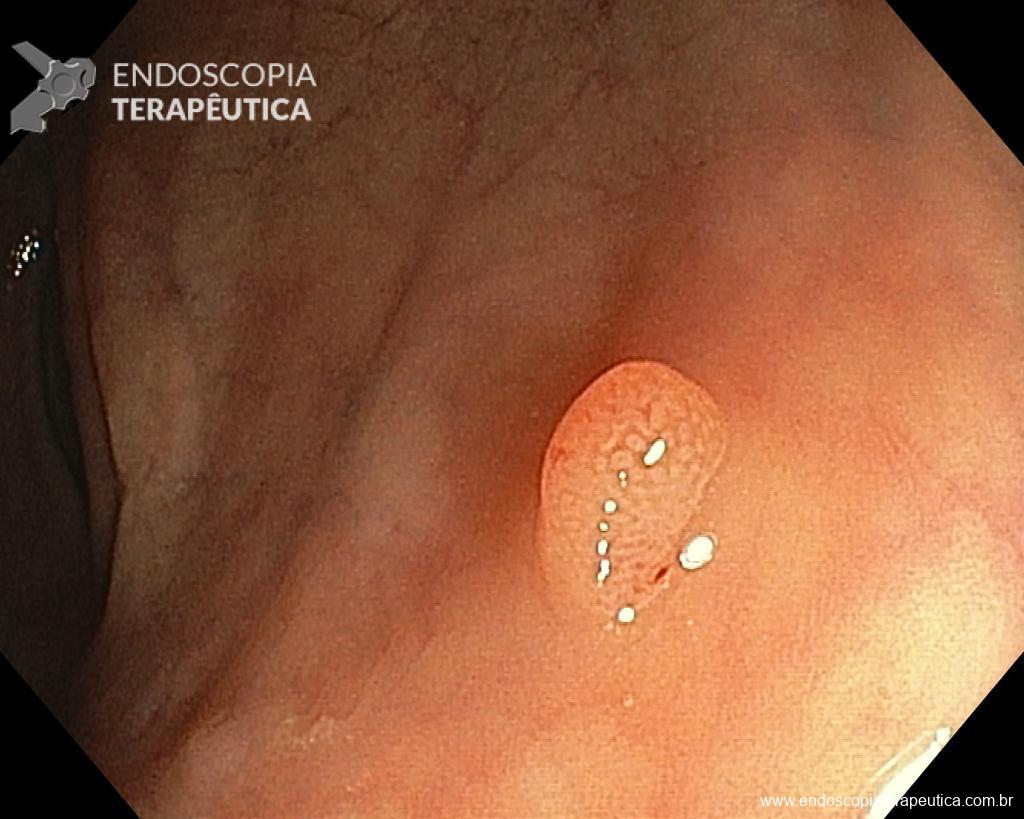
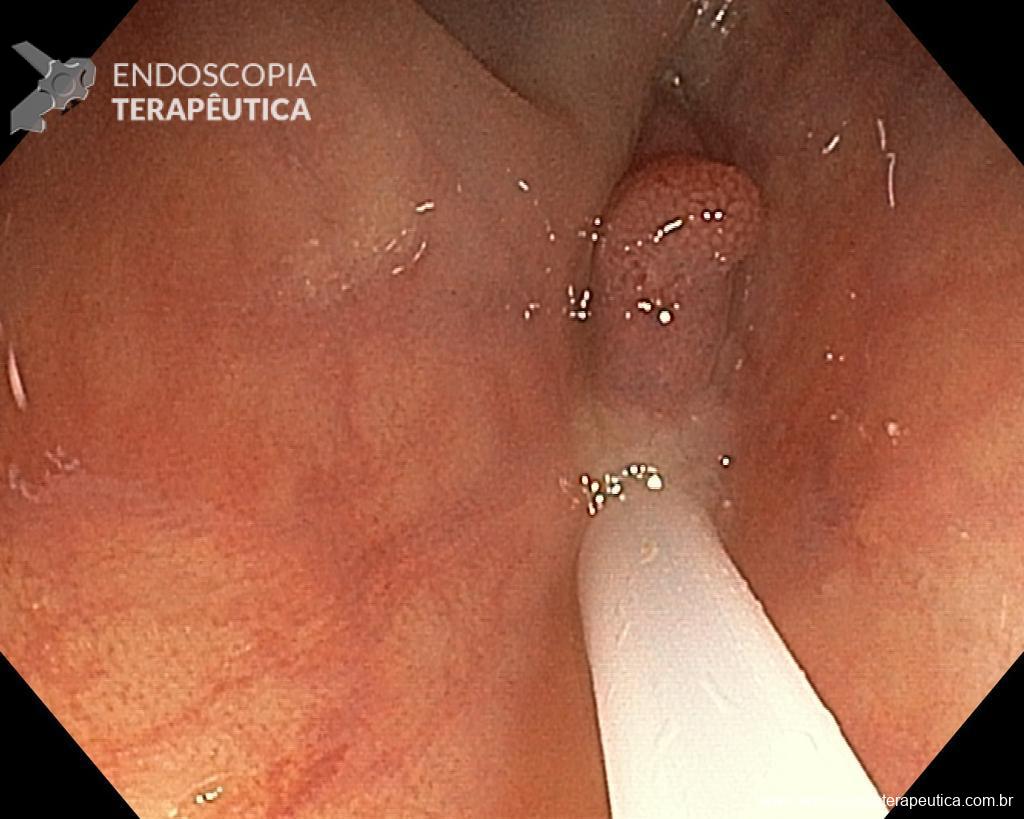
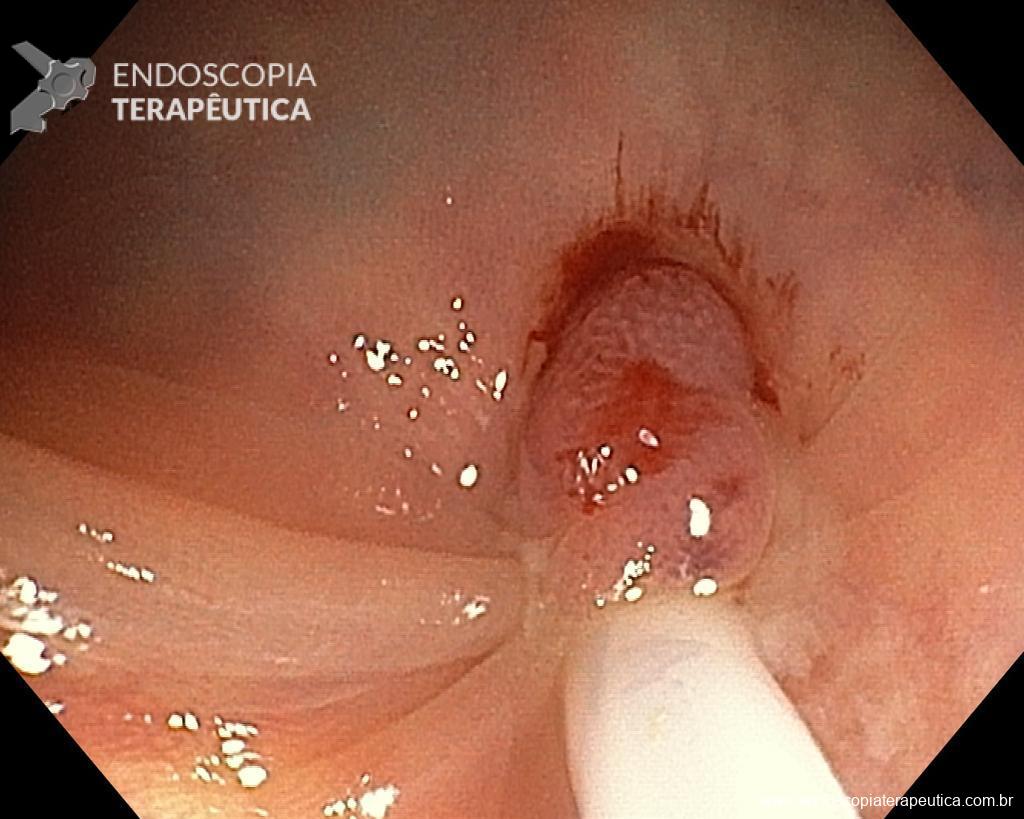
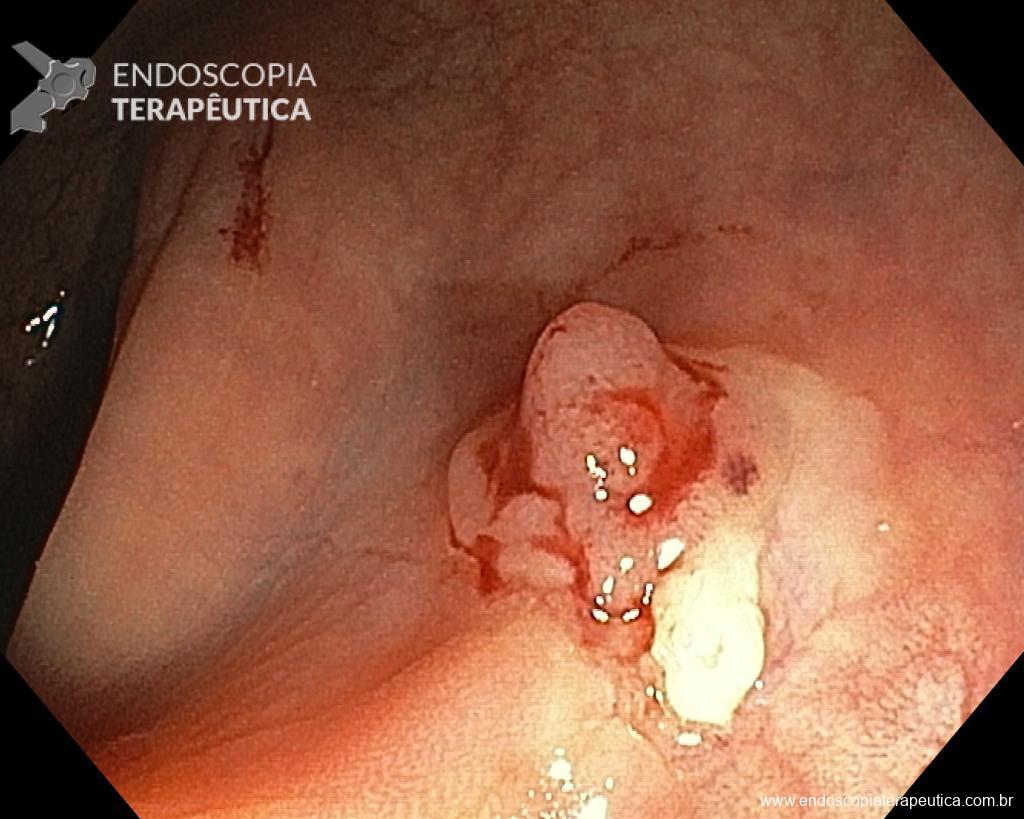
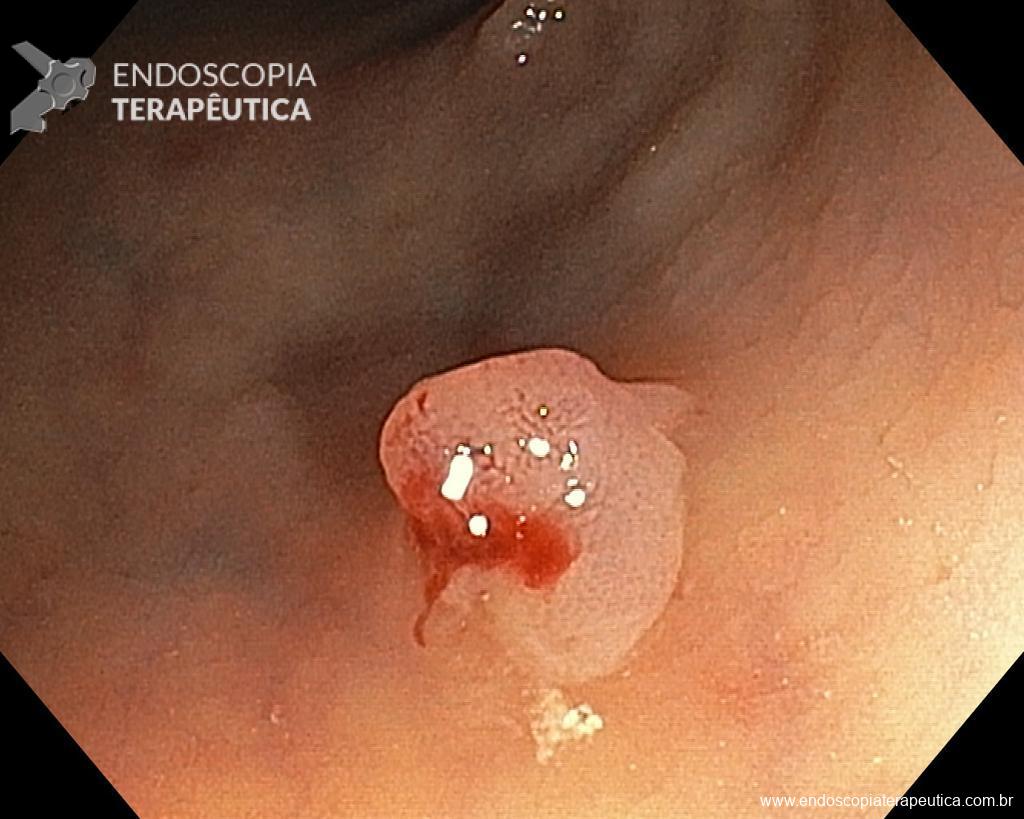
Homem, 60 anos, previamente hígido, sem comorbidades ou histórico familiar relevante para neoplasias do trato gastrointestinal, foi submetido a primeira colonoscopia para fins de rastreamento/prevenção do câncer colorretal obtendo o seguinte achado:
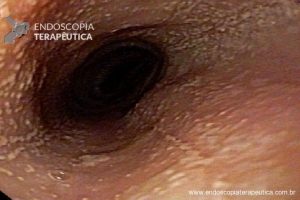
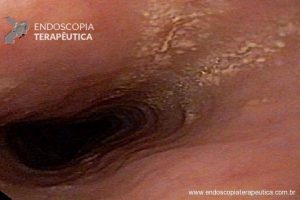
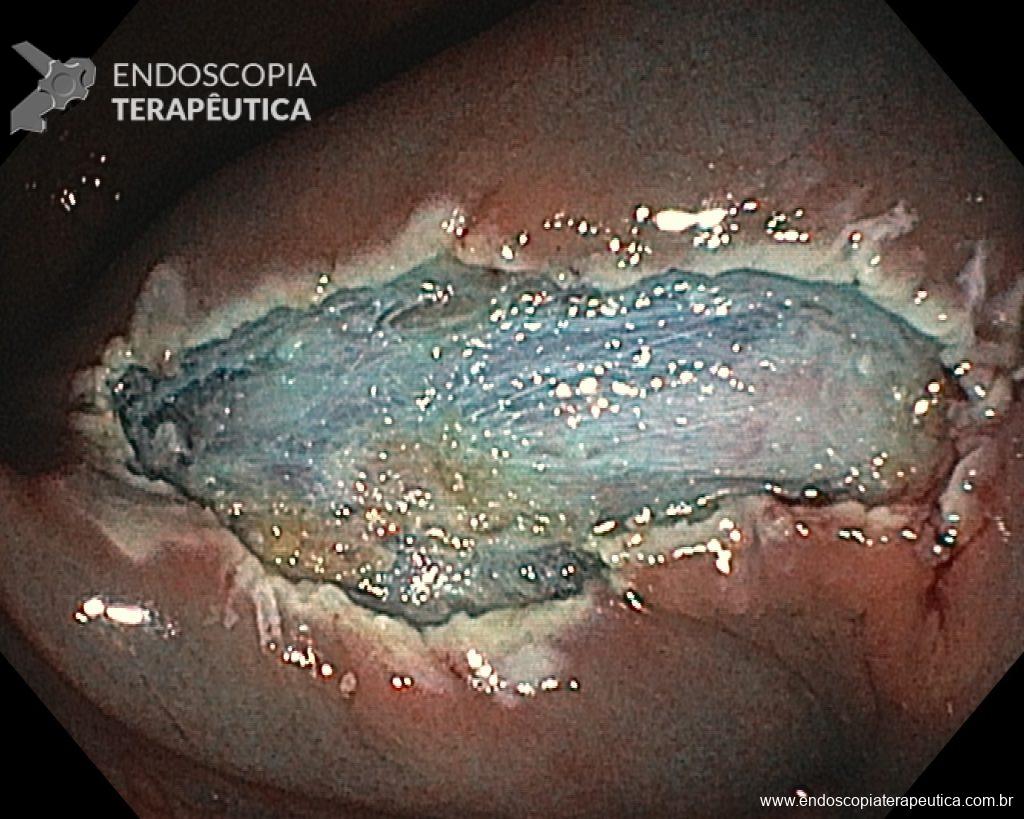
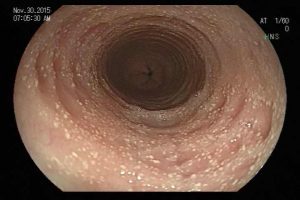
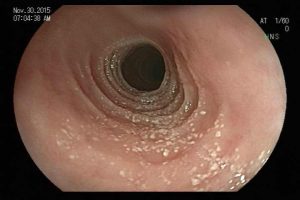
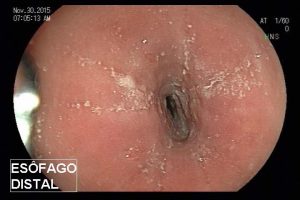
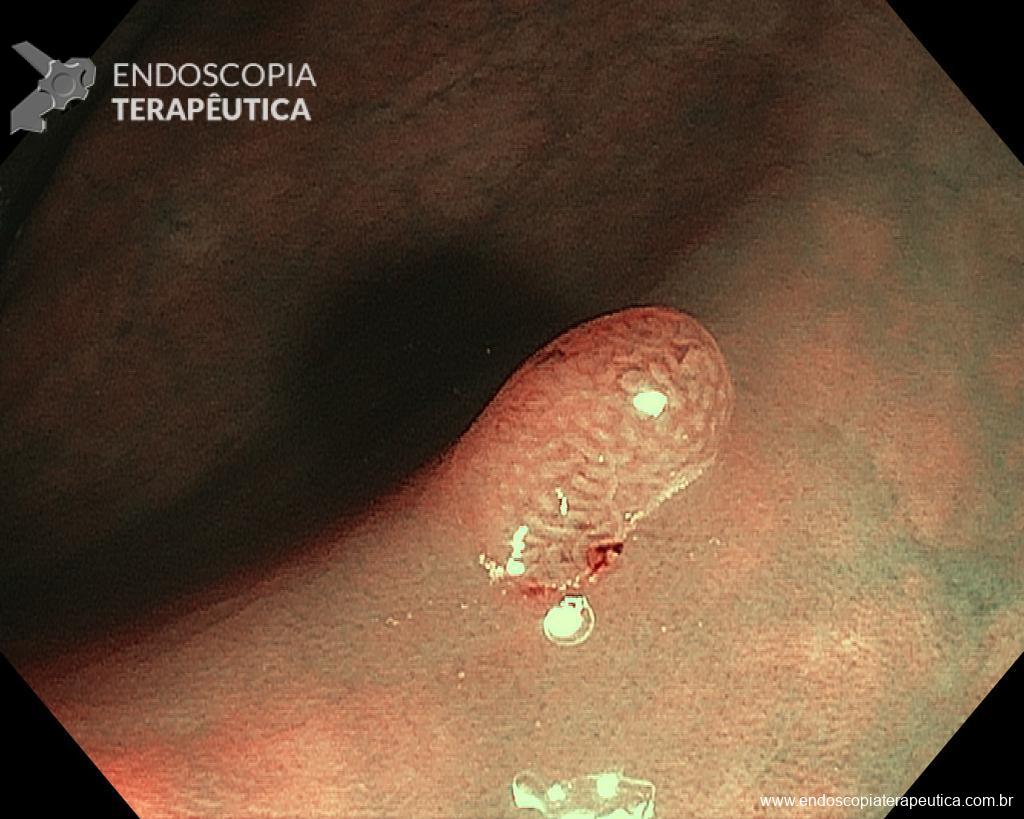
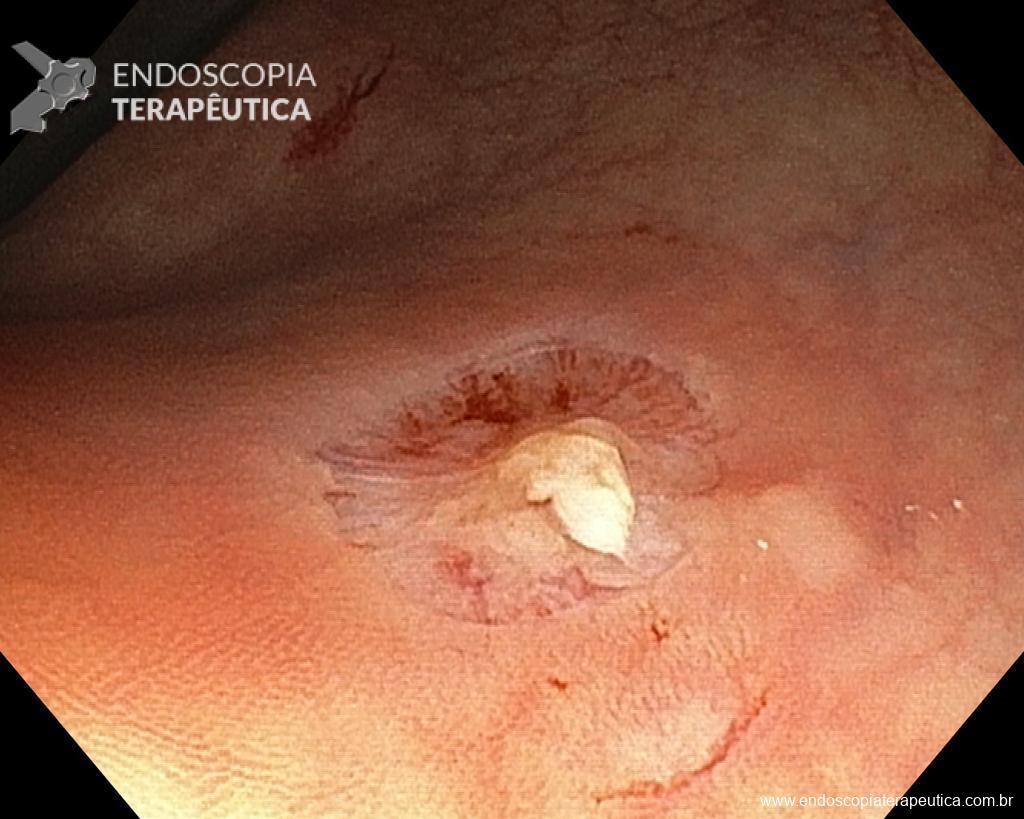
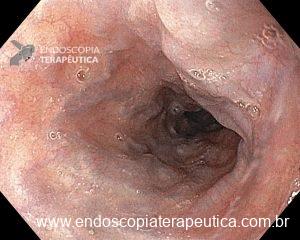
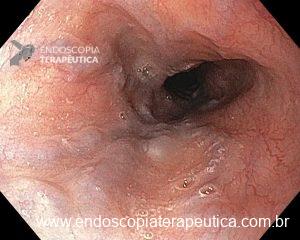
– Lesão plano-elevada de crescimento lateral (LST), do tipo granular homogênea (LST-G-H), com superfície e vasculatura regulares à cromoscopia virtual com NBI, medindo cerca de 4cm, localizada no ceco (Paris 0-IIa / JNET 2A).

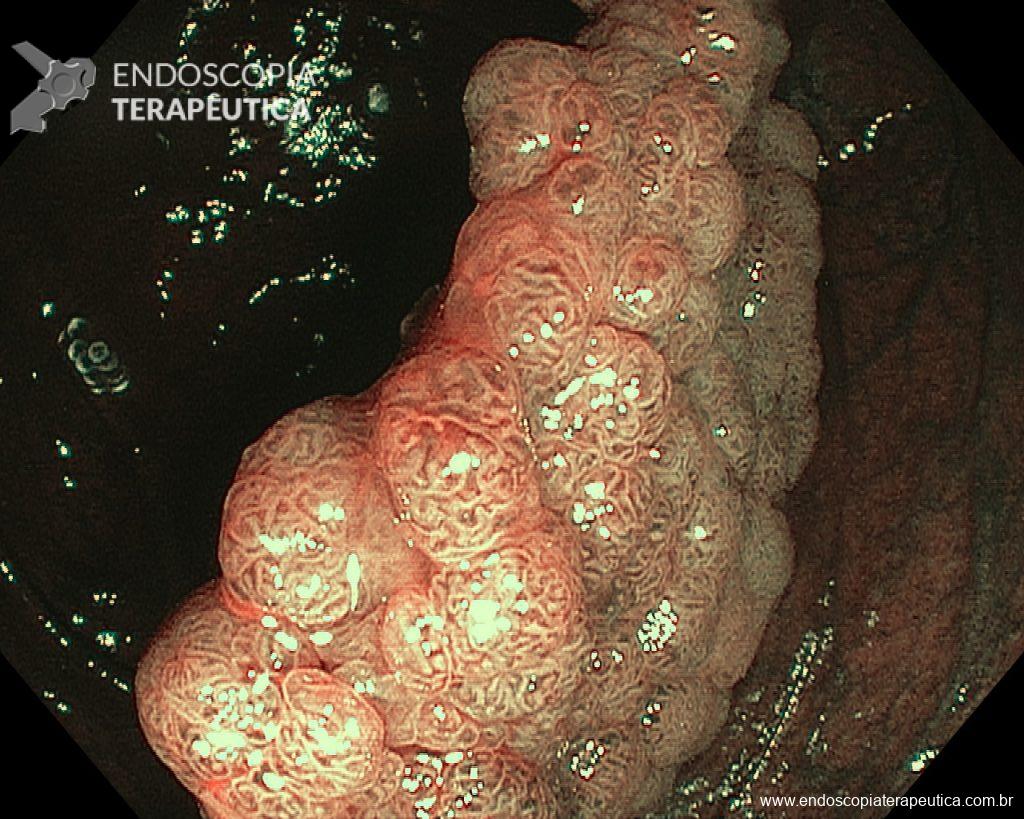
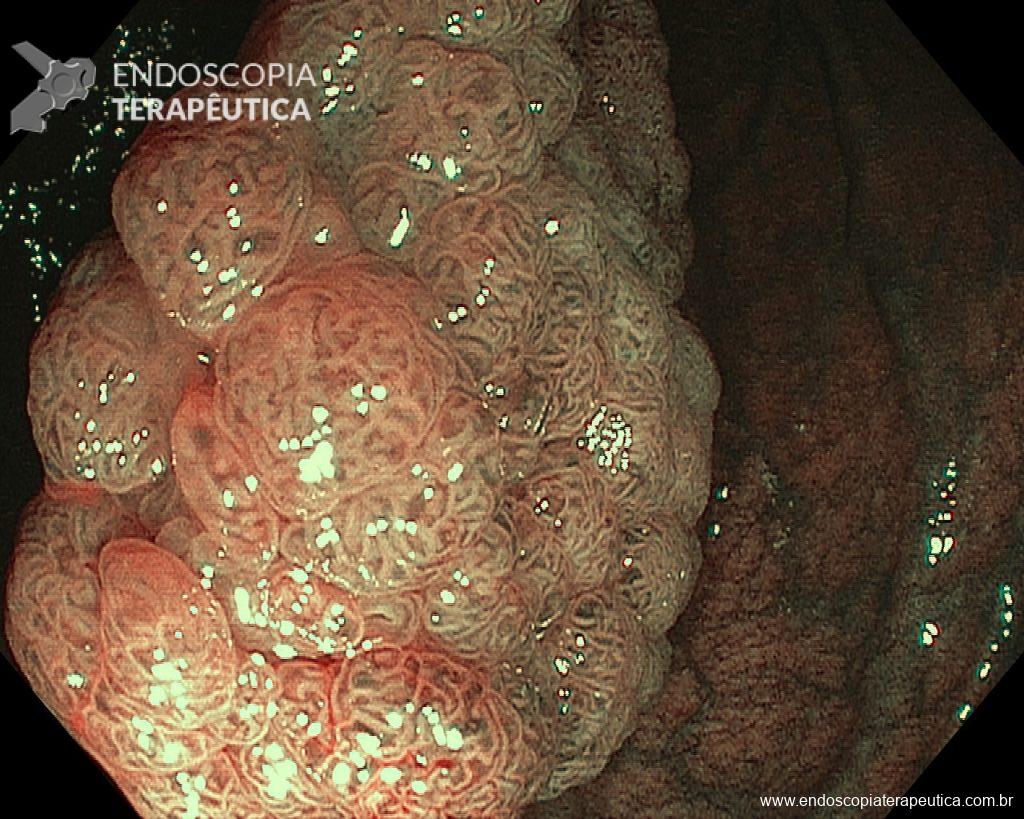
Diante de uma lesão deste tamanho é natural que surjam dúvidas acerca do tratamento ideal a ser oferecido ao paciente, especialmente naqueles que não dominam as técnicas avançadas de ressecção endoscópica, sobretudo a Dissecção Endoscópica da Submucosa (ESD).
Classificação das LST
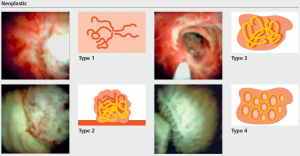
- O termo LST foi originalmente proposto por Kudo et al e descreve um padrão de crescimento de tumores colorretais de diâmetro ≥10 mm, que tendem a se espalhar lateralmente com um menor eixo vertical. As LSTs podem ser classificadas em dois tipos: LST tipo granular (LST-G), com grânulos e nódulos na superfície do tumor, e LST tipo não granular (LST-NG), com superfície plana e lisa. A primeira pode ser subclassificada em duas: LST-G tipo homogênea (LST-G-H), com grânulos ou nódulos distribuídos de maneira uniforme na superfície do tumor, e LST-G tipo nodular mista (LST-G-M), com nódulos grosseiros e de tamanhos diferentes na superfície; a segunda também é subclassifcada em duas: LST-NG tipo pseudodeprimida (LST-NG-PD), quando há uma depressão no centro da lesão, e tipo LST-NG plano-elevada (LST-NG- F), sem depressão, ou seja, totalmente plana.
saiba mais sobre classificação macroscópica nesse post: clique aqui
Prevalência e localização das LST
- A frequência estimada das LSTs entre todos os tumores colorretais epiteliais, excluindo carcinomas avançados, varia na literatura, ficando em média 4,5%, porém, estudos mais recentes com maior casuística apontam para uma prevalência que pode alcançar até 12,3%.
- As LST-G são as mais prevalentes, respondendo por cerca de 65-70% de todas as LSTs. Enquanto as LST-G-H tendem a se localizar mais no cólon proximal, as LST-G-M acometem mais o reto e usualmente alcançam maiores diâmetros. Já as LST-NG são mais comumente encontradas no cólon transverso.
LST x risco de malignidade
- Cada subtipo tem características diferentes e únicas, o que requer uma decisão sobre a política de tratamento de forma individualizada.
- Mais da metade das lesões LST-G-H são adenomas, sendo rara a presença de carcinoma, ainda que atinjam grande diâmetro, porém, mesmo quando presente, tende a ser restrita a mucosa (Tis – intramucoso).
- Quanto as LST-NG, embora ambas, LST-NG-F e LST-NG-PD, sejam consideradas como subtipo, a segunda possui maior taxa de invasão submucosa mesmo em tamanhos pequenos, cuja natureza tende a ser multifocal, inclusive é o subtipo de maior risco entre todas as LSTs. Já as LST-NG-F apresentam baixo risco de invasão submucosa, e nos poucos casos presentes, tende a ser focal.
LST x escolha do tratamento endoscópico
- A ESD é amplamente utilizada no trato gastrointestinal superior, no entanto, devido às diferenças anatômicas e histológicas entre o cólon e o estômago, não é estabelecida como a técnica terapêutica padrão para tumores colorretais. Ademais, é fundamental levar em consideração, mesmo apesar dos avanços nos últimos anos, que a técnica de ESD ainda é bastante escassa na maior parte dos centros médicos, de forma que a escolha da técnica de tratamento endoscópico não pode causar mais dificuldades do que o problema em si.
- Quase todas as LST-G-H não invadem a submucosa. Apesar de maior comparada à ESD, quando bem executada, a taxa de recorrência após EPMR é baixa, sem preocupações clínicas relevantes, visto que quando ocorre é geralmente unifocal, diminuta e facilmente tratada em uma única sessão. Portanto, neste tipo morfológico, EMR e EPMR podem ser adotadas como primeira opção, sobretudo pelo seu maior perfil de segurança.
- Pelo fato das LST-NG-PD possuírem a maior taxa de invasão submucosa, mesmo em tamanhos pequenos, com uma natureza invasiva mais multifocal e com tendência de maior profundidade, independentemente se observada apenas em um local, a ressecção em bloco, principalmente por ESD, deve sempre ser considerada a primeira opção para permitir uma avaliação patológica mais fidedigna.
- Quanto as LST-G-M, a maioria das invasões submucosas acontecem abaixo do maior nódulo, porém, em até 17,1% delas ocorrem também focos de invasão fora do nódulo dominante (invasão multifocal). Como este tipo morfológico é o que alcança os maiores diâmetros, a ressecção em bloco por EMR é frequentemente considerada difícil. Por essas razões, quando se optar por realizar EPMR, faz-se necessário garantir a ressecção do nódulo dominante em peça única ou proceder ESD, a fim de obter diagnósticos patológicos precisos. Convém lembrar que as grandes LST-G-M se localizam mais frequentemente no reto, onde tanto o perfil de segurança quanto os desdobramentos de um tratamento endoscópico não curativo por impossibilidade de avaliação histológica (colostomia definitiva) favorecem a realização de ESD em detrimento da EPMR.
- As LST-NG-F apresentam risco bem menor de invasão submucosa quando comparadas às LST-NG-PD, em algumas séries até comparáveis ao risco das LST-G-H, logo, várias daquelas lesões podem ser curadas por tratamento endoscópico com EMR ou EPMR. No entanto, como o tamanho deste tipo morfológico está associado a uma maior possibilidade de invasão da submucosa, especialmente quando maiores que 30 mm de diâmetro, a ressecção em bloco por ESD também pode ser adotada se forem difíceis de remover em bloco por EMR.
Dicas de ouro para realizar uma EPMR
1. Gastar tempo suficiente avaliando a lesão a ser tratada.
Certifique-se de inspecionar a lesão a ser ressecada. Faça questão de passar tempo suficiente avaliando a morfologia da lesão de acordo com a classificação de Paris, bem como os padrões vasculares e glandulares. Não é perda de tempo, na verdade, você ganhará tempo decidindo a melhor forma de abordar a lesão! Preste atenção nas margens, pois elas podem se estender além da prega. Inspecione a lesão com luz branca de alta definição e cromoscopia convencional ou virtual. Uma avaliação minuciosa pode identificar lesões com possível invasão da submucosa e consequentemente aqueles pacientes que se beneficiarão da ressecção em peça única.
2. Não subestimar a relevância da posição da lesão.
Tenha uma boa posição com o aparelho retificado e relaxado. Posicione a lesão entre 5 e 6 horas no campo endoscópico. O aparelho e o acessório devem responder “um para um” aos movimentos das mãos, dos dedos e também das rodas. Trabalhar na melhor posição é extremamente eficaz em minimizar os riscos e maximizar o resultado da ressecção. Se um endoscópio de rigidez variável estiver sendo usado, aproveite o potencial de retroflexão da ponta. Posicione o paciente de forma que qualquer fluido ou pedaços ressecados se acumulem longe da lesão, para que o campo de trabalho seja mantido limpo e a visão ideal esteja preservada em caso de complicação.
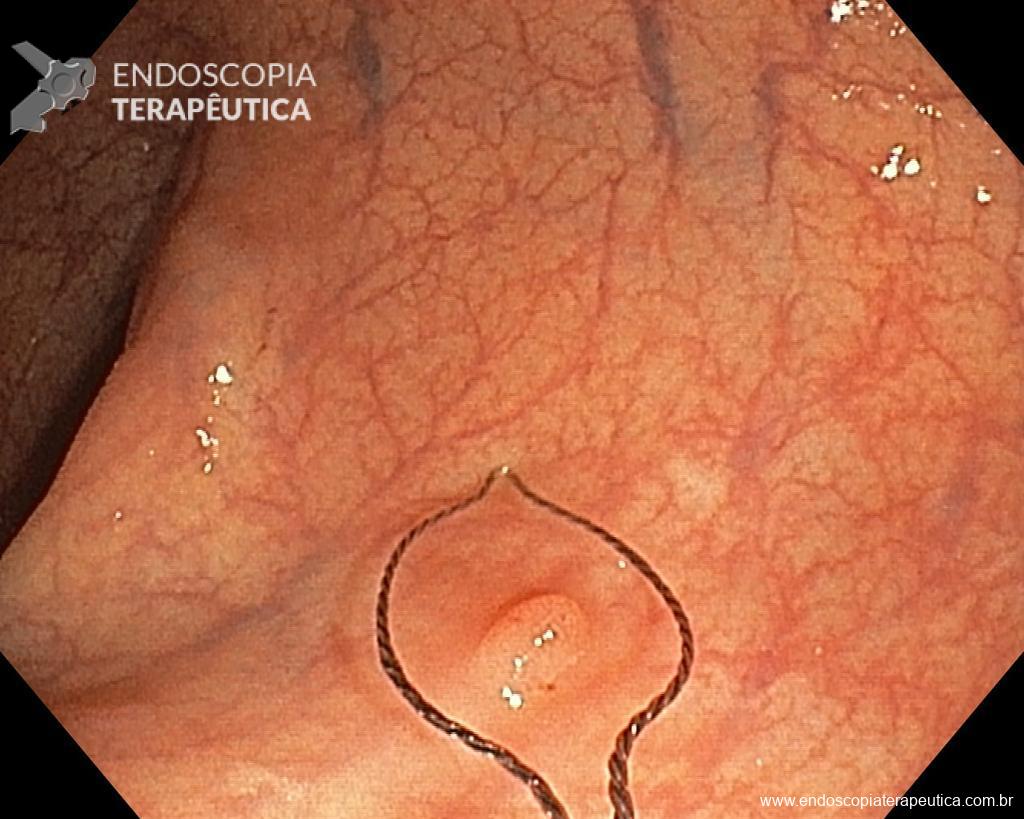
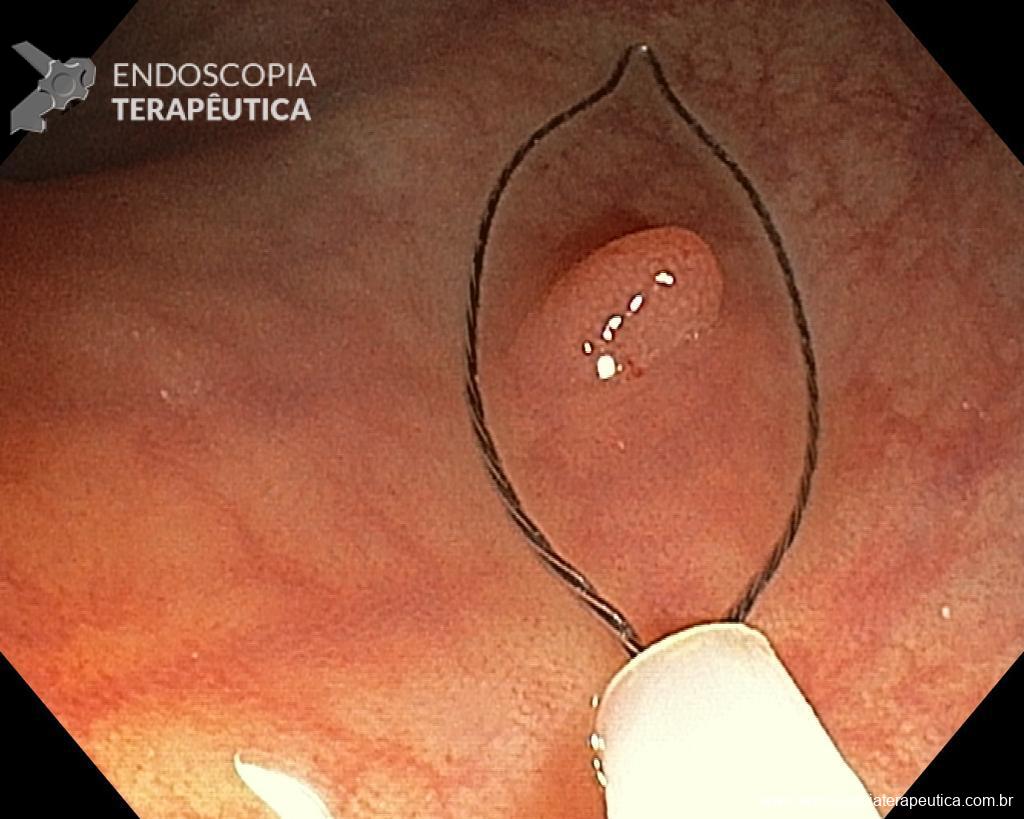
3. Escolher bem a alça.
Dependendo da morfologia ou tamanho do pólipo, selecionar a alça mais adequada pode fazer a diferença no sucesso do procedimento e, portanto, nos resultados. Alças rígidas pequenas (10–20 mm) ou grandes (25–33 mm) que possuem fio trançado devem ser preferidas para EPMR e EMR em bloco, respectivamente. Por outro lado, alças monofilamentares podem ser a melhor opção para capturar lesões que possuem dificuldade em elevar, como recorrência após EMR ou situações que já houve tentativa de ressecção prévia. Use o aparelho como uma extensão de sua mão, colocando-o paralelo à parede. Adapte o corte ao plano da lesão, fragmento por fragmento. Quanto mais ângulo você criar entre a alça e a parede, maior a probabilidade de envolver a muscular própria. Feche bem a alça para manter a lesão no lugar antes de ressecá-la. Esteja ciente da possibilidade de fibrose submucosa resultante da coleta de biópsias anteriores, tentativas de ressecção prévia e LST-NG, pois nestas situações a apreensão da alça pode ser difícil, eventualmente necessitando de técnicas alternativas para a remoção da lesão
4. Não seja guloso!
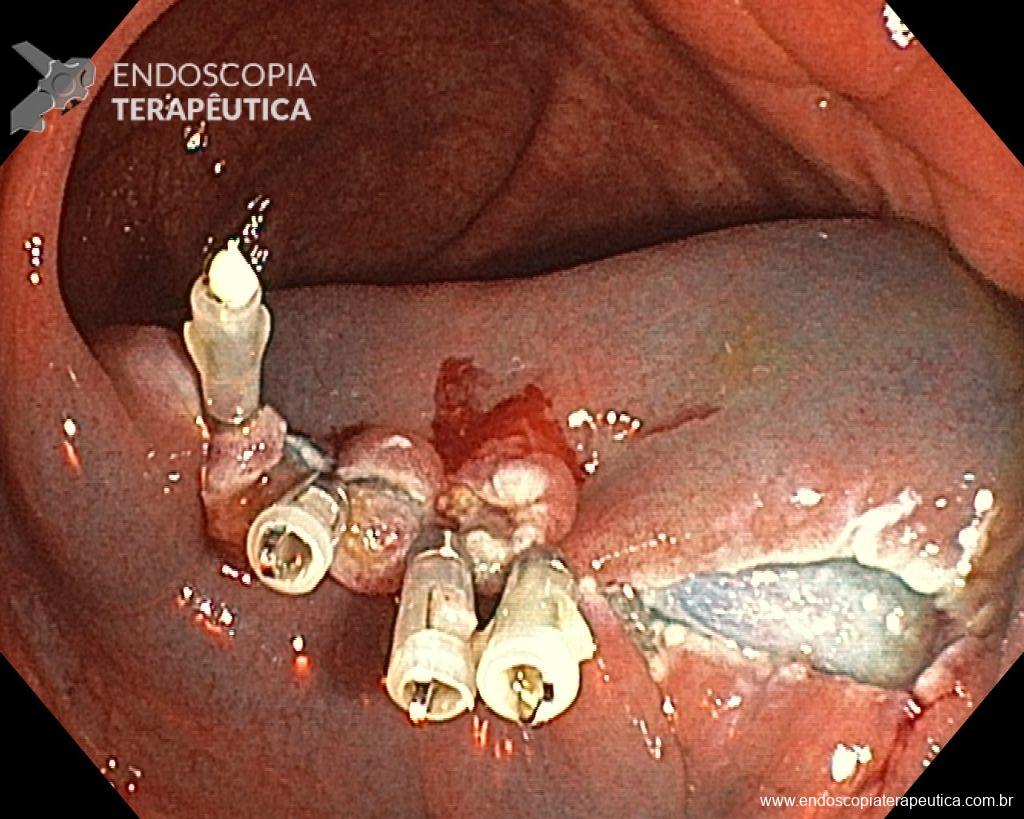
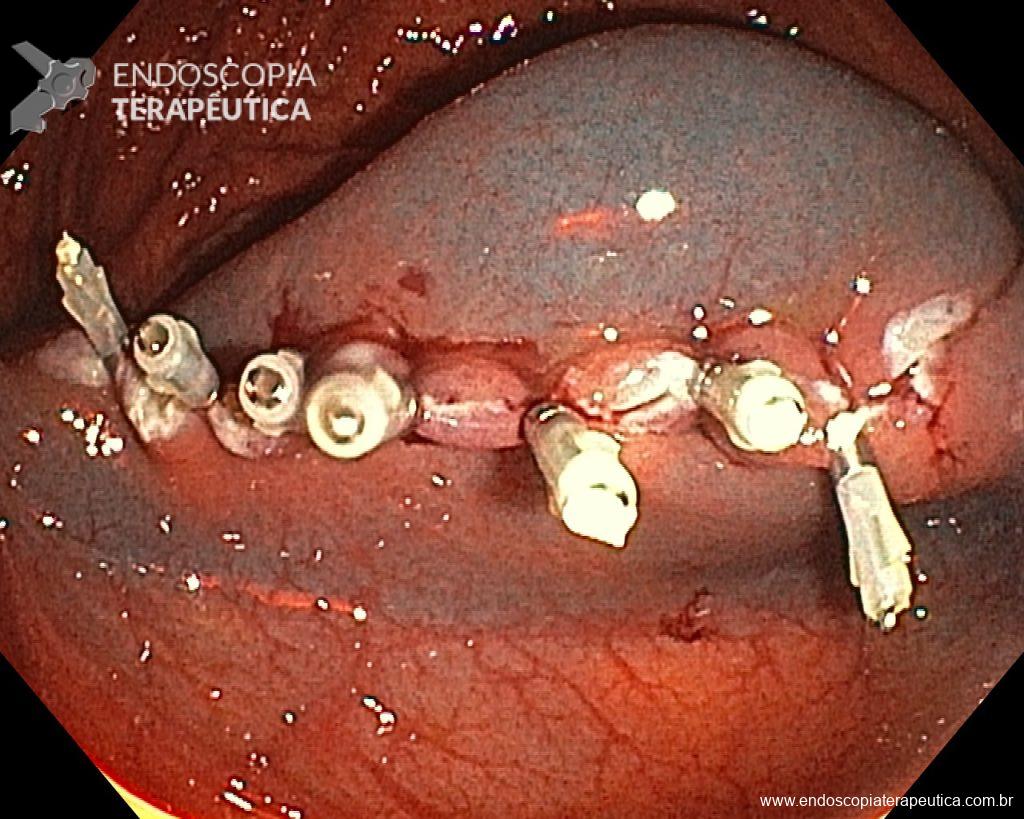
Uma vez escolhida a técnica de EPMR, tenha em mente que o objetivo deve ser a remoção completa da lesão com a maior segurança possível. Para isso, a estratégia correta é fundamental: não faça a bolha submucosa toda de uma vez, em vez disso, faça injeções sucessivas seguidas do corte, preferencialmente no sentido proximal-distal; sempre que disponível, dê preferência a soluções viscosas, que garantam uma maior patência da bolha; utilize uma alça de menor tamanho (10-15 mm) para apreender a bolha formulada, além de facilitar, diminui o risco de perfuração quando se tenta apreender toda a lesão de forma inadvertida.
5. Não entrar em pânico com sangramento.
Quando ocorrer sangramento intraprocedimento (IPB), não entre em pânico – é apenas um sangramento. Embora seja verdade que só a experiência prática pode deixá-lo confiante perante o IPB, esteja preparado para abordá-lo sistematicamente, como faria com qualquer outro procedimento endoscópico. Antes de iniciar o procedimento você deve se certificar que seu conjunto de endoscopia está totalmente equipado e capaz de lidar com todos os tipos de IPB. Faça uso consciente de tudo o que puder, sem entrar em pânico. Use a bomba de lavagem para remover o sangue do tecido alvo e limpar o ponto em que você precisa intervir. Se você julgar que o vaso é pequeno (até cerca de 2 mm), você pode coagulá-lo de imediato com a ponta da alça em modo de “soft coagulation”. Por outro lado, se o vaso é maior que 2 mm, a utilização de uma pinça de coagulação é uma estratégia mais efetiva. Enquanto aguarda o acessório, caso esteja usando um cap acoplado a ponta do aparelho, utilize-o como um “dedo” e faça pressão sobre o vaso. Quando estiver pronto com seu dispositivo, use a bomba de água novamente para limpar a área, abra a pinça e apreenda o vaso, tracionando-o em sua direção (e para longe da parede) antes da coagulação. O uso de coagulação com plasma de argônio (APC) durante EMR deve ser minimizado, da mesma forma com os clipes hemostáticos, que devem ser utilizados quando você já tentou de tudo e o sangramento continua.
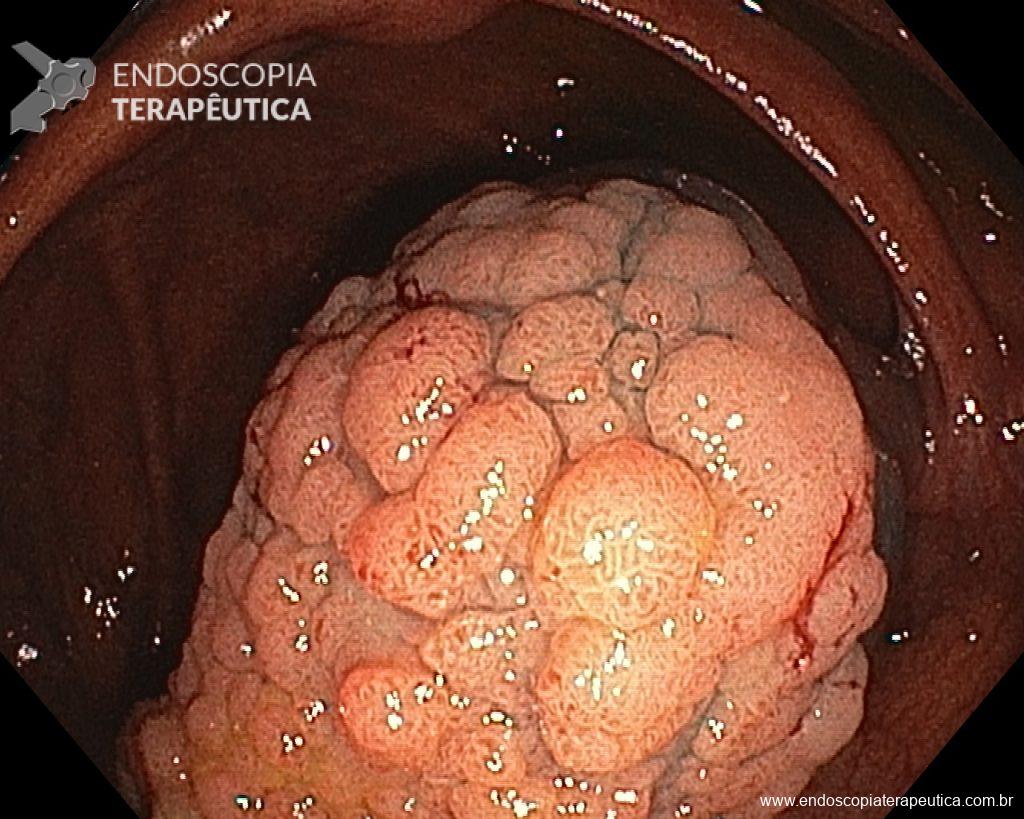
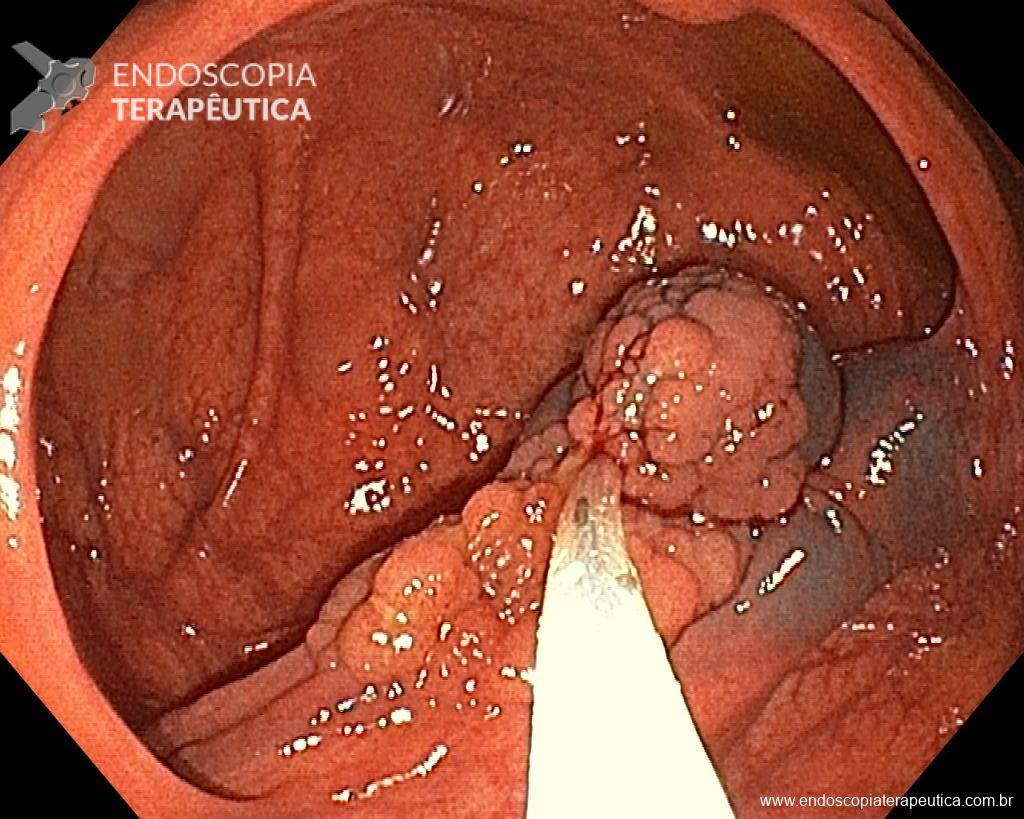
Diante do exposto, para o caso exemplificado acima, foi optado pela ressecção através da técnica de EPMR, tanto pelo tipo morfológico (LST-G-H) e características da superfície da lesão (JNET 2A), como também pela localização (ceco), que apresenta um risco maior de complicações.
Referências
- Papparella L et al. Efficacy and safety of endoscopic resection techniques of large colorectal lesions: experience of a referral center in Italy. Eur J Gastroenterol Hepatol 2022; 34: 375–381.
- Ishigaki T et al. Treatment policy for colonic laterally spreading tumors based on each clinicopathologic feature of 4 subtypes: actual status of pseudo-depressed type. Gastrointest Endosc 2020; 92: 1083-94.
- Auriemma F and Repici A. Mistakes in endoscopic resection and how to avoid them. UEG Education 2017; 17: 27–29.
Como citar este artigo
Brasil G. Mais vale uma Mucosectomia de cólon em Piecemeal (EPMR) bem feita, do que uma tentativa de Mucosectomia En-bloc (EMR) frustrada – Dicas para realizar sem receios! Endoscopia Terapêutica 2023, Vol 2. Disponível em: endoscopiaterapeutica.net/pt/mais-vale-uma-mucosectomia-de-colon-em-piecemeal-epmr-bem-feita-do-que-uma-tentativa-de-mucosectomia-en-bloc-emr-frustrada-dicas-para-realizar-sem-receios/



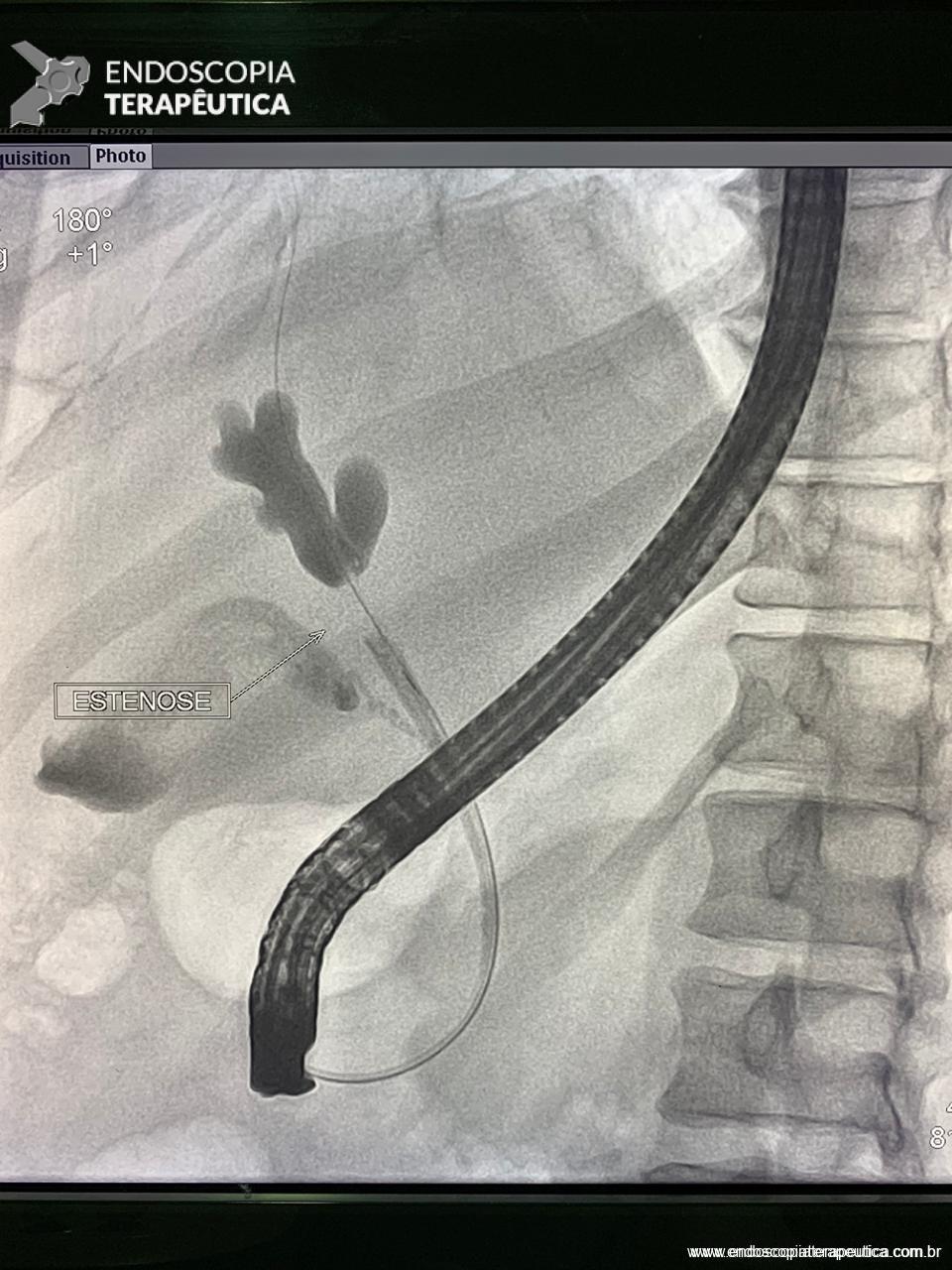
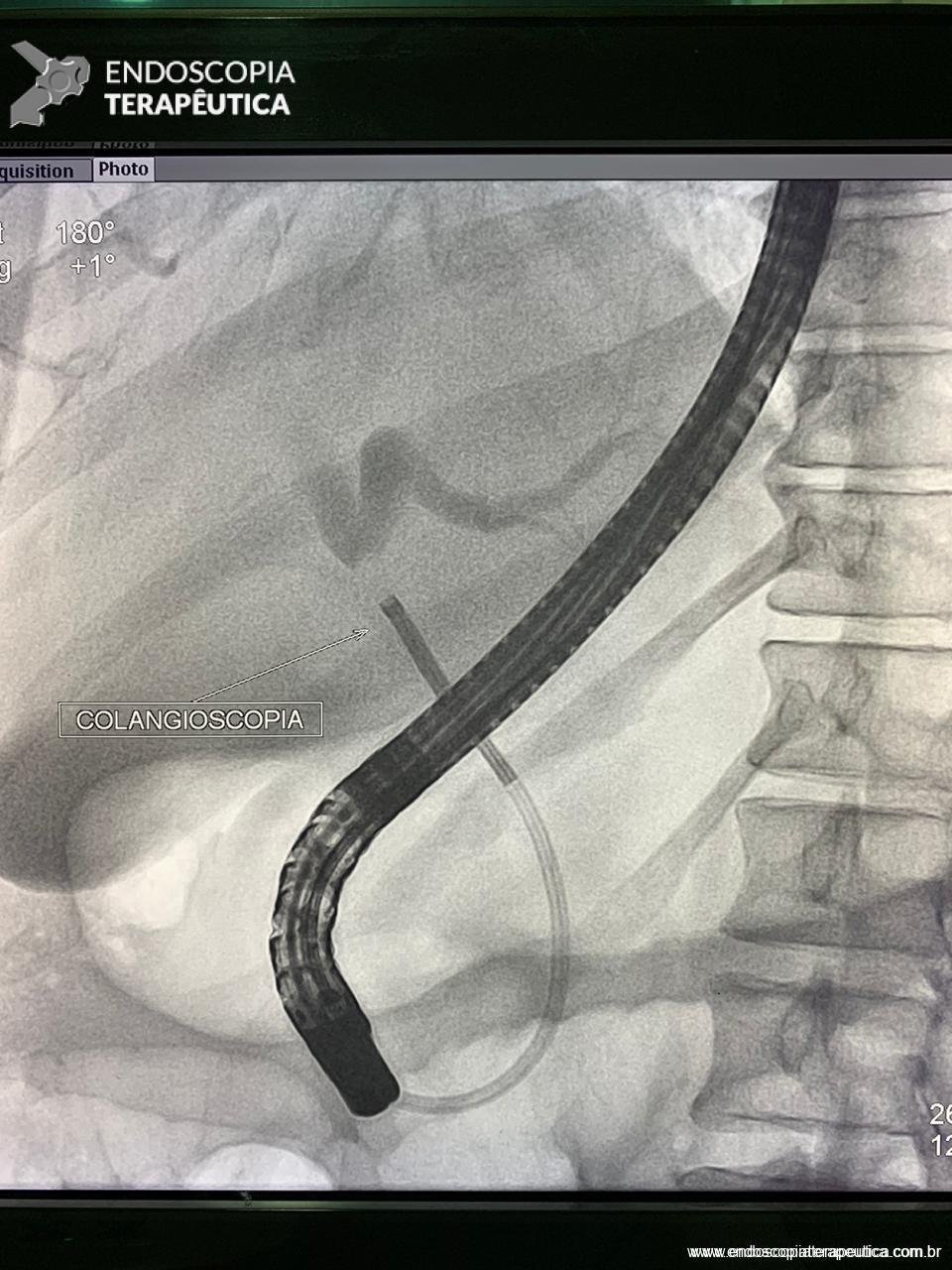
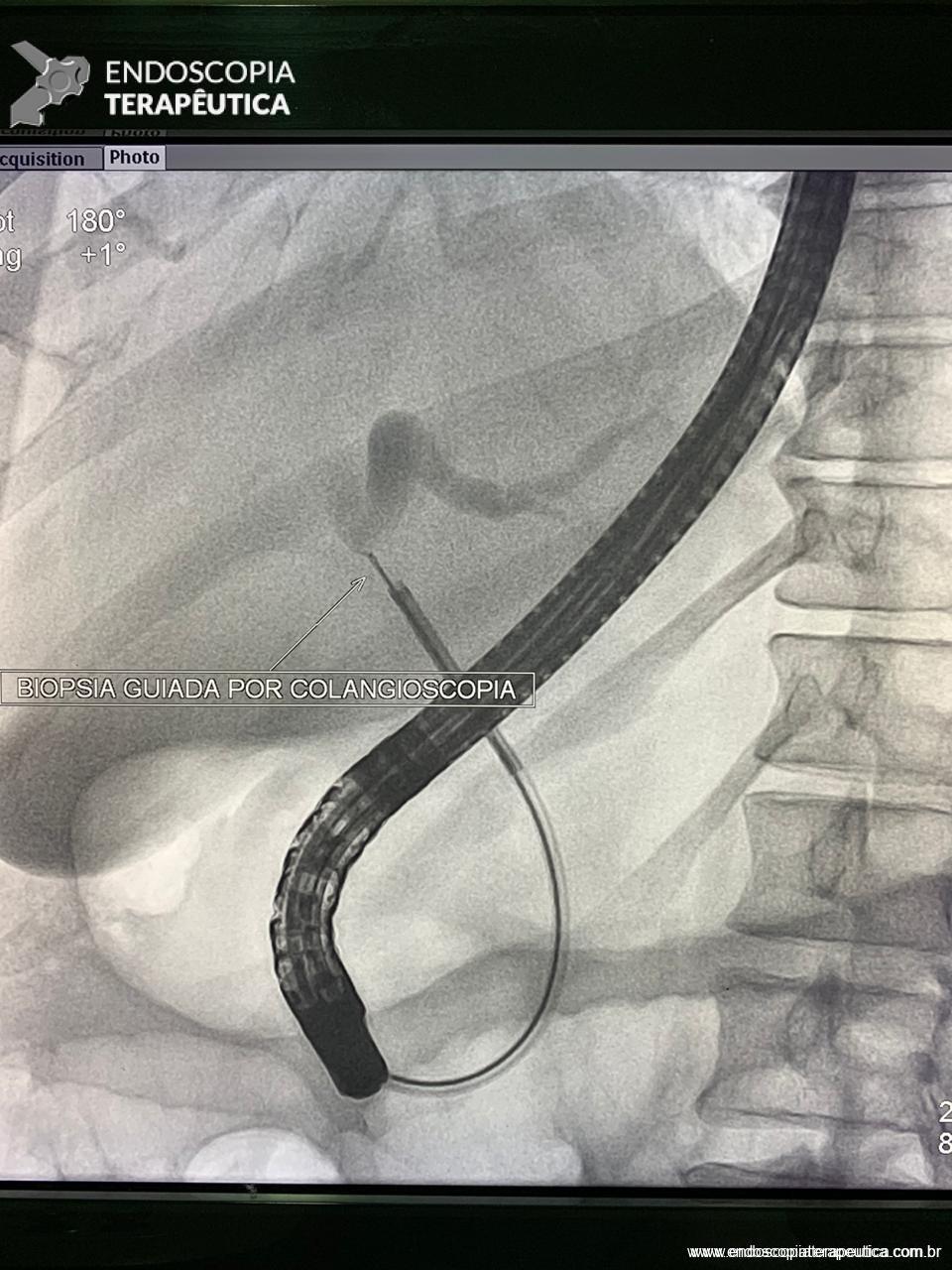


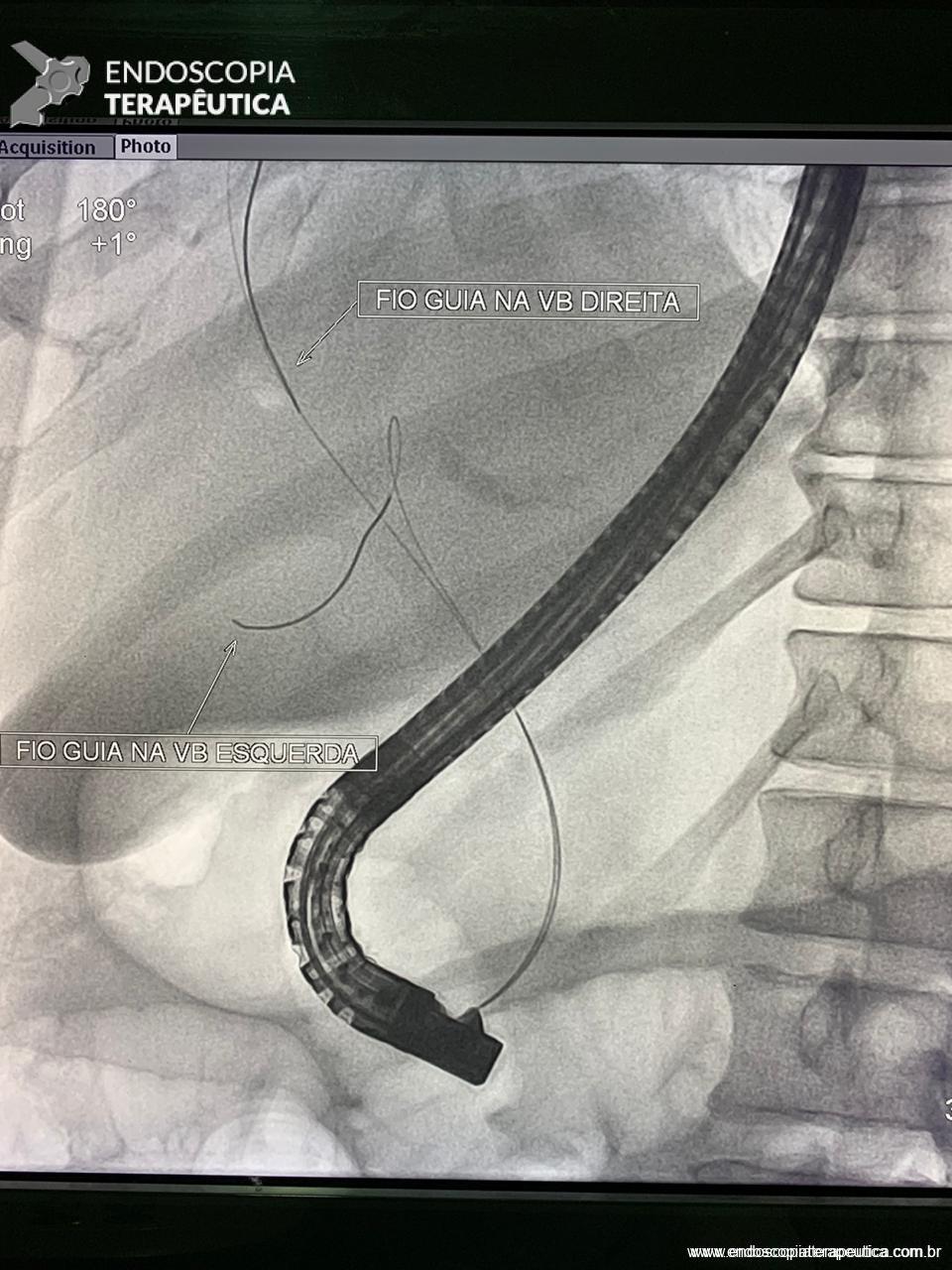
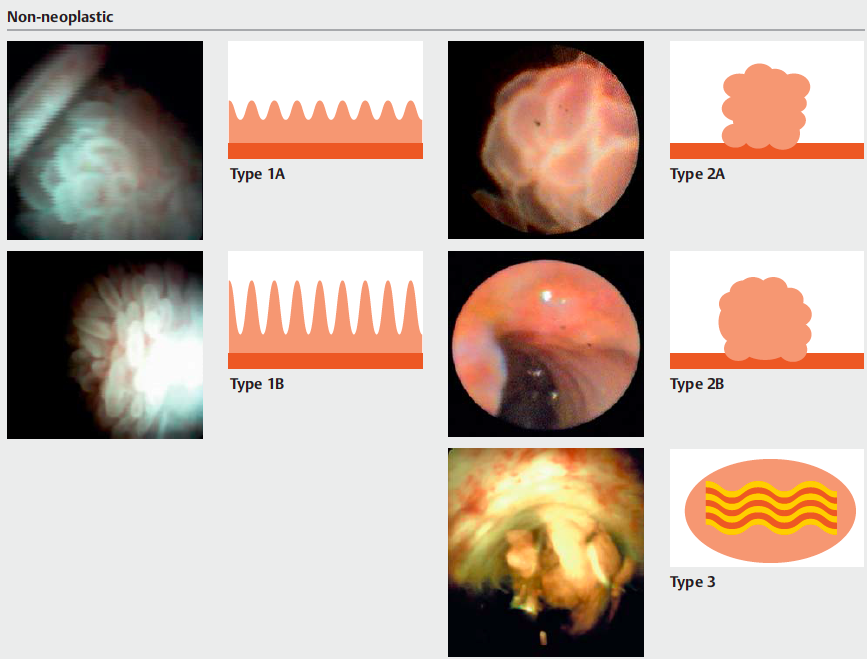
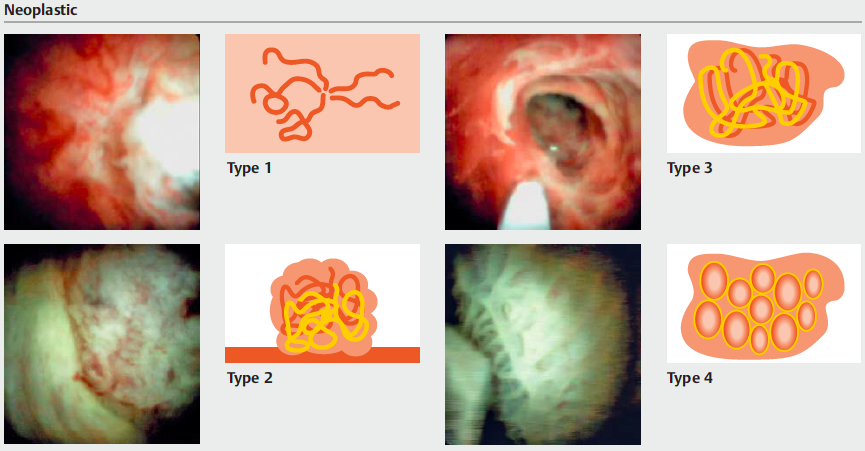 Medranda-Robles et al. Endoscopy. 2018 Nov;50(11):1059-1070.
Medranda-Robles et al. Endoscopy. 2018 Nov;50(11):1059-1070.