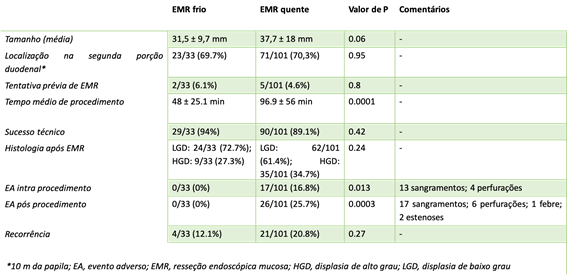
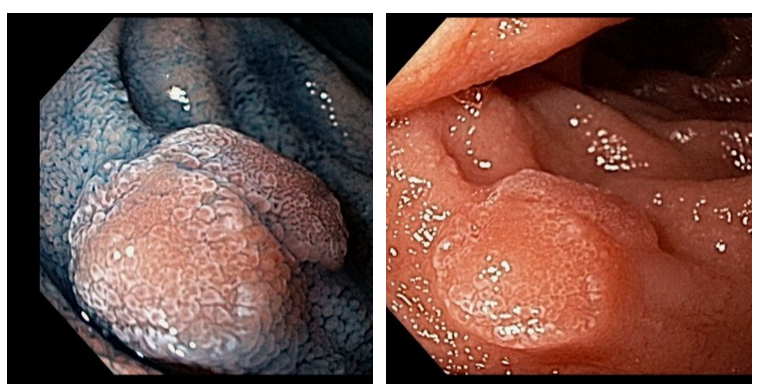
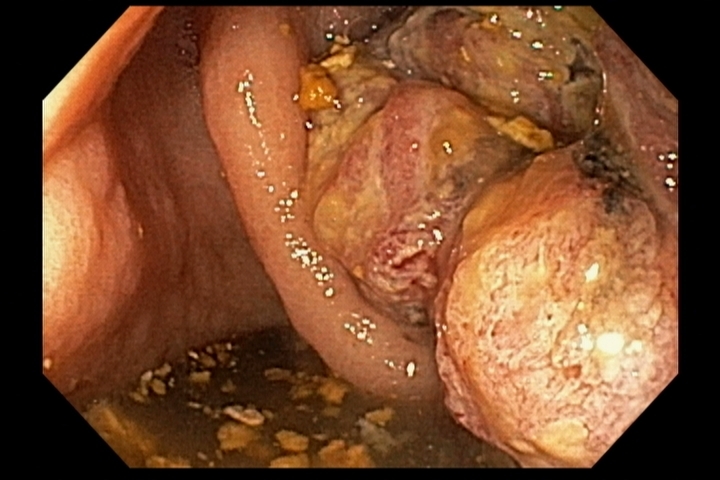
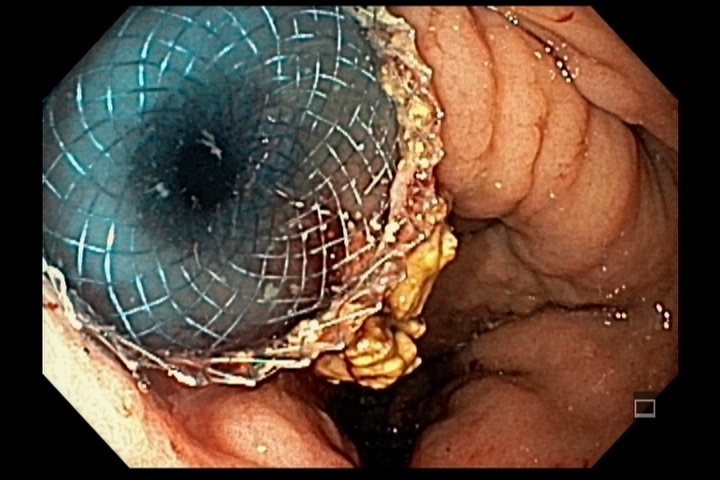
Ingestão de cáusticos e endoscopia – quando podemos realmente ajudar no quadro agudo?
A ingestão de cáusticos representa problema relevante tanto pelos danos agudos como crônicos, envolvendo pacientes de todas as faixas etárias. Na população pediátrica está habitualmente associada a ingestão acidental principalmente de produtos de limpeza armazenados de forma incorreta e reaproveitamento de embalagens. Nas outras faixas etárias, tentativas de suicídio através da ingesta intencional de cáusticos são causa relevante, senão a mais frequente e grave.
Os agentes cáusticos podem sem ácidos (ácido muriático, ácido sulfúrico, ácido fórmico -“formol”) ou álcalis (bases), dos quais os principais representantes em nosso meio são o hipoclorito de sódio (água sanitária) e hidróxido de sódio (soda cáustica). O potencial de dano relevante está associado a dois fatores principais, o pH do produto (maior risco com pH<2 ou >11) e o volume ingerido.
A ingestão de cáusticos alcalinos está associada a dano por necrose por liquefação onde há saponificação dos lipídeos, desnaturação de proteínas e trombose capilar com potencial de danos mais profundos e perfuração. O dano secundário à ingestão de ácidos está associado por sua vez à necrose por coagulação. Há uma evolução natural no processo de dano e cicatrização da mucosa que pode ser dividido em três fases principais:
- Fase aguda (até 10 dias) – necrose aguda (liquefação ou coagulação), trombose e ativação de cascata inflamatória; início da deposição de colágeno e re-epitelização.
- Fase sub-aguda (10 dias – 6 a 8 semanas) – maior atividade dos mecanismos de reparação, aumento de colágeno e reepitelização o que pode conferir melhora sintomática inicial, com potencial de retorno à dieta oral. Considerada uma fase “traiçoeira” pois os sintomas melhoram enquanto o esôfago se reepiteliza e forma possíveis estenoses.
- Fase crônica (>6 a 8 semanas) – fase de cicatrização e estenoses. Há recrudescimento de sintomas de odinofagia, disfagia e vômitos pelo estabelecimento de estenoses cicatriciais no esôfago.
Manejo inicial
O manejo inicial visa oferecer suporte, com avaliação de possíveis danos às vias áreas, hidratação, dieta zero e realização de exames complementares. Os laboratoriais incluem hemograma, ureia, creatinina, enzimas hepáticas, enquanto os exames de imagem podem incluir radiografia simples (avaliar pneumoperitônio, pneumotórax ou pneumomediastino) e endoscopia. A tomografia tem capacidade de avaliar a profundidade do dano ao trato digestivo (não avaliada pela endoscopia), sendo utilizada em diversos centros, porém não é utilizada rotineiramente em nosso meio.
Endoscopia
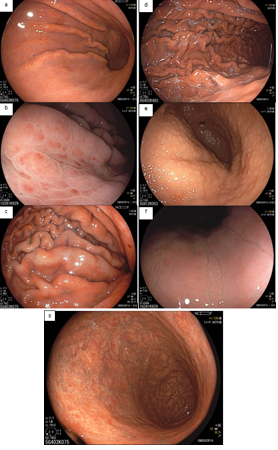
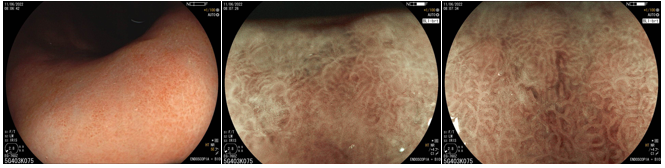
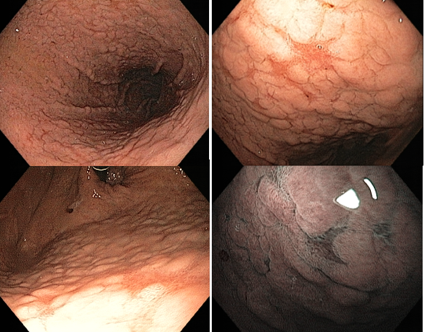
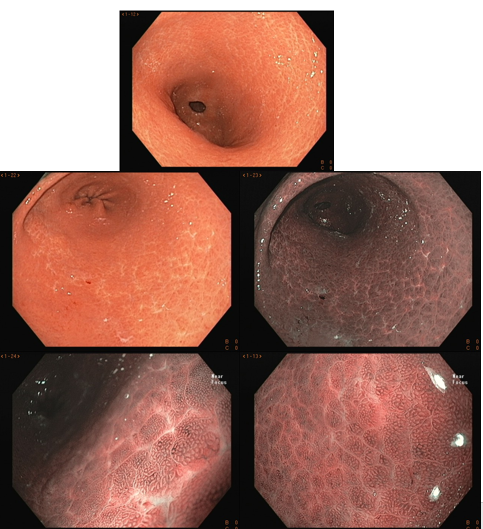
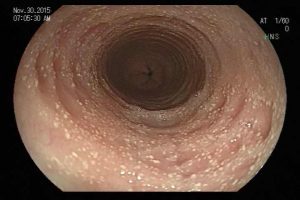
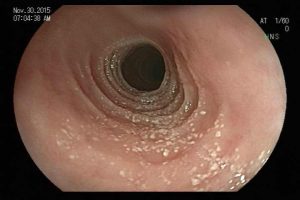
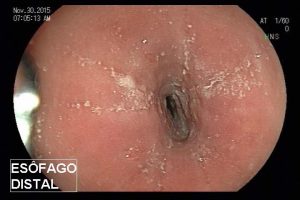
A endoscopia digestiva alta possui papel importante no tratamento dos pacientes com ingestão cáustica através da classificação das lesões e consequente identificação do grupo de pacientes com maior risco para desenvolvimento de estenoses, os quais devem ser incluídos em um programa de dilatação. A classificação utilizada é a Classificação de Zargar, sendo bastante simples:
- Grau 1 – edema e enantema;
- Grau 2 a – Friabilidade, erosões, eritema, exsudato inflamatório difuso;
- Grau 2 b – úlceras superficiais ou profundas, confluentes ou não;
- Grau 3 a – áreas de necrose;
- Grau 3 b – necrose extensa.
A endoscopia deve ser realizada o quanto antes, preferencialmente nas primeiras 24h da ingesta e no máximo até 48h após. Após esse período, o risco de agravamento de lesões é maior e a endoscopia deve ser suspensa, podendo ser realizada após 3 semanas da ingestão, momento onde podem ser iniciadas as sessões de dilatação nos pacientes de risco para desenvolvimento de estenoses (Zargar 2b ou 3). Alguns estudos sugerem a realização de estudo contrastado para confirmar a presença de estenose antes da dilatação, o que também pode ser realizado nos pacientes que não conseguiram fazer endoscopia nas primeiras 48h. A presença de necrose esofágica pode estar associada a perfuração sendo importante avaliar a profundidade da lesão com tomografia. Quadros de necrose extensa habitualmente são cirúrgicos.
É importante considerar que a ingestão de cáusticos pode desencadear uma série de alterações sistêmicas como acidose metabólica, distúrbios eletrolíticos, insuficiência renal e também danos (ou hiperatividade) das vias aéreas (principalmente os mais voláteis) requerendo cuidado adicional na sedação destes pacientes.
Mensagens principais:
- A endoscopia deve ser realizada precocemente (máximo 48h);
- Não induzir vômitos pelo risco de refluxo ao esôfago e agravamento dos danos;
- Zargar 1 e 2a – baixo risco de desenvolvimento de estenoses;
- Zargar 3a e 3b – risco de perfuração;
- Risco aumentado de estenose e perfuração – pH <2 ou >11;
- Danos às vias aéreas com cáusticos voláteis;
É importante avaliar que em muitas ocasiões não temos informações fidedignas relacionadas ao produto ingerido por diversos motivos:
- Crianças ou responsáveis podem desconhecer o produto ingerido ou não darem informações verdadeiras por temor de possíveis repercussões;
- Pacientes com tentativa de suicídio estão atravessando momento de grande pesar e instabilidade emocional, desconhecida pelo emergencista e podem maximizar ou minimizar dados relevantes;
- Produtos formulados, manipulados, diluídos podem conter substâncias desconhecidas ou causarem reações químicas incertas;
- Ingestão de produtos cáusticos em ambientes de trabalho, escolas, creches, fazendas, casa de terceiros etc – o temor de repercussões negativas e responsabilização por danos podem influenciar funcionários e familiares.
Quer saber mais sobre esofagites cáusticas ou tratamento de estenoses? Entre em contato conosco!
Referências
- Methasate A, Lohsiriwat V. Role of endoscopy in caustic injury of the esophagus. World J Gastrointest Endosc. 2018 Oct 16;10(10):274-282. doi: 10.4253/wjge.v10.i10.274. PMID: 30364838; PMCID: PMC6198306.
- ASGE Standards of Practice Committee, Lightdale JR, Acosta R, Shergill AK, Chandrasekhara V, Chathadi K, Early D, Evans JA, Fanelli RD, Fisher DA, Fonkalsrud L, Hwang JH, Kashab M, Muthusamy VR, Pasha S, Saltzman JR, Cash BD; American Society for Gastrointestinal Endoscopy. Modifications in endoscopic practice for pediatric patients. Gastrointest Endosc. 2014
- Chirica M, Kelly MD, Siboni S, Aiolfi A, Riva CG, Asti E, Ferrari D, Leppäniemi A, Ten Broek RPG, Brichon PY, Kluger Y, Fraga GP, Frey G, Andreollo NA, Coccolini F, Frattini C, Moore EE, Chiara O, Di Saverio S, Sartelli M, Weber D, Ansaloni L, Biffl W, Corte H, Wani I, Baiocchi G, Cattan P, Catena F, Bonavina L. Esophageal emergencies: WSES guidelines. World J Emerg Surg. 2019
- Tosca J, Villagrasa R, Sanahuja A, Sanchez A, Trejo GA, Herreros B, Pascual I, Mas P, Peña A, Minguez M. Caustic ingestion: development and validation of a prognostic score. Endoscopy. 2021 Aug;53(8):784-791. doi: 10.1055/a-1297-0333. Epub 2021 Jan 18. PMID: 33096569.
Como citar este artigo
Ferreira F. Ingestão de cáusticos e endoscopia – quando podemos realmente ajudar no quadro agudo? Endoscopia Terapêutica 2022. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/ingestao-de-causticos-e-endoscopia–quando-podemos-realmente-ajudar-no-quadro-agudo/