Duplicação cística de esôfago
INTRODUÇÃO
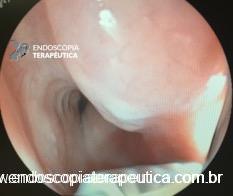
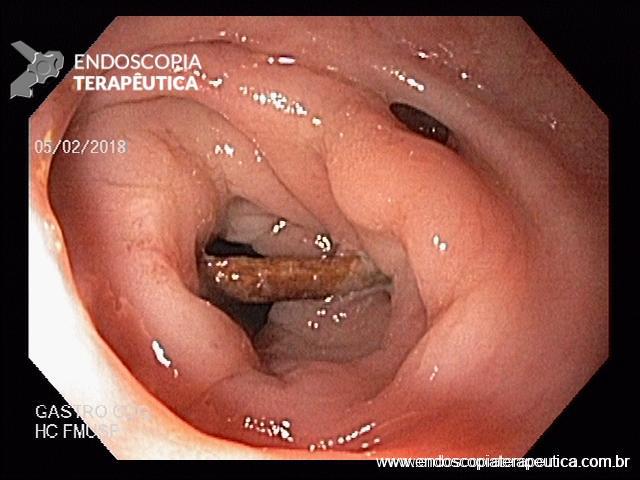
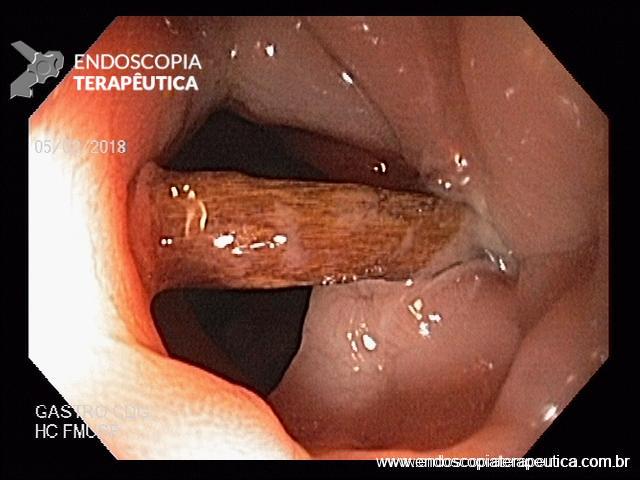
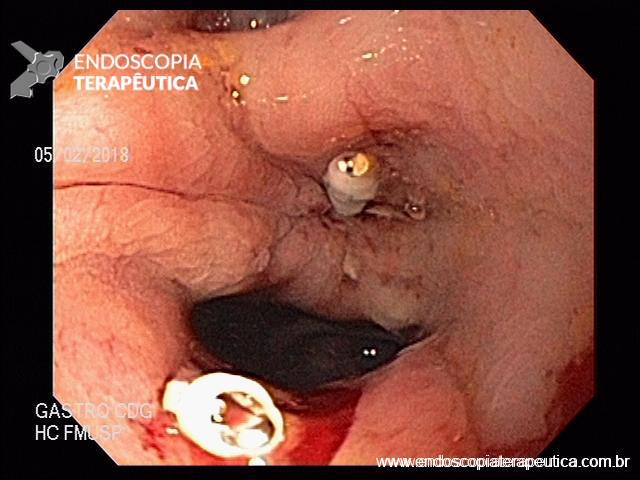
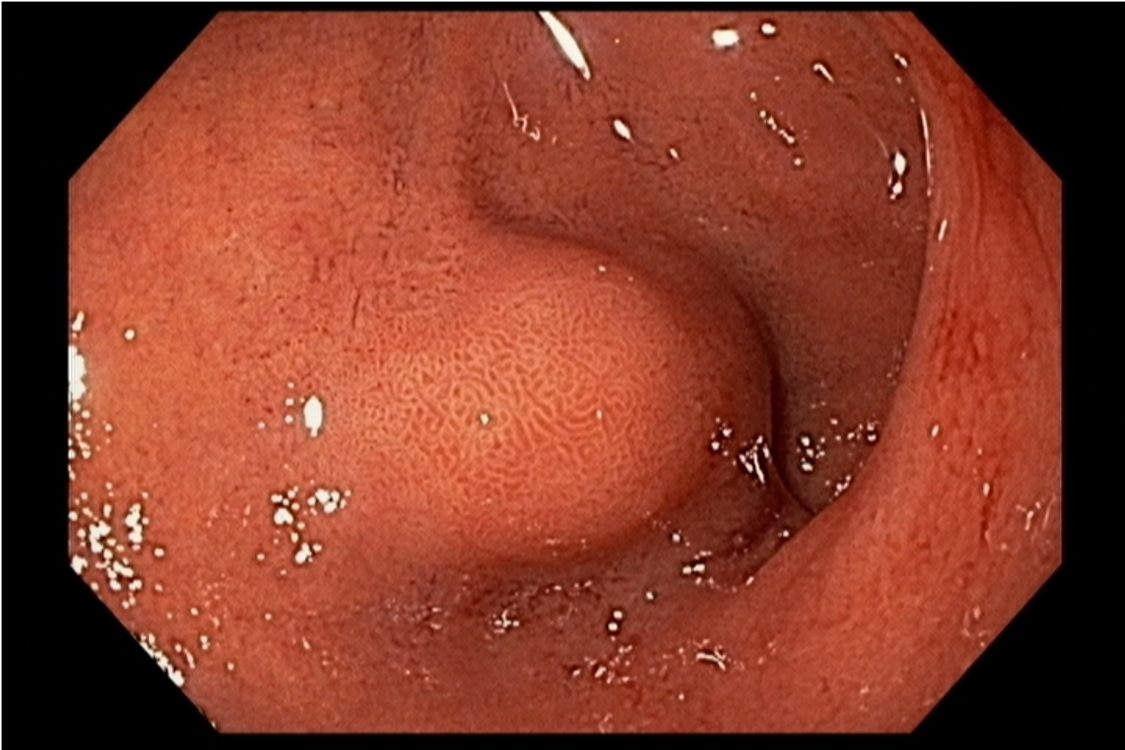
Em exames de endoscopia digestiva alta de rotina, o achado de lesão subepitelial em esôfago é ocasional, porém presente com certa frequência.
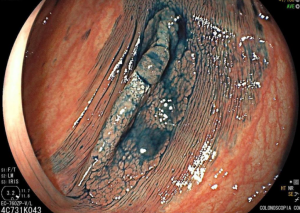
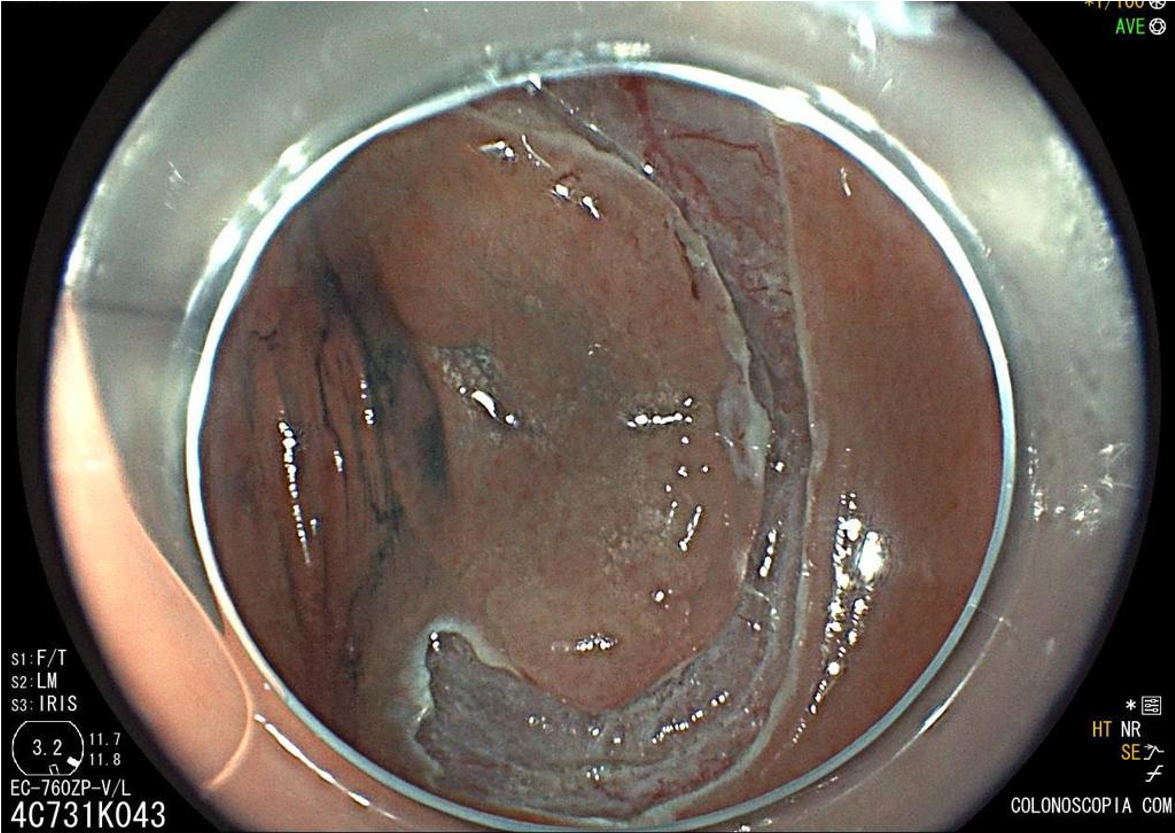
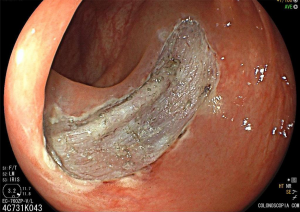
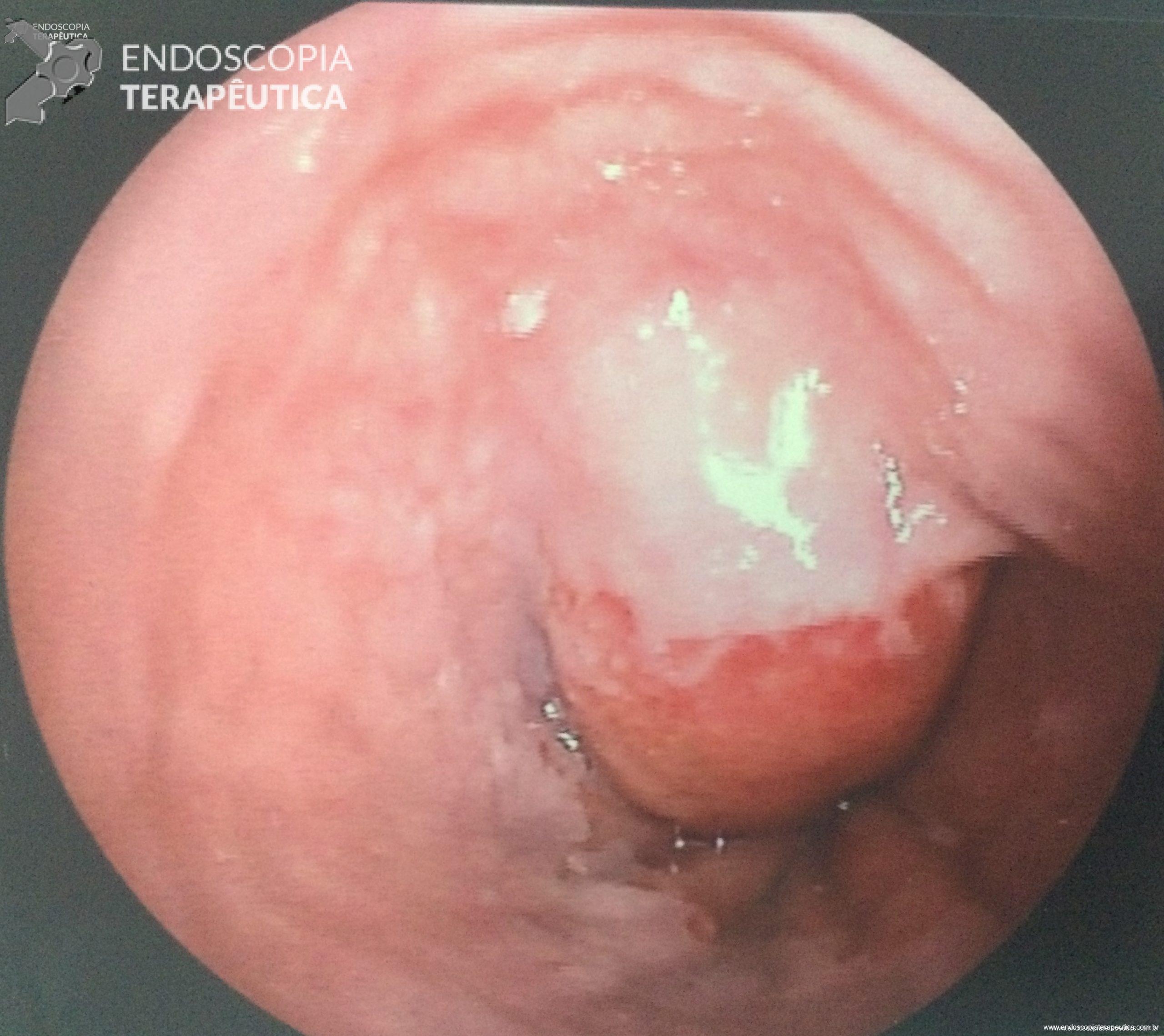
Geralmente, o paciente se apresenta assintomático quanto à lesão encontrada, e o exame endoscópico foi indicado por outras causas, tais como dispepsia, suspeita de refluxo gastroesofágico, empachamento, etc (Figura 1).
Apesar da sintomatologia não estar relacionada à lesão subepitelial encontrada, seu esclarecimento diagnóstico nos direciona à investigação mais específica por meio de outros métodos de imagem, como a tomografia computadorizada, a ressonância magnética nuclear e a ecoendoscopia.
Nas lesões subepiteliais, as biópsias da mucosa não esclarecem o seu diagnóstico, justamente por estarem recobertas por mucosa íntegra e não serem representativas da lesão subepitelial.
Porém, quando encontramos uma solução de continuidade da lesão subepitelial com a mucosa (por exemplo, em lesões com ulcerações ou erosões na mucosa que a recobre), as amostras teciduais nas áreas ulceradas ou erodidas, por meio de biópsias endoluminais (pinças tipo fórceps), merecem ser investidas para o diagnóstico histológico.
São várias as hipóteses diagnósticas das lesões subepiteliais em esôfago:
- Cisto de retenção;
- Lipoma submucoso;
- Schwannoma;
- Hemangioma;
- Leiomioma;
- GIST;
- Duplicação cística.
Dentre as possibilidades diagnósticas, a duplicação cística de esôfago deve ser considerada.
DUPLICAÇÃO CÍSTICA ESOFÁGICA
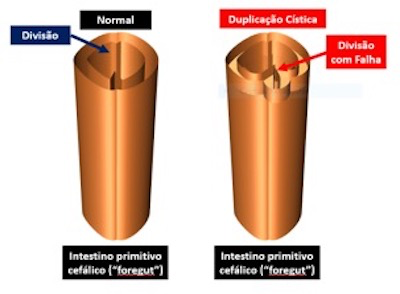
A duplicação cística é decorrente de alterações da formação do tubo digestório. Na fase embrionária, a endoderme se divide em 3 segmentos distintos:
- intestino primitivo cefálico (foregut);
- intestino primitivo médio (midgut);
- intestino primitivo caudal (hindgut).
Para a formação do segmento proximal do tubo digestivo (3ª a 8ª semana de gestação) [1], o intestino primitivo cefálico (foregut), que se constitui como um único tubo, divide-se em 2 tubos paralelos e origina 2 segmentos tubulares:
- Segmento anterior: que forma a traqueia e seus ramos segmentares;
- Segmento posterior: que origina o todo o esôfago.
Uma grande falha na junção da endoderme possibilita uma fusão anômala e, consequentemente, formam as atresias de esôfago e de traqueia (total ou parcial) associadas ou não à fistula esofagotraqueal.
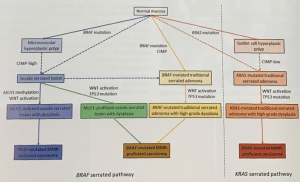
Esporadicamente, pode haver uma junção irregular dos bordos de fusão, de maneira a resultar em um recesso intramural no esôfago, ou mesmo um recesso para-esofágico (extramural), o qual origina a duplicação cística do esôfago (Figura 2).

Figura 1a: intestino primitivo cefálico com formação de traqueia e esôfago.
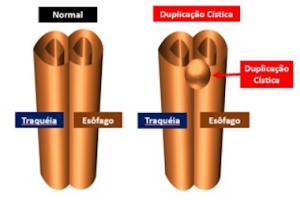
Figura 2: a) Intestino primitivo cefálico com formação de traqueia e esôfago. b) Intestino primitivo cefálico com falha e formação de duplicação cística.
Histologicamente, o interior da duplicação cística de esôfago é revestido por epitélio escamoso ou entérico, os quais secretam secreção seromucosa. Externamente, é formada por dupla camada de musculatura lisa e, raramente, pode apresentar uma comunicação nítida com a luz esofágica.
Quanto à localização esofágica, a maior parte das duplicações císticas situam-se na região posterolateral direita do mediastino inferior e com maior predominância no terço distal (2/3) comparado ao terço proximal e médio (1/3) [2].
Por ser uma malformação congênita, o diagnóstico é mais frequente em crianças (80%) [3], as quais apresentam sintomas. No adulto, a sintomatologia geralmente é ausente, e, quando se apresenta algum sintoma (< 7%), está relacionado ao efeito compressivo da lesão em órgãos adjacentes [2]. Assim, a sintomatologia pode variar em função da localização da duplicação cística no esôfago (tabela 1).
| Localização em esôfago | Sintoma relacionado |
| 1/3 proximal | estridor, tosse |
| 1/3 médio | dor torácica, disfagia |
| 1/3 distal | disfagia, epigastralgia, vômitos, arritmia cardíaca [4] |
INVESTIGAÇÃO DIAGNÓSTICA
Tomografia Computadorizada (CT): identifica-se uma imagem de massa homogênea, com íntimo contato com o esôfago, arredondada ou ovalada, bem delimitada, de contornos regulares, associada à densidade de fluido no seu interior e que não se altera à injeção de contraste.
Ressonância Magnética Nuclear (RMN): demonstra formação cística, localizada junto à parede esofágica, com hipossinal em T1, hipersinal em T2 e sem aspecto sólido em T1 com contraste.
Ecoendoscopia:
É indicada [5]:
- Quando CT ou RMN não definem diagnóstico;
- Em lesões suspeitas de malignidade;
- Em formações atípicas.
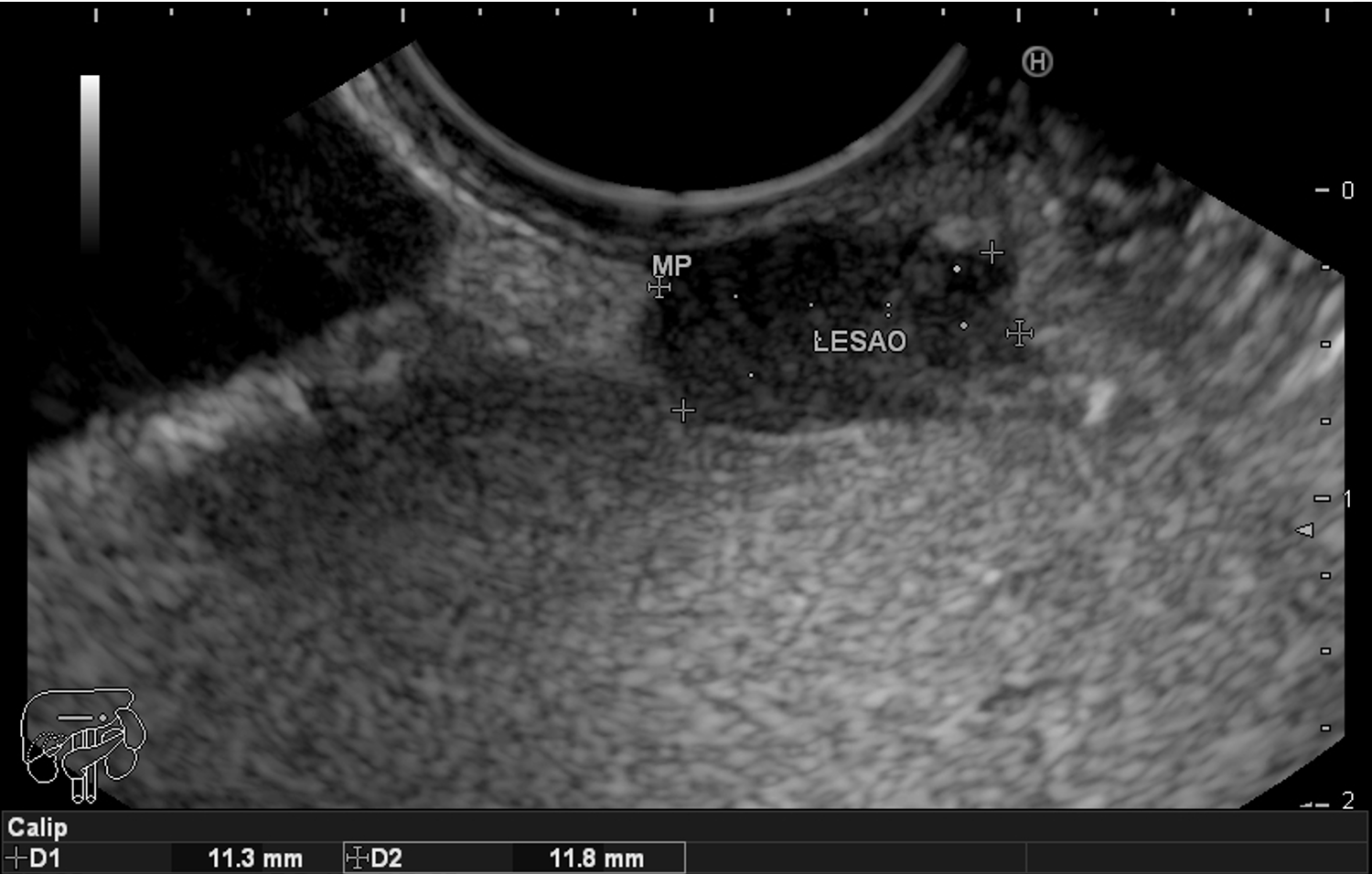
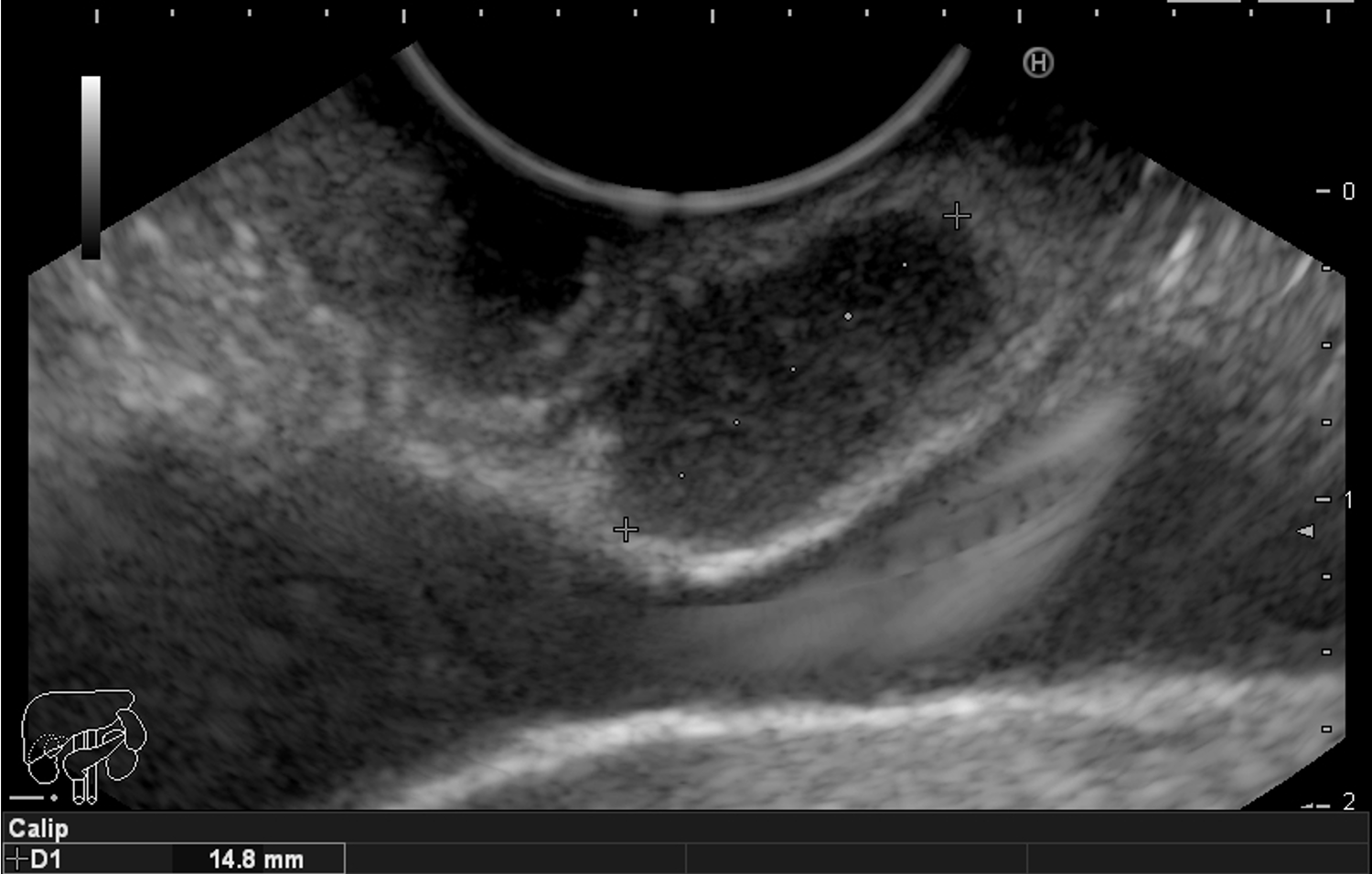
A imagem ecográfica típica de duplicação cística de esôfago tem ecotextura anecoica ou hipoecoica, homogênea, alongada ou ovalada, de contornos regulares, limites precisos, com reforço hiperecoico no seu limite posterior. Situa-se inserida em camada submucosa, muscular própria ou até mesmo subserosa, com 3 a 5 camadas na parede [3] (Figura 3). Por vezes, podem ser múltiplas formações císticas intramurais com lobulações, e até mesmo, com septações em sua parede [6] (Figura 4). O conteúdo intracístico também pode ser heterogêneo, com imagens de debris ou pontos puntiformes de permeio (Figura 5).
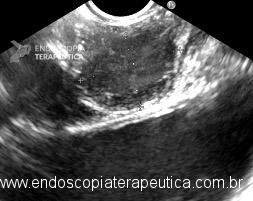
Figura 3: ecoendoscopia setorial com imagem hipoecoica inserida em camada submucosa e muscular própria de esôfago distal.

Figura 4: ecoendoscopia radial com imagem anecoica inserida em camada submucosa e muscular própria de esôfago com septos finos.
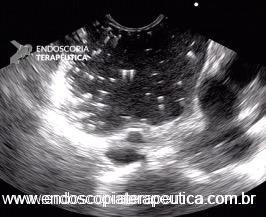
Figura 5: ecoendoscopia setorial com imagem hipoecoica inserida em camada submucosa e muscular própria de esôfago distal com pontos hiperecoicos de permeio.
A princípio, a diferenciação quanto à natureza sólida ou cística da imagem pode ser definida pela ecoendoscopia. Porém mesmo ecoendoscopistas experientes podem ter dúvidas, uma vez que a secreção espessa da duplicação cística (muco) pode mimetizar uma imagem sólida ecográfica.
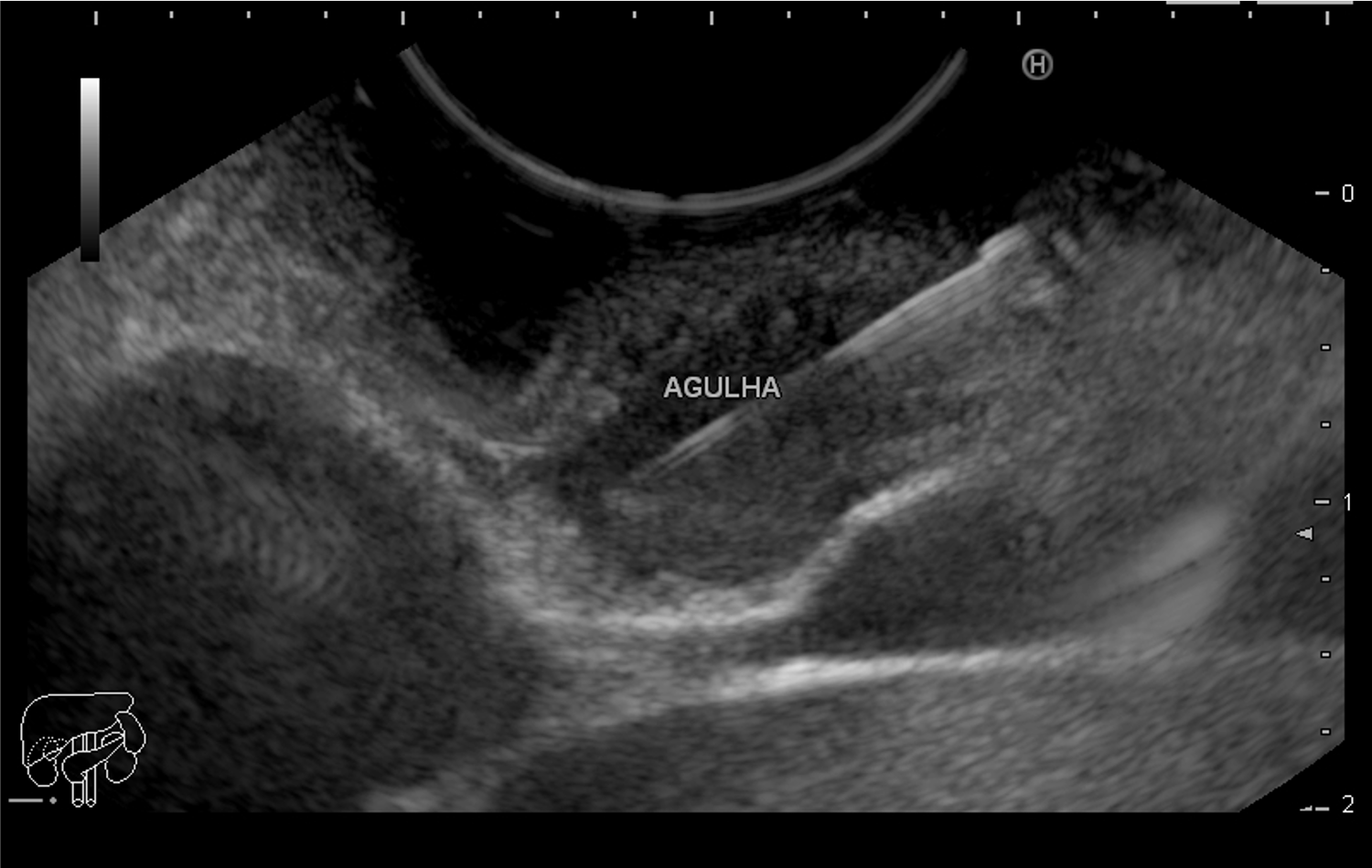
Nessas situações, a punção ecoguiada se faz necessária para possibilitar o diagnóstico diferencial entre duplicação cística de esôfago, leiomioma, GIST ou mesmo um conglomerado linfonodal paraesofágico. A amostra da punção ecoguiada pode revelar material mucoide com células epiteliais, semelhantes ao epitélio esofágico ou entérico. A grande preocupação em relação à punção ecoguiada é a infecção. Com taxas de 14% [4] [8], a infecção intracística pós-punção ecoguiada se demonstrou com morbidade e mortalidade temerárias pela potencial evolução para mediastinite, mesmo com uso de antibióticos em doses terapêuticas. Assim, há uma tendência dos ecoendoscopistas em reservar a punção ecoguiada somente em casos extremamente necessários [9].
O tratamento da duplicação cística de esôfago é indicado em pacientes sintomáticos. A remoção ou a enucleação cirúrgica estão sendo os tratamentos de eleição.
Nos pacientes assintomáticos, o tratamento conservador é predominante frente aos riscos inerentes da cirurgia esofágica (fístula, refluxo gastroesofágico) e mortalidade cirúrgica de 1% [10]. Outros advogam que a baixa taxa anual de crescimento da duplicação cística de esôfago não justifica a morbimortalidade da cirurgia [11]. Há relatos de indicações cirúrgicas em pacientes assintomáticos, justificadas pelo risco de ulceração ou perfuração da duplicação cística de esôfago, com sucesso no seguimento [12].
Saiba mais:
Guideline comentado da ASGE sobre lesões subepiteliais TGI
Tumor de células granulares no esôfago
QUIZ! – Lesão subepitelial de esôfago
Como citar este artigo:
Matuguma, SE. Duplicação cística de esôfago. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/duplicacao-cistica-de-esofago
Referências
- Nobuhara KK, Gorski YC, La Quaglia MP, Shamberger RC. Bronchogenic cysts and esophageal duplications: common origins and treatment. J Pediatr Surg [Internet]. 1997 Oct;32(10):1408–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9349757
- Pisello F, Geraci G, Arnone E, Sciutto A, Modica G, Sciumè C. Acute onset of esophageal duplication cyst in adult. Case report. G Chir [Internet]. 30(1–2):17–20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19272226
- Whitaker JA, Deffenbaugh LD, Cooke AR. Esophageal duplication cyst. Case report. Am J Gastroenterol [Internet]. 1980 Apr;73(4):329–32. Available from: http://www.ncbi.nlm.nih.gov/pubmed/7416128
- Bowton DL, Katz PO. Esophageal cyst as a cause of chronic cough. Chest [Internet]. 1984 Jul;86(1):150–2. Available from: http://www.ncbi.nlm.nih.gov/pubmed/6734280
- Adler D, Liu R. Duplication cysts: Diagnosis, management, and the role of endoscopic ultrasound. Endosc Ultrasound [Internet]. 2014;3(3):152. Available from: http://www.eusjournal.com/text.asp?2014/3/3/152/138783
- Bhatia V, Tajika M, Rastogi A. Upper gastrointestinal submucosal lesions–clinical and endosonographic evaluation and management. Trop Gastroenterol [Internet]. 31(1):5–29. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20860221
- Wildi SM, Hoda RS, Fickling W, Schmulewitz N, Varadarajulu S, Roberts SS, et al. Diagnosis of benign cysts of the mediastinum: the role and risks of EUS and FNA. Gastrointest Endosc [Internet]. 2003 Sep;58(3):362–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14528209
- Cevasco M, Menard MT, Bafford R, McNamee CJ. Acute Infectious Pseudoaneurysm of the Descending Thoracic Aorta and Review of Infectious Aortitis. Vasc Endovascular Surg [Internet]. 2010 Nov 30;44(8):697–700. Available from: http://journals.sagepub.com/doi/10.1177/1538574410376449
- Béchade D, Desramé J, Algayres JP. Gastritis cystica profunda in a patient with no history of gastric surgery. Endoscopy [Internet]. 2007 Dec;39(S 1):E80–1. Available from: http://www.thieme-connect.de/DOI/DOI?10.1055/s-2006-945070
- Salo JA, Ala-Kulju K V. Congenital esophageal cysts in adults. Ann Thorac Surg [Internet]. 1987 Aug;44(2):135–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/3619537
- Versleijen MW, Drenth JP, Nagengast FM. A Case of Esophageal Duplication Cyst with a 13-year Follow-up Period. Endoscopy [Internet]. 2005 Sep;37(9):870–2. Available from: http://www.thieme-connect.de/DOI/DOI?10.1055/s-2005-870219
- Noguchi T, Hashimoto T, Takeno S, Wada S, Tohara K, Uchida Y. Laparoscopic resection of esophageal duplication cyst in an adult. Dis esophagus Off J Int Soc Dis Esophagus [Internet]. 2003;16(2):148–50. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12823217
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!