CPRE em pacientes com Y-de-Roux
A realização de colangiopancreatografia retrógrada endoscópica (CPRE) em pacientes com anatomia em Y de Roux representa um grande desafio para os endoscopistas.
Na era da epidemia de obesidade, essa situação é encontrada com frequência crescente devido à popularidade da cirurgia de bypass gástrico em Y-de-Roux e à alta prevalência de cálculos biliares nesses pacientes.
Frequentemente, é impossível acessar a papila usando um duodenoscópio padrão devido ao comprimento da alça intestinal que deve ser percorrida. Para superar esses problemas, abordagens não padronizadas, técnicas inovadoras e acessórios especializados foram desenvolvidos para realizar CPRE nesses casos.
Considerações gerais
Antes de realizar a CPRE em pacientes submetidos à reconstrução em Y de Roux, o endoscopista deve obter detalhes sobre a ressecção anatômica, o tipo de reconstrução, o comprimento das alças, os tipos de anastomoses e a presença ou ausência de uma papilotomia prévia.
É importante ainda estar ciente do intervalo de tempo após a cirurgia. No período pós-operatório imediato, devem-se pesar os riscos em relação à ruptura da anastomose contra os benefícios potenciais da CPRE.
Escolhendo a melhor abordagem
Existem várias técnicas disponíveis para realizar CPRE em pacientes com anatomia em Y-de-Roux, cada uma com vantagens e desvantagens Nenhuma abordagem foi identificada como a melhor para todos os pacientes, portanto, o endoscopista deve selecionar a abordagem caso a caso, levando em consideração os seguintes fatores:
- Comprimento da alça do Y (longa versus curta);
- Se o paciente tem uma papila virgem ou uma anastomose biliodigestiva, por exemplo;
- A indicação de CPRE, incluindo a probabilidade de repetir procedimentos e a necessidade de manobras terapêuticas;
- A experiência do serviço (enteroscopia profunda, radiologia intervencionista, cirurgia);
- O risco cirúrgico do paciente.
Técnicas
As abordagens transorais envolvem o uso de duodenoscópios, colonoscópios pediátricos ou enteroscópios.
CPRE usando duodenoscópio padrão: o duodenoscópio de visão lateral é o endoscópio ideal para realizar CPRE, particularmente para a canulação de uma papila virgem. Infelizmente, a abordagem apenas com duodenoscópio é frequentemente malsucedida. Portanto, reservamos a abordagem transoral usando um duodenoscópio padrão para pacientes com um alça curta do Y-de-Roux.
CPRE usando um enteroscópio ou colonoscópio pediátrico: um enteroscópio ou colonoscópio pediátrico pode ser uma opção para realizar uma CPRE quando o uso de um duodenoscópio não for viável.
Uma desvantagem dessa abordagem é que a perspectiva de visão frontal e a falta do “elevador” no aparelho tornam a canulação seletiva mais difícil. Além disso, a capacidade de manobra do enteroscópio longo ou colonoscópio pode ser muito limitada devido à formação de alça. A falta de eixo devido à visão frontal desses aparelhos também pode dificultar ou impossibilitar a canulação.
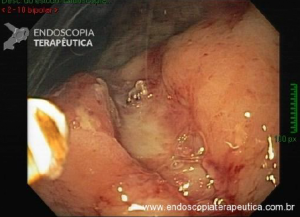
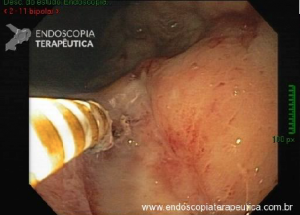
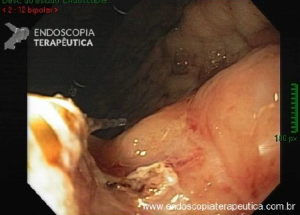
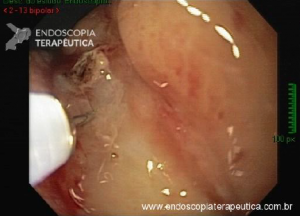
CPRE usando técnicas de enteroscopia profunda: há uma experiência crescente com o desempenho de CPREs usando técnicas de enteroscopia profunda, incluindo enteroscopia de balão duplo (DBE), enteroscopia de balão único (SBE) e espiral enteroscopia.
Embora as técnicas de enteroscopia profunda representem um avanço significativo para a realização de CPRE em pacientes com anatomia alterada cirurgicamente, elas ainda não são amplamente realizadas fora de centros especializados. Além disso, elas têm as mesmas limitações supracitadas inerentes ao uso de enteroscópios para CPRE, incluindo capacidade de manobra restrita, orientação desfavorável da papila, falta de um elevador de instrumento e relativa escassez de acessórios compatíveis com enteroscópio.
CPRE assistida por enteroscópio de duplo balão: relatos de casos e algumas séries mostram que a papila pode ser alcançada em mais de 90% das vezes e a canulação seletiva em mais de 80% dos casos usando a técnica de CPRE assistida por enteroscópio de duplo balão.
Tal como acontece nos casos que usam endoscópios de visualização frontal, a canulação da papila pode ser difícil por essa técnica. Um problema adicional é que há um número limitado de acessórios que são compatíveis com um enteroscópio.
CPRE assistida por enteroscópio de balão único: desempenho de CPREs assistidas por enteroscópio de balão único em pacientes com Y de Roux foi associada a taxas de sucesso de diagnóstico que variam de 60 a 80%.
CPRE assistida por enteroscopia em espiral: a enteroscopia em espiral utiliza um overtube rotativo que permite o avanço profundo do aparelho. As vantagens potenciais da CPRE assistida por uma enteroscopia espiral sobre a duplo balão ou balão único incluem relativa facilidade de uso, melhor controle do endoscópio e, talvez, uma curva de aprendizado mais curta.
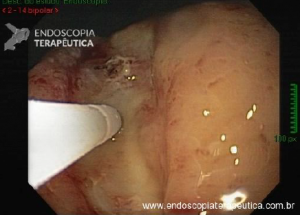
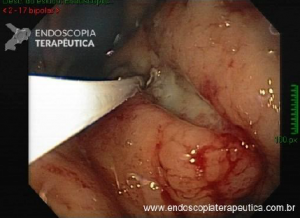
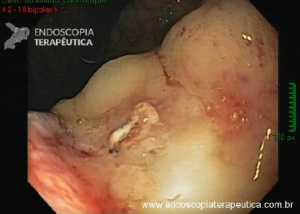
Abordagens transorais menos comuns: foi desenvolvida uma técnica que usa a colocação guiada por ecoendoscopia de um stent metálico (LAMS) entre o “pouch” e o estômago excluso para facilitar uma CPRE anterógrada transoral usando um duodenoscópio. A experiência preliminar com essa abordagem em pacientes com anatomia de bypass gástrico em Y de Roux tem sido promissora, com sucesso técnico semelhante e taxas de eventos adversos em comparação com CPRE assistida por laparoscopia e CPRE assistida por enteroscopia.
Como citar este artigo
Ruiz R. CPRE em pacientes com Y-de-Roux. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/cpre-em-pacientes-com-y-de-roux
Referências bibliográficas
- Nguyen NT, Root J, Zainabadi K, et al. Accelerated growth of bariatric surgery with the introduction of minimally invasive surgery. Arch Surg 2005; 140:1198.
- Pories WJ. Bariatric surgery: risks and rewards. J Clin Endocrinol Metab 2008; 93:S89.
- Shiffman ML, Sugerman HJ, Kellum JH, et al. Gallstones in patients with morbid obesity. Relationship to body weight, weight loss and gallbladder bile cholesterol solubility. Int J Obes Relat Metab Disord 1993; 17:153.
- Lopes TL, Wilcox CM. Endoscopic retrograde cholangiopancreatography in patients with Roux-en-Y anatomy. Gastroenterol Clin North Am 2010; 39:99.
- Hintze RE, Adler A, Veltzke W, Abou-Rebyeh H. Endoscopic access to the papilla of Vater for endoscopic retrograde cholangiopancreatography in patients with billroth II or Roux-en-Y gastrojejunostomy. Endoscopy 1997; 29:69.
- Elton E, Hanson BL, Qaseem T, Howell DA. Diagnostic and therapeutic ERCP using an enteroscope and a pediatric colonoscope in long-limb surgical bypass patients. Gastrointest Endosc 1998; 47:62.
- Wright BE, Cass OW, Freeman ML. ERCP in patients with long-limb Roux-en-Y gastrojejunostomy and intact papilla. Gastrointest Endosc 2002; 56:225.
- Aabakken L, Bretthauer M, Line PD. Double-balloon enteroscopy for endoscopic retrograde cholangiography in patients with a Roux-en-Y anastomosis. Endoscopy 2007; 39:1068.
- Emmett DS, Mallat DB. Double-balloon ERCP in patients who have undergone Roux-en-Y surgery: a case series. Gastrointest Endosc 2007; 66:1038.
- Itoi T, Ishii K, Sofuni A, et al. Long- and short-type double-balloon enteroscopy-assisted therapeutic ERCP for intact papilla in patients with a Roux-en-Y anastomosis. Surg Endosc 2011; 25:713.
- Thomas J. Wang, Christopher C. Thompson, Marvin RyouGastric access temporary for endoscopy (GATE): a proposed algorithm for EUS-directed transgastric ERCP in gastric bypass patients Surg Endosc 2019
Confira também: CPRE em pacientes com gastrectomia a Billroth II