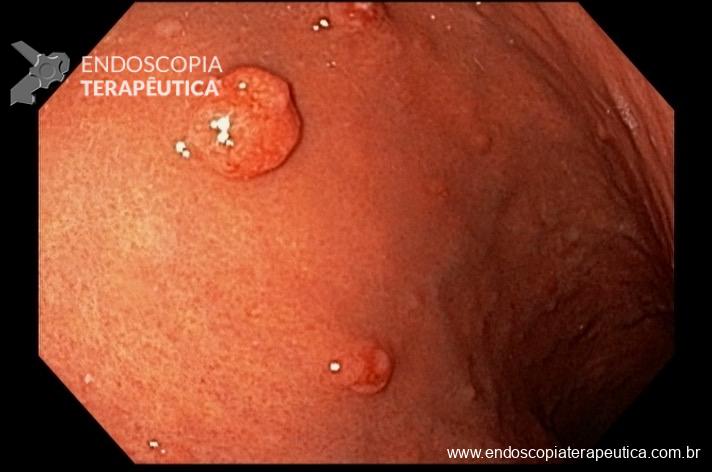
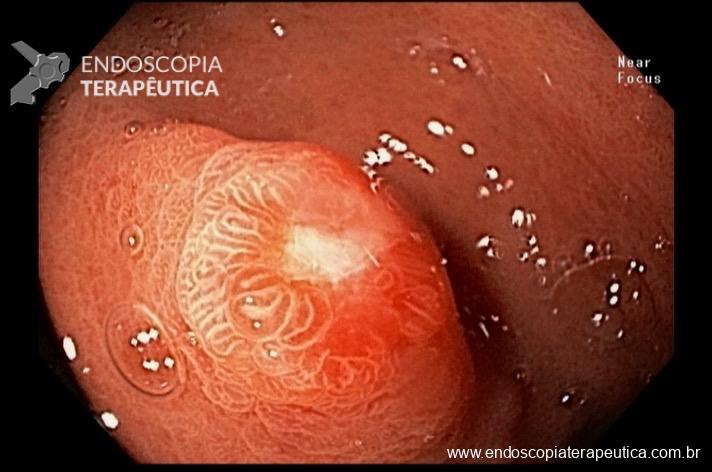
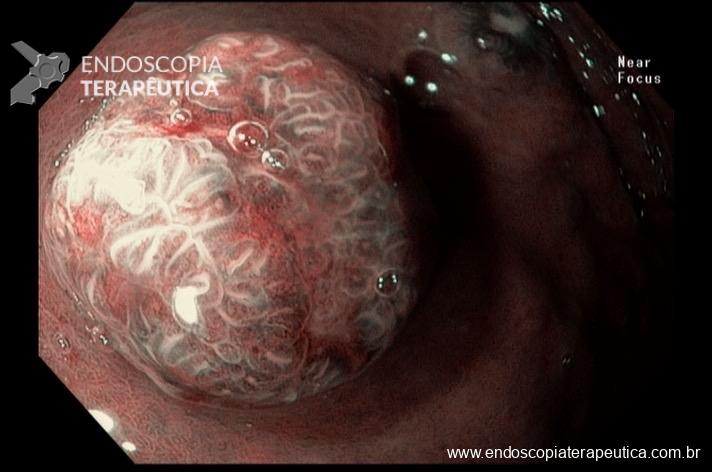
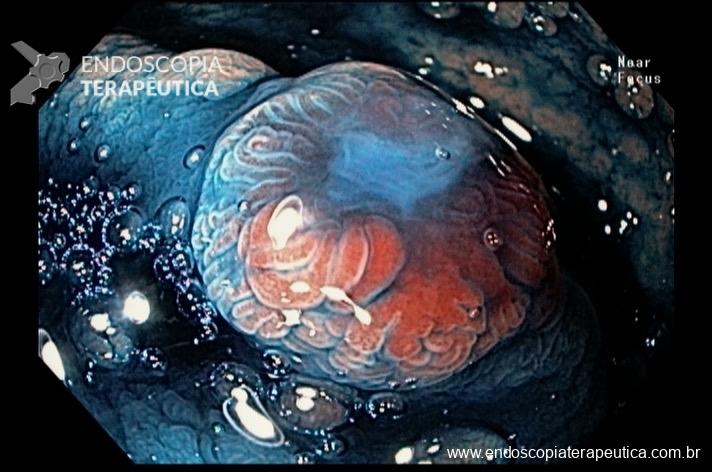
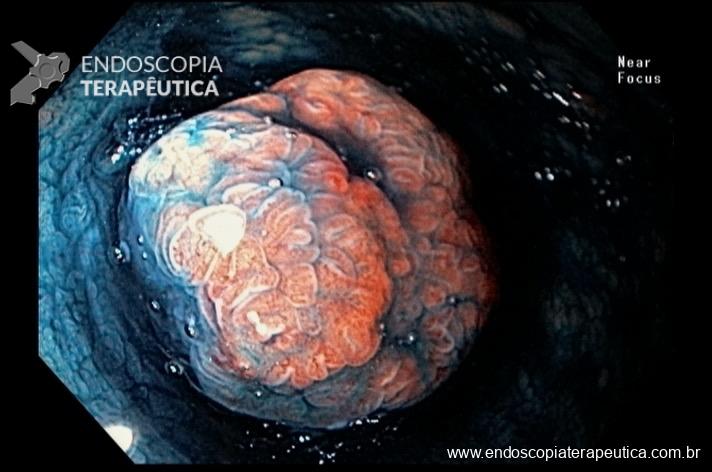
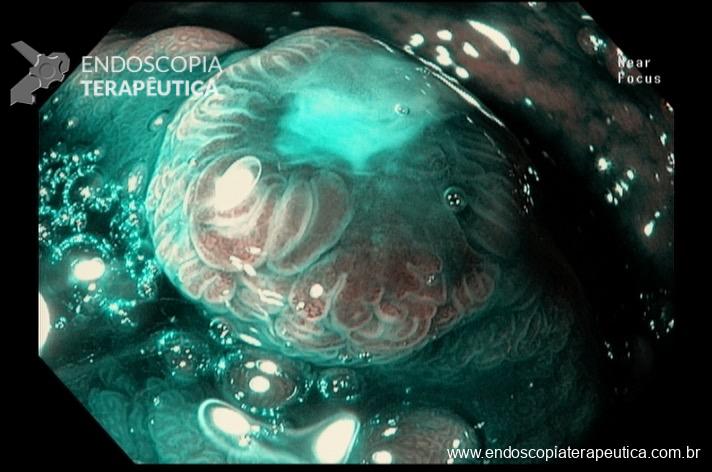
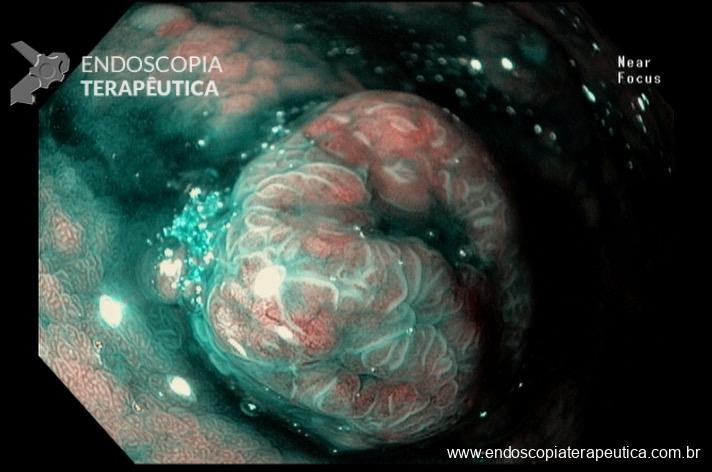
Quiz! Qual a alternativa correta?
MEDIDAS DE PREVENÇÃO CONTRA O CORONAVÍRUS
ATENÇÃO: esse artigo é dedicado a proteção dos profissionais envolvidos com os procedimentos de endoscopia digestiva
MEDIDAS DE PREVENÇÃO
Casos suspeitos ou confirmados
Indivíduos com suspeita de infecção na comunidade devem usar uma máscara médica para conter suas secreções respiratórias.
As recomendações da OMS e do CDC diferem ligeiramente quanto as recomendações para a equipe médica.
A OMS recomenda [1]:
- Precauções padrão, de contato e de gotículas (ou seja, avental, luvas e máscara), com proteção para os olhos ou para a face.
- Uso de máscaras tipo respiradores durante os procedimentos de geração de aerossóis
O CDC recomenda que [2]:
- pacientes com suspeita ou confirmação de COVID-19 sejam colocados em um quarto isolado com porta fechada.
- O paciente deve usar uma máscara facial se for transportado para fora da sala (para estudos que não possam ser realizados na sala).
- Pacientes submetidos a procedimentos de geração de aerossóis devem realiza-los em sala de pressão negativa.
- Qualquer pessoa que entre no quarto de um paciente com suspeita ou confirmação de COVID-19 deve usar o equipamento de proteção individual (EPI) apropriado: avental, luvas, proteção para os olhos e um respirador (por exemplo, um respirador N95).
- Se o suprimento de respiradores for limitado, o CDC reconhece que as máscaras faciais são uma alternativa aceitável (além das precauções de contato e proteção ocular), mas os respiradores devem ser usados durante os procedimentos de geração de aerossóis.
Procedimentos geradores de aerossóis
Alguns procedimentos realizados em pacientes com COVID-19 podem gerar aerossóis infecciosos. Em particular, os procedimentos que provavelmente induzem a tosse (por exemplo, indução de escarro, aspiração aberta de vias aéreas) devem ser realizados com cautela e evitados, se possível.
Se realizado, o seguinte deve ocorrer:
- O profissional de saúde na sala deve usar um respirador N95 ou de nível superior, proteção para os olhos, luvas e avental.
- O número de profissionais de saúde presentes durante o procedimento deve ser limitado apenas aos essenciais para o atendimento ao paciente e suporte ao procedimento.
- Idealmente, os procedimentos devem ocorrer em salas com pressão negativa com o mínimo de 6 trocas de ar por hora.
- Limpar e desinfectar as superfícies da sala de procedimentos imediatamente.
Endoscopia digestiva é um procedimento gerador de aerossol?
Essa é outra grande discussão.
Classicamente, a endoscopia digestiva não está listada pela WHO e CDC como procedimento gerador de aerossol. Os procedimentos geradores de aerossóis incluem intubação traqueal, ventilação não-invasiva, traqueostomia, ressuscitação cardiopulmonar, ventilação manual (pré-intubação) e broncoscopia.
No entanto, vários experts, alguns artigos e recomendações de sociedades (inclusive a SOBED) consideram a endoscopia como procedimento gerador de aerossol. [3-6]
A definição do CDC na página dedicada ao paciente com suspeita ou confirmação de COVID é um pouco mais ampla: “Some procedures … could generate infectious aerosols. In particular, procedures that are likely to induce coughing (e.g., sputum induction, open suctioning of airways).…”
Nesse contexto, entendo que a endoscopia digestiva alta tem a possibilidade de gerar aerossóis, caso o paciente apresente reatividade de vias aéreas durante o procedimento, levando a tosse. Essa é uma cena bem comum, especialmente no início do exame durante a passagem pelo cricofaríngeo. Cumpre salientar a proximidade do endoscopista com a boca aberta do paciente (com bucal) nesse momento.
Outra possibilidade de geração de aerossóis seria pelo canal de trabalho e canal de ar e água do aparelho. Um artigo de 2010 [7] mediu a quantidade de bioaerosol coletado durante procedimentos de colonoscopia, mostrando que a aspiração contínua do canal de trabalho durante a remoção da pinça de biópsia reduz significativamente a quantidade de bactérias aerossolizadas. Esse é o único estudo focado na geração de aerossóis durante os exames de endoscopia, mostrando que a aerossolização existe, apesar de ainda não sabermos suas consequências clínicas.
Vídeo: como reduzir saída de secreções pelo canal de trabalho
Quais EPIs devemos utilizar durante procedimentos endoscópicos?
A SOBED recomenda o uso dos seguintes EPIs durante os procedimentos endoscópicos [4]:
| · Uso de roupa privativa
· Calçados fechados e impermeáveis · Touca · Propé descartável · Máscara N95 ou PFF2 · Óculos de proteção ou “face shield” · Avental impermeável com mangas longas · Luvas que cubram inclusive a região do punho, pode-se usar uma fita de micropore ou esparadrapo para fixar a primeira luva ao avental
|
- .
- Aventais, luvas e máscaras devem ser descartados ao término de cada procedimento.
- Se paciente suspeito ou confirmado para COVID, deve-se descartar também a touca e o propé.
- Óculos de proteção e face shield devem ser higienizados ao término de cada procedimento.
Como me paramentar e desparamentar para realizar exame de um paciente com COVID-19?
Adotar a seguinte sequência de paramentação:
- Colocar o propé
- Colocar a máscara N95
- Colocar a touca
- Colocar o avental impermeável
- Colocar os óculos de proteção ou protetor facial
- Colocar dois pares de luvas
Ao término do exame:
A maioria das contaminações entre os profissionais de saúde ocorre durante a retirada dos EPIs. Portanto, fique atento a esta etapa e treine a sequência em todos os exames, mesmo nos pacientes assintomáticos! Se possível peça ajuda para fazer a desparamentação.
- Retirada do primeiro par de luvas
- Retire o propé
- Retirada do avental e do segundo par de luvas
- Agarre o avental pela frente e afaste-o do corpo para que os laços de trás se quebrem, tocando-o apenas com as mãos enluvadas.
- Ao remover, dobre ou enrole o avental de dentro para fora em um pacote.
- Retire as luvas ao mesmo tempo, apenas tocando no interior das mesmas.
- Higienizar as mãos
- Saia do quarto do paciente
- Retirada dos óculos ou face shield
- Retirada da touca
- Retirada da máscara (remova a máscara por trás sem tocar na parte da frente)
- Lavar as mãos ou usar um sanitizador de mãos à base de álcool imediatamente após a remoção de todos os EPI.
Assista a este vídeo feito pelo grupo de Infectologia do Hospital Marieta Bornhausen de Itajaí, mostrando a correta sequencia de colocação e retirada dos EPIs. Única ressalva seria a colocação do avental impermeável, se disponível.
Estratégias para uso estendido das máscaras N95 na falta de EPIs
Muito se discute a respeito das máscaras tipo respiradores, visto que não há disponibilidade em larga escala e os casos no Brasil ainda vão aumentar bastante.
Neste contexto, existem algumas opções para reuso e/ou uso estendido das máscaras N95/PFF2 [8]:
- Utilizar um protetor facial (face shield) para barrar as gotículas.
- Utilizar uma máscara cirúrgica descartável tentando cobrir a maior parte da máscara N95.
Uma outra alternativa seria utilizar a máscara tipo respirador durante o turno inteiro, sem tirar e por entre os exames, descartando-a ao final do turno (existem métodos off label para esterilizar a máscara, vide abaixo). No entanto, esse tipo de máscara gera desconforto e na prática é muito difícil utilizar o turno inteiro sem levar a mão no rosto para ajustá-la de vez em quando.
Em breve teremos mais um post dedicado às máscaras N95. Aguarde!
Como retirar e higienizar o protetor facial (face shield)?
- Limpe uma superfície com um germicida sobre a qual o protetor facial será colocado.
- Com as mãos higienizadas ou com luvas limpas, retire o face shield
- Limpe o face shield com germicida, ou água e sabão ou álcool 70%
- Coloque-o sobre a superfície que você preparou
- Higienização das mãos
- Retirada da máscara tipo respirador
- Higienização das mãos
Assista a este video sobre cuidados com o face shield, incluindo colocação, retirada e higienização:
Na impossibilidade de adquirir um protetor facial alguns profissionais estão fabricando conforme o video abaixo, disponibilizado pela Dra. Ana Paula Kotinda, residente do serviço de endoscopia do HCFMUSP:
Link para documento do CDC com intruções para colocação e retirada dos EPIs (documento gerado pré-COVID): https://www.cdc.gov/hai/pdfs/ppe/ppe-sequence.pdf
REFERÊNCIAS
- WHO – Rational use of personal protective equipment for coronavirus disease 2019 (COVID-19). Disponível em https://apps.who.int/iris/bitstream/handle/10665/331215/WHO-2019-nCov-IPCPPE_use-2020.1-eng.pdf
- Interim Infection Prevention and Control Recommendations for Patients with Suspected or Confirmed Coronavirus Disease 2019 (COVID-19) in Healthcare Settings. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/infection-control/control-recommendations.html
- Endoscopy activity and COVID-19: BSG and JAG guidance. Disponível em:https://www.bsg.org.uk/covid-19-advice/endoscopy-activity-and-covid-19-bsg-and-jag-guidance/
- Recomendações SOBED para Endoscopia Segura durante a pandemia por Coronavírus. Disponível em: https://www.sobed.org.br/sobed-comunica/noticias/single/nid/atualizacao-003-das-recomendacoes-sobed-para-endoscopia-segura-durante-a-pandemia-por-coronavirus/
- Soetikno R, Teoh AYB, Kaltenbach T. Considerations in performing endoscopy during the COVID-19 pandemic. Gastrointestinal endoscopy (epub ahead of print)
- WEO recommendations on digestive endoscopy and the COVID-19 pandemic. Disponível em http://www.worldendo.org/2020/03/24/weo-advice-on-digestive-endoscopy-and-the-covid-19-pandemic/
- Vavricka SR, Tutuian R, Imhof A, Wildi S, Gubler C, Fruehauf H, Ruef C, Schoepfer AM, Fried M. Air suctioning during colon biopsy forceps removal reduces bacterial air contaminatio in the endoscopy suite. Endoscopy. 2010 Sep;42(9):736-41
- Recommended Guidance for Extended Use and Limited Reuse of N95 Filtering Facepiece Respirators in Healthcare Settings. Disponível em: https://www.cdc.gov/niosh/topics/hcwcontrols/recommendedguidanceextuse.html
Transmissão do novo coronavírus
VIROLOGIA
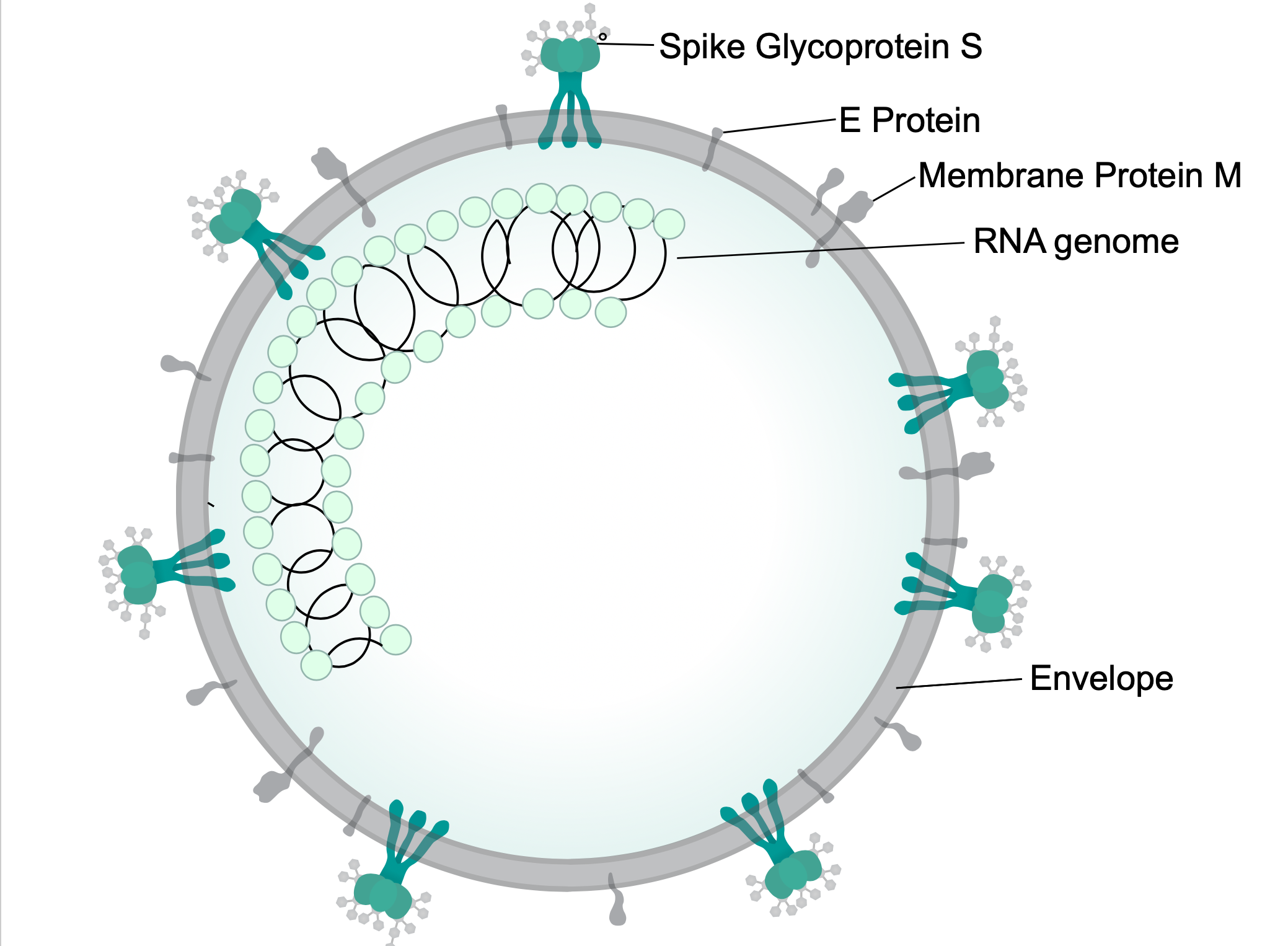
- O SARS-CoV-2 é um betacoronavírus, medindo entre 50-200 nanômetros, muito semelhante ao coronavírus causador da SARS.
- Proteína mais importante da sua superfície é a proteína S (spike), a qual tem afinidade pela enzima de conversão de angiotensina 2 (ACE2)
- O vírus se liga a ACE2 para invadir a célula hospedeira. Esse é o mesmo receptor utilizado pelo vírus da SARS [1].
- Por isso o nome SARS-CoV-2
Figura 1: https://en.wikipedia.org/wiki/Severe_acute_respiratory_syndrome_coronavirus_2
TRANSMISSÃO
Como ocorre a transmissão do SARS-CoV-2?
- A principal via de transmissão é através de GOTÍCULAS respiratórias, semelhante à disseminação da influenza.
- Através das gotículas, o vírus liberado nas secreções respiratórias quando uma pessoa tosse, espirra ou fala pode infectar outra pessoa se entrar em contato direto com as membranas mucosas;
- Essas gotículas normalmente não viajam mais do que dois metros, e não permanecem suspensas no ar. Por isso o distanciamento social é tão importante.
- A segunda via importante de transmissão ocorre quando uma pessoa toca uma superfície infectada (fomites) e depois toca nos olhos, nariz ou boca. Fomites não porosos (plástico, metal) são mais propensos a propagar a infecção do que os não porosos (roupas, papel, etc)
- A WHO e o CDC questionam a relevância da transmissão pelo ar (airborne transmission), embora não a descartem.
- Transmissão através de partículas de aerossóis em curta distância é uma alternativa plausível [12]
Saiba mais sobre gotículas, aerossóis e transmissão nesse post: clique aqui
Link para documento da WHO: clique aqui
Audio Interview: Practical Measures to Help Prevent Covid-19 NEJM: https://www.nejm.org/doi/pdf/10.1056/NEJMe2006742?articleTools=true
Qual a diferença entre gotículas e aerossóis?
- Gotículas são partículas > 5-10 μm, que geralmente não percorrem distâncias maiores que 1-2 metros.
- Aerossóis apresentam diâmetro menor que 5 μm. Podem ser resultantes da evaporação de gotas maiores ou podem estar presentes em partículas de poeira. Eles podem permanecer no ar por longos períodos de tempo e percorrer distâncias superiores a 1 m.
Veja aqui definições do CDC sobre droplets e airborne transmission:
https://www.cdc.gov/infectioncontrol/guidelines/isolation/scientific-review.html
Saiba mais sobre gotículas, aerossóis e transmissão nesse post: clique aqui
O vírus pode ser transmitido pelo ar?
Essa é uma grande discussão ainda em aberto. Ainda precisamos de mais estudo para compreender melhor a transmissão do vírus. Alguns autores consideram que a transmissão pelo ar em distâncias curtas pode ser uma via importante de transmissão.
Em uma análise de mais de 75.000 casos da China, não foi relatado casos de transmissão pelo ar. Tampouco foi relatada transmissão oral-fecal, apesar de terem sido isolados RNA do vírus em amostra de fezes. [2, 8]
Em uma carta ao editor publicada no NEJM, os pesquisadores realizaram um estudo experimental, simulando a nebulização do vírus no laboratório, identificando sua presença em aerossóis mesmo 3 horas após. No entanto, a WHO faz algumas ressalvas quanto a esse estudo:
- “This is a high-powered machine that does not reflect normal human cough conditions.”
- “Further, the finding of COVID-19 virus in aerosol particles up to 3 hours does not reflect a clinical setting in which aerosol-generating procedures are performed”
- “In addition, it is important to note that the detection of RNA in environmental samples based on PCR-based assays is not indicative of viable virus that could be transmissible”
Para se ter uma ideia de como essa discussão é complicada, ainda hoje se discute se o vírus da influenza (muito mais conhecido e estudado do que o coronavírus) é transmissível pelo ar. Lembrando que o vírus da influenza apresenta mecanismo de transmissão muito semelhante ao SARS-CoV-2.
No entanto, a transmissão pelo ar é possível em circunstâncias específicas, como nos procedimentos geradores de aerossóis. Por esse motivo, as recomendações da WHO e do CDC dizem que os profissionais de saúde devem se equipar com máscaras tipo respiradores (N95 ou PFF2). [2,3]
Em um artigo para o center for infection diseases research and policy, a Prof. Lisa Brousseau, da University of Illinois em Chicago, alerta para a falta de evidências sobre os modos de transmissão, e sobre a possibilidade da transmissão pelo ar em curtas distância, ou seja, na distância que trabalhamos com os pacientes. Talvez a transmissão pelo ar em longas distâncias e longos períodos (como exemplo da tuberculose) realmente não seja importante, mas não podemos nos esquecer da inalação de aerossóis em curta distância. [12]
Pessoas assintomáticas podem transmitir o vírus?
Existem evidências que portadores assintomáticos podem transmitir o vírus e duas publicações recentes fazem relatos de infecções à partir de portadores assintomáticos.
Uma Research Letter publicada no JAMA em Fevereiro relata o caso de uma portadora assintomática, sem alterações clínicas, laboratoriais e de imagem, que transmitiu o vírus para 5 membros de sua família. A portadora assintomática era habitante de Wuhan, epicentro da pandemia e foi visitar os demais membros de sua família, que moravam em outra cidade. Todos os cinco membros adoeceram e testaram positivo para Covid-19 com alterações clínicas, laboratoriais e em tomografias de tórax.
A portadora assintomática permaneceu em isolamento e nunca desenvolveu sintomas ou alterações dos exames laboratoriais ou de imagem, mesmo após a confirmação laboratorial por RT-PCR. Toda a sequência de eventos detalhada na figura abaixo sugere que a transmissão ocorreu à partir da portadora assintomática.[4]
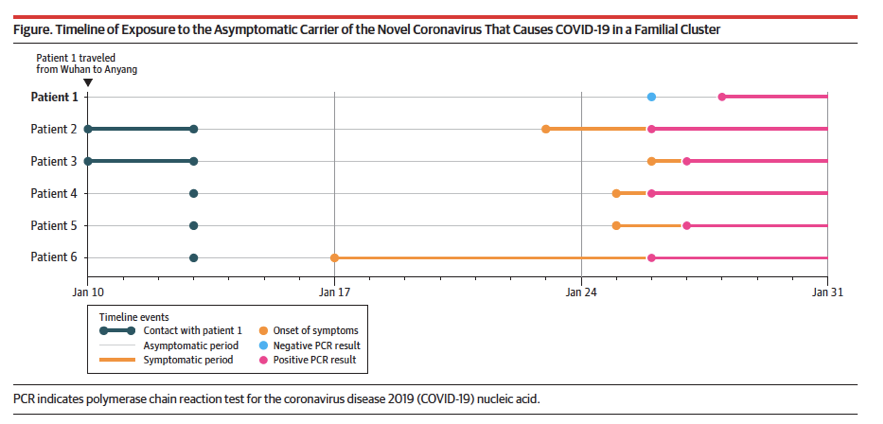
Ref – Wang M. Presumed Symptomatic Carrier Transmission of Covid-19. JAMA 2020. Doi:10.1001/jama.2020.2565
Essa mesma sequência de eventos foi mostrada em outras famílias estudadas na China, com pacientes em fase pré-sintomática.[5]
Ainda não existem estimativas seguras da proporção de portadores assintomáticos do vírus, e nem do seu real potencial de transmissão. Pesquisadores de Nanjing, na China, seguiram uma série de 24 pacientes assintomáticos com PCR positiva para Covid-19. Esses pacientes eram contatos próximos de pacientes infectados. Durante o seguimento apenas 7 pacientes (29,2%) permaneceram realmente assintomáticos, sem alterações clínicas, laboratoriais e de imagem. A média de idade desses pacientes era de 14 anos. [6]
Um estudo conduzido com os passageiros e tripulação do navio Diamond Princess mostrou que a proporção de portadores assintomáticos naquela população foi de 17,9% (95%CI 15,5-20,2%) [7]
Pode acontecer transmissão pela saliva e fezes?
O RNA da SARS-CoV-2 foi detectado em amostras de sangue e fezes segundo alguns estudos [8-11]. Mas de acordo com um relatório conjunto da OMS-China [8], a transmissão fecal-oral não foi um fator significativo na disseminação da infecção.
Tosse e espirro gera aerossol?
Sim.
Existe correlação entre carga viral e sintomas?
Não se sabe
REFERÊNCIAS
- Kenneth McIntosh. Coronavirus disease 2019 (COVID-19). In UpToDate, Post TW (Ed), UpToDate, Waltham, MA. (Acessado em 28 Março, 2020.)
- Modes of transmission of virus causing COVID-19:implications for IPC precaution recommendations. Disponível em : https://www.who.int/publications-detail/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipc-precaution-recommendations
- Centers for Disease Control and Prevention. Interim Infection Prevention and Control Recommendations for Patients with Confirmed 2019 Novel Coronavirus (2019-nCoV) or Patients Under Investigation for 2019-nCoV in Healthcare Settings. February 3, 2020. https://www.cdc.gov/coronavirus/2019-nCoV/hcp/infection-control.html
- Wang M. Presumed Ssymptomatic Carrier Transmission of Conid-19. JAMA 2020. Doi:10.1001/jama.2020.2565
- Quian G, Young N, Ma AHY, Wang L, Li G, Chen X, Chen X. A Covid-19 Transmission of a Family Cluster by presimptomatic infectors in China.CID 2020. doi:10.1093/cid/ciaa316
- Hu Z, Song C, Xu C, Jin G, Chen Y, Xu X et al. Clinical characteristics of 24 asymptomatic infections with COVID-19 screened among close contacts in Nanjing, China. Sci Cina Lif Sci 2020, 63, https://doi.org/10.1007/s11427-020-1661-04.
- Mizumoto K, Kagaya K, Zarebski A, Chowell B. Estimating the asymptomatic proportion of coronavirus disease 2019 (Covid-19) cases on board the Diamond Princess cruise ship, Yokohama Japan, 2020.www.eurosurveillance.org. doi:10.2807/1560-7917.ES.2020.25.10.2000180
- World Health Organization. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020 [Internet]. Geneva: World Health Organization; 2020 Available from:https://www.who.int/docs/default- source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf.
- Detection of Novel Coronavirus by RT-PCR in Stool Specimen from Asymptomatic Child, China. Tang A, Tong ZD, Wang HL, Dai YX, Li KF, Liu JN, Wu WJ, Yuan C, Yu ML, Li P, Yan JB. Emerg Infect Dis. 2020;26(6) Epub 2020 Jun 17.
- Detectable 2019-nCoV viral RNA in blood is a strong indicator for the further clinical severity.Chen W, Lan Y, Yuan X, Deng X, Li Y, Cai X, Li L, He R, Tan Y, Deng X, Gao M, Tang G, Zhao L, Wang J, Fan Q, Wen C, Tong Y, Tang Y, Hu F, Li F, Tang X. Emerg Microbes Infect. 2020;9(1):469. Epub 2020 Feb 26.
- Detection of SARS-CoV-2 in Different Types of Clinical Specimens. Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, Tan W. JAMA. 2020;
- Lisa Brosseau. COVID-19 transmission messages should hinge on science. Fonte: http://www.cidrap.umn.edu/news-perspective/2020/03/commentary-covid-19-transmission-messages-should-hinge-science
Esse artigo foi escrito em coautoria com Dra. Daniela Milhomem Cardoso
Gotículas, aerossóis e transmissão do coronavírus
Artigo muito bem escrito e de extrema lucidez, de autoria da Prof. Lisa Brosseau, da Universidade de Illinois. Copiei os trechos mais importantes para quem quiser uma leitura mais resumida. O texto completo está disponível em: http://www.cidrap.umn.edu/news-perspective/2020/03/commentary-covid-19-transmission-messages-should-hinge-science
Antes de iniciar, vejamos as definições do CDC sobre os modos de transmissão de doenças infecciosas. Link aqui.
Droplet transmission
- Droplet transmission is, technically, a form of contact transmission, and some infectious agents transmitted by the droplet route also may be transmitted by the direct and indirect contact routes.
- However, in contrast to contact transmission, respiratory droplets carrying infectious pathogens transmit infection when they travel directly from the respiratory tract of the infectious individual to susceptible mucosal surfaces of the recipient, generally over short distances, necessitating facial protection.
- Respiratory droplets are generated when an infected person coughs, sneezes, or talks or during procedures such as suctioning, endotracheal intubation, cough induction by chest physiotherapy and cardiopulmonary resuscitation.
Airborne transmission
- Airborne transmission occurs by dissemination of either airborne droplet nuclei or small particles in the respirable size range containing infectious agents that remain infective over time and distance (e.g., spores of Aspergillus spp, and Mycobacterium tuberculosis).
- Microorganisms carried in this manner may be dispersed over long distances by air currents and may be inhaled by susceptible individuals who have not had face-to-face contact with (or been in the same room with) the infectious individual
Duas observações importantes a respeito destas definições e que terão impacto no entendimento do modo de transmissão do coronavírus:
- A transmissão por gotículas é uma forma de transmissão por contato. Gotícula da pessoa doente entrando em contato com a mucosa de outra pessoa.
- A transmissão pelo ar através de aerossóis, deve incluir a capacidade de percorrer longas distâncias
Existe, portanto, uma lacuna aqui, ou seja: a inalação de aerossóis em curta distância. Leiam o texto e deixem suas opiniões.
Dr. Brosseau is a national expert on respiratory protection and infectious diseases and professor (retired), University of Illinois at Chicago.
____________________________________
Many experts in public health have, for very good reason, voiced frustration at the lack of science-based information they read regarding the ongoing COVID-19 pandemic. And it’s OK to say that we’re still gathering evidence.
An often ignored, yet important mode of transmission for infectious respiratory diseases—close-range aerosol transmission—needs to be part of the equation, and I’ll detail the science on that later on.
Better communication is needed
Infection prevention, medical, and public health professionals should be communicating to everyone that the exact modes of transmission for SARS-CoV-2—are unknown. There are no studies, yet, to support any particular mode of transmission over another.
The precautionary principle suggests we should approach this organism as we would any novel highly transmissible respiratory disease—as a contact, droplet and airborne disease, but with one important caveat: Short-range aerosol transmission is also a strong possibility.
Taking lessons from the little we already know about COVID-19 as well as influenza, SARS, and MERS, all of which show many similarities to COVID-19, the precautionary approach suggests that we focus on preventing short-range aerosol transmission in both public and healthcare settings.
We need to strategically protect health workers
For aerosol-generating procedures, the CDC should be recommending respirators with higher levels of protection than an N95 filtering facepiece respirator (eg, a powered air-purifying respirator), but at this point, it does not.
In the face of supply shortages, the CDC last week changed its recommendations to allow the use of medical masks instead of respirators, saving the latter for aerosol-generating procedures.1 Healthcare organizations must return to using respirators for confirmed and suspected COVID-19 patients when supply chain problems are resolved. Requirements for airborne infection isolation rooms remain in place. Organizations are encouraged to designate entire units for COVID-19 patient care and develop re-use procedures for personal protective equipment.
In addition to being clearer in its messaging about disease transmission, the CDC should be working hard to ensure there are enough testing kits and laboratories available, purchasing or providing personal protective equipment (including respirators), supporting public health agencies with thoughtful decision-making and policies, and insisting that workers who protect the public are themselves protected.
Mixed messages about COVID-19 transmission
To date there is no direct research-based evidence describing exactly how SARS-CoV-2 is transmitted. Many sources say that COVID-19 is transmitted only by droplets and contact, but guidance from leading public health groups on transmission routes are inconsistent and conflicting.
Droplet transmission is usually defined as “respiratory droplets carrying infectious pathogens that transmit infection when they travel directly from the respiratory tract of the infectious individual to susceptible mucosal surfaces of the recipient, generally over short distances, necessitating facial protection.”3
Close contact involves hand transfer of surface contamination to mouth, nose or eyes, hand washing and gloves being common controls.
The WHO says, “Based on the available evidence, the COVID-19 virus is transmitted between people through close contact and droplets, not by airborne transmission.”4
Airborne transmission is defined as “dissemination of either airborne droplet nuclei or small particles in the respirable size range containing infectious agents that remain infective over time and distance.”7 An important requirement of airborne transmission is that it can occur only at a long distance from the source, according to the CDC.8
In risk communication guidelines for healthcare, however, the WHO states, “COVID-19 appears to spread most easily through close contact with an infected person. When someone who has COVID-19 coughs or sneezes, small droplets are released and, if you are too close, you can breathe in the virus” (emphasis added).9 But wait: Inhalation is not part of the traditional definition of droplet transmission.
For healthcare organizations, the CDC recommends airborne, in addition to standard (contact) and droplet precautions, for the care of COVID-19 suspected or confirmed patients.10
For the general public, the CDC describes SARS-CoV-2 transmission as primarily by droplets from coughs or sneezes, which “land in the mouths or noses of people who are nearby or possibly inhaled into the lungs” (emphasis added).11 But, again, inhalation is a new addition to the traditional definition of droplets. In contrast to its recommendations for healthcare, the CDC makes no mention of airborne transmission in public settings.
The Chinese Center for Disease Control and Prevention, which has dealt with by far more COVID-19 cases than any other agency, says that COVID-19 transmission occurs primarily by respiratory droplets and close contact, with the “possibility of aerosol transmission in a relatively closed environment for a long time exposure to high concentrations of aerosols.”12
Close-range aerosol transmission
Underlying the CDC and WHO statements about transmission is this: Inhalation of particles near the source may be an important mode of transmission.
Based on research now more than 70 years out of date, the infection control paradigm of contact, droplet, and airborne transmission fails to recognize inhalation of small airborne particles very close to an infectious source—ie, within 6 feet.13
Some everyday examples might help for illustration. Have you ever seen dust particles traveling through the air in a beam of light? Some of these eventually deposit on surfaces, but many remain airborne for long periods. Have you ever used hairspray or aerosolized cooking oil? Many of those droplets remain airborne nearby as you inhale particles and smell hairspray and cooking oil for several minutes.
The same thing happens when someone coughs or sneezes. Talking, breathing, coughing, and sneezing create an aerosol (a suspension of particles in the air) containing particles in a range of sizes, with viable infectious organisms present in both small and large particles.14-20
Infectious aerosols are inhalable
Contrary to popular belief, the larger particles (5 to 15 micrometers [µm]) will not immediately drop to the ground but will remain airborne for several minutes. Smaller particles (less than 5 µm) will remain in the air for many minutes or even hours.
All particles will immediately begin to evaporate (mucus contains a lot of water), which means the range of particle sizes will decrease overall. Smaller particles are more affected by diffusion than gravity, thus making them more likely to remain airborne. In the absence of air currents, airborne particles will disperse slowly throughout a space (see the figures below).
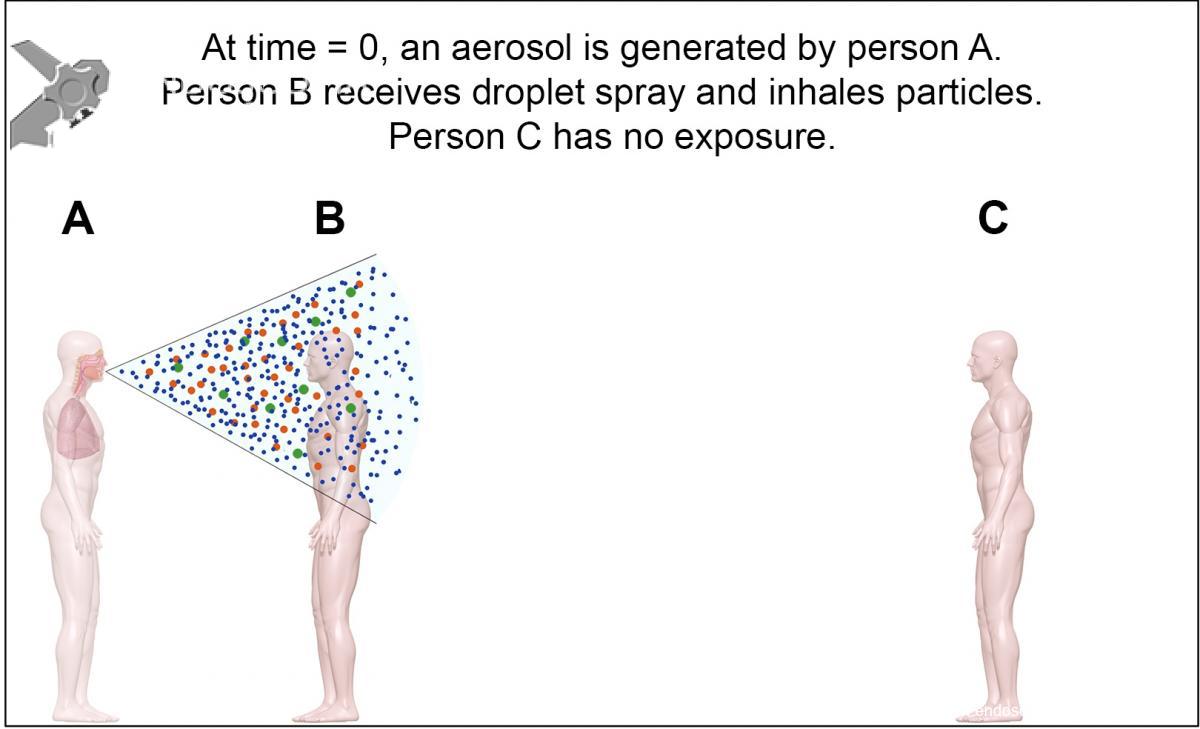
Figure 1. When an aerosol is initially emitted (time = 0), the particles are clustered near the source at location A. A person near the source (location B) may receive large-particle spray and inhale particles of all sizes. Figures: Absolute Science Illustration
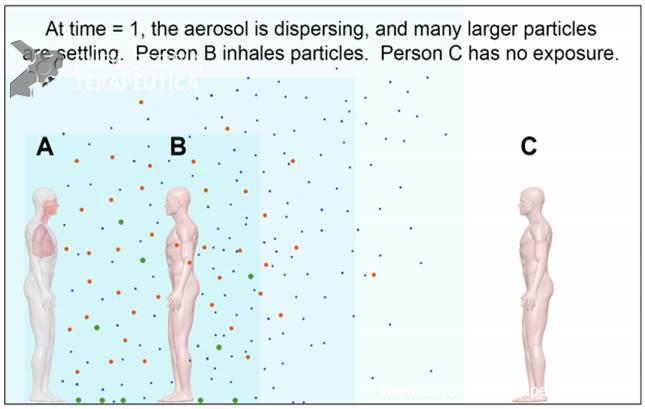
Figure 2. After some time (time = 1), the particles begin to disperse and larger particles begin to settle from the air. Person B will continue to inhale particles of all sizes. Figures: Absolute Science Illustration
Figure 3. After more time (time = 2), the small particles are uniformly dispersed and more of the larger particles have settled from the air. Persons B and C will inhale particles that are generally smaller, have a smaller size range, and are at a lower concentration than at time = 0. Figures: Absolute Science Illustration
All of the particle sizes in a typical cough or sneeze aerosol are inhalable. The larger particles will deposit in the nose, while smaller particles deposit in the lungs, where cell receptors for many infectious respiratory viruses are typically located.
Droplet transmission likely less important than thought
Droplet transmission is probably much less important for most respiratory infectious diseases than is short-range aerosol transmission by inhalation. Aerosol particles are not all large, and they do not all immediately fall to the ground. It is rare for coughs or sneezes to be propelled into nearby mouths or noses. The eyes, however, may be a portal of entry for some infectious organisms, such as influenza viruses.26,27
What aerosol transmission with other diseases can tell us
The traditional definition of airborne transmission—long-range inhalation of droplet nuclei—arises simply because some organisms are hardier than others. Tuberculosis and measles (classic examples of airborne respiratory diseases) remain viable in air for long periods. Viability dissipates with time, not distance. Therefore, diseases that are considered “airborne” must also be capable of transmitting disease by inhalation of aerosols near the source.
Close-range aerosol transmission
An increasing number of studies with animals and in human settings indicate that close-range aerosol transmission by inhalation is important for influenza.28-31 SARS and MERS demonstrate increased transmission in healthcare settings, especially to healthcare workers near aerosol-generating procedures. Tellier et al30 concluded that airborne transmission is likely for these two coronaviruses based on epidemiologic investigations, human respiratory sampling, and lower respiratory tract receptors for MERS.
Transmission in healthcare settings
SARS-CoV and MERS-CoV exhibit high levels of transmission in healthcare settings, in particular during aerosol-generating procedures. More than half of those contracting SARS during the 2003 pandemic were healthcare workers.
These data, along with recent US reports of healthcare worker infections in long-term care facilities and employees on cruise ships, are suggestive of both short- and long-range aerosol transmission in healthcare and other workplace settings.
Contact transmission of influenza, SARS, and MERS
The possibility of contact transmission and the utility of hand washing for any organism should be informed by scientific data that support biological plausibility (eg, receptors for the organism in the nose, mouth, or eyes) or demonstrate transmission in relevant animal species or humans.
Data support influenza transmission to the eyes in ferrets.26,27 The effectiveness of hand hygiene in community settings is minimal.38 Few data are available on contact transmission for SARS or MERS, although it seems unlikely if receptors are located primarily in the lower respiratory tract.30
Data are thus only somewhat suggestive of contact as a mode of transmission for COVID-19 in community settings and align with CDC advice that it is not the most important mode.
References
- Interim infection prevention and control recommendations for patients with suspected or confirmed coronavirus disease 2019 (COVID-19) in healthcare settings.
- CDC. Coronavirus disease 2019 (COVID-19): schools, workplaces & community locations. Updated Mar 15, 2020
- CDC. Infection control: isolation precautions.
- WHO. Advice on the use of masks in the community, during home care and in healthcare settings in the context of the novel coronavirus (2019-nCoV) outbreak. Jan 29, 2020
- WHO. Infection prevention and control during health care for probable or confirmed cases of Middle East respiratory syndrome coronavirus (MERS-CoV) infection: interim guidance. Updated October 2019
- Rational use of personal protective equipment for coronavirus disease 2019 (COVID-19): interim guidance. Feb 27, 2020
- Guideline for isolation precautions: preventing transmission of infectious agents in healthcare settings. 2007
- Infection control: how infections spread.
- WHO. The COVID-19 risk communication package for healthcare facilities. Updated Mar 10, 2020
- CDC. Interim infection prevention and control recommendations for patients with suspected or confirmed coronavirus disease 2019 (COVID-19) in healthcare settings. Updated Mar 10, 2020
- Coronavirus disease 2019 (COVID-19): how COVID-19 spreads.
- Chinese Center for Disease Control and Prevention.General questions: COVID-19 prevention and control.
- Gralton J, Tovey E, McLaws ML, et al.The role of particle size in aerosolised pathogen transmission: a review. J Infect 2011 Jan;62(1):1-13
- Yang S, Lee GWM, Chen CM, et al. The size and concentration of droplets generated by coughing in human subjects. J Aerosol Med 2007 winter;20(4):484-94
- Milton DK, Fabian MP, Cowling BJ, et al.Influenza virus aerosols in human exhaled breath: particle size, culturability, and effect of surgical masks. PLoS Pathog 2013 Mar 7;9(3):e1003205
- Lindsley WG, Pearce TA, Hudnall JB, et al.Quantity and size distribution of cough-generated aerosol particles produced by influenza patients during and after illness. J Occup Environ Hyg 2012 Dec 11;9(7):443-9
- Lindsley WG, Blachere FM, Thewlis RE, et al.Measurements of airborne influenza virus in aerosol particles from human coughs. PLOS One 2010 Nov 30;5(11):e15100
- Noti JD, Lindsley WG, Blachere FM, et al.Detection of infectious influenza virus in cough aerosols generated in a simulated patient examination room. Clin Infect Dis 2012 Jun 1;54(11):1569-77
- Blachere FM, Lindsley WG, Pearce TA, et al.Measurement of airborne influenza virus in a hospital emergency department. Clin Infect Dis 2009 Feb;8(4):438-40
- Yan J, Grantham M, Pantelic J, et al.Infectious virus in exhaled breath of symptomatic seasonal influenza cases from a college community. Proc Natl Acad Sci USA 2018 Jan 30;115(5):1081-6
- Interim guidance for U.S. hospital preparedness for patients under investigation (PUIs) or with confirmed Ebola virus disease (EVD): a framework for a tiered approach.
- Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). Feb 25, 2020
- Woelfel R, Corman VM, Guggemos W, et al.Clinical presentation and virological assessment of hospitalized cases of coronavirus disease 2019 in a travel-associated transmission cluster. medRxiv 2020 Mar 8
- Liu Y, Ning Z, Chen Y, et al. Aerodynamic characteristics and RNA concentration of SARS-CoV-2 aerosol in Wuhan hospitals during COVID-19 outbreak. bioRxiv 2020 Mar 10
- Johnson DL, Mead, KR, Lynch RA, et al.Lifting the lid on toilet plume aerosol: a literature review with suggestions for future research. Am J Infect Control 2013 Mar;41(3):254-58
- Belser JA, Gustin KM, Katz JM, et al.Influenza virus infectivity and virulence following ocular-only aerosol inoculation of ferrets. J Virol 2014 Sep;88(17):9647-54
- Belser JA, Lash RR, Garg S, et al.The eyes have it: influenza virus infection beyond the respiratory tract. Lancet Infect Dis 2018 Jul;18(7):e220-7
- Zhou J, Wei J, Choy KT, et al.Defining the sizes of airborne particles that mediate influenza transmission in ferrets. Proc Natl Acad Sci USA 2018 Mar 6;115(10):E2386-92
- Mermel LA.The great influenza centennial—what have we learned about the epidemiology and prevention of transmission?Clin Microbiol Infect 2018 Dec;24(12):1227-8
- Tellier R, Yuguo Li Y, Cowling BJ, at al.Recognition of aerosol transmission of infectious agents: a commentary. BMC Infect Dis 2019 Jan 31;19(1):101
- Cowling BJ, Ip DK, Fan, VJ, et al.Aerosol transmission is an important mode of influenza A virus spread. Nat Commun 2013 Jun 4;4:1935
- van Doremalen N, Bushmaker T, Morris D, et al.Aerosol and surface stability of HCoV-19 (SARS-CoV-2) compared to SARS-CoV-1. medRxiv 2020 Mar 13
- Pyankov OV, Pyankova OG, Agranovski IE.Inactivation of airborne influenza virus in the ambient air. J Aerosol Sci 2012 Nov;53:21-8
- Pyankov OV, Bodnev SA, Pyankova OG, et al.Survival of aerosolized coronavirus in the ambient air. J Aerosol Sci 2018 Jan;115:158-63
- Van Doremalen N, Bushmaker T, Munster VJ.Stability of Middle East respiratory syndrome coronavirus (MERS-CoV) under different environmental conditions. Euro Surveill 2013 Sep 19;18(38):20590.
- MacIntyre CR, Chughtai AA, Rahman B, et al.The efficacy of medical masks and respirators against respiratory infection in healthcare workers. Influenza Other Respir Viruses 2017;11(6):511-7
- Zhou P, Huang Z. Xiao Y, et al.Protecting Chinese healthcare workers while combating the 2019 novel coronavirus. Infect Control Hosp Epidemiol 2020 (published online Mar 5)
- Moncion K, Young K, Tunis M, et al.Effectiveness of hand hygiene practices in preventing influenza virus infection in the community setting: a systematic review. Can Commun Dis Rep 2019 Jan 3;45(1):12-23
Other resources
Brosseau L, Ann RL. N95 respirators and surgical masks. NIOSH Science Blog. Oct 14, 2009
Jones R, Brosseau L. Aerosol transmission of infectious disease. J Occup Environ Med 2015 May;57(5):501-8
NIOSH. Workplace safety and health topics: respirators
Shaffer R, Cichowicz JK, Chew G, et al. Non-occupational uses of respiratory protection – what public health organizations and users need to know. NIOSH Science Blog. Jan 4, 2018
Sietsema M, Radonovich L, Hearl FJ, et al. A control banding framework for protecting the US workforce from aerosol transmissible infectious disease outbreaks with high public health consequences. Health Secur 2019 Apr 19;17(2):124-32
Endoscopia Digestiva e a pandemia de COVID-19.
A pandemia chegou até nós. Atualmente (23/03 -22hs) já temos cerca de 1891 casos registrados, com 34 mortes. Como o Brasil tem até o momento dificuldades em testar todos os suspeitos, estes números provavelmente estão abaixo da realidade.
Os governos estaduais e municipais em sua grande maioria investiram no isolamento social, como arma para diminuir a velocidde de propagação da doença, evitando assim o sufocamento do serviços de saúde.
Porém, muitos serviço públicos e particulares de endoscopia não pararam suas atividades. Para este grupo, a Sobed (Sociedade Brasileira de Endoscopia Digestiva) lançou a terceira ataualização de suas orientações com relação a prevenção do Corona Virus (CoVid19)
QUIZ! – Anestesia tópica
Lesão em Reto – Qual seu diagnóstico e conduta?!
Mulher, 51 anos, previamente hígida, assintomática, submeteu-se a Colonoscopia para fins de rastreamento do câncer colorretal. Não possui comorbidades ou história familiar de neoplasia do trato gastrointestinal. É procedente de Timbaúba-PE (interior do estado – Zona da Mata Norte) e possui antecedente de banhos de rio naquela região.
Colonoscopia:
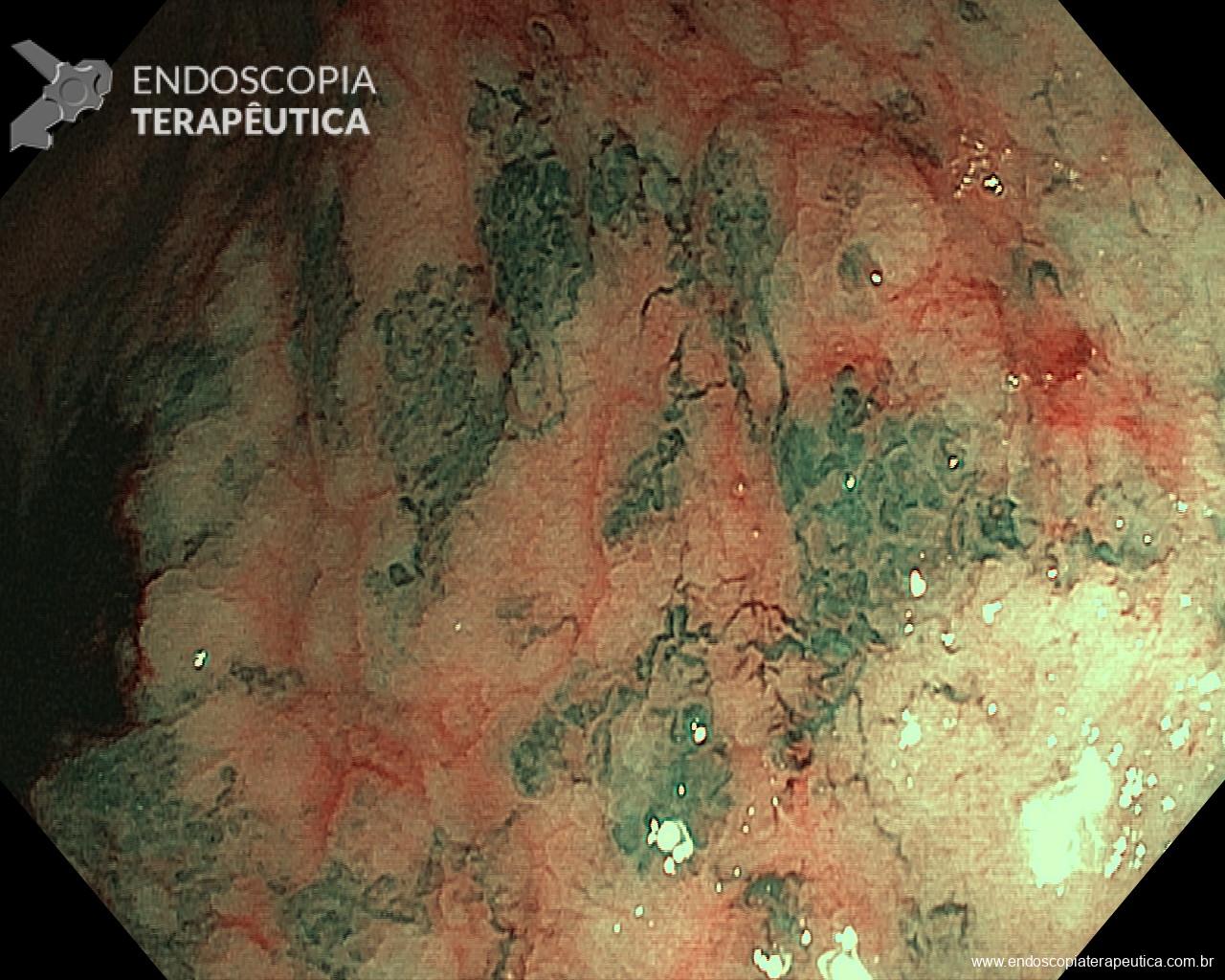
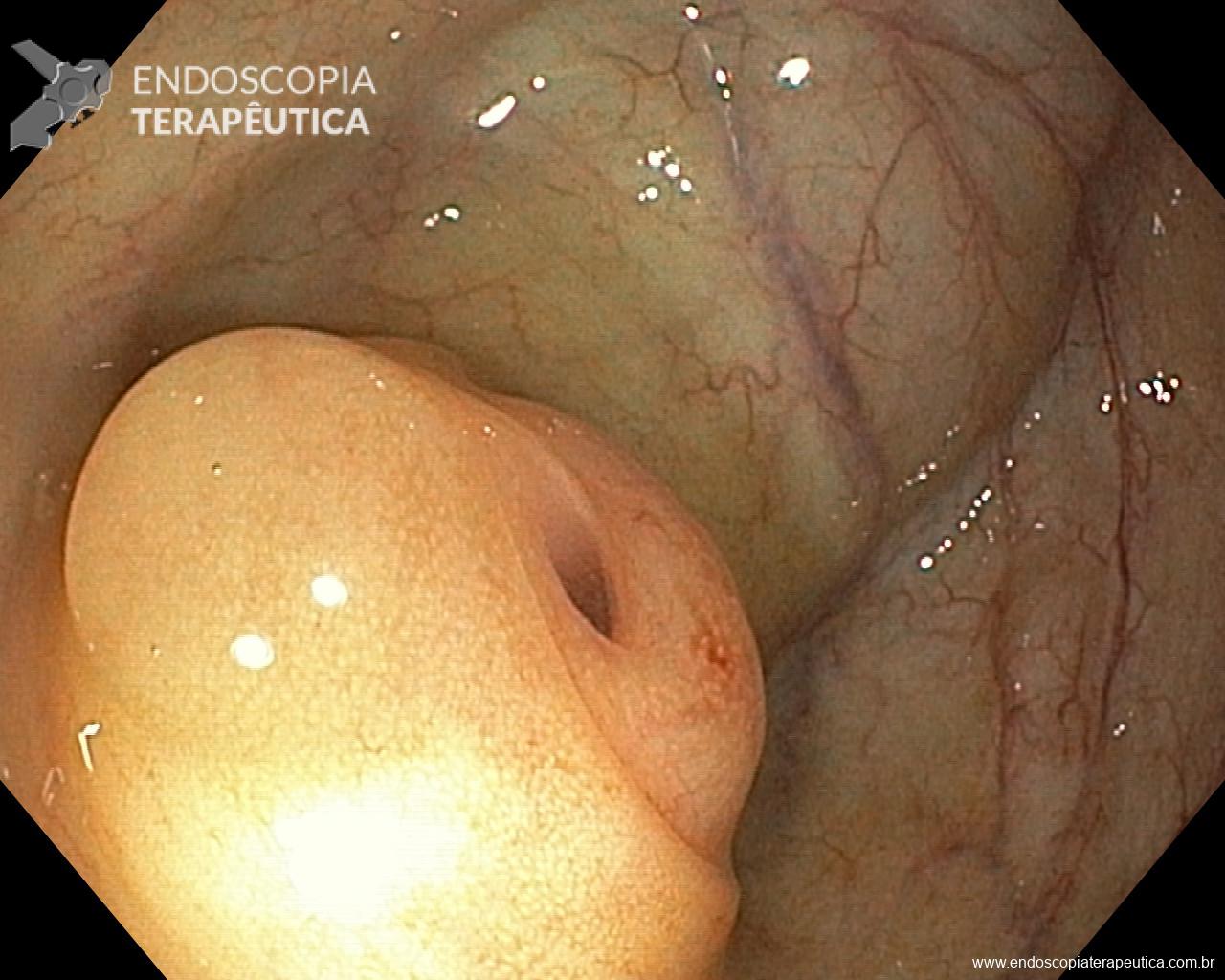
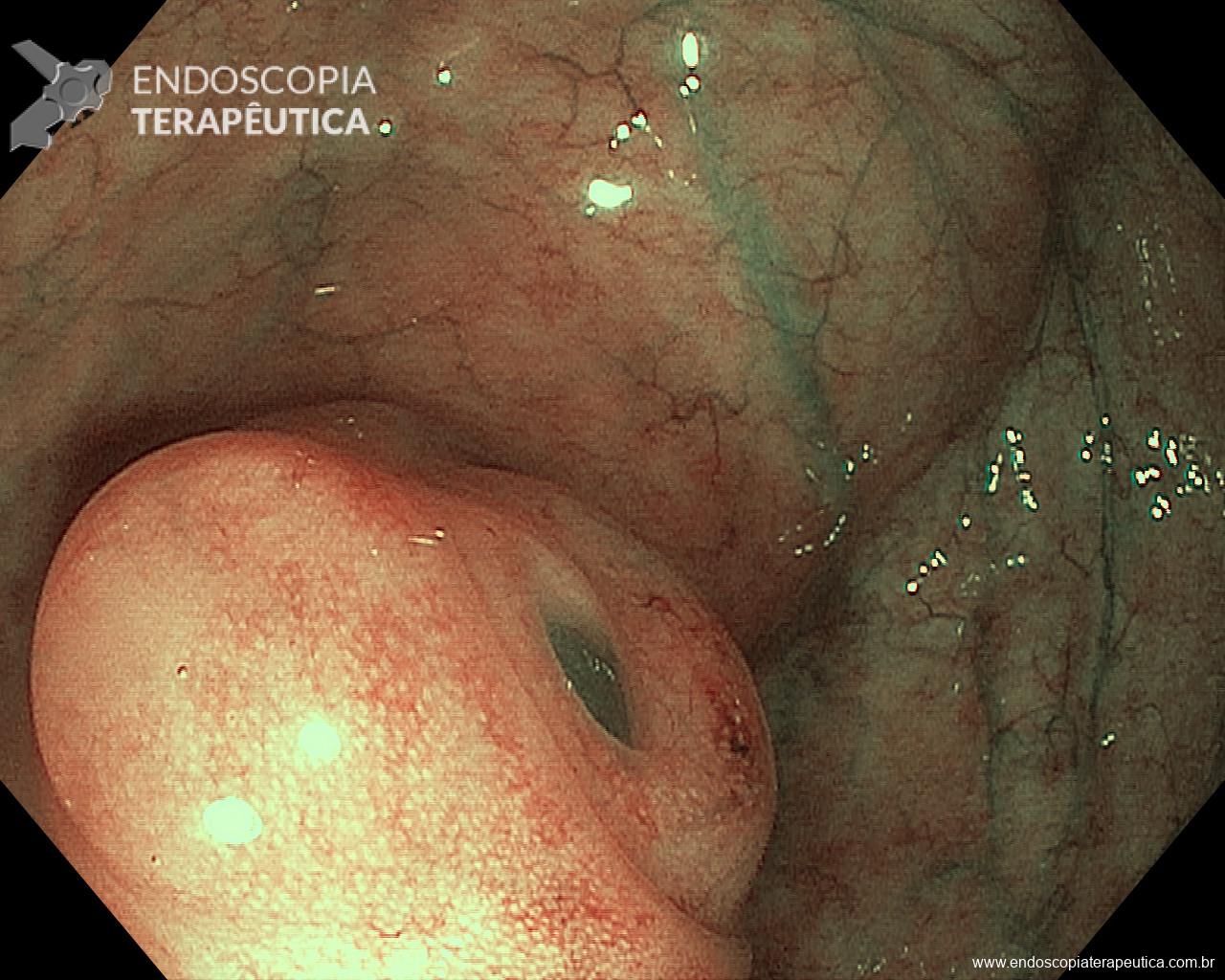
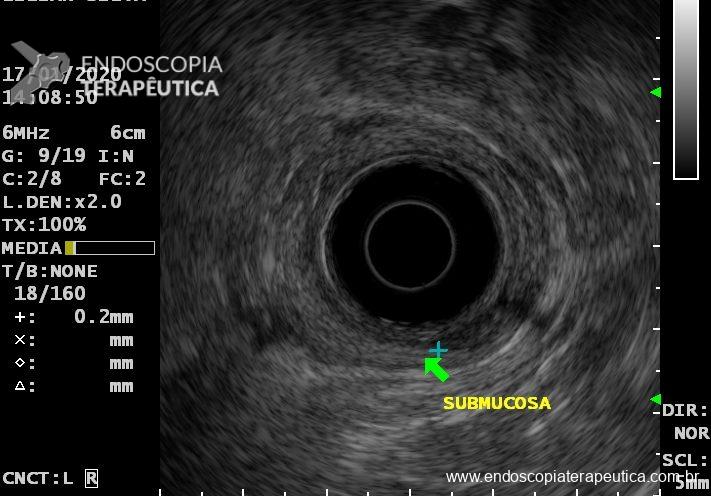
Na parede anterior do reto distal, a cerca de 1cm da linha pectínea, observa-se abaulamento arredondado, discretamente avermelhado, recoberto por mucosa íntegra, de consistência elástica, sem anormalidades à cromoscopia virtual com NBI, tampouco sinal da tenda presente, medindo cerca de 10mm.
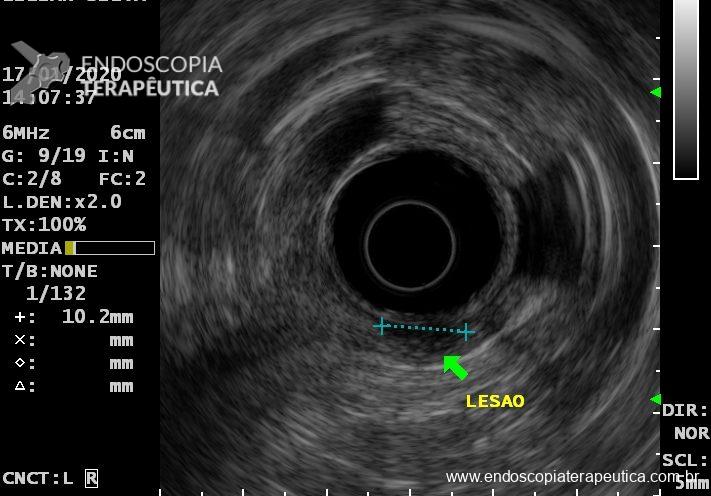
Em virtude dos achados da Colonoscopia, paciente foi referenciada à Ecoendoscopia:
Presença de lesão hipoecóica, heterogênea, doppler negativa, com limites bem definidos, medindo 10mm no maior eixo, localizada nas camadas mucosa e submucosa.
Manejo das fistula e deiscências após bypass gástrico
Hoje vamos fazer o post de uma maneira diferente.
Fiz uma vídeo-aula sobre tratamento endoscópico das deiscências pós gastroplastia redutora, focando no bypass gástrico.
Roteiro da aula:
- Introdução: 00m:00s – 00m:56s
- Etiologia e diagnóstico da fístula: 00m:56s – 04m:00s
- Racional do tratamento: 02m:45s – 03m:30s
- Opções para tratamento endoscópico: 03m:30s – 05m:45s
- Próteses: 05m:48s – 21m:06s
- Vácuo: 21m:06s – 25m:30s
- Duplo pigtail: 25m:30s – 29m:00s
Aproveite e inscreva-se no nosso canal para receber as atualizações mais recentes.
Bons estudos!
Quiz! – polipectomia a frio