O bypass gástrico em Y de Roux é uma técnica cirúrgica consagrada para o tratamento da obesidade com comprovada eficácia e segurança. Queixas de dumping são consideradas comuns principalmente no primeiro e segundo ano após a cirurgia, sendo habitualmente de leve intensidade e manejadas com orientação dietética.
A síndrome de dumping ocorre pelo trânsito acelerado de secreção digestiva e alimentar para o intestino proximal podendo estar relacionado a distensão de alças e hipersecreção com alteração da osmolaridade, estímulo vagal e hipoglicemia por hiperinsulinemia. As queixas podem ser precoces, quando ocorrem até 30 minutos após a alimentação, ou tardias, quando ocorrem entre 1-3h após a ingesta alimentar. Pacientes com dumping tardio também podem apresentar dumping precoce.
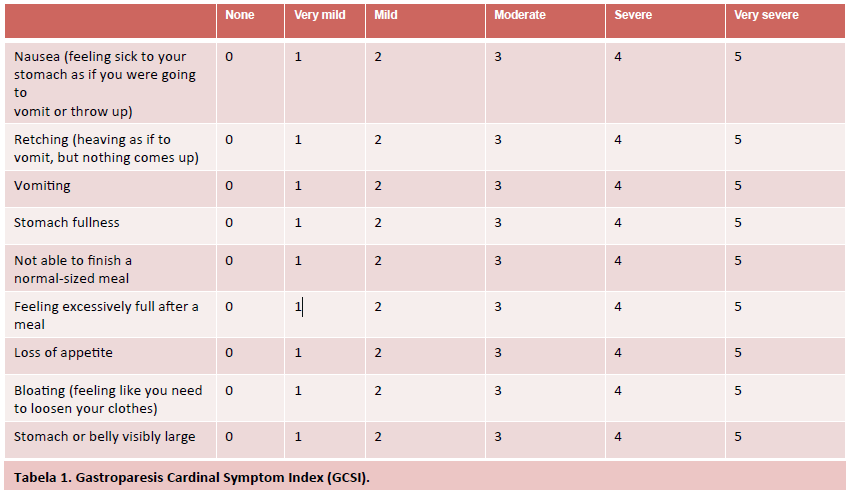
O escore de Sigstad é utilizado como uma maneira de identificar se a etiologia dos sintomas está relacionada ao dumping e mesmo estratificar sua gravidade e a resposta ao tratamento. Este escore é realizado através da ingestão de dieta rica em glicose e avaliação dos sintomas posteriormente atribuindo uma pontuação para cada um, estando descritos na tabela 1. Escores iguais ou superiores a 7 sugerem que a etiologia está relacionada a dumping e estimam a gravidade do quadro.
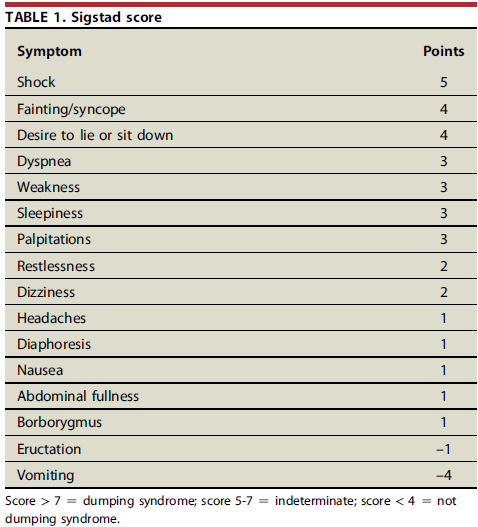
Escore de Sigstad. Vargas et al, 2020.
O manejo clínico envolve fracionamento da dieta com baixo volume (6 ou mais refeições por dia), restrição de ingesta de líquido durante as refeições (fazer ingesta 1h antes ou 1h depois), restrição de açúcar e carboidratos simples, aumento de ingesta de fibras e proteínas. O tratamento medicamentoso tem como objetivo retardar o trânsito alimentar e pode ser realizado com espessantes como goma guar e pectina porém a aderência ao tratamento é baixa devido ao paladar. Octreotide pode ser usado em casos de dumping precoce ou tardio, porém possui algumas desvantagens como administração subcutânea, custo elevado e tendência a formação de cálculos, sendo pouco utilizado. A medicação mais utilizada é a acarbose, um inibidor da alfa-glicosidase intestinal, que interfere na digestão de carboidratos reduzindo a resposta insulínica e hipoglicemia, com boa resposta para casos de dumping tardio.
Alguns pacientes apresentam quadros moderados a graves de difícil manejo, sendo refratários a modificação dos hábitos alimentares e ao tratamento medicamentoso. Em situações assim, acabamos nos deparando com uma encruzilhada entre o impacto negativo na qualidade de vida do paciente que consegue reduzir um pouco os sintomas do dumping, porém ainda possui queixas persistentes, enquanto o tratamento através de abordagem cirúrgica revisional possui sua própria morbidade e riscos.
Métodos:
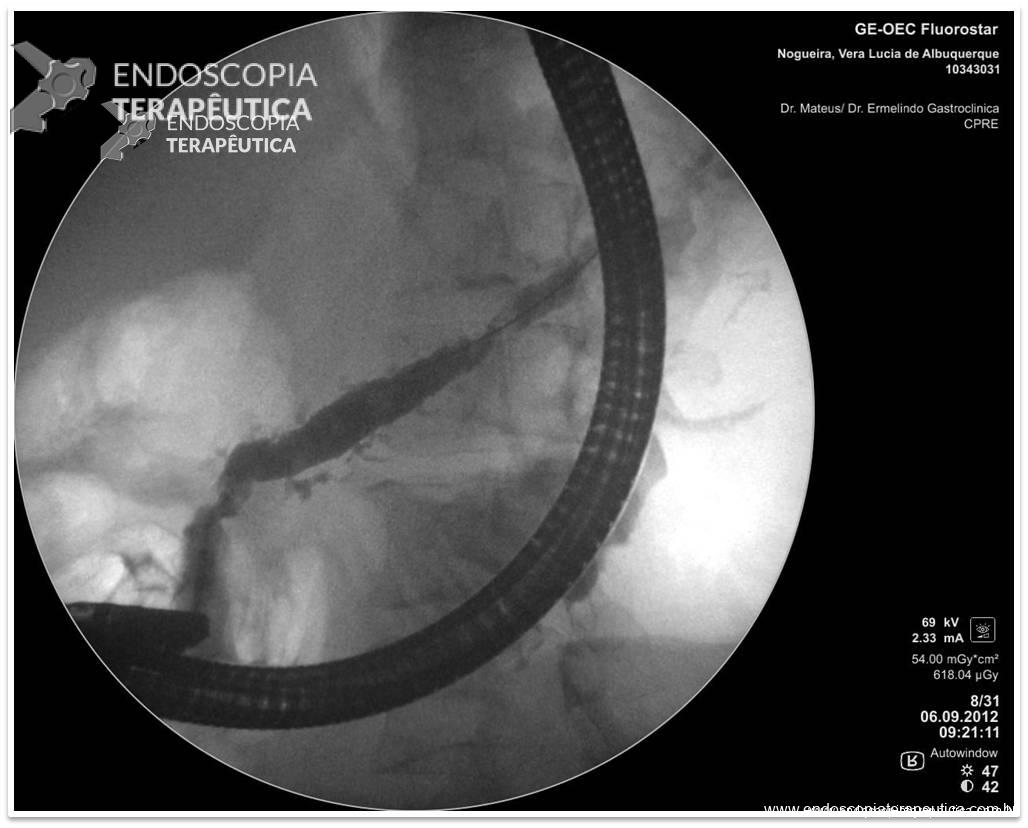
Os autores realizaram um estudo prospectivo, em dois centros terciários (Estados Unidos e Alemanha), entre os anos de 2014 e 2018, envolvendo pacientes com queixa de dumping no pós operatório de bypass gástrico em Y de Roux, submetidos a tratamento endoscópico através de remodelamento da anastomose gastrojejunal (endoscopic transoral outlet reducion – TORe) com uso de sutura endoscópica e plasma de argônio.
Foram avaliados o peso e IMC em três momentos (antes da cirurgia, no momento da intervenção endoscópica e no seguimento com 3 meses), a intensidade das queixas de dumping através do escore de Sigstad e uso de medicação sintomática para dumping (antes e depois da intervenção).
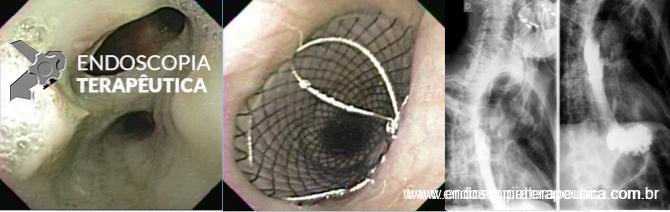
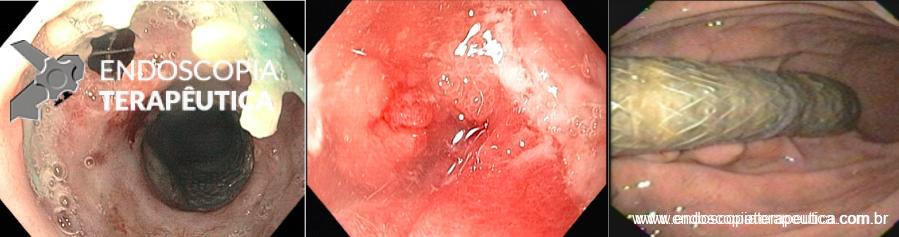
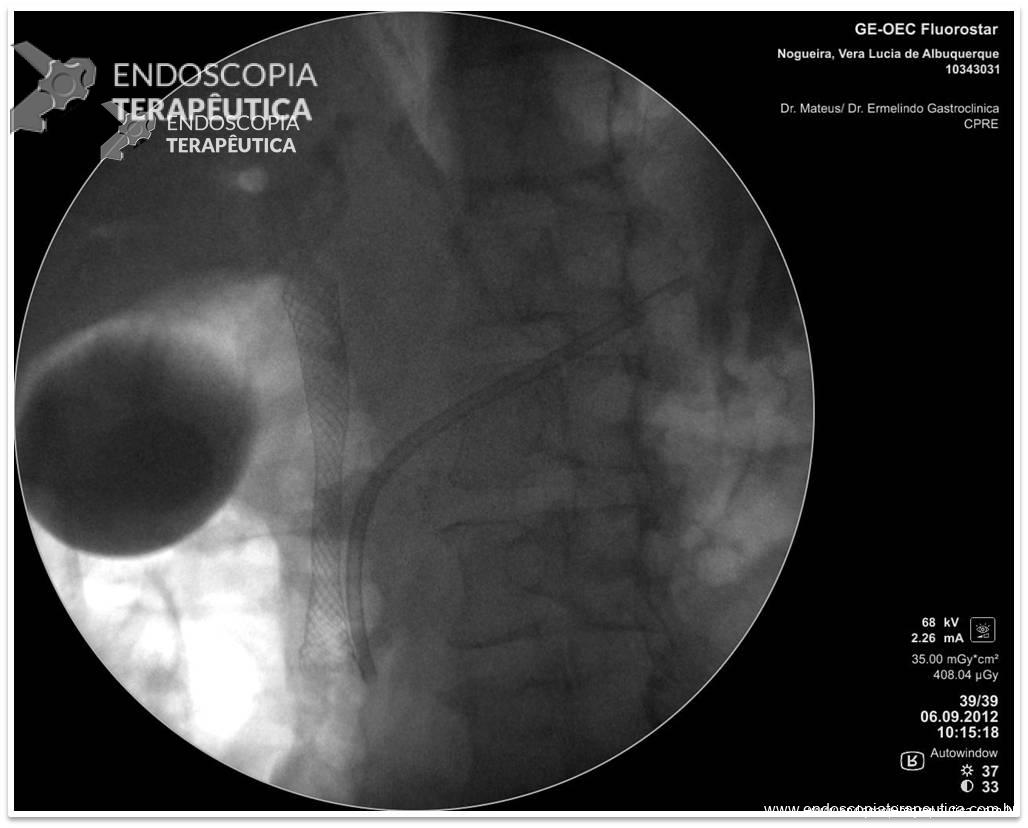
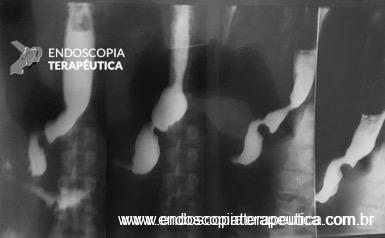
O procedimento foi realizado por apenas um médico especialista em cada centro, utilizando aparelho terapêutico (duplo canal). Inicialmente foi realizada aplicação de plasma de argônio no pouch gástrico com potência de 55W. Foi utilizado dispositivo de sutura de parede total modelo Overstich, iniciando a sutura na face jejunal utilizando fio de prolene, com pontos interrompidos em forma de oito ou separados, com objetivo final de reduzir a anastomose para 10mm. Os pacientes receberam prescrição de antieméticos, analgésicos e foram orientados a manter dieta específica por 2 semanas. Não há detalhamento sobre o tipo de dieta prescrita.
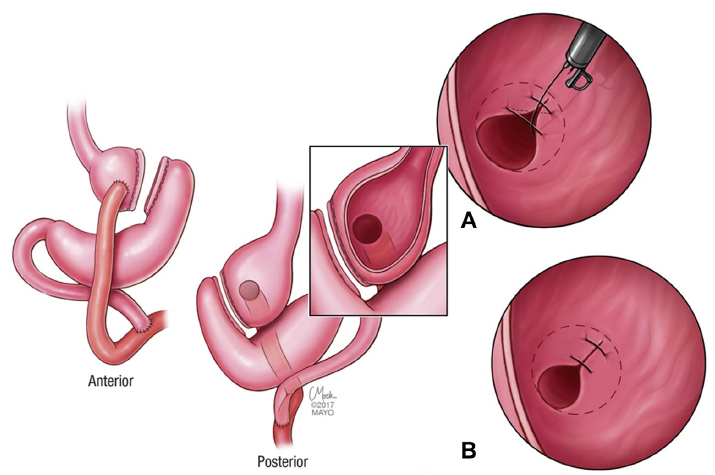
Ilustração sobre técnica de TORe. Vargas et al, 2020.
Foi definida como falha terapêutica a necessidade de repetir o procedimento (TORe), utilizar sondas alimentares ou necessitar de cirurgia de reversão do bypass.
Resultados:
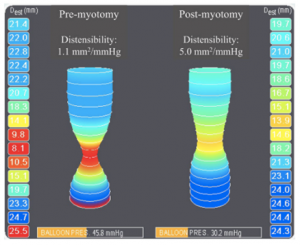
O procedimento foi realizado em 115 pacientes, com idade média de 44,7 ± 9 anos, predominantemente sexo feminino (84%), em média 8,9 ± 1,1 anos após o bypass. A anastomose gastrojejunal possuia em média 39,8 ± 6,7mm antes do procedimento. A maior parte dos pacientes (87%, n=100) fazia uso de terapêutica medicamentosa com acarbose para controle do quadro de dumping. O escore de sigstad era de 17,02 ± 6,1 no momento da intervenção.
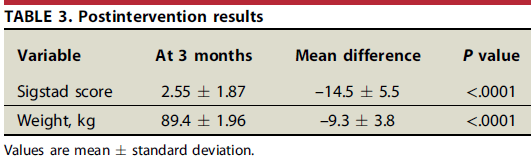
Resultados escore de Sigstad e perda de peso após procedimento. Vargas et al, 2020.
Foi obtido sucesso técnico em 100% dos casos, com tempo médio de 38,9 ± 17,3min para realização do procedimento, necessitando em média de 3 suturas (2-5).
O procedimento teve sucesso em controlar o dumping após 3 meses em 97% dos casos (n=109), com interrupção do uso de medicação em todos pacientes nesse grupo.
Houve falha em 6 pacientes, dos quais três foram referenciados para tratamento cirúrgico e três foram submetidos a novo procedimento endoscópico por apresentarem anastomose gastrojejunal ampla durante exame de controle. Não há relato do índice de sucesso nesse grupo de três pacientes que foi submetido a novo procedimento (TORe).
Não houve eventos adversos graves como sangramento, perfuração, estenose ou óbito.
Os autores sugerem o seguinte fluxograma para manejo de dumping após bypass gástrico em Y de Roux.
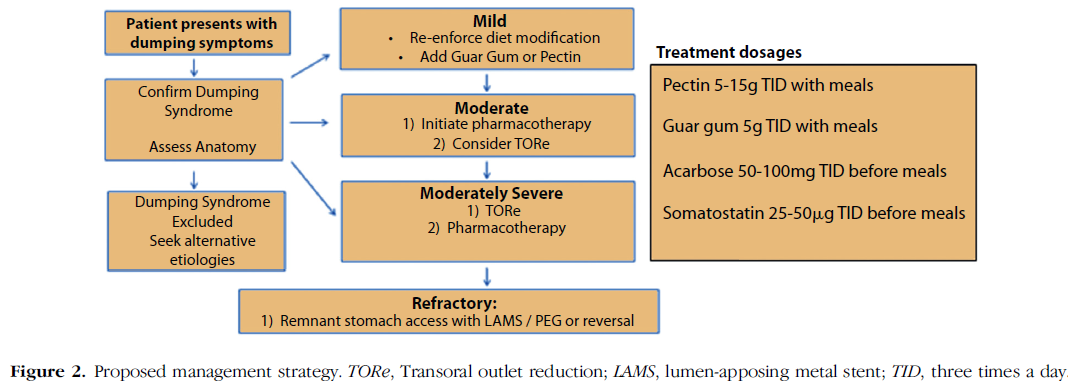
Fluxograma proposto para tratamento de dumping pós BGYR. Vargas et al, 2020.
Considerações
A publicação é muito interessante por apresentar uma alternativa eficaz, segura e minimamente invasiva para tratamento de casos refratários ou muito sintomáticos de dumping pós bypass gástrico em Y de Roux. Trata-se de estudo prospectivo, embora sem caso controle, com casuística bastante relevante, envolvendo 115 pacientes, majoritariamente com dumping moderado a severo (escore de 17) com resposta satisfatória na redução do escore para valores inferiores a 7 (não sugestivo de dumping) em 97% dos casos. Dos 6 casos de falha terapêutica, apenas três foram encaminhados para cirurgia. O artigo incluiu como falha três pacientes que foram submetidos a novo procedimento endoscópico através da técnica de TORe porém seria interessante que fosse relatada a resposta deste pequeno grupo ao procedimento.
Embora o seguimento seja curto, de apenas 3 meses, temos outras publicações na literatura mostrando manutenção de perda de peso após TORe com seguimento mais longo, sendo razoável extrapolar esses resultados para o caso de dumping. Brunaldi publicou trabalho comparando sutura isoladamente e sutura associada a plasma de argônio para perda de peso sendo evidenciada de perda do excesso de peso após TORe de 24,98%, 26,95% e 24,22% em 3, 6 e 12 meses, respectivamente.
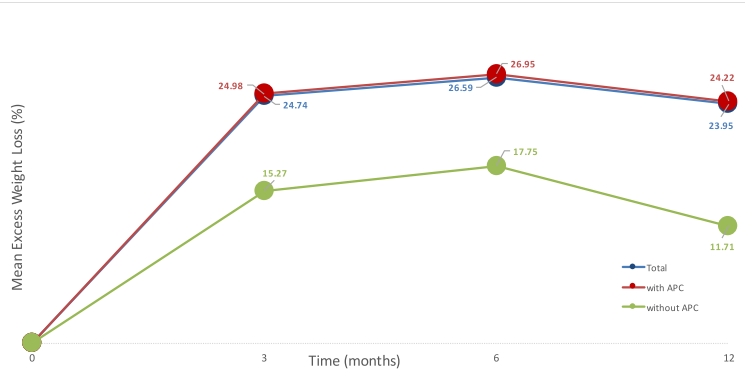
Perda da % de excesso de peso após remodelamento de anastomose gastrojejunal. Brunaldi et al, 2017.
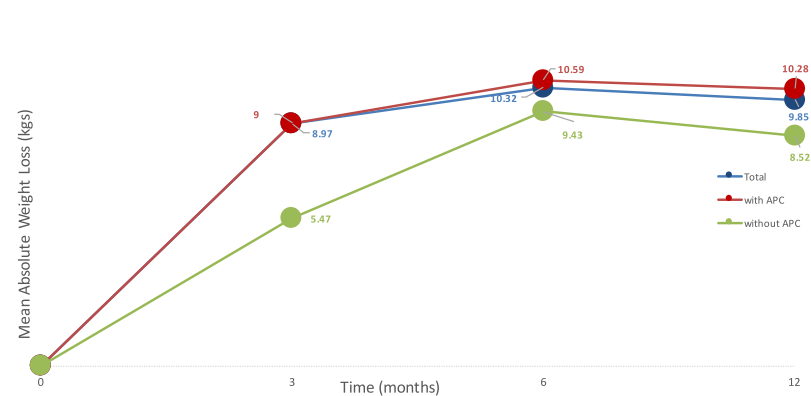
Perda de peso (Kg) após remodelamento de anastomose gastrojejunal. Brunaldi et al, 2017.
Uma importante limitação do procedimento está relacionada ao custo elevado que ainda está associado aos dispositivos de sutura endoscópica, além de quantidade restrita de endoscopistas com experiência em seu uso. Com o tempo, espera-se uma redução dos custos e popularização do método.
Referências:
Artigo original: Vargas EJ, Abu Dayyeh BK, Storm AC, Bazerbachi F, Matar R, Vella A, et al. Endoscopic management of dumping syndrome after Roux-en-Y gastric bypass: a large international series and proposed management strategy. Gastrointest Endosc 2020;92(1):91–6.
Outras referências:
Brunaldi VO, Jirapinyo P, Turiani D, De Moura H, Okazaki O, Bernardo WM, et al. Endoscopic Treatment of Weight Regain Following Roux-en-Y Gastric Bypass: a Systematic Review and Meta-analysis. 2017;
Berg P, McCallum R. Dumping Syndrome: A Review of the Current Concepts of Pathophysiology, Diagnosis, and Treatment. Dig Dis Sci. 2016;61(1):11–8.
Moon RC, Teixeira AF, Neto MG, Zundel N, Sander BQ, Ramos FM, et al. Efficacy of Utilizing Argon Plasma Coagulation for Weight Regain in Roux-en-Y Gastric Bypass Patients: a Multi-center Study. Obes Surg. 2018;28(9):2737–44.