CÂNCER COLORRETAL HEREDITÁRIO E SÍNDROMES DE POLIPOSE COLORRETAL – DESVENDANDO O MISTÉRIO – O QUE É FOCINHO DE PORCO E O QUE É TOMADA?
A maior parte dos casos de câncer colorretal é esporádica. Estima-se, no entanto, que fatores hereditários estejam envolvidos em cerca de 35% dos casos diagnosticados e que em 5% dos pacientes há uma síndrome genética bem caracterizada.
Recentemente, diversos autores têm reportado uma elevação nas taxas de incidência e mortalidade entre adultos jovens, com idade inferior a 50 anos. Nesse grupo etário em especial, acredita-se que 20% dos diagnósticos podem ter associação com síndromes hereditárias.
A correta identificação dessas situações permite a implementação de seguimento agressivo, além da precisa indicação de cirurgias que podem reduzir o impacto do câncer colorretal.
Existem inúmeras síndromes descritas, o que é inicialmente confuso. O texto a seguir se propõe a resumir as principais síndromes hereditárias associadas ao câncer colorretal, destacando as diferenças entre elas, características clínicas específicas, alterações genéticas envolvidas e recomendações de seguimento para cada situação.
Didaticamente, as síndromes podem ser divididas em dois grandes grupos: síndromes associadas à polipose de cólon e síndromes não associadas à polipose de cólon.
| SÍNDROMES DE CÂNCER COLORRETAL HEREDITÁRIO |
| ASSOCIADAS À POLIPOSE |
NÃO ASSOCIADAS À POLIPOSE |
| FAP – POLIPOSE ADENOMATOSA FAMILIAR
FAP ATENUADA
MAP – POLIPOSE RECESSIVA
SÍNDROME PEUTZ-JEGHERS
POLIPOSE JUVENIL
POLIPOSE SERRILHADA
POLIPOSE HAMARTOMATOSA
POLIPOSE MISTA |
SÍNDROME DE LYNCH
SÍNDROME “X” |
SÍNDROMES ASSOCIADAS À POLIPOSE
FAP – POLIPOSE ADENOMATOSA FAMILIAR
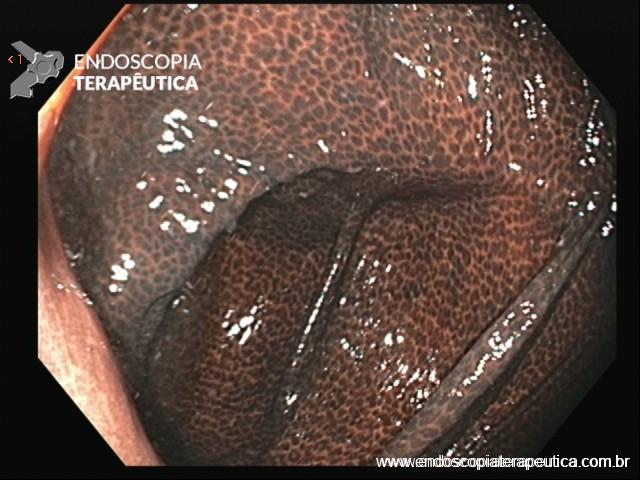
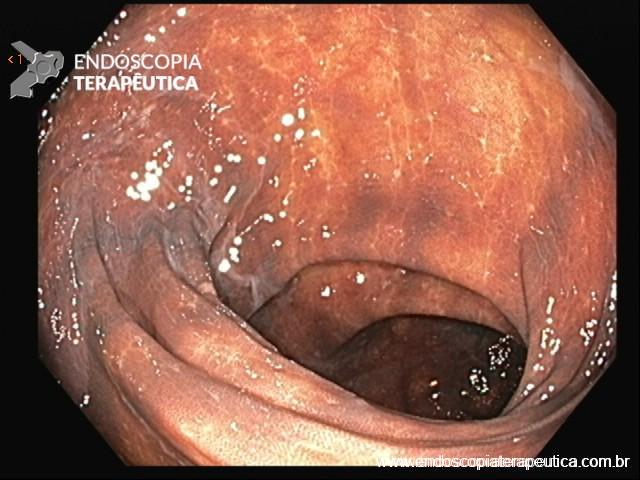
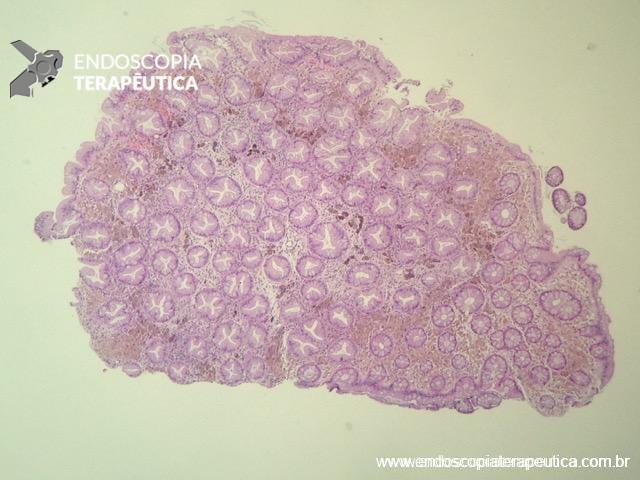
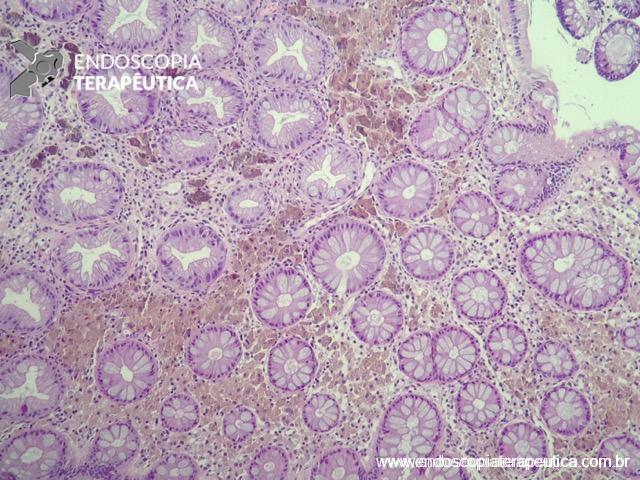
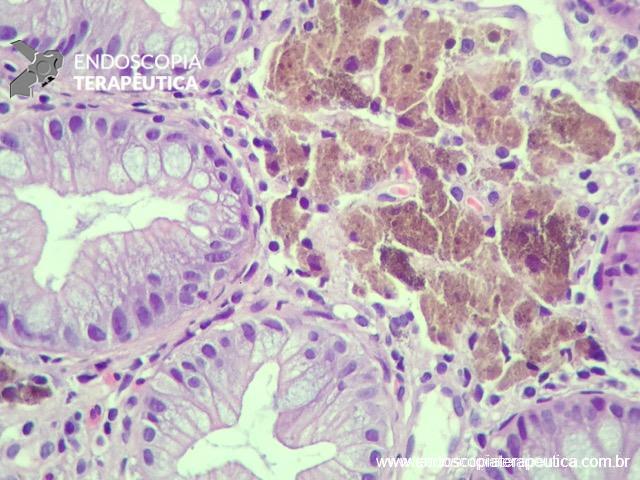
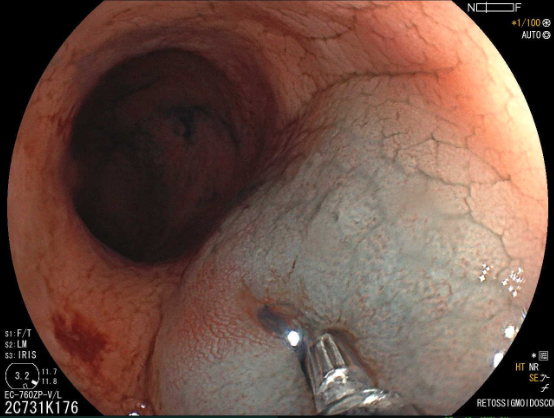
A FAP é a mais conhecida e estudada das síndromes. Causada por uma mutação autossômica dominante no gene APC, responde por 1% dos casos de câncer colorretal. O diagnóstico baseia-se no achado de mais de 100 adenomas distribuídos pelo cólon e, em muitos casos, as lesões são quantificadas aos milhares. Os adenomas surgem durante a adolescência e o risco de evolução de câncer colorretal é de 100% até a idade de 40-50 anos.
É interessante destacar que, em cerca de 20% dos indivíduos, a mutação do gene APC é “de novo”, ou seja, são os primeiros da família a apresentar o quadro de FAP.
Há, ainda, uma grande associação com outras neoplasias ou alterações extra-colônicas que incluem adenomas duodenais e gástricos (95% dos casos), pólipos gástricos de glândulas fúndicas (80-90% dos casos), osteomas (80%), hipertrofia congênita de epitélio pigmentar da retina (75%), cistos epidermoides (50%), anormalidades dentárias (17%), tumores desmoides (15-30%) adenomas de suprarrenal (5%), neoplasias biliares, carcinoma papilar de tireoide, hepatoblastoma e meduloblastoma.
O câncer de duodeno corresponde à segunda neoplasia mais comum em pacientes portadores de FAP. As lesões precursoras, os adenomas duodenais, surgem cerca de 15 anos após os adenomas de cólon. Há um escore, denominado Escore de Spigleman, que estadia e orienta o seguimento endoscópico desses pacientes.
Para os familiares de pacientes portadores de FAP, a investigação está indicada a partir da adolescência, 10-12 anos de idade, com sigmoidoscopia anual ou bianual.
Escore de Spigelman e recomendações para adenomas duodenais associados à FAP
| VARIÁVEIS |
1 PONTO |
2 PONTOS |
3 PONTOS |
| Número de pólipos |
1-4 |
5-20 |
> 20 |
| Tamanho dos pólipos (mm) |
1-4 |
5-10 |
> 10 |
| Histologia |
tubular |
tubulovilosa |
vilosa |
| Displasia |
leve |
moderada |
acentuada |
| |
|
|
|
| SCORE DE SPIGELMAN |
|
ESTADIAMENTO |
RECOMENDAÇÃO |
| 0 |
|
0 |
EDA 5 ANOS |
| 1-4 |
|
I |
EDA 3-5 ANOS |
| 5-6 |
|
II |
EDA 3 ANOS |
| 7-8 |
|
III |
EDA 1 ANO |
| 9-12 |
|
IV |
CIRURGIA OU EDA EM 6 MESES |
O tratamento cirúrgico envolve três opções a depender da extensão do acometimento da doença e manifestações extra-colônicas: colectomia total com anastomose ileocólica, proctocolectomia com bolsa ileal e proctocolectomia com ileostomia. Em situações específicas, há estudos controlados mostrando que é possível proceder a quimioprevenção de pólipos adenomatosos, com sulindac (um anti-inflamatório não esteroidal) ou celecoxib (inibidor da COX-2). O mecanismo envolve apoptose com redução no tamanho e número dos pólipos, mas sem impacto na redução do risco de câncer.
FAP ATENUADA
A FAP atenuada é definida pela presença de menos de 100 adenomas, que se desenvolvem em torno da quarta ou quinta década de vida. Está também associada à mutação do APC. Manifestações extra-colônicas podem estar associadas, exceto a hipertrofia do epitélio pigmentar da retina, que é uma manifestação exclusiva da FAP.
Em alguns casos, os adenomas podem se concentrar no cólon direito e, a depender da quantidade de pólipos, os pacientes podem ser tratados endoscopicamente com polipectomias seriadas.
A colonoscopia de seguimento está indicada a cada 2 anos, a partir de 18-20 anos de idade.
MAP – SÍNDROME DE POLIPOSE RECESSIVA
A MAP é uma síndrome rara, autossômica recessiva, associada a mutações no gene MYH, com alta penetrância. Acredita-se que cerca de 1-2% da população norte-americana e europeia seja de portadores heterozigóticos da mutação. A média de idade ao diagnóstico é em torno de 40-50 anos e o números de pólipos pode variar entre < 100 (maior parte dos casos) até milhares. Cerca de 30% dos pacientes desenvolvem o câncer sem associação com polipose.
Cerca de 5% dos pacientes podem apresentar manifestações extra-colônicas, como adenomas duodenais e há uma predileção de distribuição dos pólipos no cólon direito.
Para portadores bialélicos da mutação no gene MYH, o seguimento está indicado a cada 2 anos, a partir de 18-20 anos. Para portadores monoalélicos, o seguimento é semelhante ao do câncer colorretal esporádico.
O tratamento depende do número, tamanho e localização dos pólipos e é semelhante ao da FAP atenuada.
SÍNDROME DE PEUTZ-JEGHERS
Trata-se de uma rara síndrome autossômica dominante causada pela mutação no gene STK11, associada à polipose hamartomatosa. Os pólipos podem se apresentar em qualquer ponto do TGI.
A OMS estabelece como critério de diagnóstico a presença de pelo menos três pólipos hamartomatosos, ou qualquer número de pólipos hamartomatosos associados à típica pigmentação mucocutânea, para pacientes sem história familiar.
Os pólipos da síndrome de Peutz-Jeghers são mais comuns no intestino delgado (78%), cólon (42%), estômago (38%) e reto (28%). Os portadores dessa síndrome podem desenvolver uma grande variedade de neoplasias (mama, estômago, pâncreas, pulmão, ovário, colo uterino) inclusive câncer colorretal, que se desenvolve em 20% dos pacientes. As recomendações de seguimento incluem todas as neoplasias associadas à síndrome (EDA, TC TÓRAX, RNM ABDOME, MAMOGRAFIA E CA-125). A colonoscopia está indicada a partir de 25 anos de idade, a cada 2 a 5 anos.
O tratamento endoscópico dos pólipos hamartomatosos pode ser uma opção. O tratamento cirúrgico depende do tamanho e localização dos pólipos ou lesões associadas.
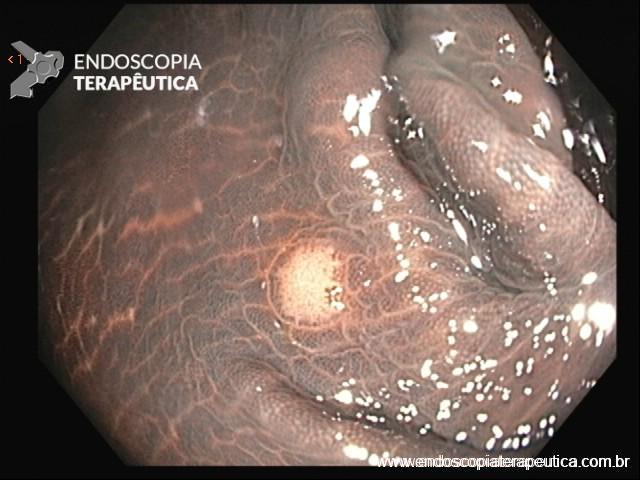
SÍNDROME DE POLIPOSE JUVENIL
Os pólipos juvenis são hamartomas e constituem os pólipos mais comuns em crianças, geralmente com apresentação solitária, sem potencial maligno.
Esses pólipos podem, no entanto, fazer parte da síndrome de polipose juvenil e, nesses casos, há potencial maligno. A síndrome de polipose juvenil é rara, autossômica dominante, que inclui mutações nos genes SMAD4 e BMPR1A.
Pacientes portadores da mutação SMAD4 têm maior risco de polipose gástrica e da síndrome de telangiectasia hemorrágica hereditária.
O diagnóstico é feito quando temos cinco ou mais pólipos juvenis no cólon, sem história familiar ou qualquer número de pólipos no estômago ou cólon, com história familiar. Os pólipos se desenvolvem na terceira década de vida e cerca de 10-20% dos pacientes apresentam anormalidades congênitas (macrocefalia, anomalias cardíacas, fissura palatina, anormalidades do TGU).
O seguimento está indicado para parentes de 1º grau a partir de 12 anos de idade com colonoscopia a cada 1-3 anos.
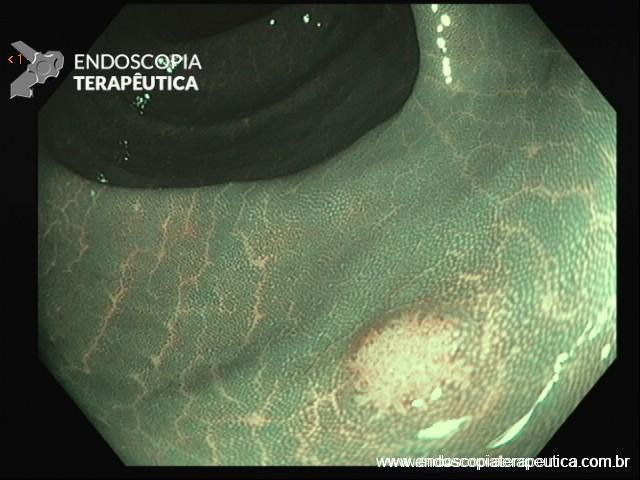
SÍNDROME DE POLIPOSE SERRILHADA
É também conhecida como síndrome de polipose hiperplásica. Acredita-se que o mecanismo de carcinogênese envolva a via do fenótipo metilador das ilhas CPG (CIMP) com provável inativação de genes supressores de tumor.
O diagnóstico da síndrome de polipose serrilhada é baseado nos seguintes critérios:
- 20 ou mais pólipos serrilhados em qualquer localização no cólon;
- 5 ou mais pólipos serrilhados proximais ao cólon sigmoide, com dois pólipos > 1 cm;
- Pelo menos 1 pólipo serrilhado proximal ao cólon sigmoide e um parente de primeiro grau portador da síndrome de polipose serrilhada.
O diagnóstico é normalmente feito durante colonoscopia de rastreamento e, uma vez confirmado, estão recomendadas colonoscopias anuais de seguimento.
SÍNDROMES DE POLIPOSE HAMARTOMATOSA
Incluem síndromes autossômicas dominantes raras associadas à mutação do gene PTEN como a Síndrome de Cowden (SC) e a Síndrome Bannayan-Riley-Ruvacalba.
Na SC, o órgão mais comumente acometido é a pele (triquilemomas faciais, papilomas orais e queratose acral). Há associação com neoplasias extra-colônicas como mama, tireoide, rim e melanoma. O risco de câncer de mama nesses casos é semelhante ao de portadores de mutação do BRCA. A maioria dos pacientes portadores dessas síndromes apresentam pólipos colônicos, hiperplásicos e hamartomatosos. As recomendações de rastreamento incluem colonoscopia a cada 5 anos, a partir de 35-40 anos de idade.
SÍNDROME DE POLIPOSE MISTA
Trata-se de uma condição rara caracterizada por múltiplos pólipos de histologias variadas (adenomatosos, hiperplásicos, hamartomatosos) que surgem durante a adolescência, como resultado da mutação do gene GREM1. O seguimento colonoscópico está indicado a cada 1-3 anos para pacientes portadores dessa síndrome.
SÍNDROMES NÃO ASSOCIADAS À POLIPOSE
SÍNDROME DE LYNCH
A síndrome de Lynch envolve mutações autossômicas dominantes dos genes de reparo (genes MMR), o que promove um risco aumentado de câncer colorretal sem associação com quadro de polipose. É responsável por cerca de 1-3% dos casos de câncer colorretal e está associada com uma grande variedade de neoplasias.
Os genes envolvidos na síndrome de Lynch incluem MLH1, MSH2, MSH6 e PMS2. Mutações em MLH1 e MSH2 estão presentes em 80% dos casos. As mutações em MLH1 estão associadas com desenvolvimento de câncer em pacientes mais jovens.
O diagnóstico da síndrome de Lynch se baseia nos critérios de Amsterdam II e Bethesda, associados à pesquisa das mutações associadas.
O risco de desenvolvimento de câncer colorretal ao longo da vida varia de 15 a 70%. As demais neoplasias associadas incluem endométrio, trato urinário, ovário, pâncreas, estômago, intestino delgado, trato biliar, cérebro e pele.
Em portadores da síndrome, as colonoscopias de rastreamento estão indicadas a cada 1-2 anos a partir de 20-25 anos de idade. Há estudos clínicos randomizados que mostram eficácia da quimioprofilaxia com uso de altas doses de AAS (600mg/dia por pelo menos 2 anos), mostrando redução de 60% na incidência do câncer colorretal nesses pacientes.
SÍNDROME “X”
Essa síndrome inclui 40% das famílias que preenchem os critérios de Amsterdam I, mas não possuem mutação nos genes de reparo identificada. Há uma elevação do risco de câncer colorretal em relação à média da população, mas não há elevação de incidência das demais neoplasias associadas à síndrome de Lynch. O seguimento colonoscópico está indicado a cada 3-5 anos, 10 anos antes da idade do membro mais jovem da família acometido.
| CRITÉRIOS DE AMSTERDAM I |
| – Pelo menos três familiares com câncer colorretal;
– Um deve ser parente de primeiro grau dos outros dois;
– Pelo menos duas gerações acometidas;
– Pelo menos um dos familiares diagnosticado antes de 50 anos de idade;
– FAP deve ser excluída. |
| CRITÉRIOS DE AMSTERDAM II |
| – Três ou mais familiares com neoplasias associadas à síndrome de Lynch;
– Um deve ser parente de primeiro grau dos outros;
– Pelo menos duas gerações acometidas;
– Pelo menos um dos familiares diagnosticado antes de 50 anos de idade;
– FAP deve ser excluída. |
| CRITÉRIOS DE BETHESDA |
| – Câncer colorretal diagnosticado antes de 50 anos de idade;
– Câncer colorretal sincrônico, metacrônico ou outra neoplasia associada à síndrome de Lynch;
– Câncer colorretal com histologia mostrando instabilidade de microssatélites em pacientes < 60 anos de idade;
– Câncer colorretal em um ou mais parentes de primeiro grau com neoplasia associada à síndrome de Lynch, um deles com diagnóstico < 50 anos de idade;
– Câncer colorretal diagnosticado em dois ou mais parentes de primeiro ou segundo grau com neoplasias associadas à síndrome de Lynch. |
Como citar este artigo:
Cardoso DM. Síndromes de polipose colorretal. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/sindromes-de-polipose-colorretal/
Referências
- Byrne RM, Tsikitis VL. Colorectal polyposis and inherited colorectal syndromes. Ann Gastroenterol 2018; 31: 1-11.
- Mahon SM. Hereditary Polyposis Syndromes. Gentics and Genomics 2018; 22(2): 151-6.
- Patel SG, Ahnen DJ. Colorectal câncer in the Young. Curr Gastroenterol Rep 2018; 20:15.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!